文档内容
秘密★启用前
嘉陵一中高 2023 级高二下期第三次月考
化学试卷
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦
干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3. 考试结束后,将答题卡交回。
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H – 1 C-12 N – 14 O-16 Ti - 48 Ba - 137
一、选择题:(本题共 14 小题,每小题 3 分,共 42 分。每小题给出的四个选项中,只有一项是符
合题目要求的。)
1.中国传统文化博大精深,蕴含着丰富的化学知识。下列说法错误的是
A.“烟花卷陌,依约丹青屏障”中烟花绽放出的绚丽色彩跟原子核外电子跃迁有关
B.古代“丹青”的“青色”,取之于“石青”,“石青”的主要化学成分是 Cu (OH) CO ,用它绘制的
2 2 3
国画在高温或遇酸条件下会变色
C.苏轼的《格物粗谈》中记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩
味”,推测文中的“气”在水中能形成分子间氢键
D.《淮南万毕术》中记载:“曾青得铁则化为铜”,铁位于元素周期表的第四周期Ⅷ族
2.下列化学用语或表述正确的是
A.1s22s22p1 →1s22s22p1 过程中可形成发射光谱 B.乙烷分子式: CH CH
x y 3 3
C.聚丙烯的结构简式: D.CH 空间填充模型:
4
3.下列物质既能发生消去反应,又能氧化生成醛基的是
A.CH CH(OH)CH B.
3 3
C. D.
4.设 N 为阿伏加德罗常数的数值,下列说法错误的是
A
A.1mol P 中含有P-P键个数为4N
4 A
第 1 页 共 8 页B.42 g C H 中含有键的数目可能为 8N
3 6 A
C.18 g D O中含有的电子数为 9 N
2 A
D.4.6 g由NO 和N O 组成的混合气体中含氧原子数为0.2N
2 2 4 A
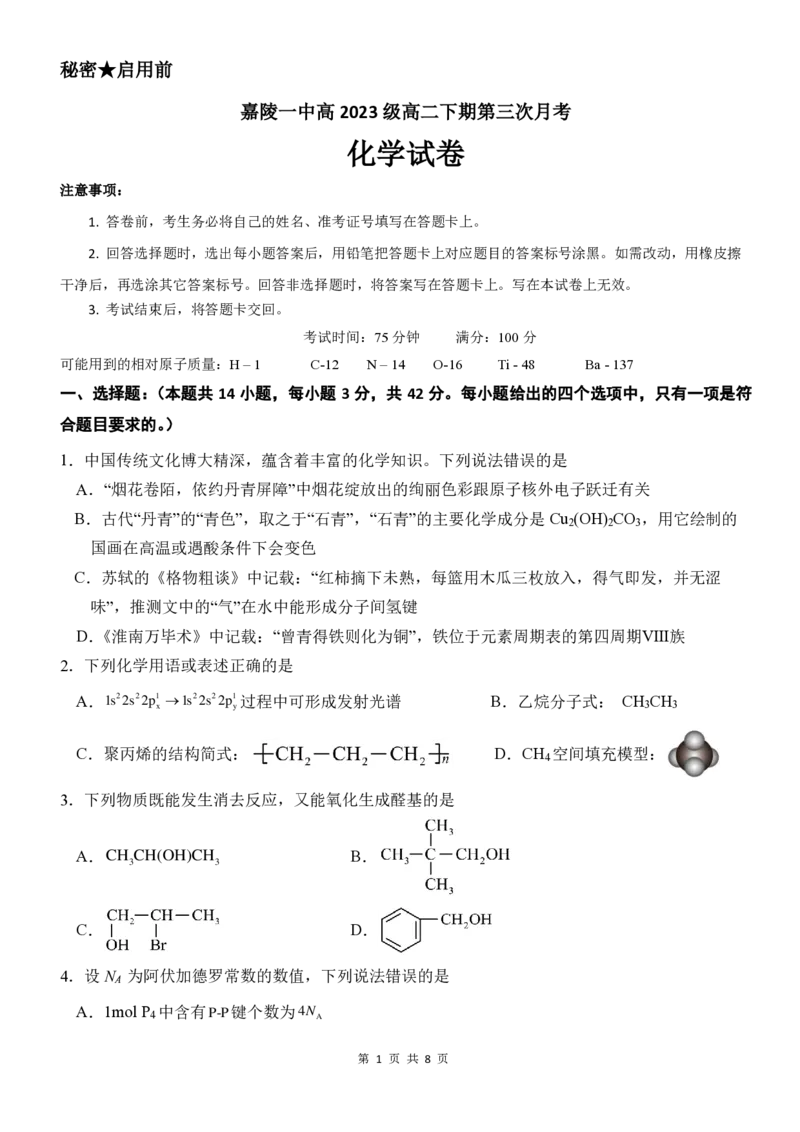
5.下列实验能达到实验目的的是(图中部分夹持装置略)
实验
实验目的 A.检验浓硫酸与乙醇共热的产物乙烯 B.证明苯环使羟基活化
实验
实验目的 C.验证乙酸酸性强于苯酚 D.证明乙炔可使溴的四氯化碳溶液褪色
6.下列物质熔、沸点的高低顺序正确的是
A.F Cl Br I B.Al O MgCl MgO
2 2 2 2 2 3 2
C.金刚石>晶体硅>碳化硅 D.Li CH COOH -CH 为推电子基,使O-H极性减弱
3 3
B 工业上常用液氨作制冷剂 断裂NH 中H-N需要吸收能量
3
C 键角∠OCH:CH OH < HCHO 碳的杂化类型不同
3
室温下,将50mLCH COOH与50mL苯混 混合过程中削弱了CH COOH分子间的氢键,
3 3
D
合,混合溶液体积为101mL 且苯与CH COOH分子间作用力弱于氢键
3
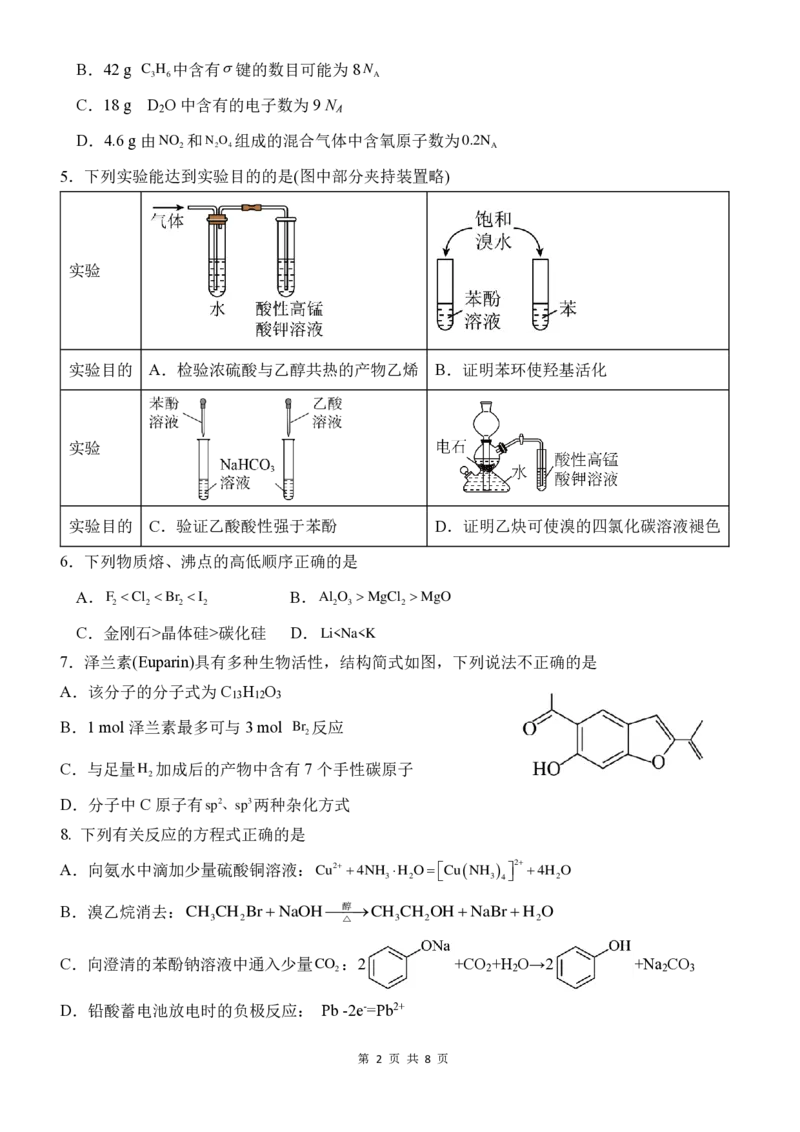
10. 6 g有机物M 完全燃烧只生成13.2 g CO 和7.2 g H O,质谱和核磁共振氢谱示意图如下。下
2 2
列关于该有机物的说法不正确的是
A.相对分子质量为60 B. 名称为异丙醇
C. 同分异构体有两种 D.能发生取代、氧化、消去反应
11.已知短周期主族元素X、Y、Z、M、N,其原子序数与其对应的0.1 mol⋅L−1最高价氧化物对应
的水化物溶液在常温下的pH关系如图所示。下列说法正确的是( )
A. X和Y元素均在p区
B. Y和N的氢化物均为电解质,且晶体类型相同
C. 元素的电负性:Z > M > N
D. XN 和ZN 的空间结构均为三角锥形
3 3
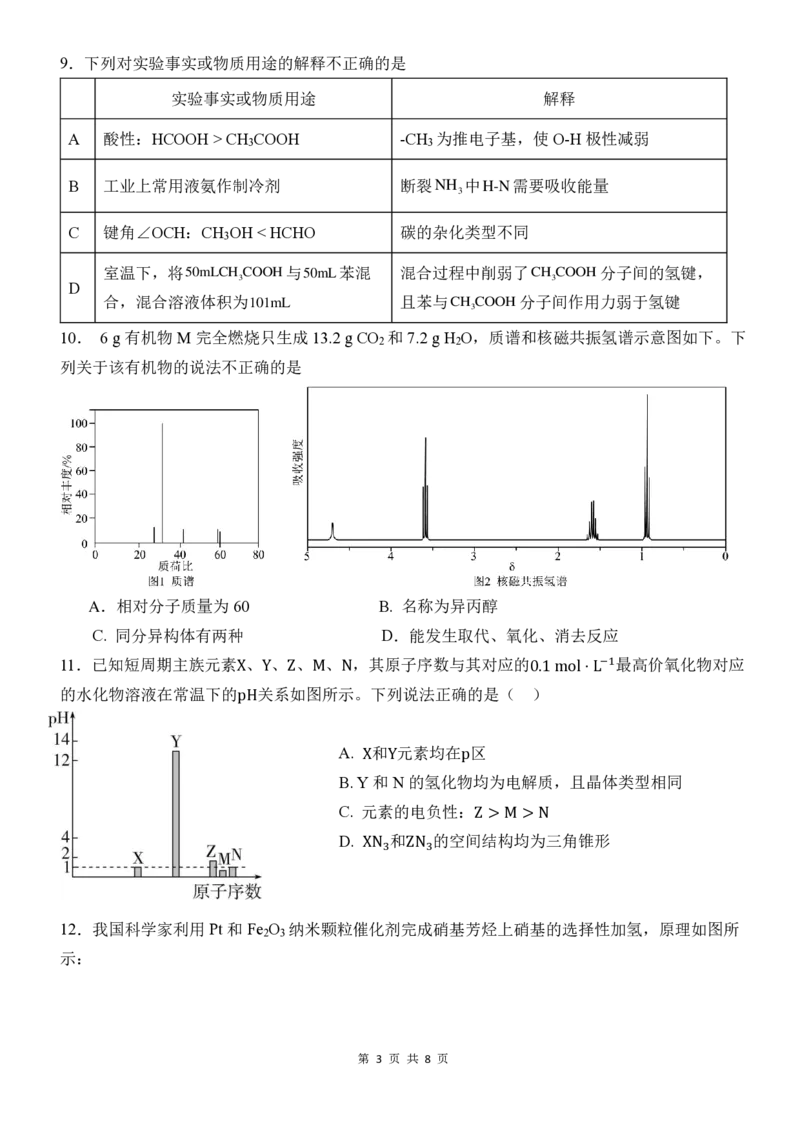
12.我国科学家利用 Pt 和Fe O 纳米颗粒催化剂完成硝基芳烃上硝基的选择性加氢,原理如图所
2 3
示:
第 3 页 共 8 页下列有关说法错误的是
A.Pt 为阳极
B.Pt 电极的电势比Fe O 电极的高
2 3
C.电池工作时,H+从左向右通过质子交换膜
D.Fe O 极的电极反应式为
2 3
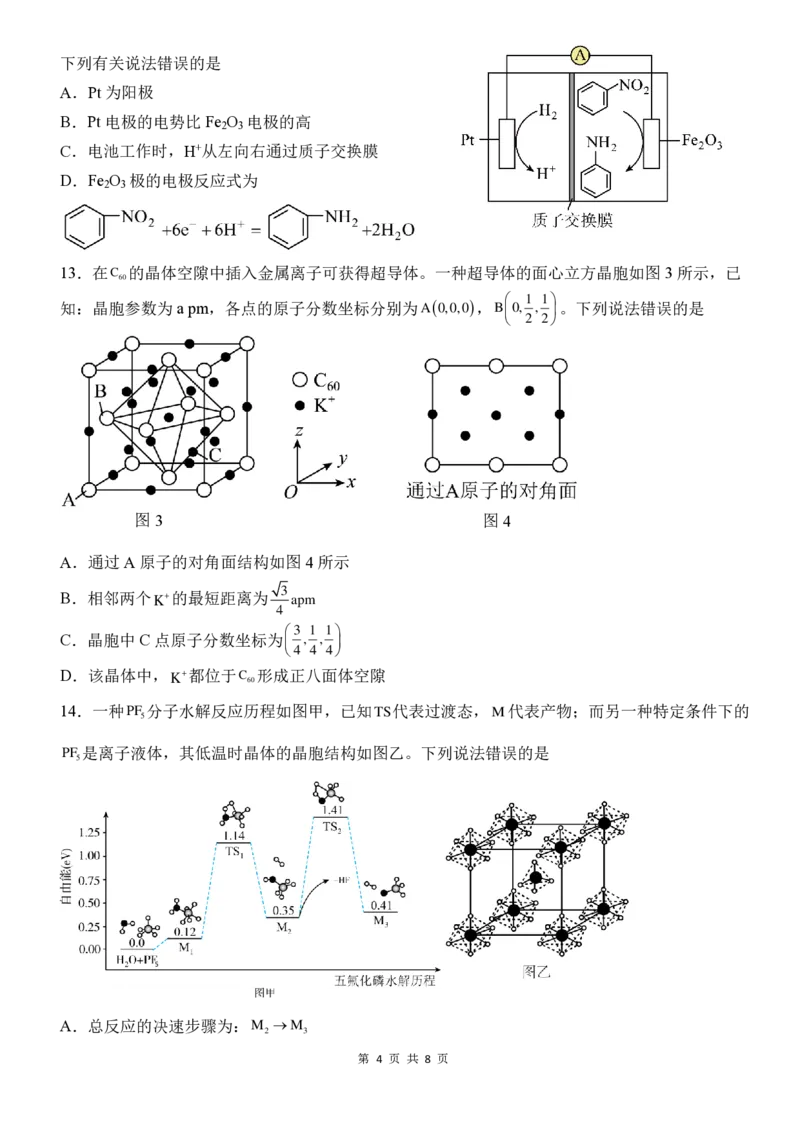
13.在C 的晶体空隙中插入金属离子可获得超导体。一种超导体的面心立方晶胞如图 3所示,已
60
1 1
知:晶胞参数为 a pm,各点的原子分数坐标分别为A(0,0,0),B0, , 。下列说法错误的是
2 2
图3 图4
A.通过 A原子的对角面结构如图 4所示
3
B.相邻两个K+的最短距离为 apm
4
3 1 1
C.晶胞中 C 点原子分数坐标为 , ,
4 4 4
D.该晶体中,K+都位于C 形成正八面体空隙
60
14.一种PF 分子水解反应历程如图甲,已知TS代表过渡态,M代表产物;而另一种特定条件下的
5
PF 是离子液体,其低温时晶体的晶胞结构如图乙。下列说法错误的是
5
A.总反应的决速步骤为:M →M
2 3
第 4 页 共 8 页B.升高温度可以增大图甲中PF 的水解程度
5
C.图乙中晶胞体心上的微粒为PF 分子
4
D.离子液体与传统溶剂相比具有难挥发的优点,是一种“绿色”溶剂
二、非选择题:(包括第 15-18 题,共计 58分)
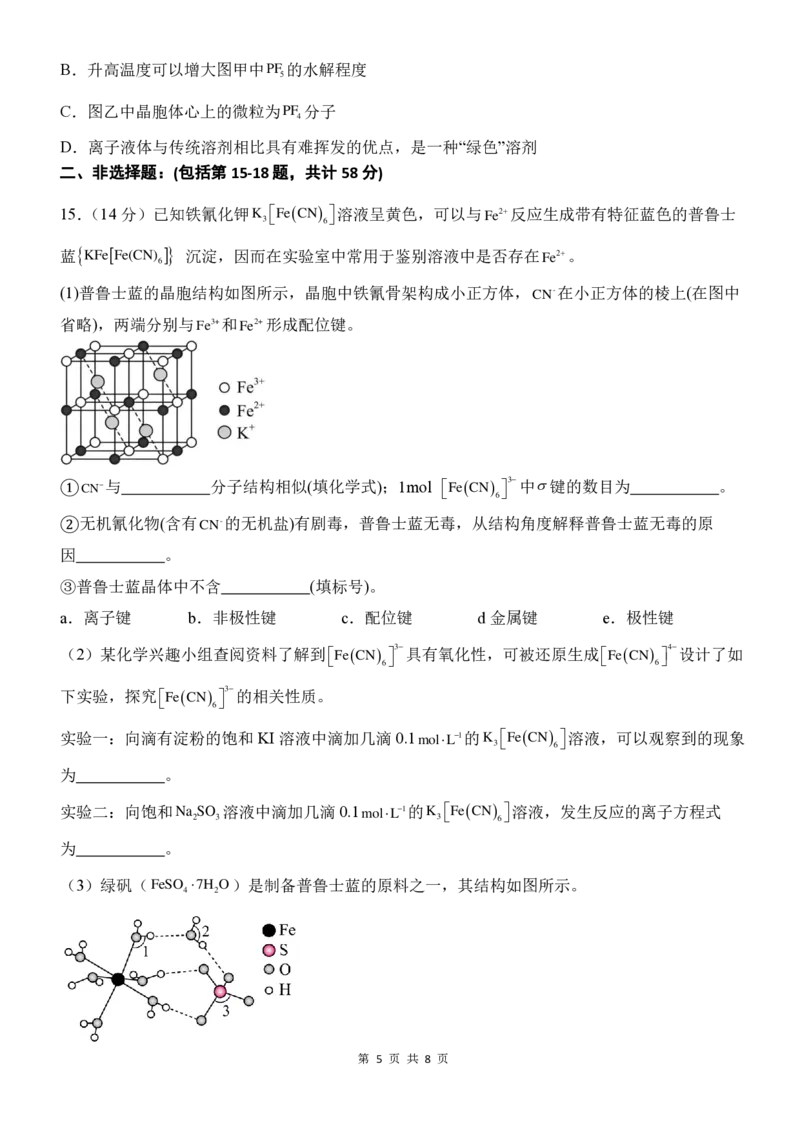
15.(14分)已知铁氰化钾K
3
Fe(CN)
6
溶液呈黄色,可以与Fe2+反应生成带有特征蓝色的普鲁士
蓝 KFeFe(CN) 沉淀,因而在实验室中常用于鉴别溶液中是否存在Fe2+。
6
(1)普鲁士蓝的晶胞结构如图所示,晶胞中铁氰骨架构成小正方体,CN-在小正方体的棱上(在图中
省略),两端分别与Fe3+和Fe2+形成配位键。
①CN−与 分子结构相似(填化学式);1mol Fe(CN) 3−中键的数目为 。
6
②无机氰化物(含有CN-的无机盐)有剧毒,普鲁士蓝无毒,从结构角度解释普鲁士蓝无毒的原
因 。
③普鲁士蓝晶体中不含 (填标号)。
a.离子键 b.非极性键 c.配位键 d金属键 e.极性键
(2)某化学兴趣小组查阅资料了解到Fe(CN) 3−具有氧化性,可被还原生成Fe(CN) 4−设计了如
6 6
下实验,探究Fe(CN) 3−的相关性质。
6
实验一:向滴有淀粉的饱和 KI溶液中滴加几滴 0.1molL−1的K
3
Fe(CN)
6
溶液,可以观察到的现象
为 。
实验二:向饱和Na
2
SO
3
溶液中滴加几滴 0.1molL−1的K
3
Fe(CN)
6
溶液,发生反应的离子方程式
为 。
(3)绿矾(FeSO 7H O)是制备普鲁士蓝的原料之一,其结构如图所示。
4 2
第 5 页 共 8 页下列说法错误的是_______
a. 键角 1、2、3的大小顺序为321 b.水分子的价层电子对互斥模型为正四面体形
c.1 个Fe2+与6个H O形成六个配位键 d.SO2−与水分子之间存在氢键
2 4
16.(16分)对重晶石矿(主要成分为BaSO ,还有少量的Fe O 、MnO等)进行“富矿精开”研究,
4 2 3
可以制备高纯纳米钛酸钡(BaTiO )。部分工艺流程如下:
3
已知:i.K (BaSO )=1.110−10 K (BaCO )=2.610−9
sp 4 sp 3
ii.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 Fe(OH) Fe(OH) Mn(OH)
3 2 2
开始沉淀的pH 1.5 6.5 8.3
沉淀完全的pH 3.7 9.7 9.8
(1)在该流程中,为加快“浸泡”速率,可采取的措施有 (写两种)。
(2)“浸泡”过程中发生反应的离子方程式为______________________________________。
(3)常温下,用NaOH调节溶液pH至9.8∼10.0,可完全沉淀的离子有 (填化学式)。
(4)在该流程中的“系列操作”是______________________。实际工业生产中,结晶时选择的温度是
20℃,结合下表分析20℃ 时Ba(OH) 8H O晶体能从混合液中析出的原因是 。
2 2
某些物质的溶解度表(g/100g水)
10℃ 20℃ 40℃ 60℃ 80℃
Ba(OH) 8H O 2.48 3.89 8.22 20.9 101
2 2
NaOH 98.0 109 129 174 314
NaCl 35.8 35.9 36.4 37.1 38.0
BaCl 33.5 35.8 40.8 46.2 52.5
2
(5)加热条件下,“合成反应”过程中发生的化学反应方程式是 。
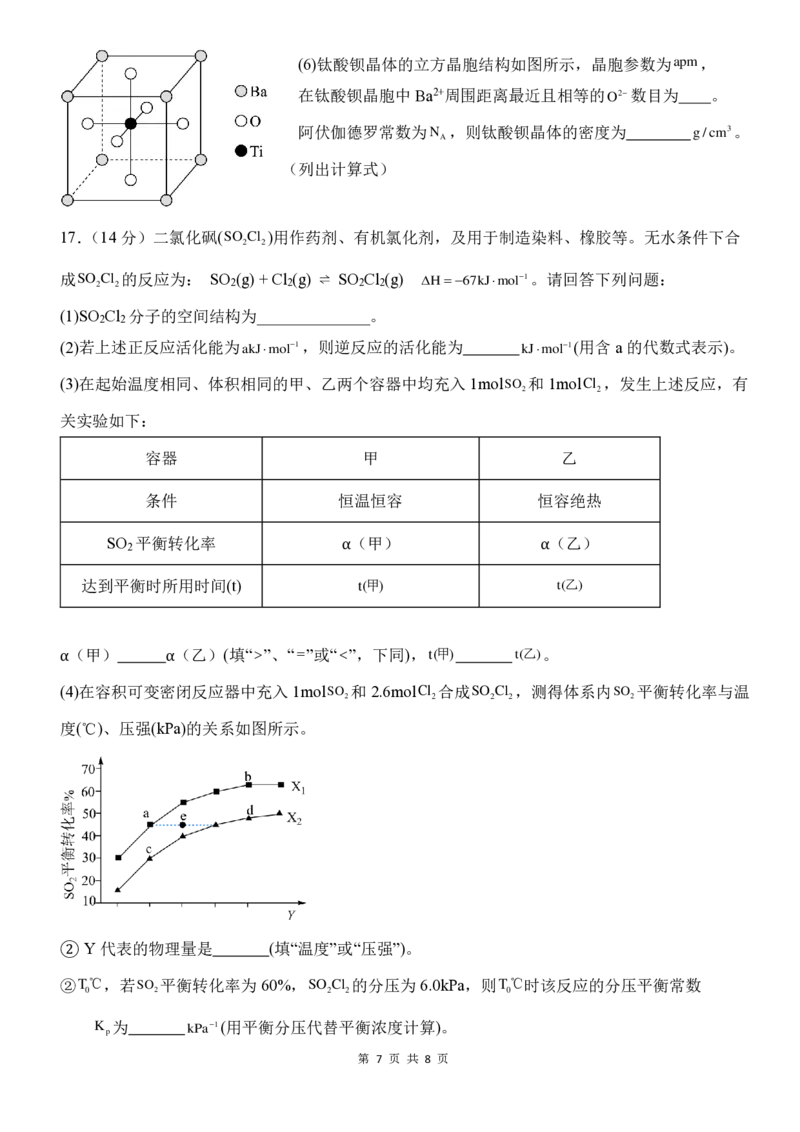
第 6 页 共 8 页(6)钛酸钡晶体的立方晶胞结构如图所示,晶胞参数为apm,
在钛酸钡晶胞中Ba2+周围距离最近且相等的O2−数目为 。
阿伏伽德罗常数为N ,则钛酸钡晶体的密度为 g/cm3。
A
(列出计算式)
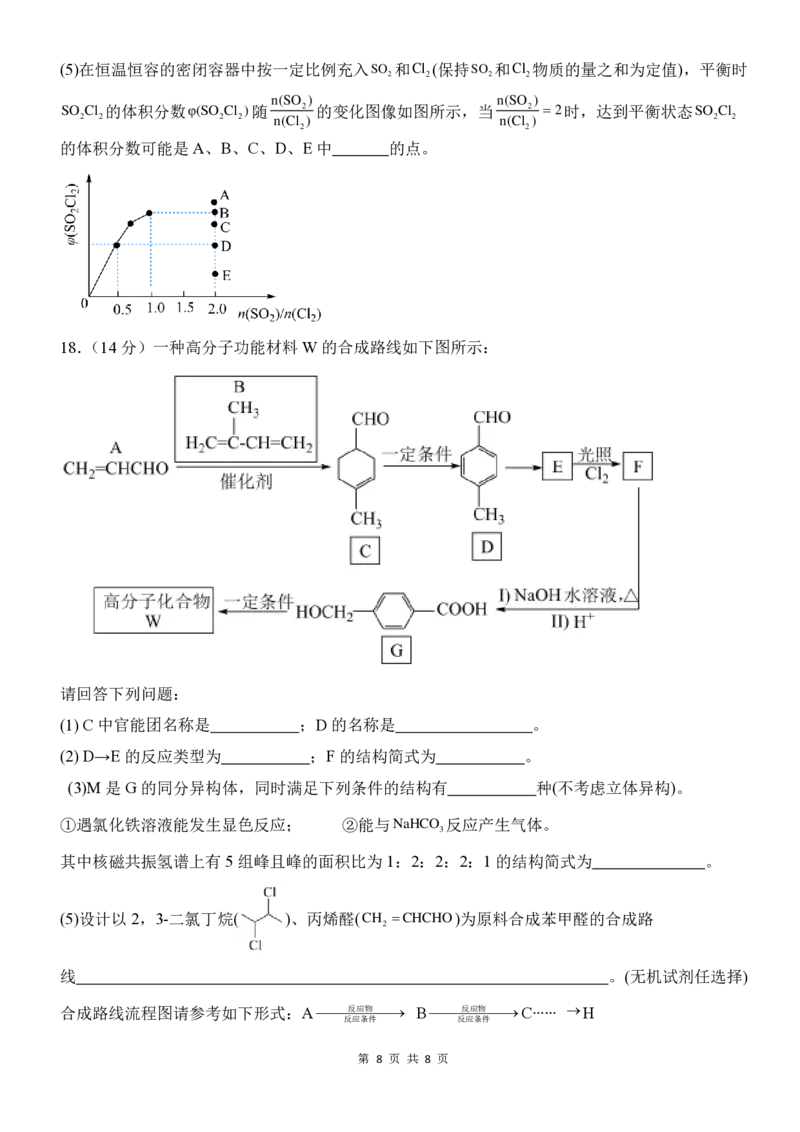
17.(14分)二氯化砜(SO Cl )用作药剂、有机氯化剂,及用于制造染料、橡胶等。无水条件下合
2 2
成SO
2
Cl
2
的反应为: SO
2
(g) + Cl
2
(g) ⇌ SO
2
Cl
2
(g) H=−67kJmol−1。请回答下列问题:
(1)SO Cl 分子的空间结构为______________。
2 2
(2)若上述正反应活化能为akJmol−1,则逆反应的活化能为 kJmol−1(用含 a的代数式表示)。
(3)在起始温度相同、体积相同的甲、乙两个容器中均充入 1molSO 和1molCl ,发生上述反应,有
2 2
关实验如下:
容器 甲 乙
条件 恒温恒容 恒容绝热
SO 平衡转化率 α(甲) α(乙)
2
达到平衡时所用时间(t) t(甲) t(乙)
α(甲) α(乙)(填“”、“=”或“”,下同),t(甲) t(乙)。
(4)在容积可变密闭反应器中充入 1molSO 和2.6molCl 合成SO Cl ,测得体系内SO 平衡转化率与温
2 2 2 2 2
度(℃)、压强(kPa)的关系如图所示。
② Y代表的物理量是 (填“温度”或“压强”)。
②T℃,若SO 平衡转化率为 60%,SO Cl 的分压为6.0kPa,则T℃时该反应的分压平衡常数
0 2 2 2 0
K 为 kPa−1(用平衡分压代替平衡浓度计算)。
p
第 7 页 共 8 页(5)在恒温恒容的密闭容器中按一定比例充入SO 和Cl (保持SO 和Cl 物质的量之和为定值),平衡时
2 2 2 2
n(SO ) n(SO )
SO Cl 的体积分数φ(SO Cl )随 2 的变化图像如图所示,当 2 =2时,达到平衡状态SO Cl
2 2 2 2 n(Cl ) n(Cl ) 2 2
2 2
的体积分数可能是 A、B、C、D、E中 的点。
18.(14分)一种高分子功能材料 W的合成路线如下图所示:
请回答下列问题:
(1) C 中官能团名称是 ;D的名称是 。
(2) D→E的反应类型为 ;F 的结构简式为 。
(3)M 是G的同分异构体,同时满足下列条件的结构有 种(不考虑立体异构)。
①遇氯化铁溶液能发生显色反应; ②能与NaHCO 反应产生气体。
3
其中核磁共振氢谱上有 5组峰且峰的面积比为 1:2:2:2:1的结构简式为 。
(5)设计以 2,3-二氯丁烷( )、丙烯醛(CH =CHCHO)为原料合成苯甲醛的合成路
2
线 。(无机试剂任选择)
合成路线流程图请参考如下形式:A⎯⎯⎯反应⎯物⎯⎯→ B⎯⎯⎯反应⎯物⎯⎯→C∙∙∙∙∙∙ →H
反应条件 反应条件
第 8 页 共 8 页