文档内容
保密★考试结束前
六校联盟2024学年第一学期期中联考
(2024.11)
高二化学试题卷
命题、审题:温岭市箬横中学(陈剑) 台州市金清中学(周彬)
考生须知:
1.本试题卷分选择题和非选择题两部分。全卷共8页,满分100分,考试时间90分钟。
2.考生答题前,务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔填写在答题纸上。
3.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 K-39 S-32 Cl-35.5
Fe-56 Cu-64 Mn-55 Ba-137
选择题部分
一、选择题(本大题共25小题,每小题2分,共50分。每小题列出的四个备选项中只有一个是符合题目
要求的,不选、多选、错选均不得分)
1.下列物质中,属于强电解质的是
A.CH COOH B.NH C.CH CH OH D.BaSO
3 3 3 2 4
2.下列物质的水溶液因水解而呈酸性的是
A.KHSO B.NaHSO C.H SO D.NH Cl
4 3 2 4 4
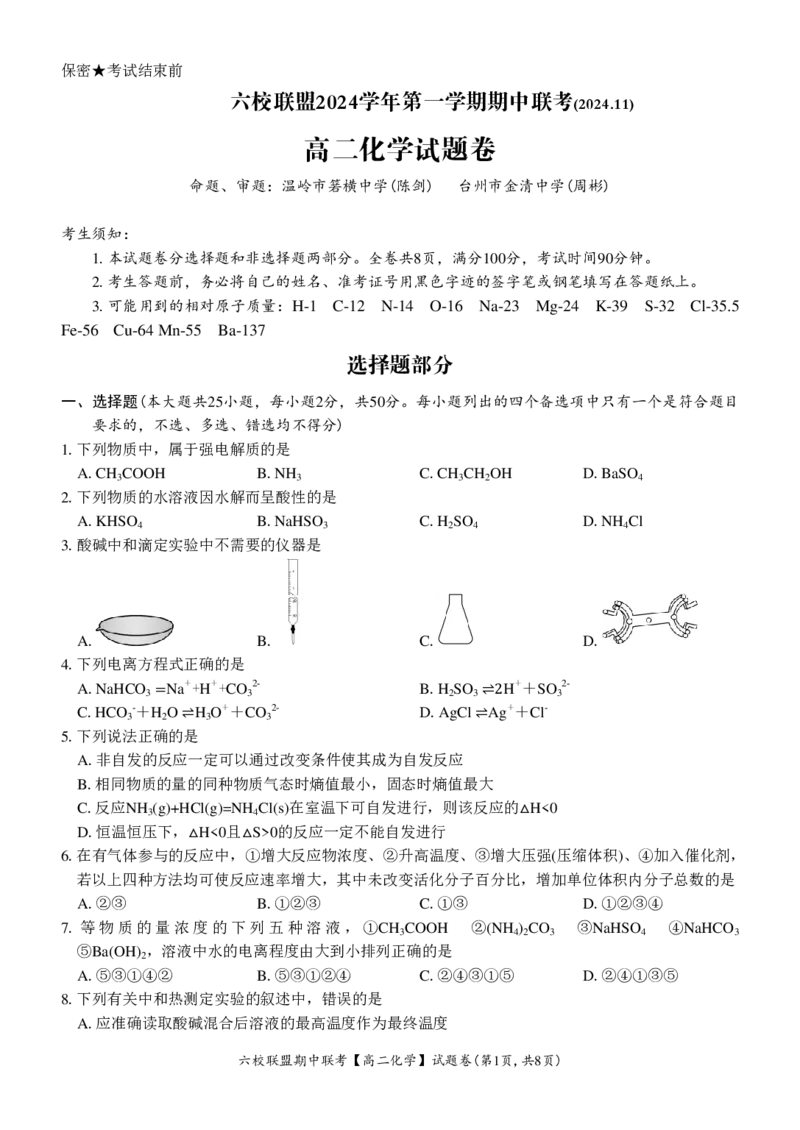
3.酸碱中和滴定实验中不需要的仪器是
A. B. C. D.
4.下列电离方程式正确的是
A.NaHCO =Na++H++CO 2- B.H SO ⇌2H++SO 2-
3 3 2 3 3
C.HCO -+H O ⇌H O++CO 2- D.AgCl ⇌Ag++Cl-
3 2 3 3
5.下列说法正确的是
A.非自发的反应一定可以通过改变条件使其成为自发反应
B.相同物质的量的同种物质气态时熵值最小,固态时熵值最大
C.反应NH (g)+HCl(g)=NH Cl(s)在室温下可自发进行,则该反应的△H<0
3 4
D.恒温恒压下,△H<0且△S>0的反应一定不能自发进行
6.在有气体参与的反应中,①增大反应物浓度、②升高温度、③增大压强(压缩体积)、④加入催化剂,
若以上四种方法均可使反应速率增大,其中未改变活化分子百分比,增加单位体积内分子总数的是
A.②③ B.①②③ C.①③ D.①②③④
7.等物质的量浓度的下列五种溶液,①CH COOH ②(NH ) CO ③NaHSO ④NaHCO
3 4 2 3 4 3
⑤Ba(OH) ,溶液中水的电离程度由大到小排列正确的是
2
A.⑤③①④② B.⑤③①②④ C.②④③①⑤ D.②④①③⑤
8.下列有关中和热测定实验的叙述中,错误的是
A.应准确读取酸碱混合后溶液的最高温度作为最终温度
六校联盟期中联考【高二化学】试题卷(第1页,共8页)
{#{QQABYYYAggCoQBBAAQhCEwWyCgIQkgCCCQgOwBAMsAAAyQFABAA=}#}B.为了保证0.50mo1/L的盐酸完全被中和,通常使氢氧化钠溶液稍稍过量
C.用温度计测量盐酸的温度后,用水冲洗干净,再测量氢氧化钠溶液的温度
D.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
9.下列热化学方程式正确的是
A.已知甲烷的燃烧热ΔH= -890.3 kJ/mol,则表示甲烷燃烧热的热化学方程式为:
CH (g)+2O (g)= CO (g)+2H O(g) ΔH= -890.3kJ/mol
4 2 2 2
B.500℃、30MPa下,将0.5mol N 和1.5mol H 置于密闭容器中充分反应生成NH (g),放热19.3kJ,其
2 2 3
热化学方程式为:N (g)3H (g)⇌2NH (g)H38.6kJmol1
2 2 3
C.已知在120℃101kPa下,1gH 燃烧生成水蒸气放出121kJ热量,其热化学方程式为:
2
H (g)+1/20 (g)=H O (g) ΔH=-242kJ∙mol-1
2 2 2
D.25℃、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ∙mol-1,硫酸溶液与氢氧化
钾溶液反应的热化学方程式为:H SO (aq)+2KOH(aq)=K SO (aq)+2H O(1) ΔH=-57.3kJ∙mol-1
2 4 2 4 2
10.下列事实不能用勒夏特列原理解释的是
A.将AlCl 溶液加热、蒸干、灼烧,最终得到Al O
3 2 3
B.将红棕色NO 压缩体积后颜色变深
2
C.用Na CO 溶液将锅炉水垢中的CaSO 转化为CaCO
2 3 4 3
D.工业上生产硫酸的过程中使用过量的空气以提高SO 的利用率
2
11.反应H (g)+2ICl(g)═ I (g)+2HCl(g) ΔH=-218 kJ/mol分两步进行,反应如下:
2 2
第一步:H (g)+ICl(g)═ HCl(g)+HI(g) ΔH= -83.2 kJ/mol (慢反应)
2
第二步:HI(g)+ICl(g)═ I (g)+HCl(g) (快反应)
2
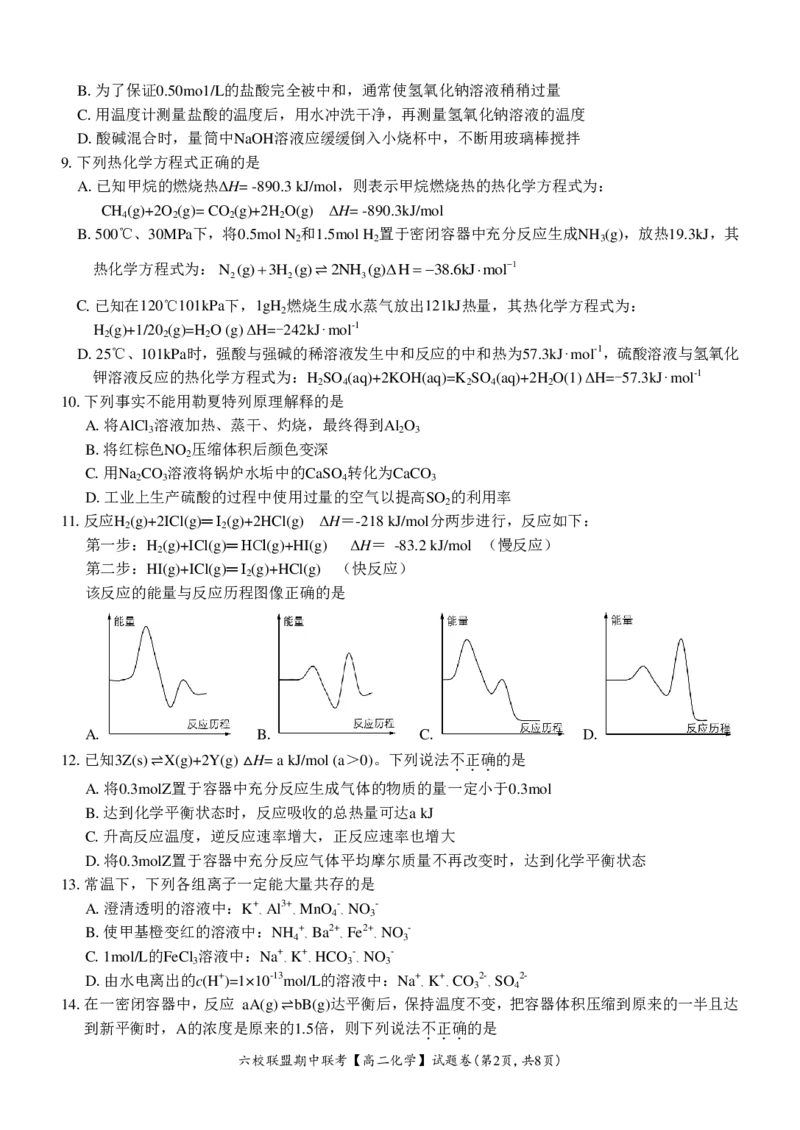
该反应的能量与反应历程图像正确的是
A. B. C. D.
12.已知3Z(s) ⇌X(g)+2Y(g) △H= a kJ/mol (a>0)。下列说法不正确的是
...
A.将0.3molZ置于容器中充分反应生成气体的物质的量一定小于0.3mol
B.达到化学平衡状态时,反应吸收的总热量可达a kJ
C.升高反应温度,逆反应速率增大,正反应速率也增大
D.将0.3molZ置于容器中充分反应气体平均摩尔质量不再改变时,达到化学平衡状态
13.常温下,下列各组离子一定能大量共存的是
A.澄清透明的溶液中:K+ Al3+ MnO - NO -
、 、 4、 3
B.使甲基橙变红的溶液中:NH + Ba2+ Fe2+ NO -
4 、 、 、 3
C.1mol/L的FeCl 溶液中:Na+ K+ HCO - NO -
3 、 、 3、 3
D.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+ K+ CO 2- SO 2-
、 、 3 、 4
14.在一密闭容器中,反应 aA(g) ⇌bB(g)达平衡后,保持温度不变,把容器体积压缩到原来的一半且达
到新平衡时,A的浓度是原来的1.5倍,则下列说法不正确的是
...
六校联盟期中联考【高二化学】试题卷(第2页,共8页)
{#{QQABYYYAggCoQBBAAQhCEwWyCgIQkgCCCQgOwBAMsAAAyQFABAA=}#}A.平衡向正反应方向移动 B.物质A的转化率变小
C.物质B的质量分数增加了 D.a>b
15.25℃时,水的电离达到平衡:H O⇌H++OH-。下列叙述正确的是
2
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体NaHSO ,平衡逆向移动,pH减小
4
C.向水中加入少量NH Cl固体,平衡正向移动,K 增大
4 W
D.将水加热至90℃,K 增大,pH不变
W
16.下列有关工业合成氨反应:N (g)+3H (g)⇌2NH (g) ΔH<0的说法不正确的是
2 2 3 ...
A.合成氨采取循环操作目的是提高氮气和氢气的利用率
B.除原料气中CO反应:[Cu(NH ) ]+(aq)+CO(g)+NH (g)⇌[Cu(NH ) CO]+(aq)ΔH<0适宜低温高压环境
3 2 3 3 3
C.合成塔压强调控在10MPa~30MPa之间,是对生产设备条件和经济成本的综合考虑结果
D.合成塔使用热交换控制体系温度400~500℃左右,主要目的是有利于平衡正向移动
17.在容积一定的密闭容器中:CO(g)+H O(g) ⇌CO (g)+H (g) ΔH<0,下列正确的是
2 2 2
A.图Ⅰ研究的是t 时增大压强对反应速率的影响
0
B.图Ⅱ研究的是t 时增大压强(缩小容积)或使用催化剂对反应速率的影响
0
C.图Ⅲ研究的是催化剂对化学平衡的影响,且乙使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且甲的温度较高
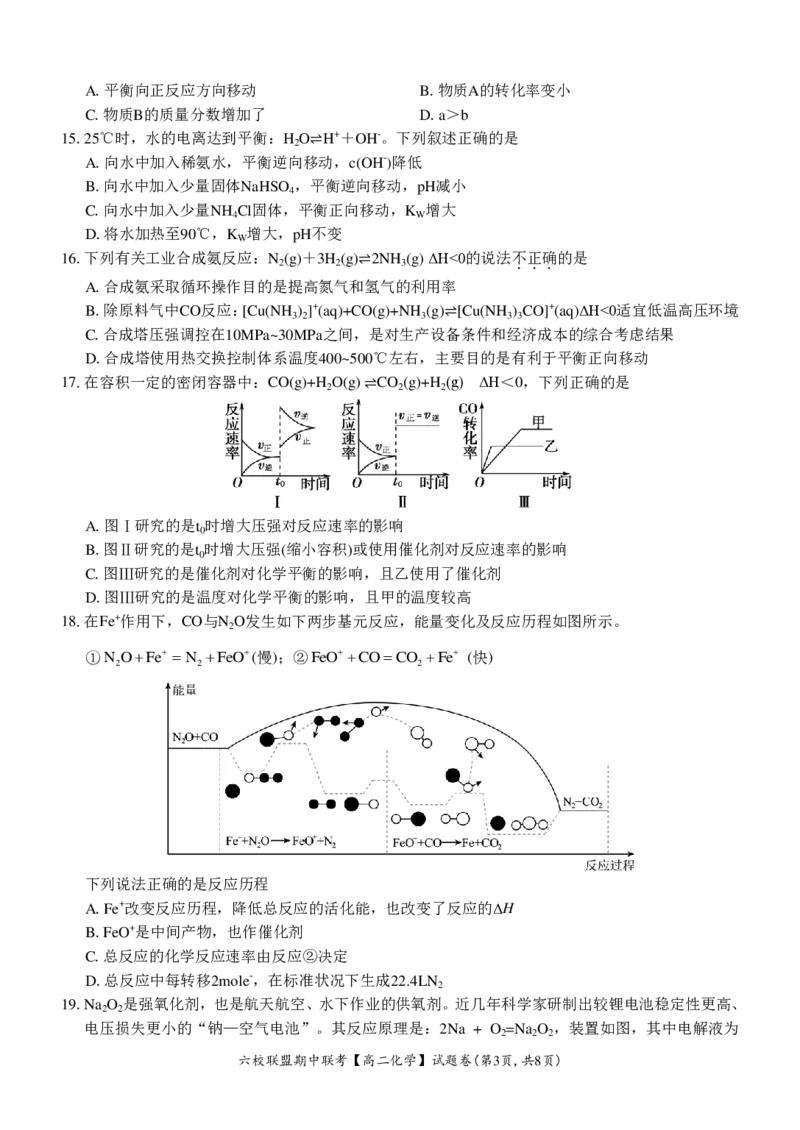
18.在Fe+作用下,CO与N O发生如下两步基元反应,能量变化及反应历程如图所示。
2
①N OFe N FeO(慢);②FeOCOCO Fe (快)
2 2 2
下列说法正确的是反应历程
A.Fe+改变反应历程,降低总反应的活化能,也改变了反应的ΔH
B.FeO+是中间产物,也作催化剂
C.总反应的化学反应速率由反应②决定
D.总反应中每转移2mole-,在标准状况下生成22.4LN
2
19.Na O 是强氧化剂,也是航天航空、水下作业的供氧剂。近几年科学家研制出较锂电池稳定性更高、
2 2
电压损失更小的“钠—空气电池”。其反应原理是:2Na + O =Na O ,装置如图,其中电解液为
2 2 2
六校联盟期中联考【高二化学】试题卷(第3页,共8页)
{#{QQABYYYAggCoQBBAAQhCEwWyCgIQkgCCCQgOwBAMsAAAyQFABAA=}#}NaPF ,可传导Na+。电池放电时,下列说法不正确的是
6 ...
A.A电极为负极,发生氧化反应
B.Na+向B电极移动
C.外电路电流方向为B→A
D.当转移电子0.2mol时,消耗1.12L(标准状况)O
2
20.常温下,等体积等pH的盐酸和醋酸两溶液,下列说法正确的是
A.分别与适量且等量的锌粒反应,平均反应速率前者大
B.两溶液导电能力相同
C.分别与等浓度的氢氧化钠溶液反应至中性,消耗的氢氧化钠的体积前者多
D.稀释10倍后,盐酸的pH比醋酸溶液的pH小
21.下列说法正确的是
A.常温下pH=2的CH COOH溶液和pH=2的H SO 溶液,c(CH COO-)=2c(SO 2-)
3 2 4 3 4
B.300 mL0.2 mol·L-1 NH Cl溶液和200mL0.3mol·L-1 NH Cl 溶液中的n(NH +)相同
4 4 4
C.稀释1mol·L-1的HCl溶液,溶液中的所有离子浓度均下降
D.常温下pH=2的HClO溶液与pH=12的NaOH溶液等体积混合,充分反应后pH>7
22.一定条件下,两体积均为1L的恒容密闭容器中发生反应:CO(g)+2H (g) ⇌CH OH(g) ΔH,容器中各
2 3
物质起始量如表:
容器 温度 CO H CH OH H 平衡转化率
2 3 2
Ⅰ T℃ amol 2mol 0mol 50%
Ⅱ T℃ 0.5mol 1mol 0mol 50%
下列说法正确的是
A.a=1
B.容器Ⅰ中5min后达到平衡,则该段时间v(CO)=0.01mol·L-1·min-1
C.若温度升高,该反应平衡平衡常数K变为1,则ΔH<0
D.T时,若起始时向容器中充入CO、H 、CH OH各1mol,则v >v
2 3 逆 正
23.已知25℃下列物质的溶度积常数:FeS:K =6.3×10-18;CuS:K =1.3×10-36;ZnS:K =1.6×10-24。
sp sp sp
以下说法正确的是
A.25℃时,饱和CuS溶液中Cu2+的浓度为 1.3×10-18mol·L-1
B.同温度下,CuS的溶解度大于ZnS的溶解度
C.因为H SO 是强酸,故CuSO +H S=CuS↓+H SO 不能发生
2 4 4 2 2 4
D.向物质的量浓度相同的FeCl 、ZnCl 的混合液中加入少量Na S,只有FeS沉淀生成
2 2 2
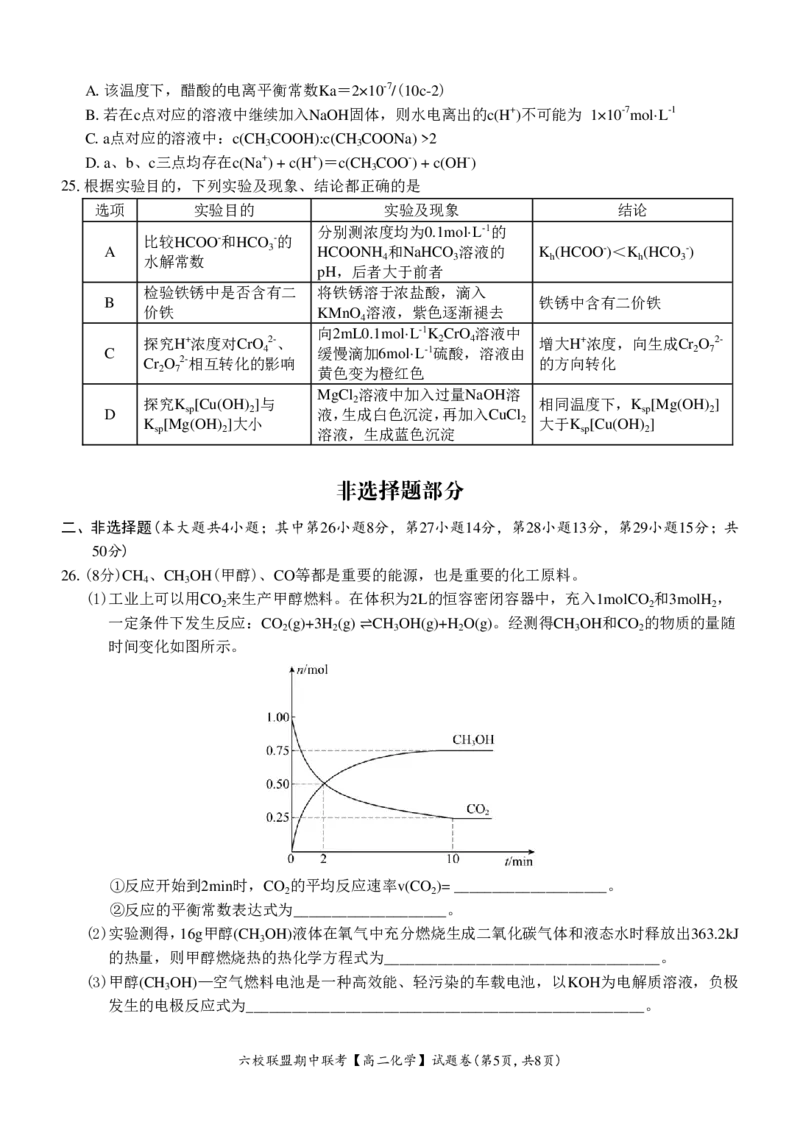
24.25℃时,将1.0L c mol·L-1 CH COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合
3
溶液中加入CH COOH或 NaOH固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙
3
述错误的是
六校联盟期中联考【高二化学】试题卷(第4页,共8页)
{#{QQABYYYAggCoQBBAAQhCEwWyCgIQkgCCCQgOwBAMsAAAyQFABAA=}#}A.该温度下,醋酸的电离平衡常数Ka=2×10-7/(10c-2)
B.若在c点对应的溶液中继续加入NaOH固体,则水电离出的c(H+)不可能为 1×10-7mol·L-1
C.a点对应的溶液中:c(CH COOH):c(CH COONa) >2
3 3
D.a、b、c三点均存在c(Na+) + c(H+)=c(CH COO-) + c(OH-)
3
25.根据实验目的,下列实验及现象、结论都正确的是
选项 实验目的 实验及现象 结论
分别测浓度均为0.1mol·L-1的
比较HCOO-和HCO -的
A 3 HCOONH 和NaHCO 溶液的 K (HCOO-)<K (HCO -)
水解常数 4 3 h h 3
pH,后者大于前者
检验铁锈中是否含有二 将铁锈溶于浓盐酸,滴入
B 铁锈中含有二价铁
价铁 KMnO 溶液,紫色逐渐褪去
4
向2mL0.1mol·L-1K CrO 溶液中
探究H+浓度对CrO 2-、 2 4 增大H+浓度,向生成Cr O 2-
C 4 缓慢滴加6mol·L-1硫酸,溶液由 2 7
Cr O 2-相互转化的影响 的方向转化
2 7 黄色变为橙红色
MgCl 溶液中加入过量NaOH溶
探究K [Cu(OH) ]与 2 相同温度下,K [Mg(OH) ]
D sp 2 液,生成白色沉淀,再加入CuCl sp 2
K [Mg(OH) ]大小 2 大于K [Cu(OH) ]
sp 2 溶液,生成蓝色沉淀 sp 2
非选择题部分
二、非选择题(本大题共4小题;其中第26小题8分,第27小题14分,第28小题13分,第29小题15分;共
50分)
26.(8分)CH 、CH OH(甲醇)、CO等都是重要的能源,也是重要的化工原料。
4 3
(1)工业上可以用CO 来生产甲醇燃料。在体积为2L的恒容密闭容器中,充入1molCO 和3molH ,
2 2 2
一定条件下发生反应:CO (g)+3H (g) ⇌CH OH(g)+H O(g)。经测得CH OH和CO 的物质的量随
2 2 3 2 3 2
时间变化如图所示。
①反应开始到2min时,CO 的平均反应速率v(CO )= ____________________。
2 2
②反应的平衡常数表达式为____________________。
(2)实验测得,16g甲醇(CH OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.2kJ
3
的热量,则甲醇燃烧热的热化学方程式为____________________________________。
(3)甲醇(CH OH)—空气燃料电池是一种高效能、轻污染的车载电池,以KOH为电解质溶液,负极
3
发生的电极反应式为____________________________________________________。
六校联盟期中联考【高二化学】试题卷(第5页,共8页)
{#{QQABYYYAggCoQBBAAQhCEwWyCgIQkgCCCQgOwBAMsAAAyQFABAA=}#}27.(14分)下表是25℃时某些弱酸的电离平衡常数。
化学式 H CO HClO HF CH COOH
2 3 3
K
a
Ka
1
4.5107 Ka
2
4.71011 4.0108 4.0104 未知
(1)0.1mol/LNaF溶液中离子浓度由大到小的顺序是____________________。
(2)pH相同的①NaHCO 、②NaClO、③NaF溶液,其物质的量浓度由大到小的顺序为_________。(填
3
序号)
(3)现有浓度为0.01 mol/L的HClO溶液,求此时c(H+)为______________。
(4)25℃时,向NaClO溶液中通入少量CO ,反应的离子方程式为____________________________。
2
(5)常温下,稀CH COOH溶液加水稀释过程中,下列数据变大的是__________。
3
c(H) c(OH-)
A.c(H+) B. C.c(H+)·c(OH-) D.
c(CH COOH) c(H+)
3
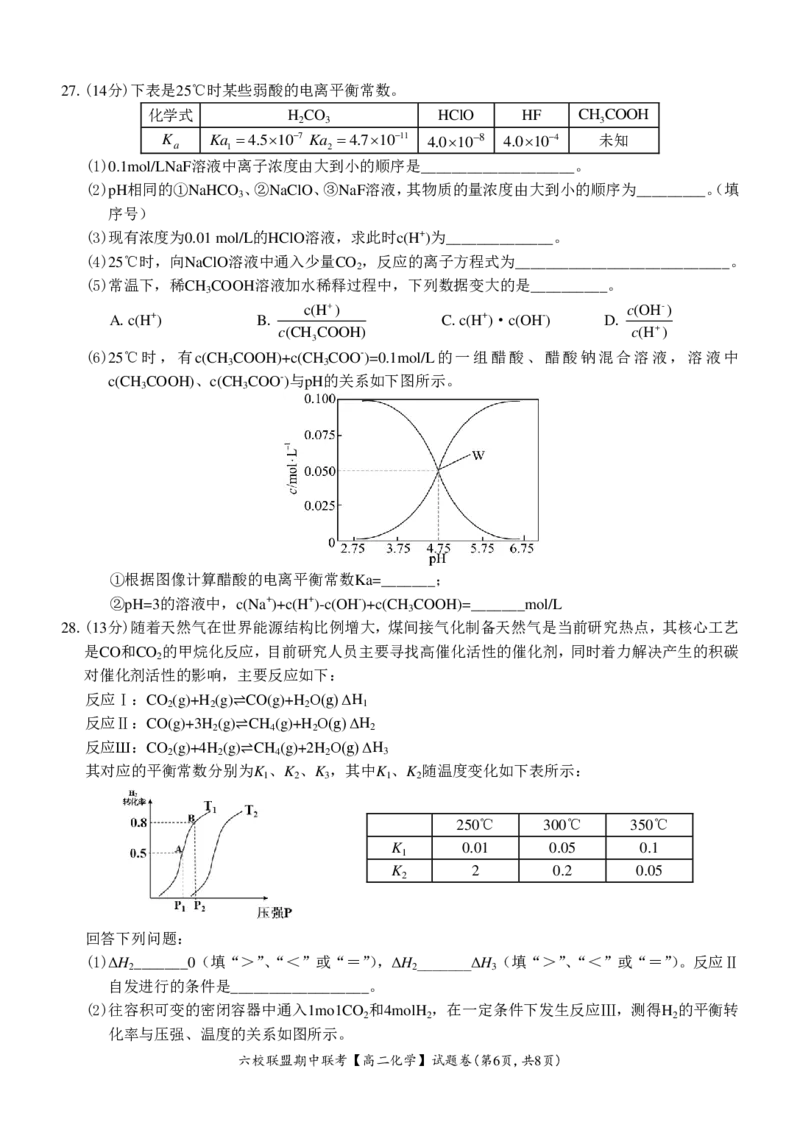
(6)25℃时,有c(CH COOH)+c(CH COO-)=0.1mol/L的一组醋酸、醋酸钠混合溶液,溶液中
3 3
c(CH COOH)、c(CH COO-)与pH的关系如下图所示。
3 3
①根据图像计算醋酸的电离平衡常数Ka=_______;
②pH=3的溶液中,c(Na+)+c(H+)-c(OH-)+c(CH COOH)=_______mol/L
3
28.(13分)随着天然气在世界能源结构比例增大,煤间接气化制备天然气是当前研究热点,其核心工艺
是CO和CO 的甲烷化反应,目前研究人员主要寻找高催化活性的催化剂,同时着力解决产生的积碳
2
对催化剂活性的影响,主要反应如下:
反应Ⅰ:CO (g)+H (g)⇌CO(g)+H O(g) ΔH
2 2 2 1
反应Ⅱ:CO(g)+3H (g)⇌CH (g)+H O(g) ΔH
2 4 2 2
反应Ш:CO (g)+4H (g)⇌CH (g)+2H O(g) ΔH
2 2 4 2 3
其对应的平衡常数分别为K 、K 、K ,其中K 、K 随温度变化如下表所示:
1 2 3 1 2
250℃ 300℃ 350℃
K 0.01 0.05 0.1
1
K 2 0.2 0.05
2
回答下列问题:
(1)ΔH _______0(填“>”、“<”或“=”),ΔH _______ΔH(填“>”、“<”或“=”)。反应Ⅱ
2 2 3
自发进行的条件是__________________。
(2)往容积可变的密闭容器中通入1mo1CO 和4molH ,在一定条件下发生反应Ⅲ,测得H 的平衡转
2 2 2
化率与压强、温度的关系如图所示。
六校联盟期中联考【高二化学】试题卷(第6页,共8页)
{#{QQABYYYAggCoQBBAAQhCEwWyCgIQkgCCCQgOwBAMsAAAyQFABAA=}#}①能说明上述反应已达到平衡状态的是_______(选填字母)。
A.4v (H )=v (CO ) B.CO 与H 的物质的量之比保持不变
正 2 逆 2 2 2
C.H-H键、H-O键断裂速率相等 D.CH 的体积分数保持不变
4
E.混合气体的密度保持不变 F.混合气体的平均分子质量保持不变
②据图可知,T _______T (填“>”、“<”或“=”)。
1 2
③若反应达到平衡点A,此时容器的体积为2L,则该温度下反应Ⅲ的平衡常数K=_______。
(3)300℃时,往容积固定的10L密闭容器中通入4molCO 、10molH 、4molCH 和1molH O发生反应
2 2 4 2
Ⅲ,此时v _______v (填“>”、“<”或“=”)
正 逆
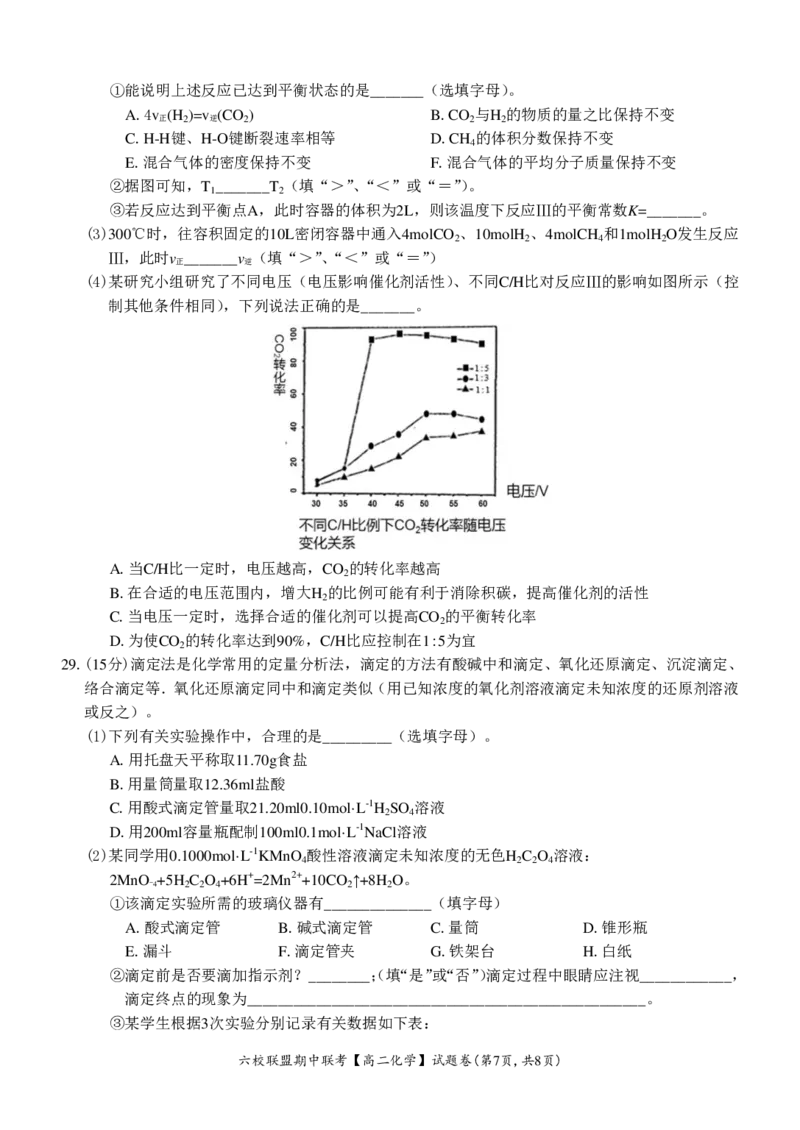
(4)某研究小组研究了不同电压(电压影响催化剂活性)、不同C/H比对反应Ⅲ的影响如图所示(控
制其他条件相同),下列说法正确的是_______。
A.当C/H比一定时,电压越高,CO 的转化率越高
2
B.在合适的电压范围内,增大H 的比例可能有利于消除积碳,提高催化剂的活性
2
C.当电压一定时,选择合适的催化剂可以提高CO 的平衡转化率
2
D.为使CO 的转化率达到90%,C/H比应控制在1:5为宜
2
29.(15分)滴定法是化学常用的定量分析法,滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、
络合滴定等.氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液
或反之)。
(1)下列有关实验操作中,合理的是_________(选填字母)。
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36ml盐酸
C.用酸式滴定管量取21.20ml0.10mol·L-1H SO 溶液
2 4
D.用200ml容量瓶配制100ml0.1mol·L-1NaCl溶液
(2)某同学用0.1000mol·L-1KMnO 酸性溶液滴定未知浓度的无色H C O 溶液:
4 2 2 4
2MnO +5H C O +6H+=2Mn2++10CO ↑+8H O。
-4 2 2 4 2 2
①该滴定实验所需的玻璃仪器有______________(填字母)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶
E.漏斗 F.滴定管夹 G.铁架台 H.白纸
②滴定前是否要滴加指示剂?________;(填“是”或“否”)滴定过程中眼睛应注视____________,
滴定终点的现象为____________________________________________________。
③某学生根据3次实验分别记录有关数据如下表:
六校联盟期中联考【高二化学】试题卷(第7页,共8页)
{#{QQABYYYAggCoQBBAAQhCEwWyCgIQkgCCCQgOwBAMsAAAyQFABAA=}#}待测H C O 溶液的 0.1000mol/LKnO 的体积(mL)
滴定次数 2 2 4 4
体积/mL 滴定前刻度 滴定后刻度 溶液体积/mL
第一次 25.00 0.00 26.11 26.11
第二次 25.00 1.56 30.30 28.74
第三次 25.00 0.22 26.31 26.09
依据上表数据列式计算该H C O 溶液的物质的量浓度为_____________。
2 2 4
④下列操作中可能使测定结果偏低的是__________ (填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO 标准液
4
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO 标准液时,开始仰视读数,滴定结束时俯视读数
4
(3)在化学分析中采用K CrO 为指示剂,以AgNO 标准溶液滴定溶液中的Cl-,利用Ag+与CrO 2- 生成
2 4 3 4
砖红色沉淀,指示到达滴定终点。当溶液中Cl﹣恰好沉淀完全(物质的量浓度等于1.0×10﹣5mol/L)
时,溶液中c(Ag+)=_____________mol/L,此时溶液中c(CrO 2-)=_____________mol/L(已知Ag CrO 、
4 2 4
AgCl的K 分别为2.0×10-12和2.0×10-10)。
sp
六校联盟期中联考【高二化学】试题卷(第8页,共8页)
{#{QQABYYYAggCoQBBAAQhCEwWyCgIQkgCCCQgOwBAMsAAAyQFABAA=}#}