文档内容
银川一中2025届高三年级第四次月考 效,
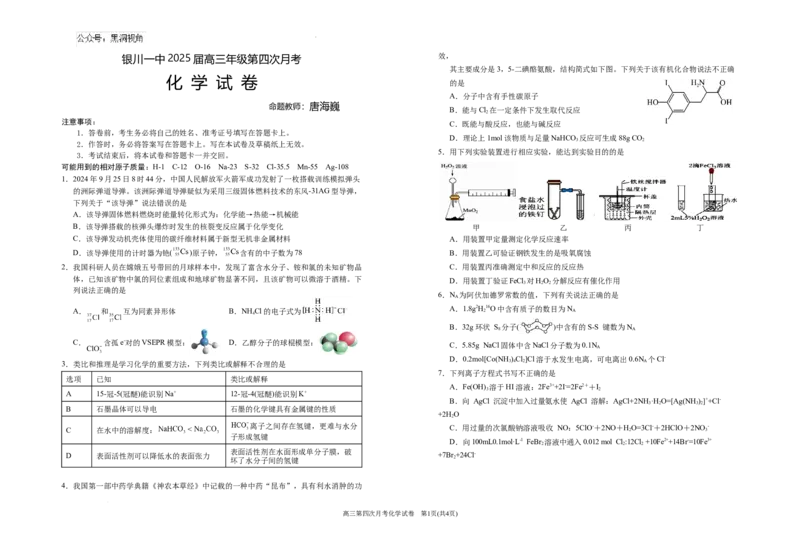
其主要成分是3,5-二碘酪氨酸,结构简式如下图。下列关于该有机化合物说法不正确
化 学 试 卷
的是
A.分子中含有手性碳原子
命题教师:唐海巍
B.能与Cl 在一定条件下发生取代反应
2
注意事项:
C.既能与酸反应,也能与碱反应
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
D.理论上1mol该物质与足量NaHCO 反应可生成88g CO
3 2
2.作答时,务必将答案写在答题卡上。写在本试卷及草稿纸上无效。
5.用下列实验装置进行相应实验,能达到实验目的的是
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Mn-55 Ag-108
1.2024年9月25日8时44分,中国人民解放军火箭军成功发射了一枚搭载训练模拟弹头
的洲际弹道导弹。该洲际弹道导弹疑似为采用三级固体燃料技术的东风-31AG型导弹,
下列关于“该导弹”说法错误的是
A.该导弹固体燃料燃烧时能量转化形式为:化学能→热能→机械能
B.该导弹搭载的核弹头爆炸时发生的核裂变反应属于化学变化 甲 乙 丙 丁
C.该导弹发动机壳体使用的碳纤维材料属于新型无机非金属材料 A.用装置甲定量测定化学反应速率
D.该导弹使用的计时器为铯( )原子钟, 含有的中子数为78 B.用装置乙可验证钢铁发生的是吸氧腐蚀
2.我国科研人员在嫦娥五号带回的月球样本中,发现了富含水分子、铵和氯的未知矿物晶 C.用装置丙准确测定中和反应的反应热
体,已知该矿物中氯的同位素组成和地球矿物显著不同,且该矿物可以微溶于酒精。下 D.用装置丁验证FeCl 对HO 分解反应有催化作用
3 2 2
列说法正确的是
6.N 为阿伏加德罗常数的值,下列有关说法正确的是
A
A.1.8g2H16O中含有质子的数目为N
A. 和 互为同素异形体 B.NH Cl的电子式为 2 A
4
B.32g环状 S 分子( )中含有的S-S 键数为N
8 A
C. 含孤e-对的VSEPR模型: D.乙醇分子的球棍模型:
C.5.85g NaCl固体中含NaCl分子数为0.1N
A
D.0.2mol[Co(NH )Cl]Cl溶于水发生电离,可电离出0.6N 个Cl-
3.类比和推理是学习化学的重要方法,下列类比或解释不合理的是 3 4 2 A
7.下列离子方程式书写不正确的是
选项 已知 类比或解释
A.Fe(OH) 溶于HI溶液:2Fe3++2I-=2Fe2++I
3 2
A 15-冠-5(冠醚)能识别Na+ 12-冠-4(冠醚)能识别K+
B.向 AgCl 沉淀中加入过量氨水使 AgCl 溶解:AgCl+2NH·H O=[Ag(NH)]++Cl-
3 2 3 2
B 石墨晶体可以导电 石墨的化学键具有金属键的性质
+2H O
2
离子之间存在氢键,更难与水分 C.用过量的次氯酸钠溶液吸收 NO:5ClO-+2NO+HO=3Cl-+2HClO+2NO -
C 在水中的溶解度: 2 3
子形成氢键
D.向100mL0.1mol·L-1 FeBr 溶液中通入0.012 mol Cl:12Cl +10Fe2++14Br-=10Fe3+
2 2 2
表面活性剂在水面形成单分子膜,破
D 表面活性剂可以降低水的表面张力 +7Br+24Cl-
坏了水分子间的氢键 2
4.我国第一部中药学典籍《神农本草经》中记载的一种中药“昆布”,具有利水消肿的功
高三第四次月考化学试卷 第1页(共4页)
学科网(北京)股份有限公司下列说法正确的是
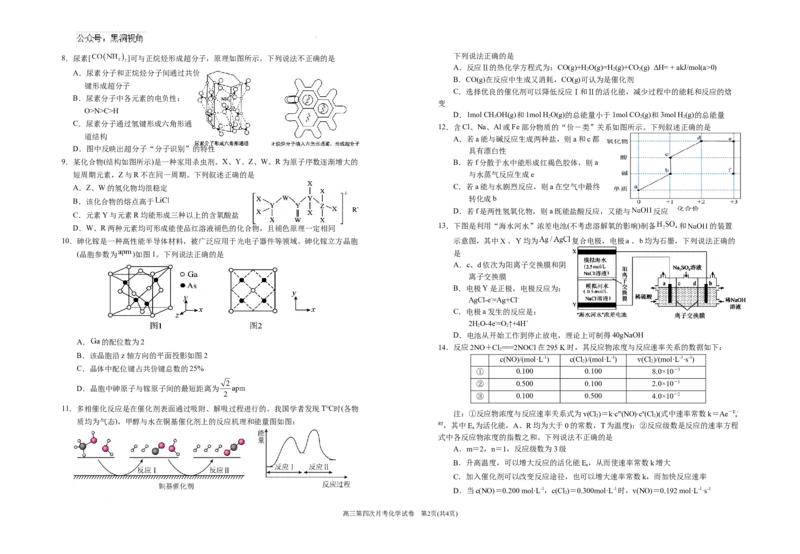
8.尿素[ ]可与正烷烃形成超分子,原理如图所示。下列说法不正确的是
A.反应Ⅱ的热化学方程式为:CO(g)+HO(g)=H (g)+CO (g) ΔH= + akJ/mol(a>0)
2 2 2
A.尿素分子和正烷烃分子间通过共价
B.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
键形成超分子
C.选择优良的催化剂可以降低反应Ⅰ和Ⅱ的活化能,减少过程中的能耗和反应的焓
B.尿素分子中各元素的电负性:
变
O>N>C>H
D.1mol CHOH(g)和1mol HO(g)的总能量小于1mol CO(g)和3mol H(g)的总能量
3 2 2 2
C.尿素分子通过氢键形成六角形通
12.含Cl、Na、Al或Fe部分物质的“价-类”关系如图所示。下列叙述正确的是
道结构
A.若a能与碱反应生成两种盐,则a和c都
D.图中反映出超分子“分子识别”的特性 具有漂白性
9.某化合物(结构如图所示)是一种家用杀虫剂。X、Y、Z、W、R为原子序数逐渐增大的 B.若f分散于水中能形成红褐色胶体,则a
短周期元素,Z与R不在同一周期。下列叙述正确的是 与水蒸气反应生成e
A.Z、W的氢化物均很稳定 C.若a能与水剧烈反应,则a在空气中最终
转化成b
B.该化合物的熔点高于
D.若f是两性氢氧化物,则a既能盐酸反应,又能与 反应
C.元素Y与元素R均能形成三种以上的含氧酸盐
13.下图是利用“海水河水”浓差电池(不考虑溶解氧的影响)制备 和 的装置
D.W、R两种元素均可形成能使品红溶液褪色的化合物,且褪色原理一定相同
10.砷化镓是一种高性能半导体材料,被广泛应用于光电子器件等领域。砷化镓立方晶胞 示意图,其中 、 均为 复合电极,电极 、 均为石墨,下列说法正确的
(晶胞参数为 )如图1。下列说法正确的是 是
A.c、d依次为阳离子交换膜和阴
离子交换膜
B.电极Y是正极,电极反应为:
AgCl-e-=Ag+Cl-
C.电极a发生的反应是:
2HO-4e-=O ↑+4H+
2 2
D.电池从开始工作到停止放电,理论上可制得40gNaOH
A. 的配位数为2
14.反应2NO+Cl===2NOCl在295 K时,其反应物浓度与反应速率关系的数据如下:
2
B.该晶胞沿z轴方向的平面投影如图2
c(NO)/(mol·L-1) c(Cl )/(mol·L-1) v(Cl )/(mol·L-1·s-1)
2 2
C.晶体中配位键占共价键总数的25% ① 0.100 0.100 8.0×10-3
② 0.500 0.100 2.0×10-1
D.晶胞中砷原子与镓原子间的最短距离为
③ 0.100 0.500 4.0×10-2
11.多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物
注:①反应物浓度与反应速率关系式为v(Cl)=k·cm(NO)·cn(Cl)(式中速率常数k=Ae-E/
2 2 a
质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
RT,其中E 为活化能,A、R均为大于0的常数,T为温度);②反应级数是反应的速率方程
a
式中各反应物浓度的指数之和。下列说法不正确的是
A.m=2,n=1,反应级数为3级
B.升高温度,可以增大反应的活化能E,从而使速率常数k增大
a
C.加入催化剂可以改变反应途径,也可以增大速率常数k,而加快反应速率
D.当c(NO)=0.200 mol·L-1,c(Cl )=0.300mol·L-1时,v(NO)=0.192 mol·L-1·s-1
2
高三第四次月考化学试卷 第2页(共4页)
学科网(北京)股份有限公司二、非选择题(共58分) (1)已知 CH 与 H 的燃烧热分别为 890kJ·mol-1,286kJ·mol-1,HO(l)=HO(g)
4 2 2 2
15.(14分) ∆H=+44kJ·mol-1,写出H(g)与CO(g)反应生成CH(g)和HO(g)的热化学方程式
2 2 4 2
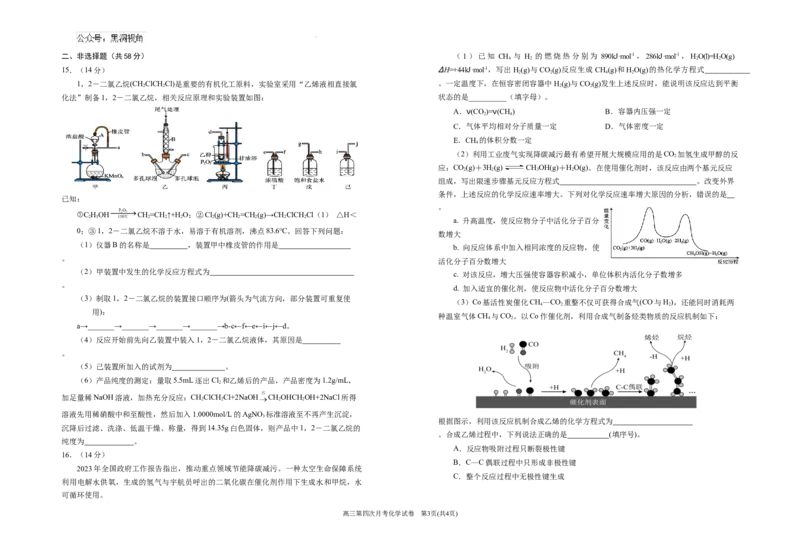
1,2-二氯乙烷(CHClCH Cl)是重要的有机化工原料,实验室采用“乙烯液相直接氯 。一定温度下,在恒容密闭容器中H(g)与CO(g)发生上述反应时,能说明该反应达到平衡
2 2 2 2
化法”制备1,2-二氯乙烷,相关反应原理和实验装置如图: 状态的是__________(填字母)。
A.ν(CO)=ν(CH) B.容器内压强一定
2 4
C.气体平均相对分子质量一定 D.气体密度一定
E.CH 的体积分数一定
4
(2)利用工业废气实现降碳减污最有希望开展大规模应用的是CO 加氢生成甲醇的反
2
应:CO(g)+3H(g) CHOH(g)+HO(g)。在使用催化剂时,该反应由两个基元反应
2 2 3 2
组成,写出限速步骤基元反应方程式 。改变外界
条件,上述反应的化学反应速率增大。下列对化学反应速率增大原因的分析,错误的是
已知:
。
①C HOH CH=CH ↑+H O;②Cl(g)+CH =CH (g)→CH ClCH Cl(1) △H<
2 5 2 2 2 2 2 2 2 2
a. 升高温度,使反应物分子中活化分子百分
0;③1,2-二氯乙烷不溶于水,易溶于有机溶剂,沸点83.6℃。回答下列问题:
数增大
(1)仪器B的名称是 ,装置甲中橡皮管的作用是
b. 向反应体系中加入相同浓度的反应物,使
。
活化分子百分数增大
(2)甲装置中发生的化学反应方程式为
c. 对该反应,增大压强使容器容积减小,单位体积内活化分子数增多
。
d. 加入适宜的催化剂,使反应物中活化分子百分数增大
(3)制取1,2-二氯乙烷的装置接口顺序为(箭头为气流方向,部分装置可重复使
(3)Co基活性炭催化CH—CO 重整不仅可获得合成气(CO与H),还能同时消耗两
4 2 2
用):
种温室气体CH 与CO。以Co作催化剂,利用合成气制备烃类物质的反应机制如下:
4 2
a→_______→_______→_______→_______→b-c←f←e←i←j←d。
(4)反应开始前先向乙装置中装入1,2-二氯乙烷液体,其原因是
。
(5)己装置所加入的试剂为 。
(6)产品纯度的测定:量取5.5mL逐出Cl 和乙烯后的产品,产品密度为1.2g/mL,
2
加足量稀NaOH溶液,加热充分反应:CHClCH Cl+2NaOH CHOHCH OH+2NaCl所得
2 2 2 2
溶液先用稀硝酸中和至酸性,然后加入1.0000mol/L的AgNO 标准溶液至不再产生沉淀,
3
根据图示,利用该反应机制合成乙烯的化学方程式为
沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的
。合成乙烯过程中,下列说法正确的是 (填序号)。
纯度为 。
A.反应物吸附过程只断裂极性键
16.(14分)
B.C—C偶联过程中只形成非极性键
2023年全国政府工作报告指出,推动重点领域节能降碳减污。一种太空生命保障系统
C.整个反应过程中无极性键生成
利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水
可循环使用。
高三第四次月考化学试卷 第3页(共4页)
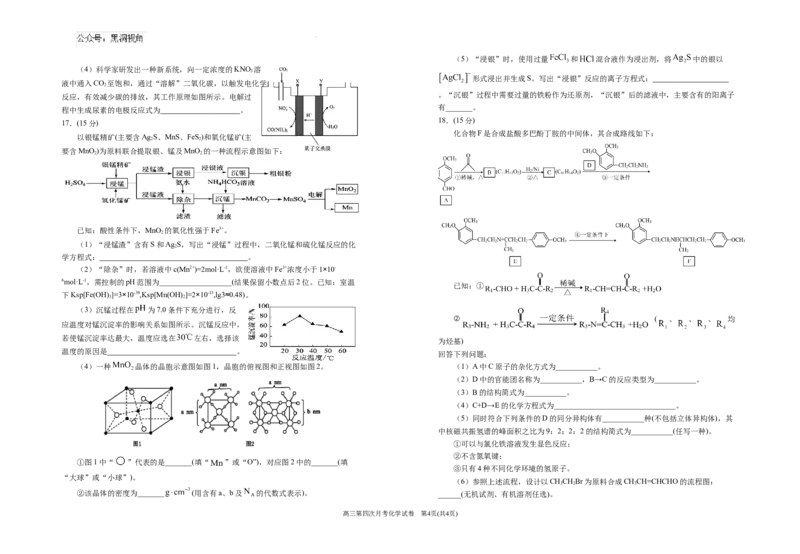
学科网(北京)股份有限公司(5)“浸银”时,使用过量 和 混合液作为浸出剂,将 中的银以
(4)科学家研发出一种新系统,向一定浓度的KNO 溶
3
形式浸出并生成S。写出“浸银”反应的离子方程式:
液中通入CO 至饱和,通过“溶解”二氧化碳,以触发电化学
2
反应,有效减少碳的排放,其工作原理如图所示。电解过 。“沉银”过程中需要过量的铁粉作为还原剂,“沉银”后的滤液中,主要含有的阳离子
有_______。
程中生成尿素的电极反应式为 。
18.(15分)
17.(15分)
化合物F是合成盐酸多巴酚丁胺的中间体,其合成路线如下:
以银锰精矿(主要含Ag S、MnS、FeS)和氧化锰矿(主
2 2
要含MnO)为原料联合提取银、锰及MnO 的一种流程示意图如下:
2 2
已知:酸性条件下,MnO 的氧化性强于Fe3+。
2
(1)“浸锰渣”含有S和Ag S,写出“浸锰”过程中,二氧化锰和硫化锰反应的化
2
学方程式: 。
(2)“除杂”时,若溶液中c(Mn2+)=2mol·L-1,欲使溶液中Fe3+浓度小于1×10-
6mol·L-1,需控制的pH范围为___________________(结果保留小数点后2位。已知:室温
已知:①
下Ksp[Fe(OH) ]=3×10-39,Ksp[Mn(OH) ]=2×10-13,lg3≈0.48)。
3 2
(3)沉锰过程在 为7.0条件下充分进行,反
② ( 、 、 、 均
应温度对锰沉淀率的影响关系如图所示。沉锰反应中,
若使锰沉淀率达最大,温度应选在 左右,选择该
为烃基)
温度的原因是 。
回答下列问题:
(4)一种 晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。 (1)A中C原子的杂化方式为___________。
(2)D中的官能团名称为___________,B→C的反应类型为___________。
(3)B的结构简式为___________。
(4)C+D→E的化学方程式为________________________________。
(5)同时符合下列条件的D的同分异构体有___________种(不包括立体异构体),其
中核磁共振氢谱的峰面积之比为9:2:2:2的结构简式为___________(任写一种)。
①可以与氯化铁溶液发生显色反应;
②不含氮氧键;
①图1中“ ”代表的是_______(填“ ”或“O”),对应图2中的_______(填
③只有4种不同化学环境的氢原子。
“大球”或“小球”)。
(6)参照上述流程,设计以CHCHBr为原料合成CHCH=CHCHO的流程图:
3 2 3
②该晶体的密度为_______ (用含有a、b及 的代数式表示)。 ______(无机试剂、有机溶剂任选)。
高三第四次月考化学试卷 第4页(共4页)
学科网(北京)股份有限公司