文档内容
梅河口市第五中学2024-2025 学年高二下学期开学考试
化学
一、选择题:本题共14 小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学无处不在,下列关于生产、生活中的化学描述错误的是
A.船舶外壳镶嵌锌块,利用了牺牲阳极保护法来保护金属船体
B.焰火、霓虹灯光、激光等都和原子核外电子跃迁有关
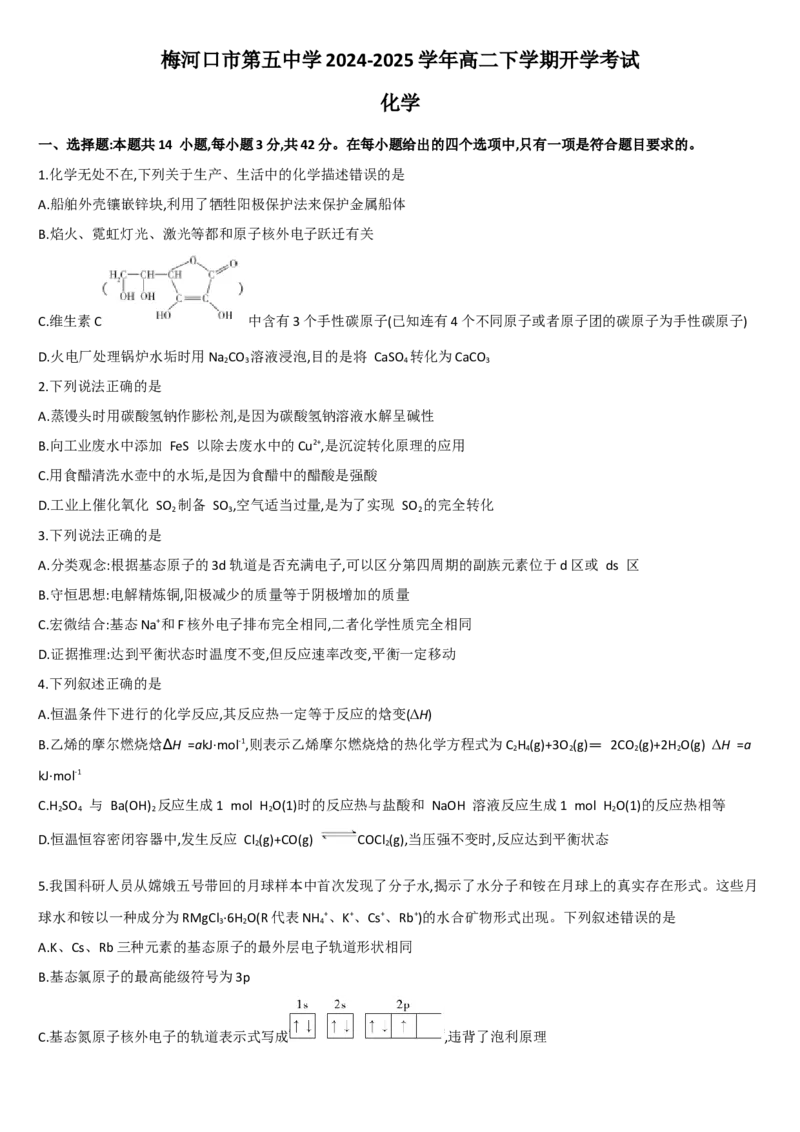
C.维生素C 中含有3个手性碳原子(已知连有4个不同原子或者原子团的碳原子为手性碳原子)
D.火电厂处理锅炉水垢时用Na CO 溶液浸泡,目的是将 CaSO 转化为CaCO
2 3 4 3
2.下列说法正确的是
A.蒸馒头时用碳酸氢钠作膨松剂,是因为碳酸氢钠溶液水解呈碱性
B.向工业废水中添加 FeS 以除去废水中的Cu2+,是沉淀转化原理的应用
C.用食醋清洗水壶中的水垢,是因为食醋中的醋酸是强酸
D.工业上催化氧化 SO 制备 SO ,空气适当过量,是为了实现 SO 的完全转化
2 3 2
3.下列说法正确的是
A.分类观念:根据基态原子的3d轨道是否充满电子,可以区分第四周期的副族元素位于d区或 ds 区
B.守恒思想:电解精炼铜,阳极减少的质量等于阴极增加的质量
C.宏微结合:基态Na+和F-核外电子排布完全相同,二者化学性质完全相同
D.证据推理:达到平衡状态时温度不变,但反应速率改变,平衡一定移动
4.下列叙述正确的是
A.恒温条件下进行的化学反应,其反应热一定等于反应的焓变(∆H)
B.乙烯的摩尔燃烧焓∆H =akJ·mol-1,则表示乙烯摩尔燃烧焓的热化学方程式为C H (g)+3O (g)= 2CO (g)+2H O(g) ∆H =a
2 4 2 2 2
kJ·mol-1
C.H SO 与 Ba(OH) 反应生成1 mol H O(1)时的反应热与盐酸和 NaOH 溶液反应生成1 mol H O(1)的反应热相等
2 4 2 2 2
D.恒温恒容密闭容器中,发生反应 Cl (g)+CO(g) COCl (g),当压强不变时,反应达到平衡状态
2 2
5.我国科研人员从嫦娥五号带回的月球样本中首次发现了分子水,揭示了水分子和铵在月球上的真实存在形式。这些月
球水和铵以一种成分为RMgCl ·6H O(R代表NH +、K+、Cs+、Rb+)的水合矿物形式出现。下列叙述错误的是
3 2 4
A.K、Cs、Rb三种元素的基态原子的最外层电子轨道形状相同
B.基态氯原子的最高能级符号为3p
C.基态氮原子核外电子的轨道表示式写成 ,违背了泡利原理D.相同物质的量的 H O和 D O, 质子总数之比为1:1
2 2
6. 在容积相等的三个密闭容器中分别按投料比 、
、 投料,发生反应: 2CO(g)+SO (g) S(g) +2CO(g),测得
2 2
的平衡转化率与温度的关系如图所示。下列说法错误的是
A.曲线Ⅰ代表的投料比为
B.正反应
C.达平衡后,保持温度不变,向容器中充入 ,平衡正向移动,平衡常数K增大
D.在a点对应的温度下,达到平衡时, 的体积分数约为33.3%
7.一定能在指定环境中大量共存的是
A.与铝反应放出氢气的溶液:K+、SO 、NO 、Na+
B.室温下,由水电离出的 的溶液中:
C.在pH = 1的溶液中:NO 、SO 、Na+、Fe2+
D.有较多 的溶液中:
8.下列实验操作、实验现象和实验结论均正确的是
实验操作 实验现象 实验结论
向 溶液中通入足量 ,
A 再将产生的气体通入 溶液 有黑色沉淀生成
中
前 者 有 白 色 沉
取两份新制氯水,分别滴加
B 淀,后者溶液变 氯气与水的反应存在限度
溶液和淀粉KI溶液
蓝色
将硫酸酸化的 溶液滴入
溶液颜色由浅绿
C 氧化性:
溶液中 变为棕黄色
将NO 和NO 的混合气体通入密 混合气体最终颜 增大压强,化学平衡向气
2 2 4
D
闭的注射器,压缩活塞 色变浅 体体积缩小的方向移动
9.相同温度下,分别在起始体积均为1 L的两个密闭容器中发生反应:
。实验测得反应的有关数据如下表:
起始物质的量/mol
容 反应 达到平衡所用
达到平衡过程中的能量变化
器 条件 时间
SO O SO
2 2 3
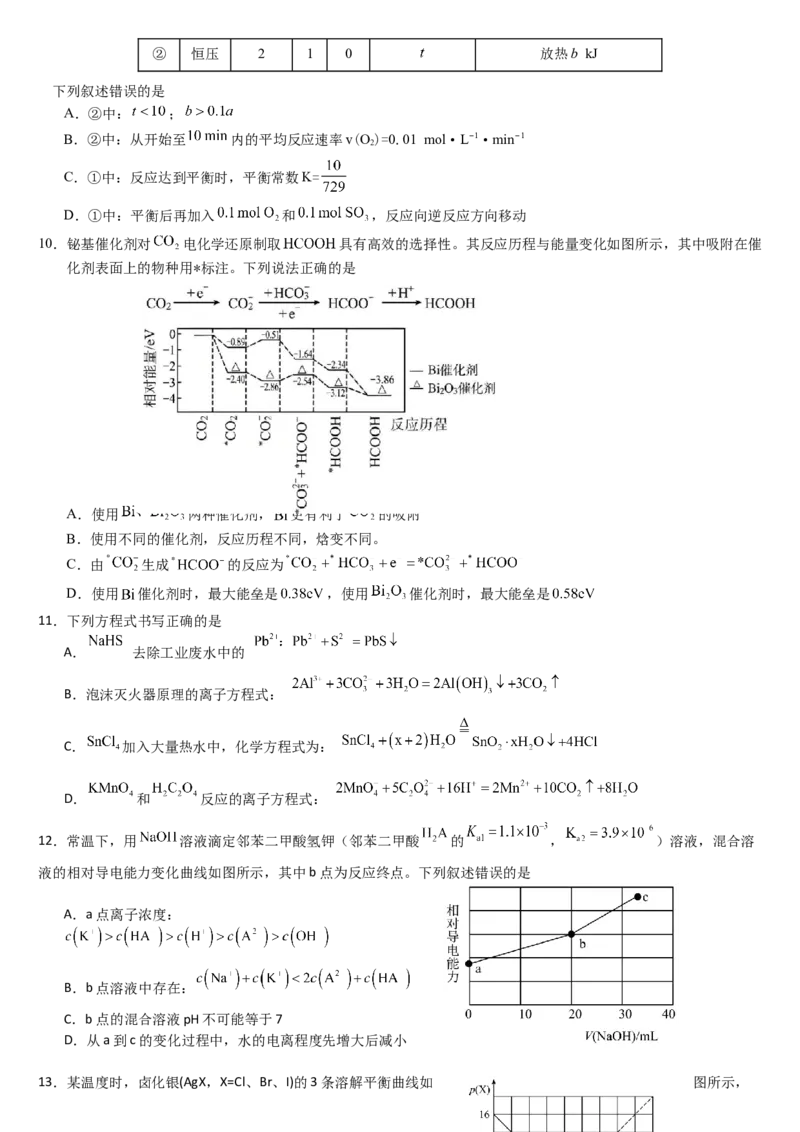
① 恒容 2 1 0 10 放热② 恒压 2 1 0 放热b kJ
下列叙述错误的是
A.②中: ;
B.②中:从开始至 内的平均反应速率v(O)=0.01 mol·L−1·min−1
2
C.①中:反应达到平衡时,平衡常数K=
D.①中:平衡后再加入 和 ,反应向逆反应方向移动
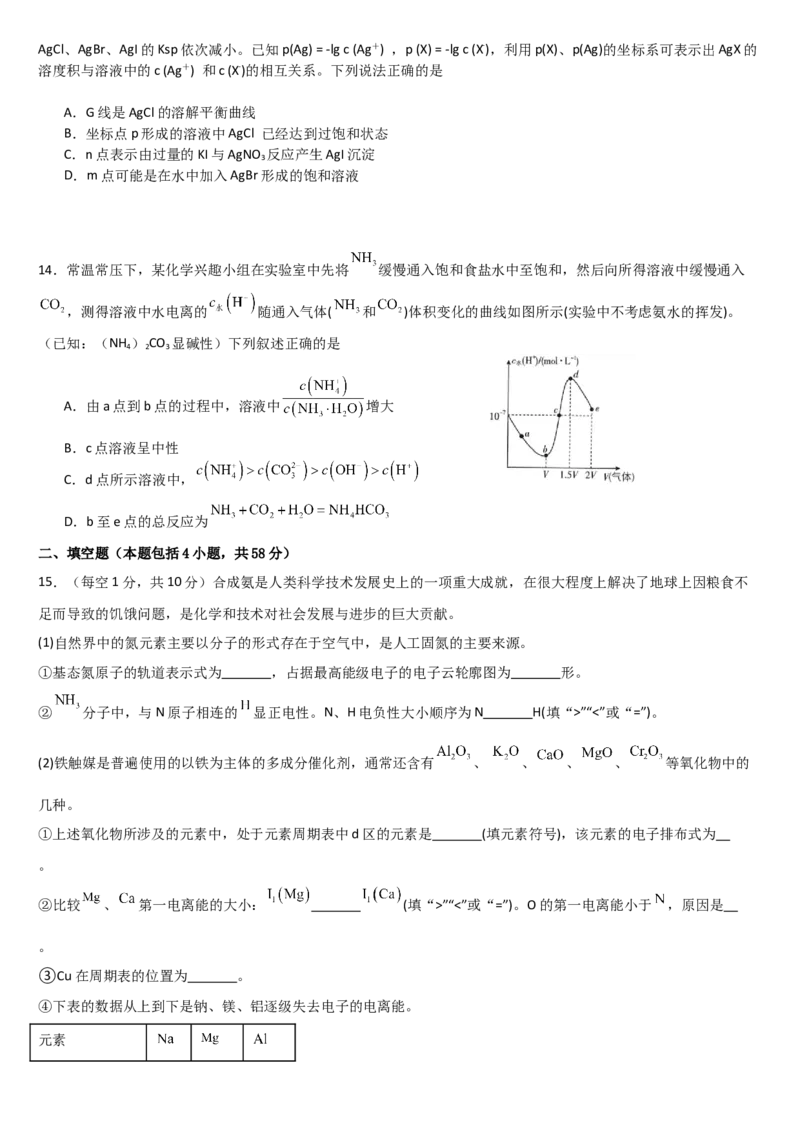
10.铋基催化剂对 电化学还原制取 具有高效的选择性。其反应历程与能量变化如图所示,其中吸附在催
化剂表面上的物种用*标注。下列说法正确的是
A.使用 两种催化剂, 更有利于 的吸附
B.使用不同的催化剂,反应历程不同,焓变不同。
C.由 生成 的反应为
D.使用 催化剂时,最大能垒是 ,使用 催化剂时,最大能垒是
11.下列方程式书写正确的是
A. 去除工业废水中的
B.泡沫灭火器原理的离子方程式:
C. 加入大量热水中,化学方程式为:
D. 和 反应的离子方程式:
12.常温下,用 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸 的 , )溶液,混合溶
液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
A.a点离子浓度:
B.b点溶液中存在:
C.b点的混合溶液pH不可能等于7
D.从a到c的变化过程中,水的电离程度先增大后减小
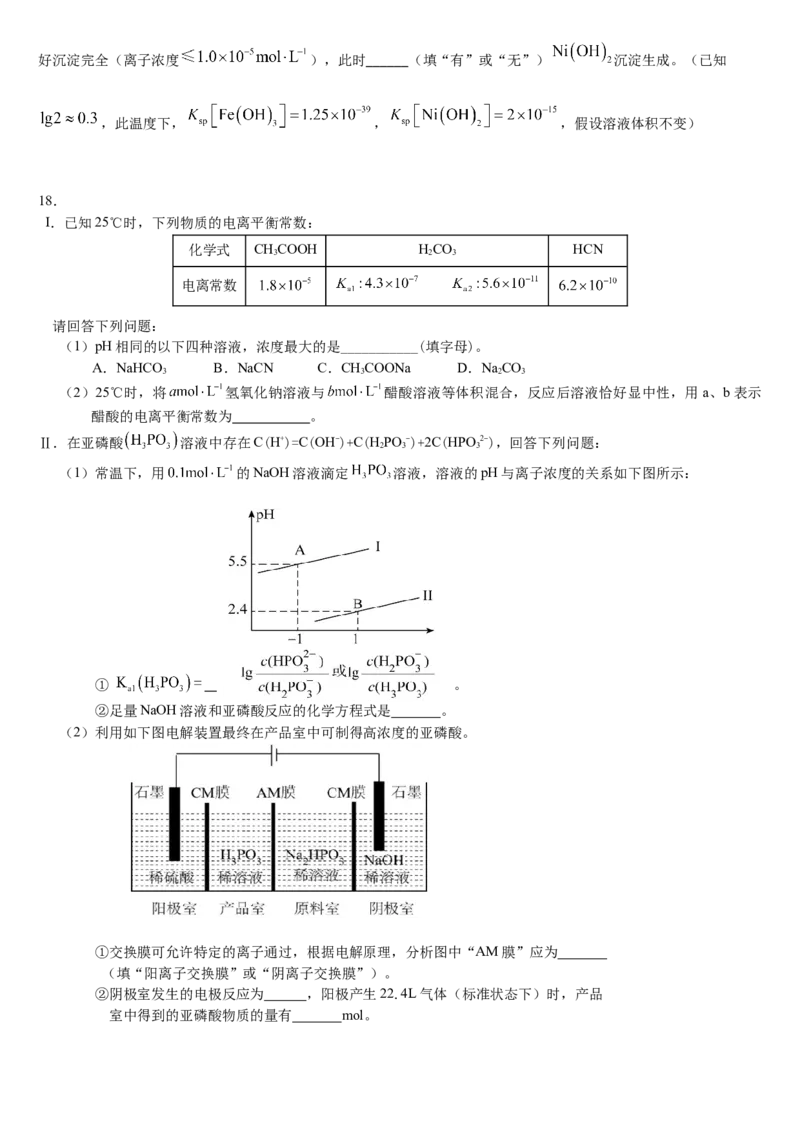
13.某温度时,卤化银(AgX,X=Cl、Br、I)的3条溶解平衡曲线如 图所示,AgCl、AgBr、AgI的Ksp依次减小。已知p(Ag) = -lg c (Ag+) ,p (X) = -lg c (X-),利用p(X)、p(Ag)的坐标系可表示出AgX的
溶度积与溶液中的c (Ag+) 和c (X-)的相互关系。下列说法正确的是
A.G线是AgCl的溶解平衡曲线
B.坐标点p形成的溶液中AgCl 已经达到过饱和状态
C.n点表示由过量的KI与AgNO 反应产生AgI沉淀
3
D.m点可能是在水中加入AgBr形成的饱和溶液
14.常温常压下,某化学兴趣小组在实验室中先将 缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入
,测得溶液中水电离的 随通入气体( 和 )体积变化的曲线如图所示(实验中不考虑氨水的挥发)。
(已知:(NH ) CO 显碱性)下列叙述正确的是
4 2 3
A.由a点到b点的过程中,溶液中 增大
B.c点溶液呈中性
C.d点所示溶液中,
D.b至e点的总反应为
二、填空题(本题包括4小题,共58分)
15.(每空1分,共10分)合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不
足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为 ,占据最高能级电子的电子云轮廓图为 形。
② 分子中,与N原子相连的 显正电性。N、H电负性大小顺序为N H(填“>”“<”或“=”)。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、 、 、 、 等氧化物中的
几种。
①上述氧化物所涉及的元素中,处于元素周期表中d区的元素是 (填元素符号),该元素的电子排布式为
。
②比较 、 第一电离能的大小: (填“>”“<”或“=”)。O的第一电离能小于 ,原因是
。
③Cu在周期表的位置为 。
④下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
元素496 738 578
4562 1451 1817
电离能( )
6912 7733 2745
9543 10540 11575
结合数据说明 的常见化合价为+2价的原因 。
⑤基态Al原子核外共有 种不同运动状态的电子。
16. 如下图所示,其中甲池的总反应为 ,请回答下列问题:
(1)甲池中负极的电极反应式为___________。
(2)丙池中总反应的离子方程式为___________。
(3)当乙池中 极质量增加 时,甲池中理论上消耗 的体积为______ (标准状况)。
(4)反应一段时间后,断开开关 ,下列物质能使乙池恢复到反应前的浓度的是______(填字母)。
a. b. c.
(5)若丙池中电极不变,将其溶液换成滴有酚酞的 溶液,开关闭合一段时间后, 极附近观察到的现象是
______。
(6)若用丙池模拟铁制品表面镀铜,需要更换电极,则铁制品应放在______(填“ ”或“ ”)电极。
17. 水溶液中的离子反应和平衡与生命活动、日常生活、工农业生产等息息相关,请根据水溶液中的离子反应与平衡
知识及下表数据回答下列问题:
时部分弱酸的电离平衡常数
化学式
电离常数(1) 溶液和 溶液中, ______ (填“>”“<”或“=”)。
的
(2)向 溶液中加入下列物质,能促进 水解 是______(填字母)。
A. B. C. D.
(3)常温下已知某浓度的 水溶液 :
①该溶液中由水电离出的 浓度为______ 。
②该 溶液中各离子浓度由大到小顺序为_____________。
③将少量 通入 溶液,反应的离子方程式为_____________。
(4)某学习小组用 的 溶液来测定未知物质的量浓度的盐酸:
①用标准的 溶液滴定待测的盐酸时,选择酚酞作指示剂,达到滴定终点的标志为:___________。
②某同学在滴定时进行了以下操作,其中会使所测盐酸的浓度偏高的是______(填字母)。
A.滴定前用蒸馏水冲洗盛放待测盐酸的锥形瓶
B.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
C.检查碱式滴定管活塞不漏水后,未润洗直接加入标准碱液
D.盛放标准碱液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失
E.读取 溶液体积时,开始仰视读数,滴定结束时俯视读数
③常温下,将 溶液滴入 溶液中,测得溶液的 变化曲线如图所示:
则 点溶液中: ______ (填“>”“<”或“=”), 点溶液中 ______。
(5)现有含 和 的混合溶液,其中 ,用碳酸钠调节溶液的 为______可使 恰好沉淀完全(离子浓度 ),此时______(填“有”或“无”) 沉淀生成。(已知
,此温度下, , ,假设溶液体积不变)
18.
I.已知25℃时,下列物质的电离平衡常数:
化学式 CHCOOH HCO HCN
3 2 3
电离常数
请回答下列问题:
(1)pH相同的以下四种溶液,浓度最大的是___________(填字母)。
A.NaHCO B.NaCN C.CHCOONa D.NaCO
3 3 2 3
(2)25℃时,将 氢氧化钠溶液与 醋酸溶液等体积混合,反应后溶液恰好显中性,用a、b表示
醋酸的电离平衡常数为 。
Ⅱ.在亚磷酸 溶液中存在C(H+)=C(OH-)+C(HPO -)+2C(HPO 2-),回答下列问题:
2 3 3
(1)常温下,用 的NaOH溶液滴定 溶液,溶液的pH与离子浓度的关系如下图所示:
① 。
②足量NaOH溶液和亚磷酸反应的化学方程式是 。
(2)利用如下图电解装置最终在产品室中可制得高浓度的亚磷酸。
①交换膜可允许特定的离子通过,根据电解原理,分析图中“AM膜”应为
(填“阳离子交换膜”或“阴离子交换膜”)。
②阴极室发生的电极反应为 ,阳极产生22.4L气体(标准状态下)时,产品
室中得到的亚磷酸物质的量有 mol。答案:
CBADC CBABC CBDC
15.(1) 哑铃 >
(2) 或[Ar]3d54s1 > N原子2p能级上的电子数处于半充满的稳定结构
第四周期 第ⅠB族 最外层上3s能级上有两个电子,第一电离能和第二电离能都较小,易同时失去两个电子
13
16 (1)
(2)
(3)
(4)
(5)溶液变红,有气泡产生
(6)
17(1)< (2)D
( 3 ) ① . ②. ③.
(4) ①. 当滴入半滴 溶液时,锥形瓶内溶液颜色由无色刚好变为粉红色,且半分钟内不变色 ②.
③. < ④.
(5) ①. ②. 无
18.
I.(1)C(2分)
(2)Ka=(a*10-7)/(b-a) (2分)
II.
(1)①10-1.4(2分) 2NaOH+H PO =Na HPO +2H O(2分)
3 3 2 3 2
(2)① 阴离子交换膜(2分)
②2HO+2e-=H ↑+2OH-(2分) 2(2分)
2 2