文档内容
2024—2025 学年高二第一学期化学科第一次联考
注意事项:
1.考试时间:75分钟,卷面满分:100 分。
2.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名与考生号、试室
号、座位号填写在答题卡上。
3.选择题用2B铅笔把答题卡上对应题目选项的答案信息点涂黑,如需改动,用
橡皮擦干净后,再选涂其他答案,但注意不能擦破答题卡,否则不能扫描。
4.请不要褶皱答题卡,以免无法扫描。
一、选择题(本大题共 16 小题,第一部分每小题 2 分,共 20 分;第二部分
每小题 4 分,共 24 分,两部分共 44 分,每个小题列出的四个选项中只有一
个是符合题目要求的,不选、多选、错选均不得分)
第一部分(10*2分=20 分)
1. 中华文化蕴含丰富的化学知识。下列诗句中主要涉及吸热反应的是
A. 雪消冰又释,景和风复暄 B. 千锤万凿出深山,烈火焚烧若等闲
C. 野火烧不尽,春风吹又生 D. 竹外桃花三两枝,春江水暖鸭先知
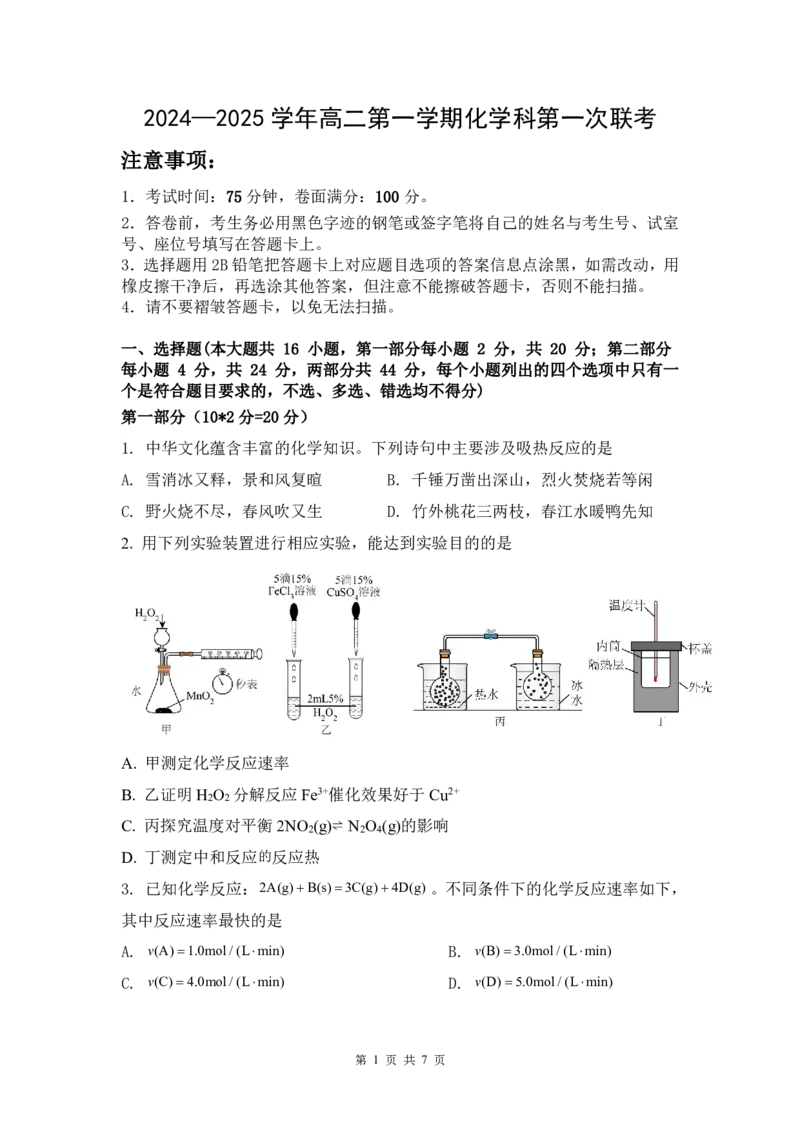
2. 用下列实验装置进行相应实验,能达到实验目的的是
A. 甲测定化学反应速率
B. 乙证明H O 分解反应Fe3+催化效果好于Cu2+
2 2
C. 丙探究温度对平衡2NO (g)⇌ N O (g)的影响
2 2 4
D. 丁测定中和反应的反应热
3. 已知化学反应:2A(g)B(s)3C(g)4D(g) 。不同条件下的化学反应速率如下,
其中反应速率最快的是
A. v(A)1.0mol/(Lmin) B. v(B)3.0mol/(Lmin)
C. v(C)4.0mol/(Lmin) D. v(D)5.0mol/(Lmin)
第 1 页 共 7 页
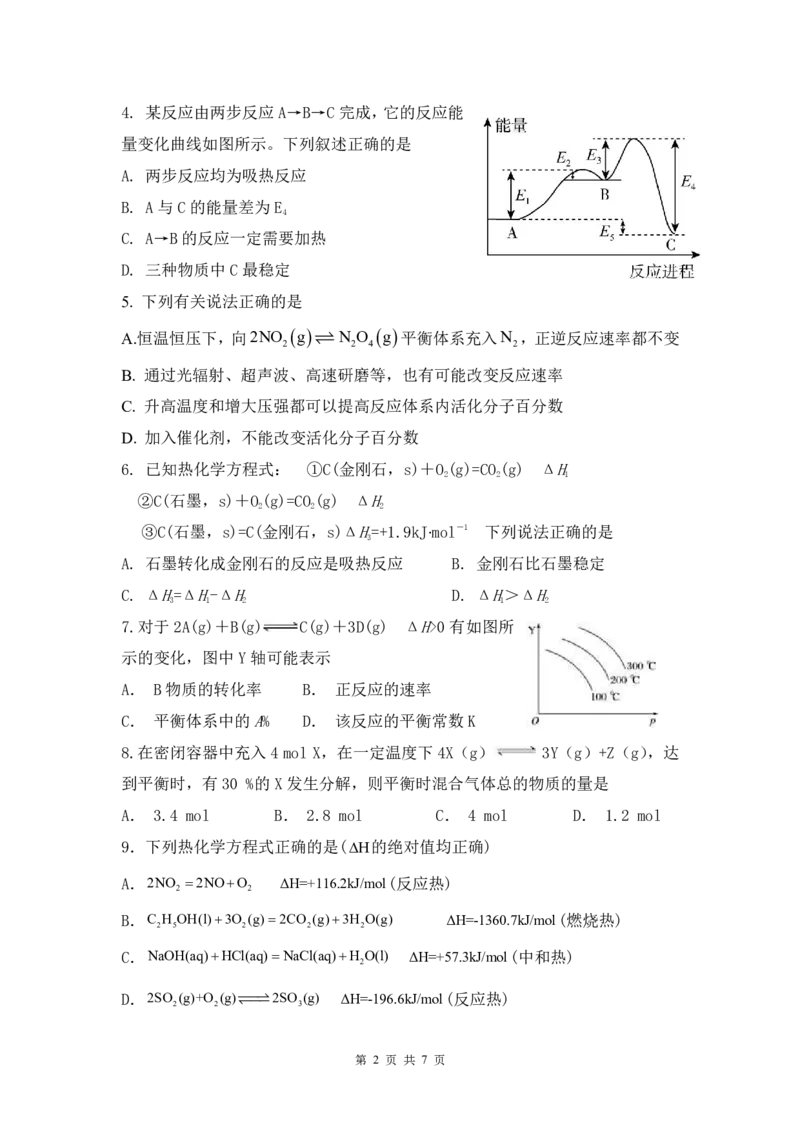
{#{QQABRQwEggAIAAJAAQgCAQmSCkIQkgAAAYgOQAAEsAAAiRFABAA=}#}4. 某反应由两步反应A→B→C完成,它的反应能
量变化曲线如图所示。下列叙述正确的是
A. 两步反应均为吸热反应
B. A与C的能量差为E
4
C. A→B的反应一定需要加热
D. 三种物质中C最稳定
5. 下列有关说法正确的是
A.恒温恒压下,向2NO g N O g 平衡体系充入N ,正逆反应速率都不变
2 2 4 2
B. 通过光辐射、超声波、高速研磨等,也有可能改变反应速率
C. 升高温度和增大压强都可以提高反应体系内活化分子百分数
D. 加入催化剂,不能改变活化分子百分数
6. 已知热化学方程式: ①C(金刚石,s)+O(g)=CO(g) ΔH
2 2 1
②C(石墨,s)+O(g)=CO(g) ΔH
2 2 2
③C(石墨,s)=C(金刚石,s)ΔH=+1.9kJ∙mol-1 下列说法正确的是
3
A. 石墨转化成金刚石的反应是吸热反应 B. 金刚石比石墨稳定
C. ΔH=ΔH-ΔH D. ΔH>ΔH
3 1 2 1 2
7.对于 2A(g)+B(g) C(g)+3D(g) ΔH>0 有如图所
示的变化,图中Y轴可能表示
A. B物质的转化率 B. 正反应的速率
C. 平衡体系中的A% D. 该反应的平衡常数K
8.在密闭容器中充入4 mol X,在一定温度下4X(g) 3Y(g)+Z(g),达
到平衡时,有30 %的X发生分解,则平衡时混合气体总的物质的量是
A. 3.4 mol B. 2.8 mol C. 4 mol D. 1.2 mol
9.下列热化学方程式正确的是(H的绝对值均正确)
A.2NO 2NOO ΔH=+116.2kJ/mol(反应热)
2 2
B.C H OH(l)3O (g)2CO (g)3H O(g) ΔH=-1360.7kJ/mol(燃烧热)
2 5 2 2 2
C.NaOH(aq)HCl(aq)NaCl(aq)H O(l) ΔH=+57.3kJ/mol(中和热)
2
D.2SO (g)+O (g)2SO (g) ΔH=-196.6kJ/mol(反应热)
2 2 3
第 2 页 共 7 页
{#{QQABRQwEggAIAAJAAQgCAQmSCkIQkgAAAYgOQAAEsAAAiRFABAA=}#}10. 可逆反应mA(s)+nB(g) eC(g)+fD(g),反应过程中,当其他
条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如下图,下
列叙述正确的是
A. 达平衡后,加入催化剂则C%增大
B. 达平衡后,若升温,平衡左移
C. 化学方程式中n>e+f
D. 达平衡后,增加A 的量有利于平衡向右移动
第二部分 (6*4分=24 分)
11. 在密闭容器中进行反应:X (g)Y (g) 2Z(g),已知X 、Y Z的起始浓
2 2 2 2
度分别为0.1molL1、0.3molL1、0.2molL1,在一定条件下,当反应达到平
衡时,各物质的浓度可能是
A. c(Z)0.3molL1 B. c X 0.2molL1
2
C. c Y 0.4molI1 D. c X c Y c(Z) 0.55molL1
2 2 2
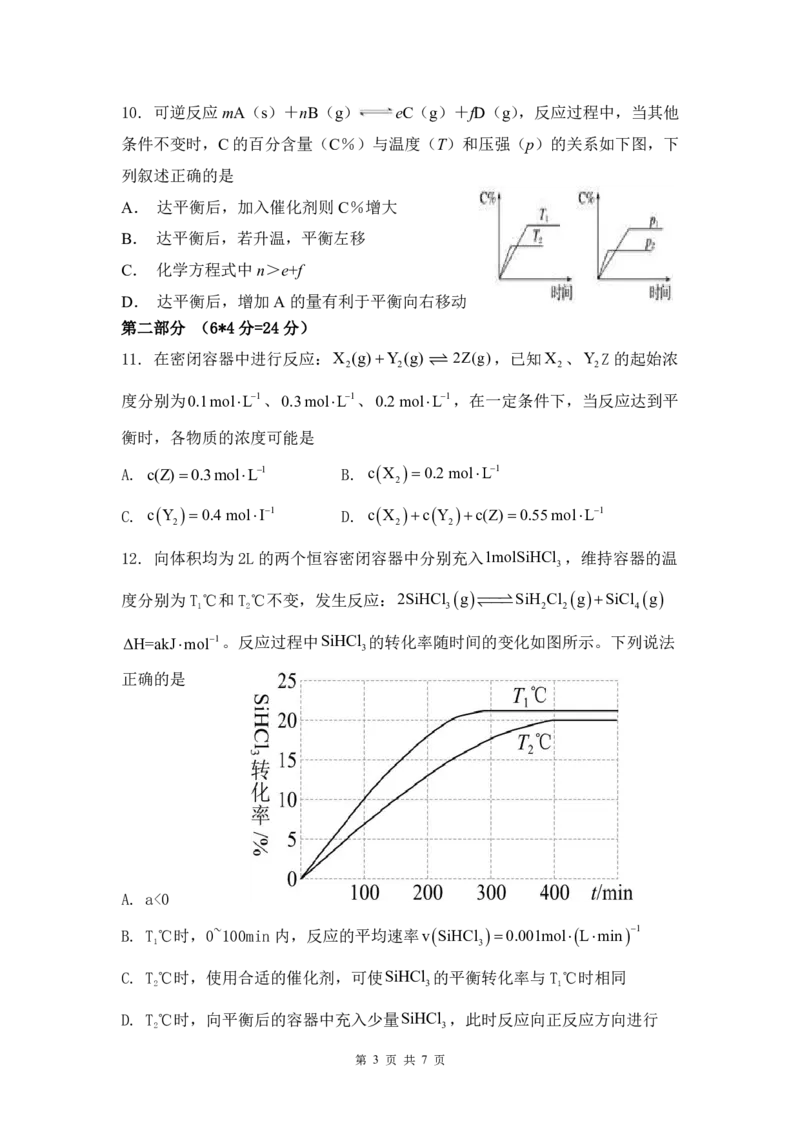
12. 向体积均为2L的两个恒容密闭容器中分别充入1molSiHCl ,维持容器的温
3
度分别为T℃和T℃不变,发生反应:2SiHCl g SiH Cl g SiCl g
1 2 3 2 2 4
ΔH=akJmol1。反应过程中SiHCl 的转化率随时间的变化如图所示。下列说法
3
正确的是
A. a<0
B. T℃时,0~100min内,反应的平均速率v SiHCl 0.001mol Lmin 1
1 3
C. T℃时,使用合适的催化剂,可使SiHCl 的平衡转化率与T℃时相同
2 3 1
D. T℃时,向平衡后的容器中充入少量SiHCl ,此时反应向正反应方向进行
2 3
第 3 页 共 7 页
{#{QQABRQwEggAIAAJAAQgCAQmSCkIQkgAAAYgOQAAEsAAAiRFABAA=}#}13. 下列事实中,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br+HOHBr+HBrO,当加入NaOH溶液后颜色变浅
2 2
B. 对2HO 2HO+O 的反应,使用MnO 可加快制O 的反应速率
2 2 2 2 2 2
C. 反应CO+NO CO+NO ΔH<0,升高温度使平衡向逆反应方向移动
2 2
D. 合成氨反应:N+3H 2NH ΔH<0,为使氨的产率提高,理论上应采取低温
2 2 3
高压的措施
14. 2NO (g)N O (g) H0,该反应经常用于探究各种因素对平衡的影响。
2 2 4
因此如何判断达到平衡状态十分重要。若在某恒压、绝热密闭容器内充入一定量
NO ,则下列判断达到平衡状态正确的项目有
2
①消耗2molNO 的同时生成1molN O ②n NO :n N O 不变
2 2 4 2 2 4
③气体密度保持不变 ④气体平均相对分子质量不变
⑤气体颜色深度不变 ⑥气体系压强保持不变 ⑦K保持不变
A. 4项 B. 5项 C. 6项 D. 7项
15. 黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO(s)+3C(s)=KS(s)+N(g)+3CO(g) ΔH=x kJ·mol-1
3 2 2 2
已知:①C(s)+O(g)=CO(g) ΔH=a kJ·mol-1
2 2
②KS(s)=S(s)+2K(s) ΔH=b kJ·mol-1
2
③2K(s)+N(g)+3O(g)=2KNO(s) ΔH=c kJ·mol-1
2 2 3
下列说法不正确的是
A. x<0 a<0 B. b>0 c<0 C. x=3a-b-c
D. 1 mol C(s)在空气中不完全燃烧生成CO的焓变小于a kJ·mol-1
16.某温度下反应2A(g)⇌ B(g)+C(g)∆H<0的平衡常数K=4.此温度下,在1L的
密闭容器中加入A,反应到某时刻测得A、B、C的物质的量浓度(mol•L-1)分别为:
0.4,0.6,0.6,下列说法正确的是
A.温度升高,该反应反应速率加快,平衡常数增大
B.平衡时,再充入一定量A气体,平衡正移,平衡常数增大
C.平衡时,充入一定量He气,反应速率加快,平衡常数不变
D.题目所述的某时刻正、逆反应速率的大小为v >v
(正) (逆)
第 4 页 共 7 页
{#{QQABRQwEggAIAAJAAQgCAQmSCkIQkgAAAYgOQAAEsAAAiRFABAA=}#}二、非选择题(本大题共 4 小题,共 56 分)
17. 实验题:50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装
置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列
问题:
(1)从实验装置上看,图中缺少的一种玻璃仪器是_______。
(2)写出表示该反应中和热的热化学方程式(中和热为
57.3kJ·mol-1):_______(用离子方程式表示)
(3)实验中改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH
溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),
所求得的中和热_______(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数
值会_______(填“偏大””、“偏小””或“无影响”)。
(5)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止
温度与起始温度差(t-t)分别为①3.3℃、②3.5℃、③4.5℃,则最终代入计算
2 1
式的温差平均值为_______℃。计算该实验测得的中和反应反应热ΔH=______(结
果保留一位小数)[已知Q=cmΔt,设盐酸和NaOH溶液的密度为1 g/cm3,反应后
混合溶液的比热容(c)为4.18 J/(g·℃)]。
18. 利用反应原理相关知识回答下列问题。
(1)已知热化学方程式:2SO (g)O (g) 2SO (g) H 197kJ/mol。相同
2 2 3
条件下,将2molSO 气体与1mol氧气放入密闭容器中充分反应,测得放出的热
2
量Q___________197 kJ(填“大于”“小于”“等于”)。
(2)氧化法脱硫的反应历程如下图所示。已知TS表示“过渡态”。
第 5 页 共 7 页
{#{QQABRQwEggAIAAJAAQgCAQmSCkIQkgAAAYgOQAAEsAAAiRFABAA=}#}①分子b为___________(写化学式)。该反应历程一共有__________个基元反应。
②下列反应速率最快的步骤为___________ (填字母)。
A.①→② B.②→③ C.③→④
(3)常温常压下,1 g液态乙醇(M 46g/mol)完全燃烧生成二氧化碳气体和液
态水时,放出约30 kJ的热量。写出乙醇燃烧热的热化学方程式___________。
该反应转移1 mol电子时,放出的热量数值为___________kJ。
(4)一些化学键的键能近似值如下表所示。由此计算
化学键 C—H C=C H—H C—C
键能(kJ/mol) 400 610 430 350
乙烯与H 加成CH CH (g)H (g)CH CH (g)反应热H=___________kJ/mol。
2 2 2 2 3 3
19. 某校化学活动小组做了如下探究实验:
实验一:测定相同体积的1mol/L的硫酸分别与足量锌粒
和锌粉反应的速率,设计如图装置:
(1)写出此反应的离子方程式 ___________。
(2)按照装置实验时,限定了两次实验时间均为10min,
则还需要测定的另一个数据是_______。
(3)根据此实验探究,可以得出的结论是:其他条件不变时,___________。
实验二:利用HCO 溶液和酸性KMnO 溶液之间的反应,探究外界条件改变对化
2 2 4 4
学反应速率的影响。实验如下表:
0.02 mol∙L−1 0.1 mol∙L−
HO
2
序 温度 KMnO 1 HCO 溶液颜色褪至无色时所
4 2 2 4
号 /K 需时间/s
V/mL V/mL V/mL
A 293 2 5 3 t
1
B 293 V 3 5 8
1
C 313 2 3 V t
2 2
第 6 页 共 7 页
{#{QQABRQwEggAIAAJAAQgCAQmSCkIQkgAAAYgOQAAEsAAAiRFABAA=}#}(4)V =________;通过实验A、B可探究_________ 的改变对反应速率的影响。
2
(5)利用实验B中数据计算,用KMnO 的浓度变化表示的反应速率为
4
v(KMnO)=____。
4
(6)实验中发现:反应一段时间后该反应速率会加快,造成此种变化的原因是:
反应体系中的某种粒子对KMnO 与HCO 之间的反应有某种特殊的作用,则该作
4 2 2 4
用是___________。
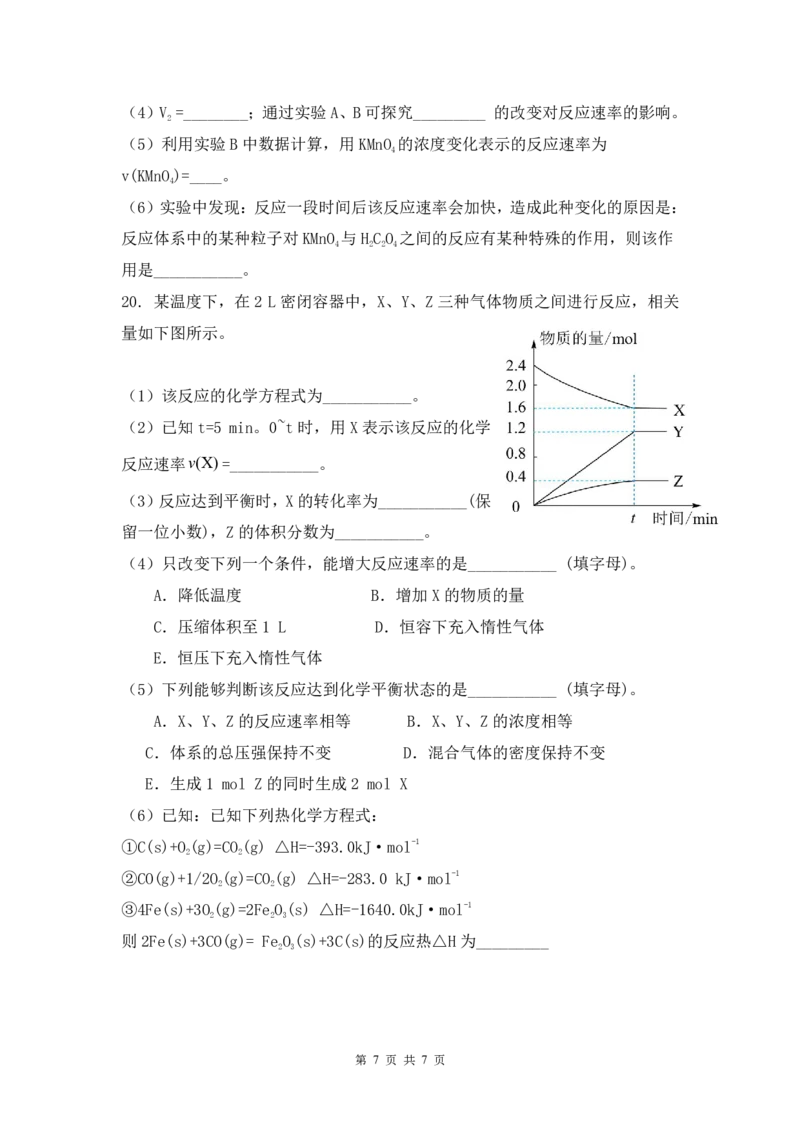
20. 某温度下,在2 L密闭容器中,X、Y、Z三种气体物质之间进行反应,相关
量如下图所示。
(1)该反应的化学方程式为___________。
(2)已知t=5 min。0~t时,用X表示该反应的化学
反应速率v(X)=___________。
(3)反应达到平衡时,X的转化率为___________(保
留一位小数),Z的体积分数为___________。
(4)只改变下列一个条件,能增大反应速率的是___________ (填字母)。
A.降低温度 B.增加X的物质的量
C.压缩体积至1 L D.恒容下充入惰性气体
E.恒压下充入惰性气体
(5)下列能够判断该反应达到化学平衡状态的是___________ (填字母)。
A.X、Y、Z的反应速率相等 B.X、Y、Z的浓度相等
C.体系的总压强保持不变 D.混合气体的密度保持不变
E.生成1 mol Z的同时生成2 mol X
(6)已知:已知下列热化学方程式:
①C(s)+O(g)=CO(g) △H=-393.0kJ·mol-1
2 2
②CO(g)+1/2O(g)=CO(g) △H=-283.0 kJ·mol-1
2 2
③4Fe(s)+3O(g)=2FeO(s) △H=-1640.0kJ·mol-1
2 2 3
则2Fe(s)+3CO(g)= FeO(s)+3C(s)的反应热△H为_________
2 3
第 7 页 共 7 页
{#{QQABRQwEggAIAAJAAQgCAQmSCkIQkgAAAYgOQAAEsAAAiRFABAA=}#}2024——2025学年高二第一学期化学科第一次联考:
一、选择题
1 2 3 4 5 6 7 8 9 10
B C C D B A A C D B
11 12 13 14 15 16
A D B B D D
二、填空题(每空2分)
17.(14分) 【答案】(1)玻璃搅拌器
(2)H+(aq)+OH-(aq)=H O(l) ∆H=-57.3 kJ/mol
2
(3) ①. 不相等 ②. 相等
(4)偏小 (5) ①. 3.4 ②. -56.8kJ/mol
18. (14分)【答案】(1)小于
(2) ①. H O ②. 5 ③. B
2 2
(3) ①. C H OH(l)+3O(g)=2CO(g)+3H O(l)H=-1380kJ/mol ②.
2 5 2 2 2
115
(4)-110
19.(14分)【答案】(1)Zn+2H+=H +Zn2+ (2)收集到气体的体积
2
(3)反应物间接触面积越大,反应速率越快 (4) ①. 5 ②. 浓度
(5)0.0005molL-1s-1 (6)Mn2+的催化作用
20.(14分,每空2分)【答案】(1)2X
3Y+Z
(2)0.08mol/Lmin
(3) ①. 33.3% ②. 12.5%
(4)BC (5)CE (6) -490.0kJ·mol-1