文档内容
启用前★注意保密
2024-2025学年度第一学期高二测试题
化学
注意事项:
1.答卷前,考生务必用黑色字迹钢笔或签字笔将自己的姓名、考生号、考场号和座位号填写在答
题卡上。用2B铅笔将相应试卷类型填涂在答题卡相应位置上。将条形码横贴在答题卡右上角“条
形码粘贴处”。
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑:
如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置
上:如需改动,先划掉原来的答案,然后再写上新的答案,不准使用铅笔和涂改液。不按以上要
求作答的答案无效。
4.考生必须保持答题卡的整洁。考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Fe-56 Cu-64 Zn-65
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4
分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列参展商品中,主要成分属于无机物的是
A.中国剪纸 B.俄罗斯小麦粉 C.埃及长绒棉 D.巴基斯坦铜器
A.A B.B C.C D.D
2.2024年7月,第33届夏季奥林匹克运动会在法国巴黎举办。我国运动健儿取得了40块金牌的优异成绩,
运动会上许多“化学元素”发挥着重要作用。下列说法错误的是
A.开幕式上的烟花表演利用了焰色试验原理
B.场馆消毒使用的过氧类消毒剂,其消杀原理与漂白液相同
C.颁奖的金牌为铁质表面镀一层薄金,这是一种新型合金材料
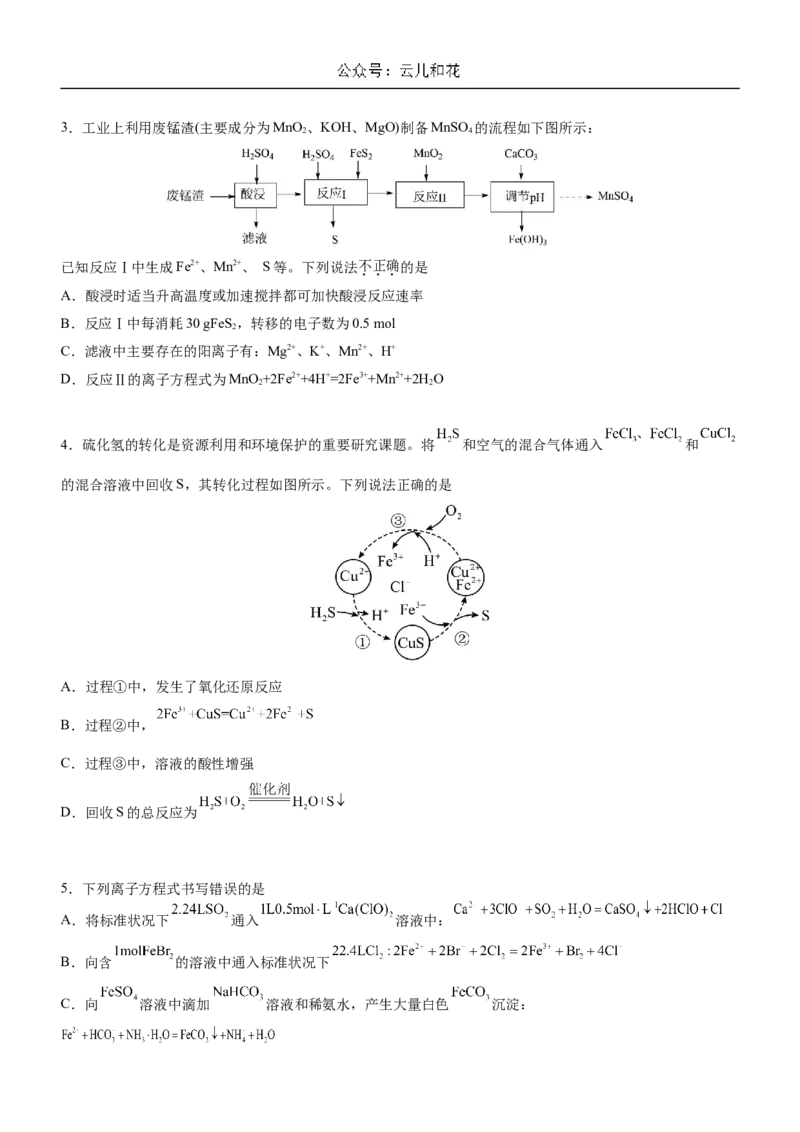
D.部分运动场馆建筑材料使用了新型碲化镉发电材料,碲属于主族元素3.工业上利用废锰渣(主要成分为MnO 、KOH、MgO)制备MnSO 的流程如下图所示:
2 4
已知反应Ⅰ中生成Fe2+、Mn2+、 S等。下列说法不正确的是
A.酸浸时适当升高温度或加速搅拌都可加快酸浸反应速率
B.反应Ⅰ中每消耗30 gFeS ,转移的电子数为0.5 mol
2
C.滤液中主要存在的阳离子有:Mg2+、K+、Mn2+、H+
D.反应Ⅱ的离子方程式为MnO +2Fe2++4H+=2Fe3++Mn2++2H O
2 2
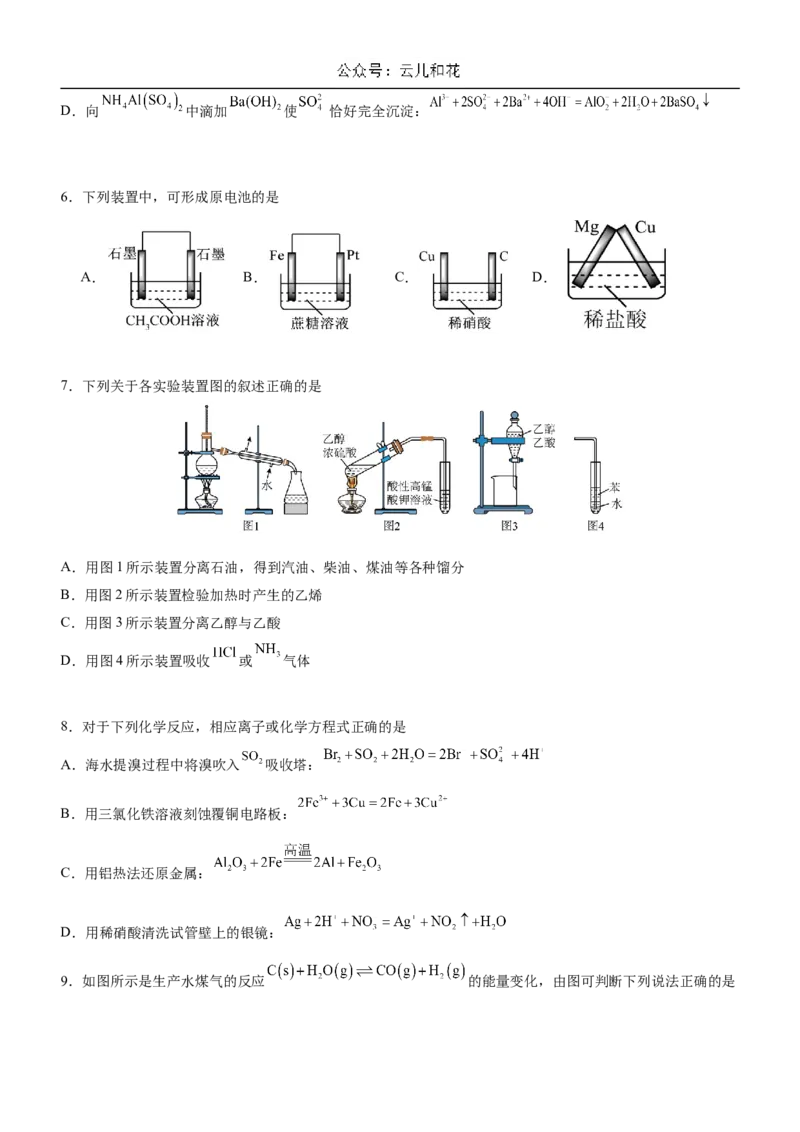
4.硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入 和
的混合溶液中回收S,其转化过程如图所示。下列说法正确的是
A.过程①中,发生了氧化还原反应
B.过程②中,
C.过程③中,溶液的酸性增强
D.回收S的总反应为
5.下列离子方程式书写错误的是
A.将标准状况下 通入 溶液中:
B.向含 的溶液中通入标准状况下
C.向 溶液中滴加 溶液和稀氨水,产生大量白色 沉淀:D.向 中滴加 使 恰好完全沉淀:
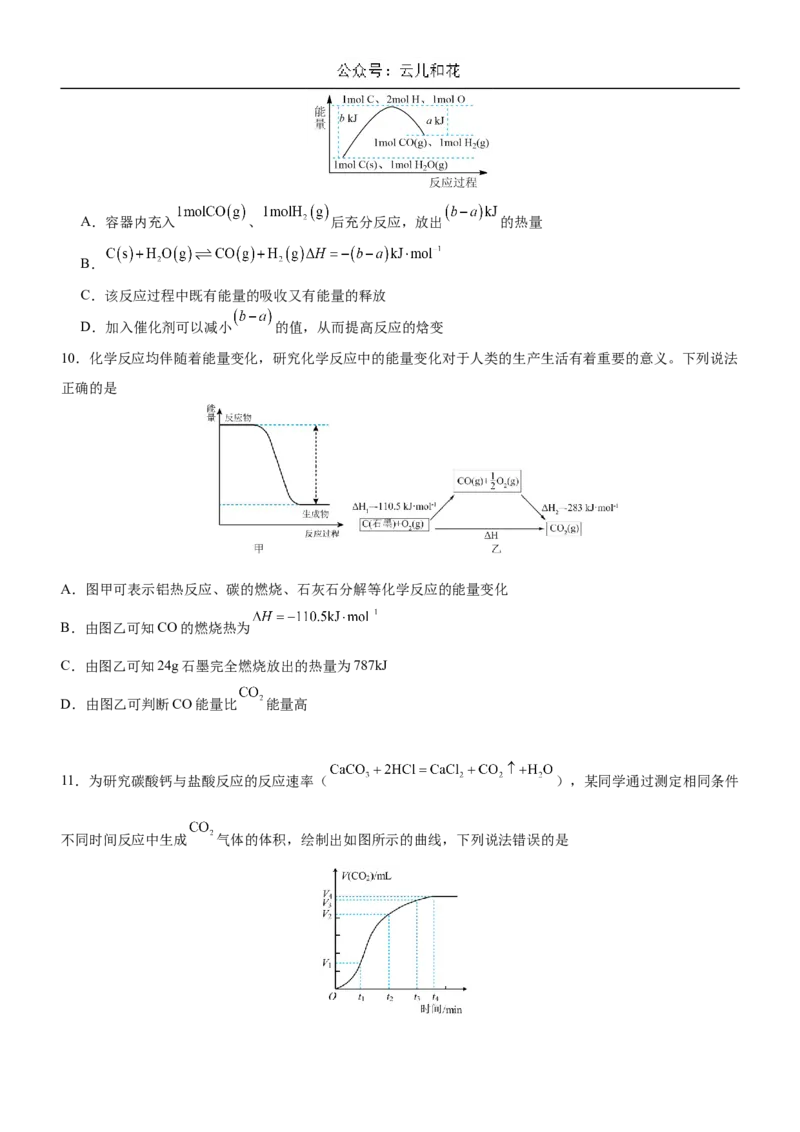
6.下列装置中,可形成原电池的是
A. B. C. D.
7.下列关于各实验装置图的叙述正确的是
A.用图1所示装置分离石油,得到汽油、柴油、煤油等各种馏分
B.用图2所示装置检验加热时产生的乙烯
C.用图3所示装置分离乙醇与乙酸
D.用图4所示装置吸收 或 气体
8.对于下列化学反应,相应离子或化学方程式正确的是
A.海水提溴过程中将溴吹入 吸收塔:
B.用三氯化铁溶液刻蚀覆铜电路板:
C.用铝热法还原金属:
D.用稀硝酸清洗试管壁上的银镜:
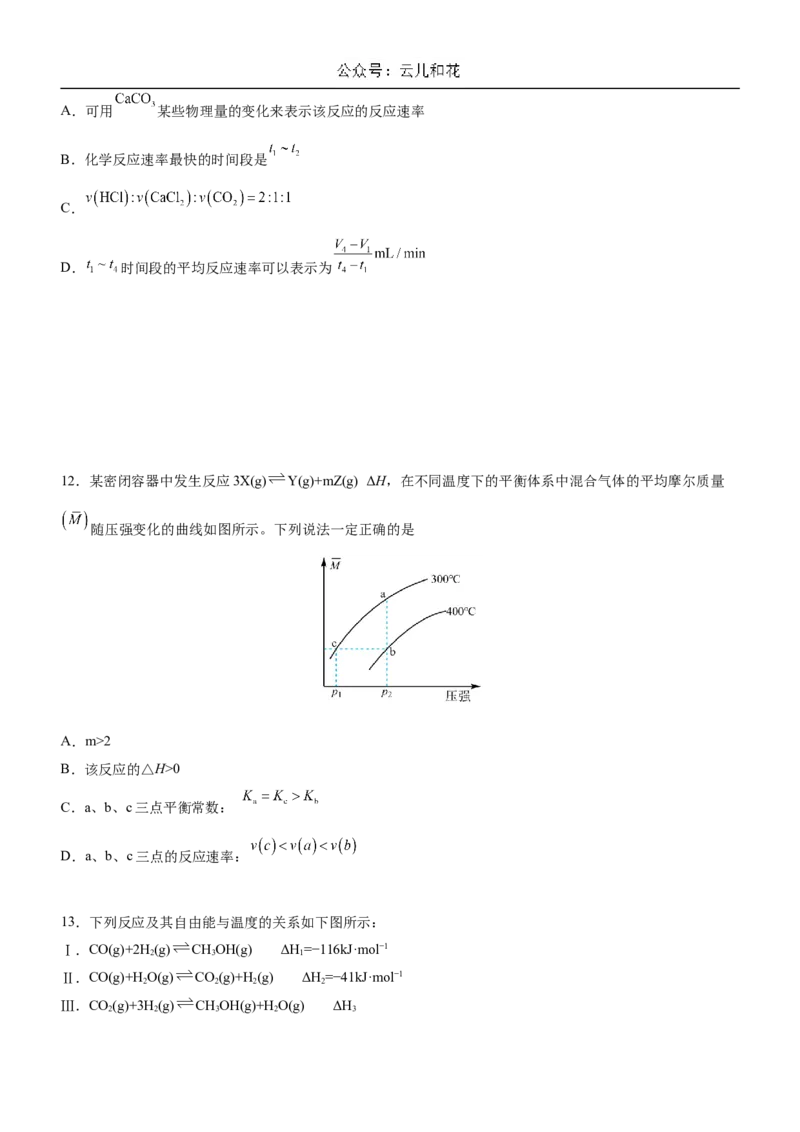
9.如图所示是生产水煤气的反应 的能量变化,由图可判断下列说法正确的是A.容器内充入 、 后充分反应,放出 的热量
B.
C.该反应过程中既有能量的吸收又有能量的释放
D.加入催化剂可以减小 的值,从而提高反应的焓变
10.化学反应均伴随着能量变化,研究化学反应中的能量变化对于人类的生产生活有着重要的意义。下列说法
正确的是
A.图甲可表示铝热反应、碳的燃烧、石灰石分解等化学反应的能量变化
B.由图乙可知CO的燃烧热为
C.由图乙可知24g石墨完全燃烧放出的热量为787kJ
D.由图乙可判断CO能量比 能量高
11.为研究碳酸钙与盐酸反应的反应速率( ),某同学通过测定相同条件
不同时间反应中生成 气体的体积,绘制出如图所示的曲线,下列说法错误的是A.可用 某些物理量的变化来表示该反应的反应速率
B.化学反应速率最快的时间段是
C.
D. 时间段的平均反应速率可以表示为
12.某密闭容器中发生反应3X(g) Y(g)+mZ(g) ΔH,在不同温度下的平衡体系中混合气体的平均摩尔质量
随压强变化的曲线如图所示。下列说法一定正确的是
A.m>2
B.该反应的△H>0
C.a、b、c三点平衡常数:
D.a、b、c三点的反应速率:
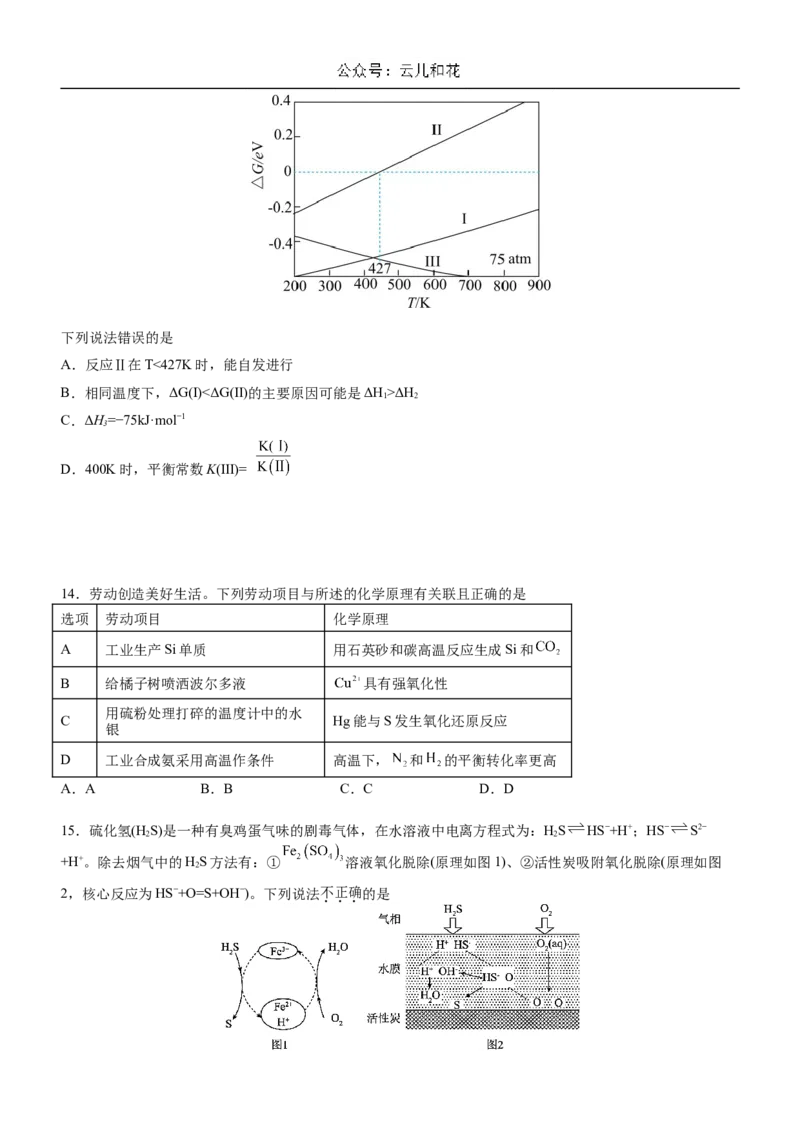
13.下列反应及其自由能与温度的关系如下图所示:
Ⅰ.CO(g)+2H(g) CHOH(g) ΔH =−116kJ·mol−1
2 3 1
Ⅱ.CO(g)+HO(g) CO(g)+H(g) ΔH =−41kJ·mol−1
2 2 2 2
Ⅲ.CO(g)+3H(g) CHOH(g)+H O(g) ΔH
2 2 3 2 3下列说法错误的是
A.反应Ⅱ在T<427K时,能自发进行
B.相同温度下,ΔG(Ⅰ)<ΔG(Ⅱ)的主要原因可能是ΔH>ΔH
1 2
C.ΔH=−75kJ·mol−1
3
D.400K时,平衡常数K(Ⅲ)=
14.劳动创造美好生活。下列劳动项目与所述的化学原理有关联且正确的是
选项 劳动项目 化学原理
A 工业生产Si单质 用石英砂和碳高温反应生成Si和
B 给橘子树喷洒波尔多液 具有强氧化性
用硫粉处理打碎的温度计中的水
C Hg能与S发生氧化还原反应
银
D 工业合成氨采用高温作条件 高温下, 和 的平衡转化率更高
A.A B.B C.C D.D
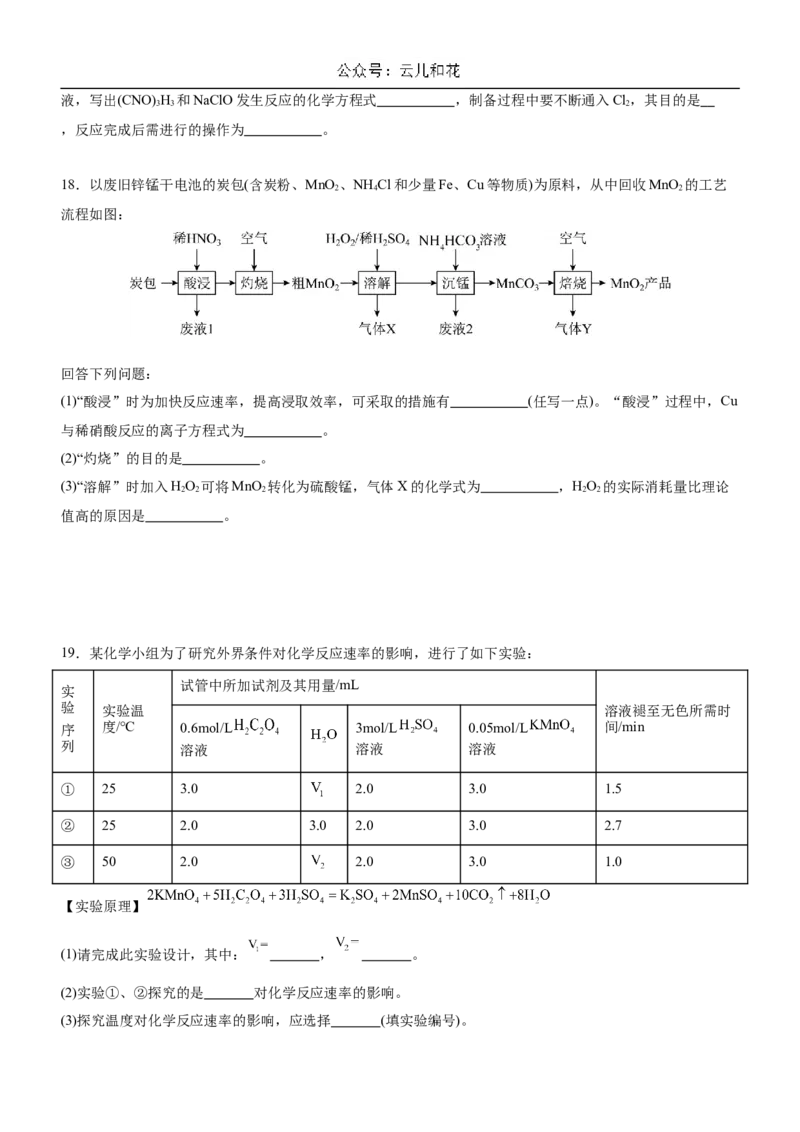
15.硫化氢(H S)是一种有臭鸡蛋气味的剧毒气体,在水溶液中电离方程式为:HS HS−+H+;HS− S2−
2 2
+H+。除去烟气中的HS方法有:① 溶液氧化脱除(原理如图1)、②活性炭吸附氧化脱除(原理如图
2
2,核心反应为HS−+O=S+OH−)。下列说法不正确的是A.图1中 溶液可以循环利用
B.图1脱除34 g HS,标准状况下,理论上消耗 体积为11.2 L
2
C.图2中,其他条件不变时,适当增大水膜的pH,HS的去除率可能增大
2
D.图2中,其他条件不变时,增大水膜的厚度,HS的去除率增大
2
16.常温下,浓度均为0.1mol/L体积均为V 的HA、HB溶液分别加水稀释至体积为V的溶液。稀释过程中,
0
pH与 的变化关系如图所示。下列叙述正确的是
A.pH随 的变化始终满足直线关系
B.溶液中水的电离程度:
C.该温度下,
D.分别向稀释前的HA、HB溶液中滴加同浓度NaOH溶液至恰好中和,HA消耗NaOH溶液体积大
二、非选择题:本题共4小题,共56分。
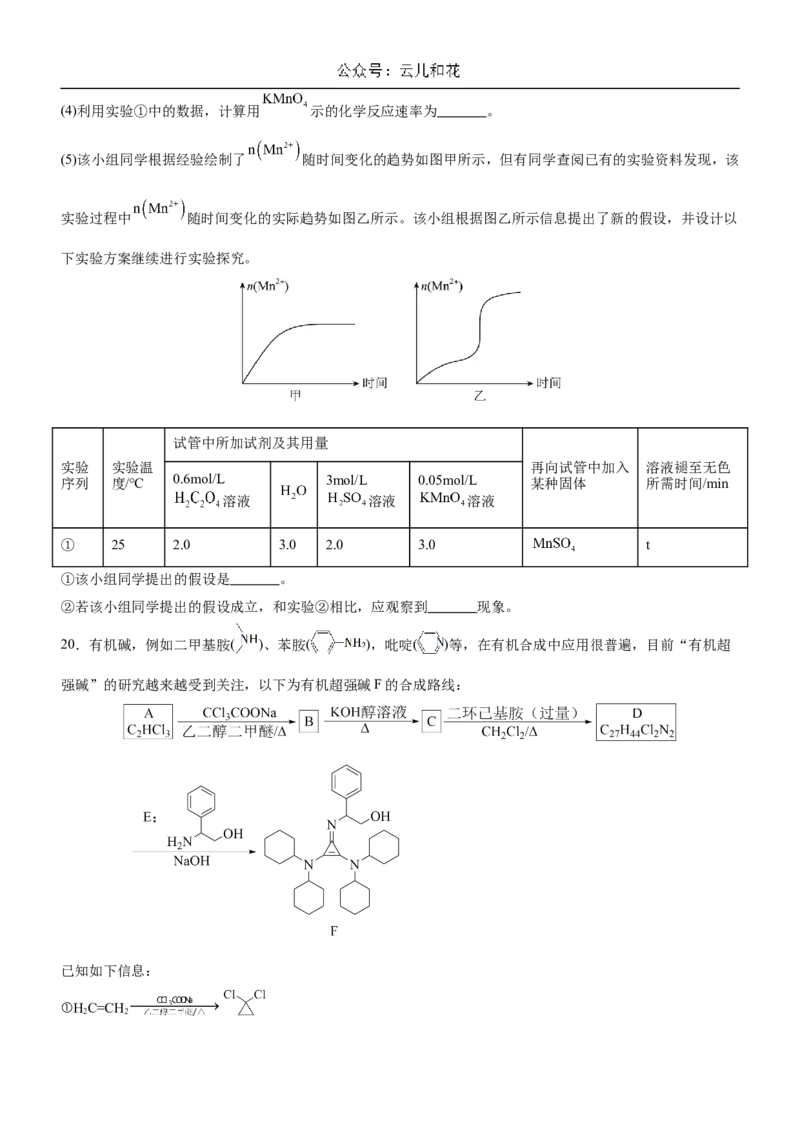
17.二氯异氰尿酸钠[(CNO) ClNa],具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温
3 2
下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和(CNO) H(氰尿酸)溶液,在10℃时
3 3
反应制备二氯异氰尿酸钠,实验装置如图所示:
回答下列问题:
(1)装置B中试剂为 ,装置D中,盛放(CNO) H 吡啶溶液的仪器名称为 。
3 3
(2)(CNO) ClNa的制备步骤如下:
3 2
①检查装置气密性后加入药品。
②关闭K,打开K,向A中滴加足量的浓盐酸,当观察到 时,关闭 ,滴入(CNO) H 的吡啶溶
1 2 3 3液,写出(CNO) H 和NaClO发生反应的化学方程式 ,制备过程中要不断通入Cl,其目的是
3 3 2
,反应完成后需进行的操作为 。
18.以废旧锌锰干电池的炭包(含炭粉、MnO 、NH Cl和少量Fe、Cu等物质)为原料,从中回收MnO 的工艺
2 4 2
流程如图:
回答下列问题:
(1)“酸浸”时为加快反应速率,提高浸取效率,可采取的措施有 (任写一点)。“酸浸”过程中,Cu
与稀硝酸反应的离子方程式为 。
(2)“灼烧”的目的是 。
(3)“溶解”时加入HO 可将MnO 转化为硫酸锰,气体X的化学式为 ,HO 的实际消耗量比理论
2 2 2 2 2
值高的原因是 。
19.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
试管中所加试剂及其用量/mL
实
验 实验温 溶液褪至无色所需时
序 度/℃ 0.6mol/L 3mol/L 0.05mol/L 间/min
列 溶液 溶液 溶液
① 25 3.0 2.0 3.0 1.5
② 25 2.0 3.0 2.0 3.0 2.7
③ 50 2.0 2.0 3.0 1.0
【实验原理】
(1)请完成此实验设计,其中: , 。
(2)实验①、②探究的是 对化学反应速率的影响。
(3)探究温度对化学反应速率的影响,应选择 (填实验编号)。(4)利用实验①中的数据,计算用 示的化学反应速率为 。
(5)该小组同学根据经验绘制了 随时间变化的趋势如图甲所示,但有同学查阅已有的实验资料发现,该
实验过程中 随时间变化的实际趋势如图乙所示。该小组根据图乙所示信息提出了新的假设,并设计以
下实验方案继续进行实验探究。
试管中所加试剂及其用量
实验 实验温 再向试管中加入 溶液褪至无色
序列 度/℃ 0.6mol/L 3mol/L 0.05mol/L 某种固体 所需时间/min
溶液 溶液 溶液
① 25 2.0 3.0 2.0 3.0 t
①该小组同学提出的假设是 。
②若该小组同学提出的假设成立,和实验②相比,应观察到 现象。
20.有机碱,例如二甲基胺( )、苯胺( ),吡啶( )等,在有机合成中应用很普遍,目前“有机超
强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
已知如下信息:
①HC=CH
2 2② +RNH
2
③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题:
(1)A的化学名称为 。
(2)由B生成C的化学方程式为 。
(3)C中所含官能团的名称为 。
(4)由C生成D的反应类型为 。
(5)D的结构简式为 。2024-2025学年度第一学期高二测试题
化学参考答案及评分标准:
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,
每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
题号 1 2 3 4 5 6 7 8
答案 D C C B D D A A
题号 9 10 11 12 13 14 15 16
答案 C C C D B C D C
17.(本题共14分,除特殊说明外,每空2分)
(1) 饱和食盐水 恒压滴液漏斗
(2) D中液面上方出现黄绿色气体 2NaClO+(CNO) H=(CNO) ClNa+NaOH+H O 使
3 3 3 2 2
反应生成的NaOH再次生成NaClO并参与反应,提高原料的利用率(4分)
打开K,通入N,将剩余的氨气排入E中,防止污染空气
1 2
18.(本题共12分,除特殊说明外,每空2分)
(1) 将炭包粉碎、搅拌等 (4分)
(2)将炭包中的炭粉转化为CO 除去
2
(3) O MnO 会催化 的分解,增大过氧化氢的消耗量,所以 的实际消耗量比理
2 2
论值高(4分)
19.(本题共14分,除特殊说明外,每空2分)
(1) 2.0 3.0
(2) 浓度
(3)②③
(4) 或
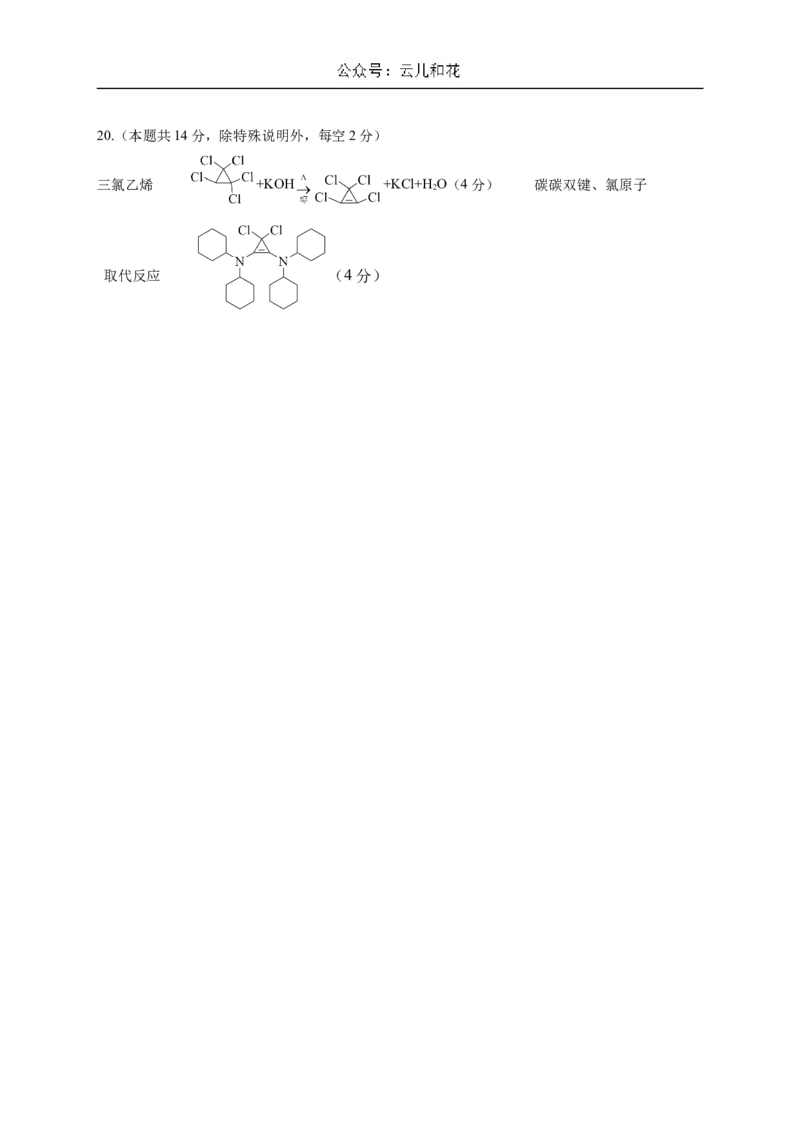
(5) 对该反应有催化作用 实验④中 溶液褪色更快20.(本题共14分,除特殊说明外,每空2分)
三氯乙烯 +KOH +KCl+H O(4分) 碳碳双键、氯原子
2
取代反应 (4分)