文档内容
高三入学考试
化学
考试时间75分钟,满分100分
注意事项:
1.答题前,考生务必在答题卡上将自己的姓名、座位号、准考证号用0.5毫米黑色签字笔填写
清楚,考生考试条形码由监考老师粘贴在答题卡上的“贴条形码区”.
2.选择题使用2B铅笔填涂在答题卡上对应题目标号的位置上,如需改动,用橡皮擦擦干净后
再填涂其它答案;非选择题用0.5毫米黑色签字笔在答题卡的对应区域内作答,超出答题区域
答题的答案无效;在草稿纸上、试卷上答题无效.
3.考试结束后由监考老师将答题卡收回.
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项
是符合题目要求的.
1.劳动成就梦想,创造美好生活.下列对相关劳动实践项目的原因解释错误的是( )
选项 劳动实践项目 原因解释
A 环保:宣传使用聚乳酸制造的包装材料 聚乳酸在自然界可生物降解
B
兴趣:新榨果汁提取液可使酸性 溶液褪色 果汁中含有还原性物质,能氧化 ,使其
褪色
C 帮厨:帮食堂师傅准备午餐——煎鸡蛋 加热使蛋白质变性
D 探究:用柠檬酸除去水垢 柠檬酸酸性强于碳酸
A.A B.B C.C D.D
2.下列化学用语或图示表达正确的是( )
A. 分子的 模型:
B.硼的基态原子轨道表示式:
C.顺—2—丁烯的结构简式:
D. 的名称:3-甲基戊烷
3.运用分类法可发现物质及其变化的规律.下列物质分类正确的是( )
选项 碱性氧化物 非金属单质 酸 醇类
A
BC 甘油
D
A.A B.B C.C D.D
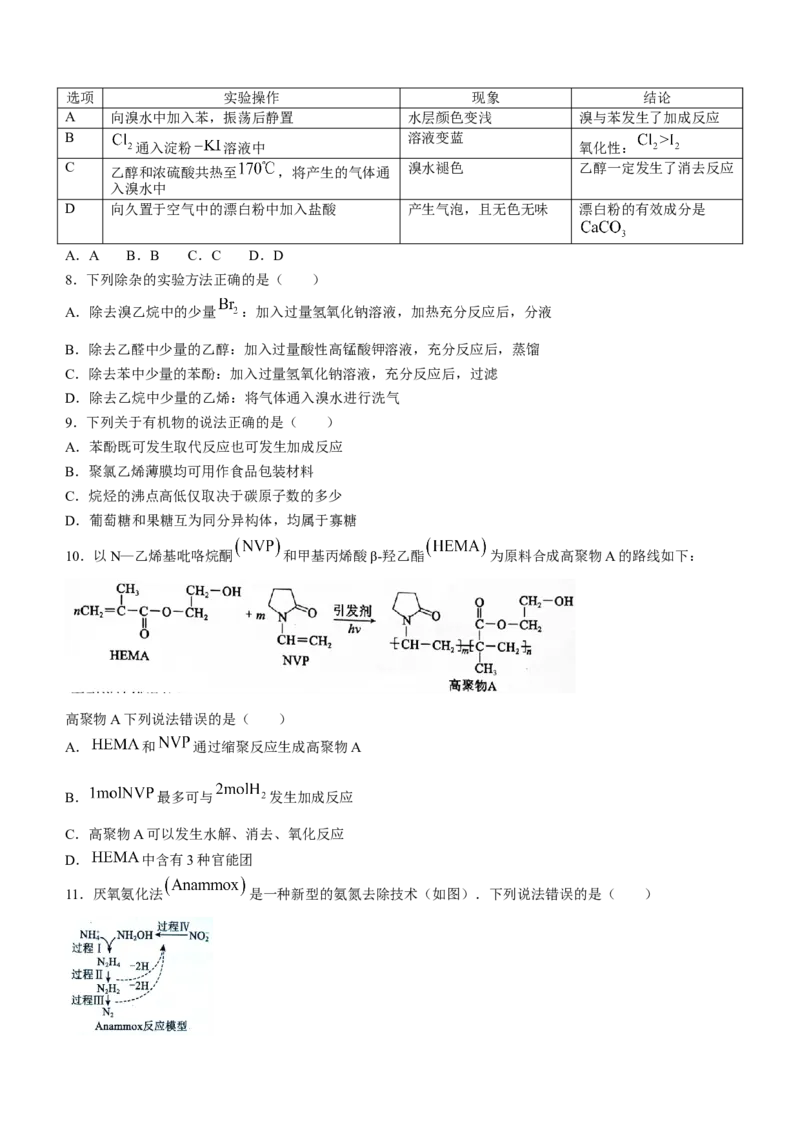
4. 杂志评选出的2019年世界十大科技进展之一是我国科研人员发现用于“点击化学”的一种新化
合物,如图所示.W、X、Y、Z为短周期主族元素且原子序数依次增大,X原子最外层有两个未成对电子,
X、Z同主族,Y元素在周期表中电负性最大,其原子的最外层电子数与W原子的核外电子总数相等.下列
说法正确的是( )
A.原子半径: B.第一电离能:
C.简单氢化物的沸点: D.X在其氢化物中均为 杂化
5.下列解释相应实验现象的离子方程式错误的是( )
A. 溶于烧碱溶液:
B.向硫酸铜溶液中滴加过量氨水:
C.向苯酚钠溶液中通入少量 ,出现白色浑浊:
D.向饱和碳酸钠溶液中通入足量
6.部分含 或含 物质的分类与相应化合价关系如图所示.下列推断不合理的是( )
A.能与 反应生成c的物质只有b
B.a位于元素周期表中的s区或 区
C.在一定条件下,d可与葡萄糖反应生成b
D.若b能与 反应生成 ,则b中含既离子键又含非极性共价键
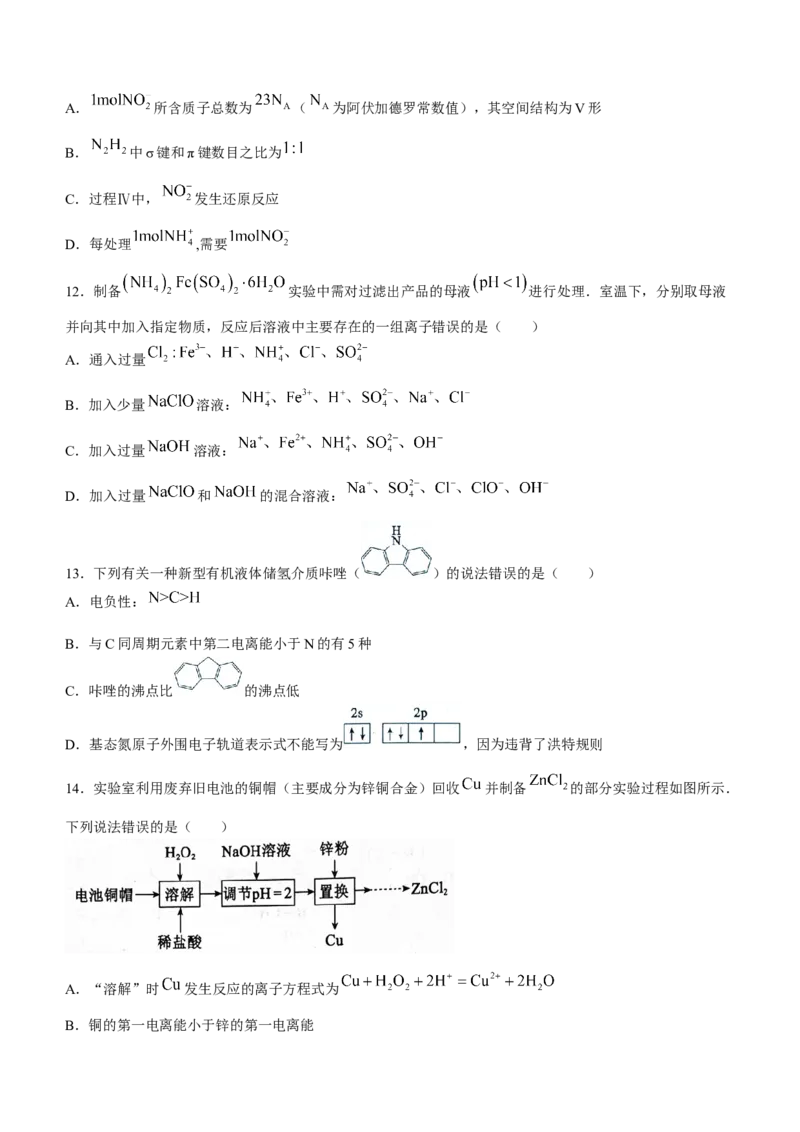
7.下列根据实验操作与现象得出的结论正确的是( )选项 实验操作 现象 结论
A 向溴水中加入苯,振荡后静置 水层颜色变浅 溴与苯发生了加成反应
B 溶液变蓝
通入淀粉 溶液中 氧化性:
C 溴水褪色 乙醇一定发生了消去反应
乙醇和浓硫酸共热至 ,将产生的气体通
入溴水中
D 向久置于空气中的漂白粉中加入盐酸 产生气泡,且无色无味 漂白粉的有效成分是
A.A B.B C.C D.D
8.下列除杂的实验方法正确的是( )
A.除去溴乙烷中的少量 :加入过量氢氧化钠溶液,加热充分反应后,分液
B.除去乙醛中少量的乙醇:加入过量酸性高锰酸钾溶液,充分反应后,蒸馏
C.除去苯中少量的苯酚:加入过量氢氧化钠溶液,充分反应后,过滤
D.除去乙烷中少量的乙烯:将气体通入溴水进行洗气
9.下列关于有机物的说法正确的是( )
A.苯酚既可发生取代反应也可发生加成反应
B.聚氯乙烯薄膜均可用作食品包装材料
C.烷烃的沸点高低仅取决于碳原子数的多少
D.葡萄糖和果糖互为同分异构体,均属于寡糖
10.以N—乙烯基吡咯烷酮 和甲基丙烯酸β-羟乙酯 为原料合成高聚物A的路线如下:
高聚物A下列说法错误的是( )
A. 和 通过缩聚反应生成高聚物A
B. 最多可与 发生加成反应
C.高聚物A可以发生水解、消去、氧化反应
D. 中含有3种官能团
11.厌氧氨化法 是一种新型的氨氮去除技术(如图).下列说法错误的是( )A. 所含质子总数为 ( 为阿伏加德罗常数值),其空间结构为V形
B. 中σ键和π键数目之比为
C.过程Ⅳ中, 发生还原反应
D.每处理 ,需要
12.制备 实验中需对过滤出产品的母液 进行处理.室温下,分别取母液
并向其中加入指定物质,反应后溶液中主要存在的一组离子错误的是( )
A.通入过量
B.加入少量 溶液:
C.加入过量 溶液:
D.加入过量 和 的混合溶液:
13.下列有关一种新型有机液体储氢介质咔唑( )的说法错误的是( )
A.电负性:
B.与C同周期元素中第二电离能小于N的有5种
C.咔唑的沸点比 的沸点低
D.基态氮原子外围电子轨道表示式不能写为 ,因为违背了洪特规则
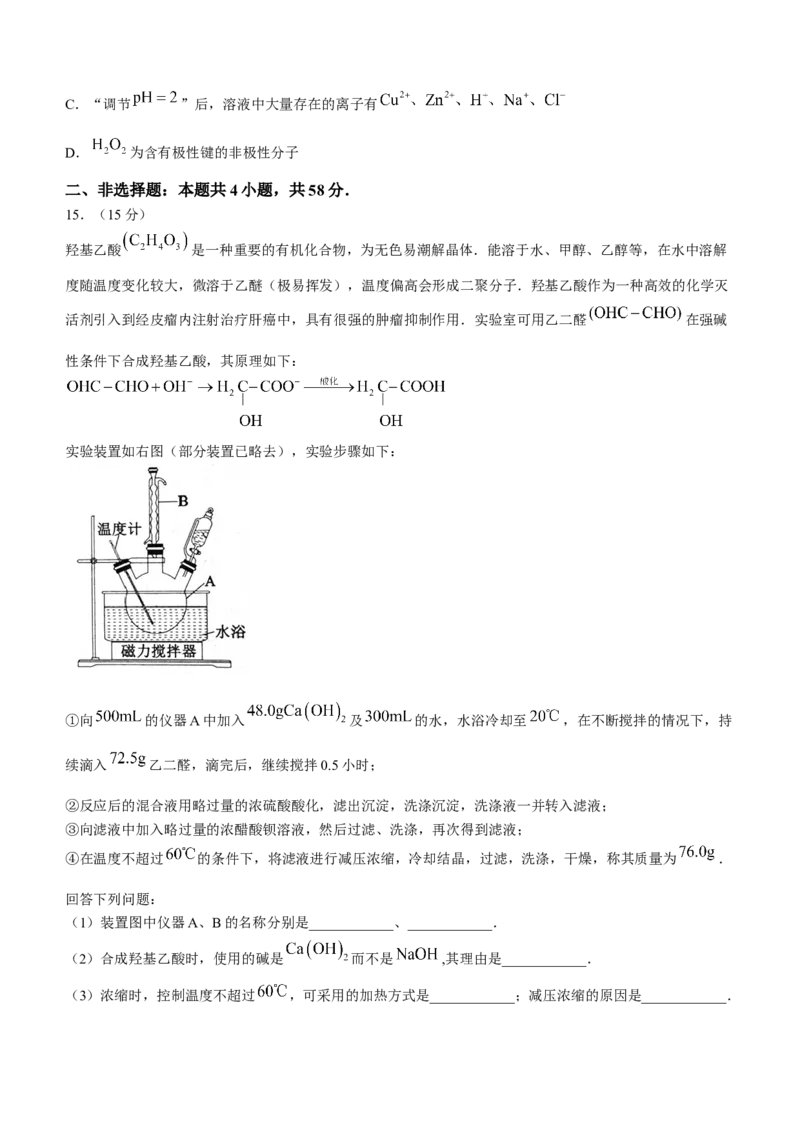
14.实验室利用废弃旧电池的铜帽(主要成分为锌铜合金)回收 并制备 的部分实验过程如图所示.
下列说法错误的是( )
A.“溶解”时 发生反应的离子方程式为
B.铜的第一电离能小于锌的第一电离能C.“调节 ”后,溶液中大量存在的离子有
D. 为含有极性键的非极性分子
二、非选择题:本题共4小题,共58分.
15.(15分)
羟基乙酸 是一种重要的有机化合物,为无色易潮解晶体.能溶于水、甲醇、乙醇等,在水中溶解
度随温度变化较大,微溶于乙醚(极易挥发),温度偏高会形成二聚分子.羟基乙酸作为一种高效的化学灭
活剂引入到经皮瘤内注射治疗肝癌中,具有很强的肿瘤抑制作用.实验室可用乙二醛 在强碱
性条件下合成羟基乙酸,其原理如下:
实验装置如右图(部分装置已略去),实验步骤如下:
①向 的仪器A中加入 及 的水,水浴冷却至 ,在不断搅拌的情况下,持
续滴入 乙二醛,滴完后,继续搅拌0.5小时;
②反应后的混合液用略过量的浓硫酸酸化,滤出沉淀,洗涤沉淀,洗涤液一并转入滤液;
③向滤液中加入略过量的浓醋酸钡溶液,然后过滤、洗涤,再次得到滤液;
④在温度不超过 的条件下,将滤液进行减压浓缩,冷却结晶,过滤,洗涤,干燥,称其质量为 .
回答下列问题:
(1)装置图中仪器A、B的名称分别是____________、____________.
(2)合成羟基乙酸时,使用的碱是 而不是 ,其理由是____________.
(3)浓缩时,控制温度不超过 ,可采用的加热方式是____________;减压浓缩的原因是____________.(4)步骤④中,冷却结晶后的晶体最适宜使用的洗涤试剂是____________(填标号).证明晶体己洗净的方
法是____________.
A.水 B.甲醇 C.乙醇 D.乙醚
(5)若要进一步提高产品的纯度,可采用的提纯方法的名称是____________.
(6)由实验数据可知,该实验合成羟基乙酸的产率为____________(保留3位有效数字).
16.(14分)
铬是自然界硬度最大的金属,具有很高的耐腐蚀性,广泛应用于冶金、化工、铸铁、耐火及高精端科技等领
域.工业上可采用铬铁矿(主要成分为 ,还含有少量 及其它不溶于水的杂质)进行金属铬的
冶炼,其流程如下:
已知:①白云石主要成分为 ;
②常温下, 完全沉淀的 约为9.4.
回答下列问题:
(1)含铬8%左右的铬铁矿通过“摇床粗选、中矿再选”两段选别的操作,得到含铬34%左右的精矿.对原
料进行上述操作,在化学上叫做元素的____________.
(2)工业上,高温下用 将 中的铬还原为金属铬的方法被称为____________法.
(3)“水浸”后的浸取液 略小于10.经检测,其中几乎不存在钙、镁元素,其原因可能是____________.
(4)取“沉铝”后的滤液于小烧杯中,用激光笔照射,发现沿着光线方向,滤液中出现一条明亮的光带,说
明该滤液中存在____________(填分散质粒子名称).
(5)“沉铝”时若 过小(加酸过多),后续过程会耗费较多原料,其原因是____________.
(6)“沉铝”后的滤液(含 )在酸性环境下用 还原为 的离子方程式为____________.
(7)铬常用于电镀行业,使金属表面覆盖一层既美观又抗腐蚀的铬,但电镀液会残留含剧毒的 ,一般
用 将其转化为对环境影响不大的 ,若处理含 的电镀液,处理过程中转移的电子数为
____________(阿伏加德罗常数为 ).17.(14分)
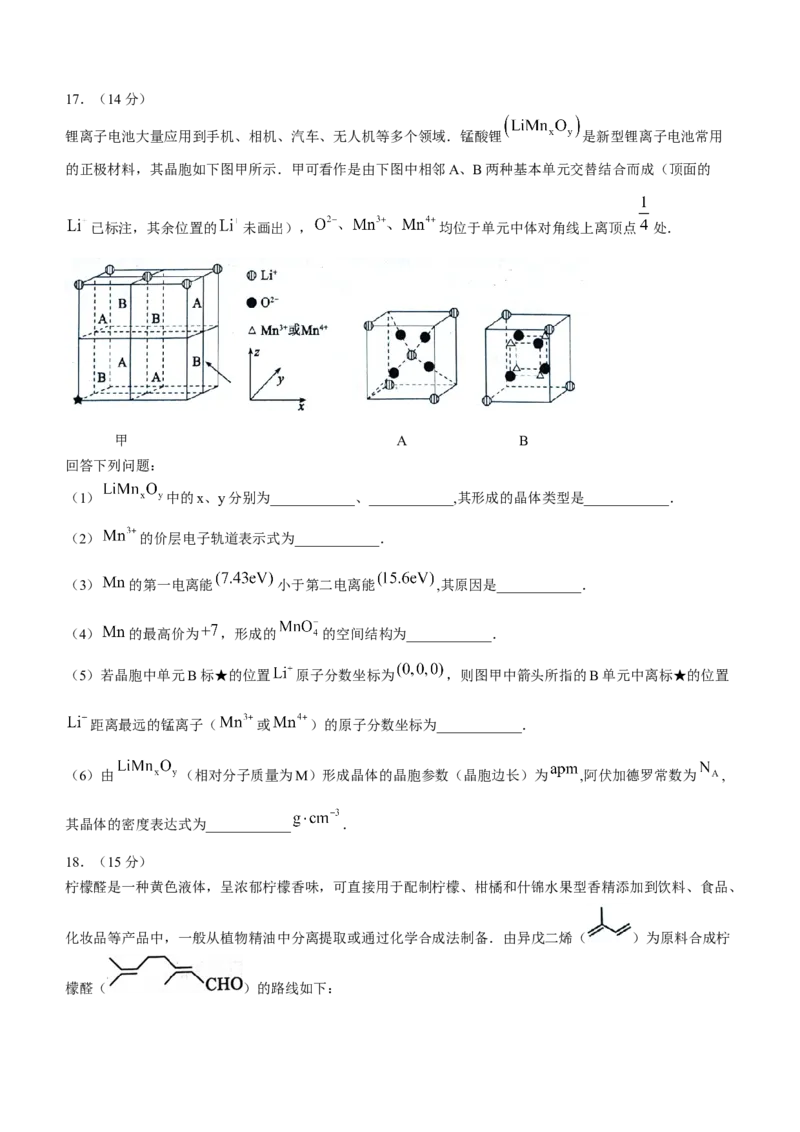
锂离子电池大量应用到手机、相机、汽车、无人机等多个领域.锰酸锂 是新型锂离子电池常用
的正极材料,其晶胞如下图甲所示.甲可看作是由下图中相邻A、B两种基本单元交替结合而成(顶面的
已标注,其余位置的 未画出), 均位于单元中体对角线上离顶点 处.
甲 A B
回答下列问题:
(1) 中的x、y分别为____________、____________,其形成的晶体类型是____________.
(2) 的价层电子轨道表示式为____________.
(3) 的第一电离能 小于第二电离能 ,其原因是____________.
(4) 的最高价为 ,形成的 的空间结构为____________.
(5)若晶胞中单元B标★的位置 原子分数坐标为 ,则图甲中箭头所指的B单元中离标★的位置
距离最远的锰离子( 或 )的原子分数坐标为____________.
(6)由 (相对分子质量为M)形成晶体的晶胞参数(晶胞边长)为 ,阿伏加德罗常数为 ,
其晶体的密度表达式为____________ .
18.(15分)
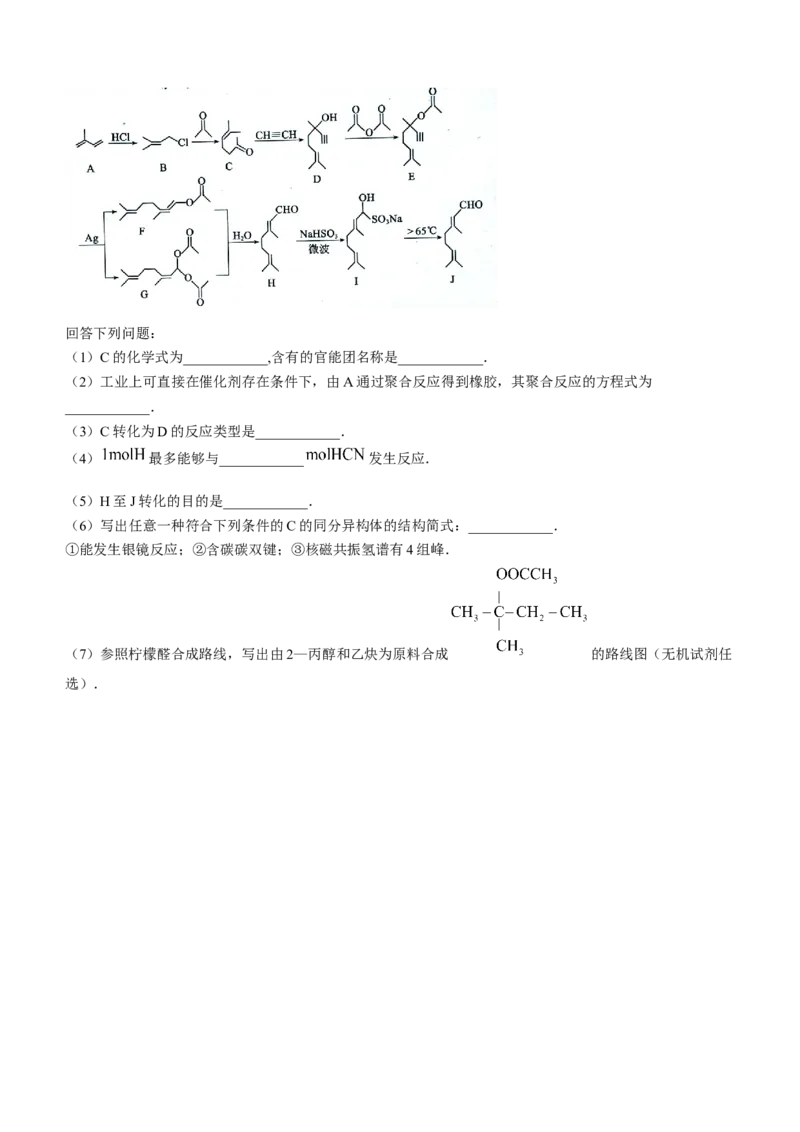
柠檬醛是一种黄色液体,呈浓郁柠檬香味,可直接用于配制柠檬、柑橘和什锦水果型香精添加到饮料、食品、
化妆品等产品中,一般从植物精油中分离提取或通过化学合成法制备.由异戊二烯( )为原料合成柠
檬醛( )的路线如下:回答下列问题:
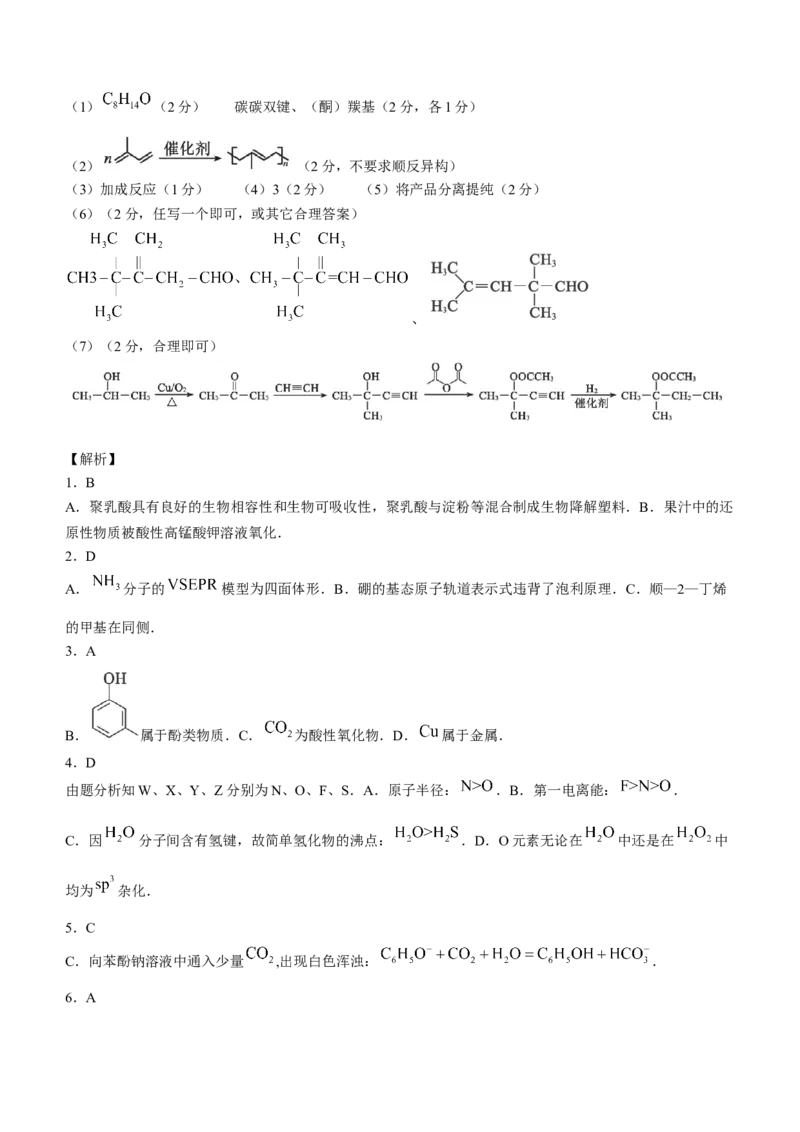
(1)C的化学式为____________,含有的官能团名称是____________.
(2)工业上可直接在催化剂存在条件下,由A通过聚合反应得到橡胶,其聚合反应的方程式为
____________.
(3)C转化为D的反应类型是____________.
(4) 最多能够与____________ 发生反应.
(5)H至J转化的目的是____________.
(6)写出任意一种符合下列条件的C的同分异构体的结构简式:____________.
①能发生银镜反应;②含碳碳双键;③核磁共振氢谱有4组峰.
(7)参照柠檬醛合成路线,写出由2—丙醇和乙炔为原料合成 的路线图(无机试剂任
选).高三入学考试
化学参考答案及评分标准
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项
是符合题目要求的.
1~5 BDADC 6~10 ABDAA 11~14 BCCD
二、非选择题:本题共4小题,共58分.
注意:1.本试卷中其他合理答案,可参照此评分标准酌情给分.
2.化学方程式反应物、生成物写错或未配平均为0分,无条件或错误或无“↑”“↓”扣1分.
15.(15分)
(1)三颈(烧)瓶(1分) 球形冷凝管(1分)
(2)价格相对便宜; 在后续加硫酸过程中可除去,避免后续结晶时,金属离子引入到产品中(2分,
各1分)
(3)水浴加热(1分) 降低溶剂的沸点,使其在低压条件下蒸发,避免温度过高使羟基乙酸形成二聚分
子而降低产率(2分)
(4)D(2分) 取最后一次洗涤液,加入稀硫酸,不产生白色沉淀(2分)
(5)重结晶(2分) (6)80.0%(2分)
16.(14分)
(1)富集(2分) (2)铝热(或“热还原”)(2分)
(3)碳酸钠过量,碱性较强,钙、镁离子均被沉淀(2分)
(4)胶体粒子(或胶粒、 ,2分)
(5)后续沉淀铬离子时,要先中和掉多余的酸(2分)
(6) (2分)
(7) (2分)
17.(14分)(1)2(1分) 4(1分) 离子晶体(2分)
(2) (2分)
(3) 带一个单位正电荷,对再失去的1个电子有较强吸引力(2分)
(4)正四面体形(2分)
(5) (2分) (6) (2分)
18.(15分)(1) (2分) 碳碳双键、(酮)羰基(2分,各1分)
(2) (2分,不要求顺反异构)
(3)加成反应(1分) (4)3(2分) (5)将产品分离提纯(2分)
(6)(2分,任写一个即可,或其它合理答案)
、
(7)(2分,合理即可)
【解析】
1.B
A.聚乳酸具有良好的生物相容性和生物可吸收性,聚乳酸与淀粉等混合制成生物降解塑料.B.果汁中的还
原性物质被酸性高锰酸钾溶液氧化.
2.D
A. 分子的 模型为四面体形.B.硼的基态原子轨道表示式违背了泡利原理.C.顺—2—丁烯
的甲基在同侧.
3.A
B. 属于酚类物质.C. 为酸性氧化物.D. 属于金属.
4.D
由题分析知W、X、Y、Z分别为N、O、F、S.A.原子半径: .B.第一电离能: .
C.因 分子间含有氢键,故简单氢化物的沸点: .D.O元素无论在 中还是在 中
均为 杂化.
5.C
C.向苯酚钠溶液中通入少量 ,出现白色浑浊: .
6.AA.能与 反应生成 的物质有b( 或 )和 .
7.B
A.向溴水中加入苯,振荡后静置,发生了萃取,溴单质从水层到苯层,并未发生反应.C.乙醇和浓硫酸共
热至 ,将产生的气体通入溴水中,溴水褪色,可能是生成的二氧化硫使溴水褪色.D.久置空气中的
漂白粉中次氯酸钙会与二氧化碳反应生成碳酸钙,碳酸钙与盐酸反应生成二氧化碳,但漂白粉的有效成分为
次氯酸钙.
8.D
A.除去溴乙烷中的少量 :加入过量氢氧化钠溶液,加热后溴乙烷也会发生反应.B.除去乙醛中少量的
乙醇:加入过量酸性高锰酸钾溶液,两种物质均会被酸性高锰酸钾溶液氧化.C.除去苯中少量的苯酚:加
入过量氢氧化钠溶液,充分反应后分液分离出苯.D.除去乙烷中少量的乙烯:将气体通入溴水,乙烯与溴
单质反应生成无色液体物质.
9.A
B.聚氯乙烯在制取过程中会加入增塑剂,有毒,不可用作生产食品包装材料.C.烷烃的沸点高低取决于碳
原子数的多少,对于有同分异构体的烷烃还要看支链的多少.D.葡萄糖和果糖互为同分异构体,都属于单
糖.
10.A
A.由反应可知该反应为加聚反应.
11.B
B. 的结构式 ,σ键和π键数目之比为 .
12.C
C.制备 的滤出产品的母液为饱和溶液,溶液中有 ,此时溶液
呈酸性,所以加入过量的 溶液后,不可能还有 .
13.C
C.咔唑的沸点比 的沸点高,因咔唑可形成分子间氢键.
14.D
D. 为含有极性键的极性分子.
15.(15分)
(1)装置图中仪器A、B的名称分别是三颈(烧)瓶、球形冷凝管.
(2)合成羟基乙酸时,使用的碱是 而不是 ,其理由是: 价格相对便宜; 在后
续加硫酸过程中可除去,避免后续结晶时,金属离子引入到产品中.(3)浓缩时,控制温度不超过 ,可采用的加热方式是水浴加热;减压浓缩的原因是降低溶剂的沸点,
使其在低压条件下蒸发,避免温度过高使羟基乙酸形成二聚分子而降低产率.
(4)步骤④中,冷却结晶后的晶体最适宜使用的洗涤试剂是乙醚.证明晶体已洗净的方法是取最后一次洗涤
液,加入稀硫酸,不产生白色沉淀.
(5)若要进一步提高产品的纯度,可采用的提纯方法的名称是重结晶.
(6)由实验数据可知,该实验合成羟基乙酸的产率为 .
16.(14分)
(1)含铬8%左右的铬铁矿通过“摇床粗选、中矿再选”两段选别的操作,得到含铬34%左右的精矿,对原
料进行这样的操作,在化学上叫做元素的富集.
(2)工业上,高温下用 将 中的铬还原为金属的方法被称为铝热法(或热还原法).
(3)水浸后的浸取液几乎不存在钙、镁元素,其原因可能是碳酸钠过量,碱性较强,钙、镁离子均被沉淀.
(4)滤液中出现一条明亮的光带,说明该滤液中存在胶体粒子(或胶粒).
(5)“沉铝”时,若 过小(加酸过多),后续沉淀铬离子时,要先中和掉多余的酸.
(6)“沉铝”后的滤液在酸性环境下用 还原为 的离子方程式如下:
(7)用 将 转化为 ,若处理含 的电镀液,处理过程中转移的电子数为
.
17.(14分)
(1)根据晶胞的组成,可算出晶胞中 个数为 个数为 和
个数为 ,所以当 取1时,x、y分别为2和4.因三种元素均形成离子,故 形成的晶
体类型是离子晶体.
(2) 的轨道表示式为 .
(3) 的第一电离能 小于第二电离能 ,其原因是 带一个单位正电荷,对再失去的1个电子
有较强吸引力.(4)由价层电子对互斥理论,可以算出 形成的 的价层电子对数为4,孤电子对数为0,故
的空间结构是正四面体形.
(5)离标★的位置 距离最远的锰离子( 或 )如图中箭头所指,其原子分数坐标为
.
(6)晶胞的“化学式”为 ,根据一个晶胞含8个 ,其晶体的密度表达式为
.
18.(15分)
(1)C的化学式为 ,含有的官能团名称是碳碳双键、(酮)羰基.
(2)聚合反应的方程式为 .
(3)因σ键总数减少,故C转化为D的反应类型是加成反应.
(4) 能和碳碳双键和醛基加成, 最多能够和 发生反应.
(5)H中混有其他有机杂质,通过转化为水溶性物质I,分离出有机杂质,再重新变成J,故H至J转化的目的
是将产品分离提纯.
(6)根据对称原则,符合条件的C的同分异构体的结构简式如下:
、
(7)参照柠檬醛合成线路,由2—丙醇和乙炔为原料合成 的路线图如下: