文档内容
2024级高二第一学期期中考试
化学科试卷
第Ⅰ卷(选择题 共44分)
一、单项选择题(本题包括16小题,1~10小题每题2分,11~16小题每题4分,共44分。)
1.化学与生产、生活、社会密切相关。下列说法正确的是
A.利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济”
B.铁制品表面镀上铜保护层,是利用牺牲阳极法
C.水凝结成冰的过程中,体系的混乱度变化ΔS>0
D.“问天”实验舱采用砷化镓太阳能电池片,该电池将化学能转化为电能
2.劳动有利于“知行合一”。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 家务劳动:热纯碱液浸泡油烟机滤网 升温促进碳酸钠水解
B 社区服务:使用氯化铵溶液清洗铁锈 氯化铵可分解产生HCl
C 帮厨活动:餐后将洗净的铁锅擦干 铁锅在潮湿环境下容易发生电化学腐蚀
D 学农活动:野炊时将煤炭碾碎使用 增大煤炭与空气接触面积,加快燃烧
3.下列措施或现象不
.
能
.
用勒夏特列原理解释的是
A.合成氨工业中需要采用高压的条件
B.Ni s +4CO g =Ni CO g ,将镍粉碎有利于四羰基镍的生成
4
C.向醋酸溶液中加入少许醋酸钠固体,溶液的pH增大
D.加热0.5mol/LCuCl 溶液,颜色由蓝色变为绿色
2
4.下列解释实验事实的方程式不
.
正
.
确
.
的是
A.0.1mol/LCH COOH溶液的pH>1:CH COOHH++CH COO-
3 3 3
B.“NO 球”浸泡在冷水中,颜色变浅:2NO (g)N O (g) ΔH<0
2 2 2 4
C.向Na CO 溶液处理水垢中的CaSO :Ca2++CO 2-CaCO ↓
2 3 4 3 3
D.向Na CO 溶液中滴入酚酞溶液,溶液变红:CO 2-+H OOH-+HCO -
2 3 3 2 3
5.硼酸(H
3
BO
3
)的电离方程式为H
3
BO
3
+H
2
OB(OH)
4
+H+。已知常温下,K
a
(H
3
BO
3
)=5.4×10-10、
K a (CH 3 COOH)=1.75×10-5。下列说法错 . 误 . 的是
A.H BO 为一元弱酸
3 3
B.0.01mol•L-1H BO 溶液的pH≈6
3 3
C.常温下,等浓度溶液的pH:CH COONa>Na[B(OH) ]
3 4
D.NaOH溶液溅到皮肤时,可用大量清水冲洗,再涂上硼酸溶液
第 页,共 页
1 86.肼(N H )又称联氨,为二元弱碱,与硫酸反应可生成 N H SO 、N H SO 。
2 4 2 5 2 4 2 6 4
下列说法正确的是
A.水溶液中N H SO 的电离方程式为 N H SO =N H2++SO2−
2 6 4 2 6 4 2 6 4
B.室温下,稀释0.01mol·L-1N H 水溶液,pH升高
2 4
C.室温下,0.01mol·L-1N H 水溶液pH=12
2 4
D.N H 的水溶液中存在:c N H+ +c N H2+ +c H+ =c OH-
2 4 2 5 2 6
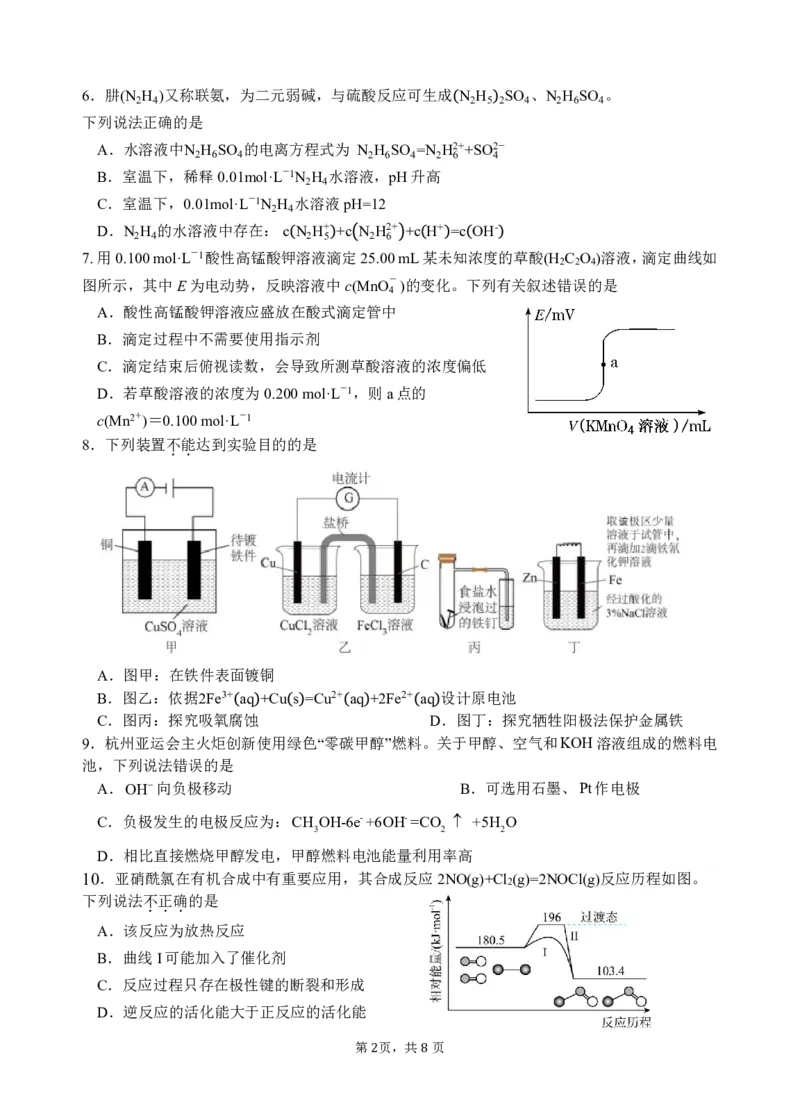
7.用0.100mol·L-1酸性高锰酸钾溶液滴定25.00mL某未知浓度的草酸(H C O )溶液,滴定曲线如
2 2 4
图所示,其中E为电动势,反映溶液中c(MnO - )的变化。下列有关叙述错误的是
4
A.酸性高锰酸钾溶液应盛放在酸式滴定管中
B.滴定过程中不需要使用指示剂
C.滴定结束后俯视读数,会导致所测草酸溶液的浓度偏低
D.若草酸溶液的浓度为0.200mol·L-1,则a点的
c(Mn2+)=0.100mol·L-1
8.下列装置不
.
能
.
达到实验目的的是
A.图甲:在铁件表面镀铜
B.图乙:依据2Fe3+ aq +Cu s =Cu2+ aq +2Fe2+ aq 设计原电池
C.图丙:探究吸氧腐蚀 D.图丁:探究牺牲阳极法保护金属铁
9.杭州亚运会主火炬创新使用绿色“零碳甲醇”燃料。关于甲醇、空气和KOH溶液组成的燃料电
池,下列说法错误的是
A.OH向负极移动 B.可选用石墨、Pt作电极
C.负极发生的电极反应为:CH OH-6e-+6OH-=CO +5H O
3 2 2
D.相比直接燃烧甲醇发电,甲醇燃料电池能量利用率高
10.亚硝酰氯在有机合成中有重要应用,其合成反应2NO(g)+Cl (g)=2NOCl(g)反应历程如图。
2
下列说法不正确的是
...
A.该反应为放热反应
B.曲线I可能加入了催化剂
C.反应过程只存在极性键的断裂和形成
D.逆反应的活化能大于正反应的活化能
第 页,共 页
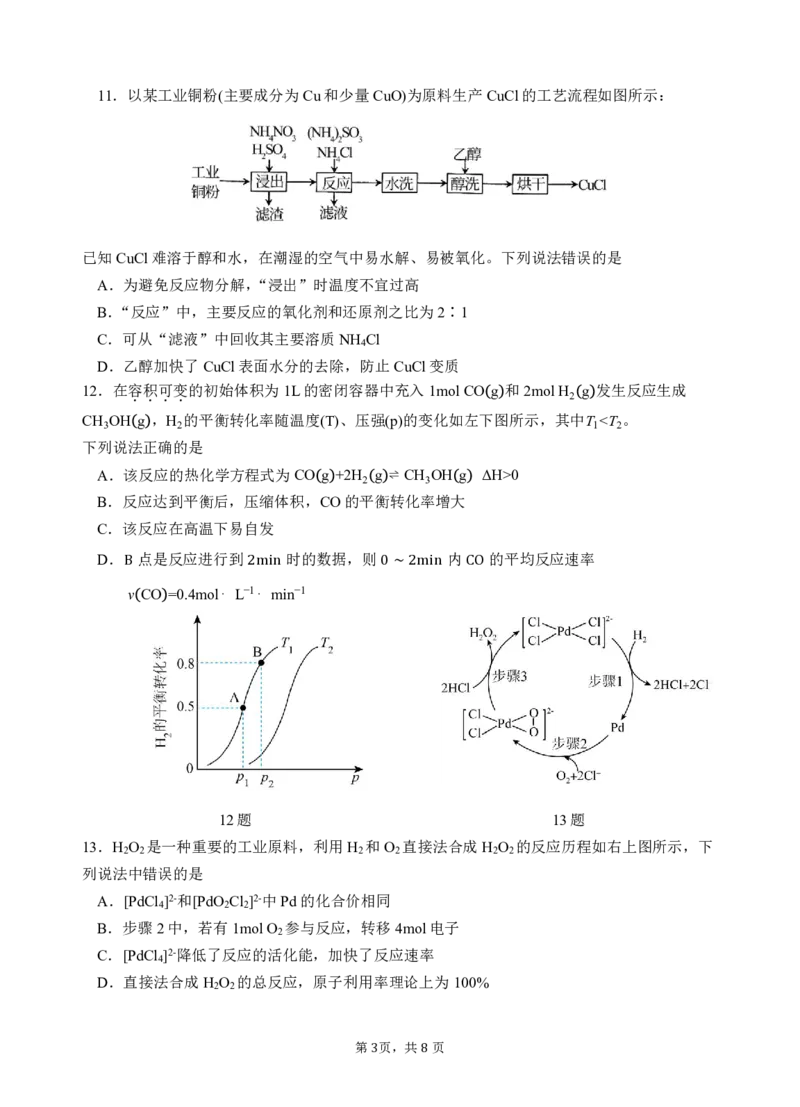
2 811.以某工业铜粉(主要成分为Cu和少量CuO)为原料生产CuCl的工艺流程如图所示:
已知CuCl难溶于醇和水,在潮湿的空气中易水解、易被氧化。下列说法错误的是
A.为避免反应物分解,“浸出”时温度不宜过高
B.“反应”中,主要反应的氧化剂和还原剂之比为2∶1
C.可从“滤液”中回收其主要溶质NH Cl
4
D.乙醇加快了CuCl表面水分的去除,防止CuCl变质
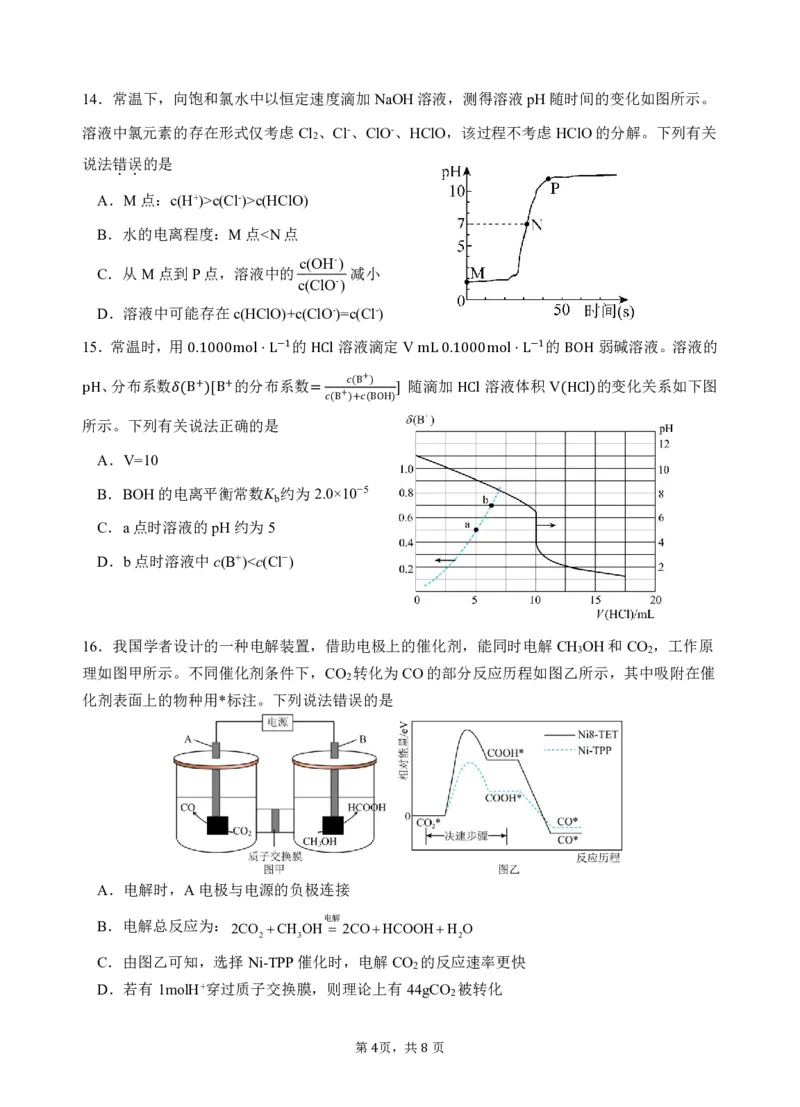
12.在容 . 积 . 可 . 变 . 的初始体积为1L的密闭容器中充入1molCO g 和2molH 2 g 发生反应生成
CH OH g ,H 的平衡转化率随温度(T)、压强(p)的变化如左下图所示,其中T 0
2 3
B.反应达到平衡后,压缩体积,CO的平衡转化率增大
C.该反应在高温下易自发
D. 点是反应进行到 时的数据,则 内 的平均反应速率
Bv CO =0.4mol⋅ L−21⋅mimnin−1 0∼2min CO
12题 13题
13.H O 是一种重要的工业原料,利用H 和O 直接法合成H O 的反应历程如右上图所示,下
2 2 2 2 2 2
列说法中错误的是
A.[PdCl ]2-和[PdO Cl ]2-中Pd的化合价相同
4 2 2
B.步骤2中,若有1molO 参与反应,转移4mol电子
2
C.[PdCl ]2-降低了反应的活化能,加快了反应速率
4
D.直接法合成H O 的总反应,原子利用率理论上为100%
2 2
第 页,共 页
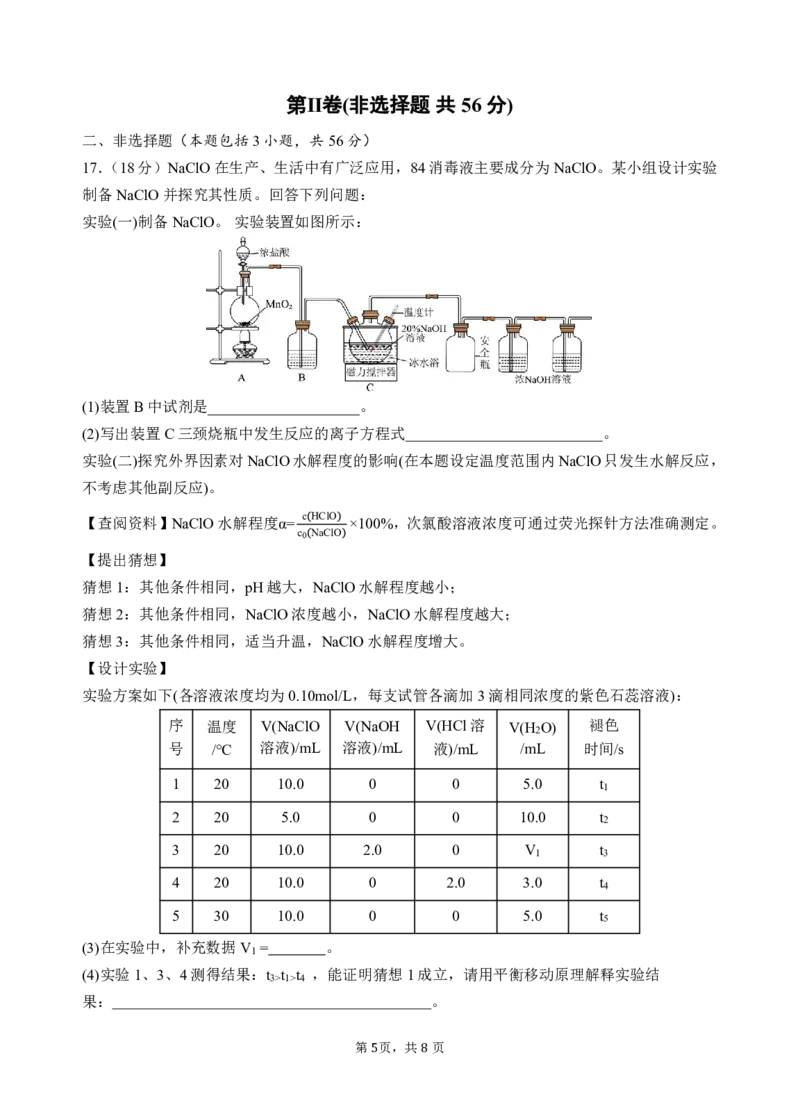
3 814.常温下,向饱和氯水中以恒定速度滴加NaOH溶液,测得溶液pH随时间的变化如图所示。
溶液中氯元素的存在形式仅考虑Cl 、Cl-、ClO-、HClO,该过程不考虑HClO的分解。下列有关
2
说法错误的是
..
A.M点:c(H+)>c(Cl-)>c(HClO)
B.水的电离程度:M点1>4
果: 。
第 页,共 页
5 8(5)实验1、2不能验证猜想2,其原因是溶液中_______浓度越小(填化学式),c(HClO)越小。可采
用的改进方案是用 方法测定不同浓度NaClO溶液中的c(HClO),计算NaClO水解程度。
(6)实验结果;t t ,但是不能证明猜想3成立,其原因是浓度不变时,升温, 也增大。
5<1
经过小组讨论,大家认为可以通过测定不同温度下NaClO水解平衡常数K ,确定温度对NaClO
h
水解程度的影响。
【查阅资料】K =
c2 OH-
,c 为溶液起始浓度。
h c0-c OH- 0
【试剂与仪器】一定浓度的NaClO溶液、0.1000mol/L的盐酸、蒸馏水、pH计等。
【设计实验】测定30℃下NaClO水解平衡常数K ,完成表中实验。
h
序号 实验内容 记录数据
取20.00mLNaClO溶液,用
消耗盐酸体积
6 0.1000mol/L盐酸滴定至终点,
为VmL
测NaClO溶液的浓度
7 测得30℃纯水的pH a
8 ________________ b
(7)分别在35℃、40℃下重复上述实验。
①实验8的实验内容是 。
②数据处理:30℃,K = (用含a、b、V的代数式表示)。
h
③实验结论:K 40℃ >K 35℃ >K 30℃ ,升高温度能促进NaClO水解。
h h h
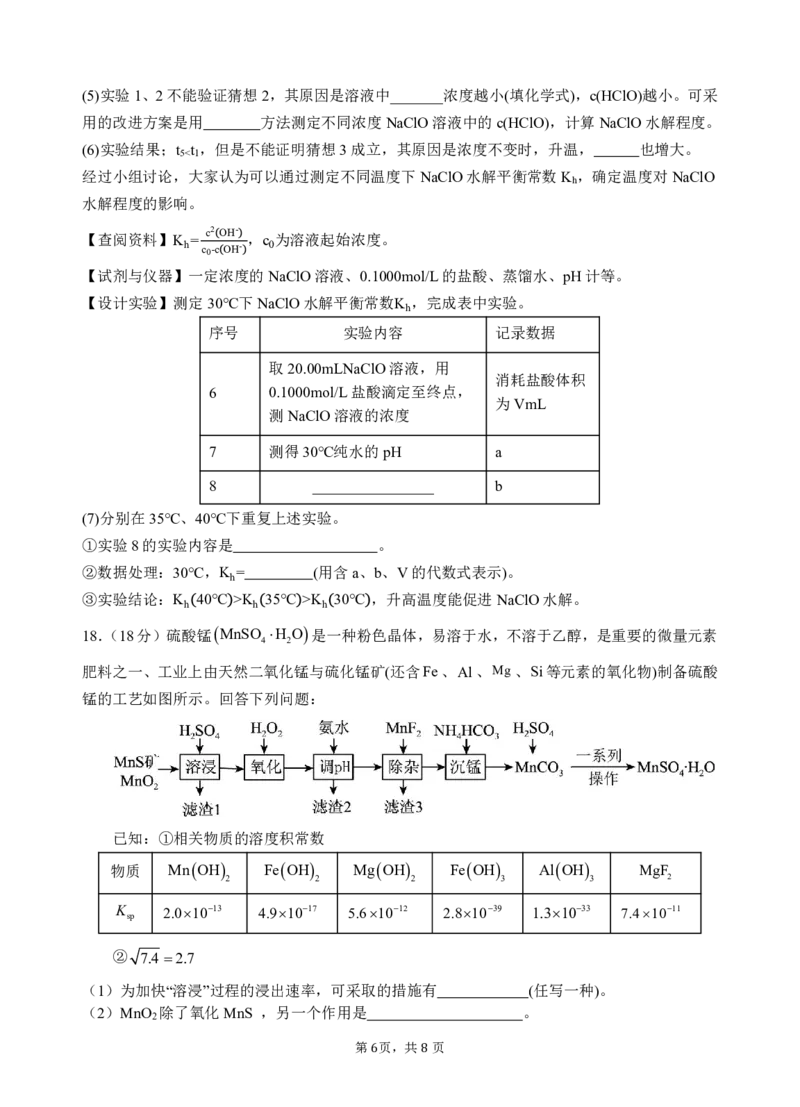
18.(18分)硫酸锰MnSO H O是一种粉色晶体,易溶于水,不溶于乙醇,是重要的微量元素
4 2
肥料之一、工业上由天然二氧化锰与硫化锰矿(还含Fe、Al、Mg、Si等元素的氧化物)制备硫酸
锰的工艺如图所示。回答下列问题:
已知:①相关物质的溶度积常数
物质 MnOH FeOH MgOH FeOH AlOH MgF
2 2 2 3 3 2
K 2.01013 4.91017 5.61012 2.81039 1.31033 7.41011
sp
② 7.4 2.7
(1)为加快“溶浸”过程的浸出速率,可采取的措施有 (任写一种)。
(2)MnO 除了氧化MnS ,另一个作用是 。
2
第 页,共 页
6 8(3)“滤渣1”中含有S和 ,请写出生成S的离子方程式 。
(4)加入MnF 除镁时,需控制溶液中c
F
molL1才能将Mg2沉淀完全。(溶液中的离
2
子浓度小于或等于1105 · 时可认为沉淀完全)
-1
(5)已知K NH H Omo 1 l .8L 105,K H CO 4.5107,K H CO 4.71011,则
b 3 2 a1 2 3 a2 2 3
NH HCO 溶液显 性(填“酸”或“碱”)。
4 3
(6)“沉锰”时发生的离子方程式为 。
(7)用惰性电极电解MnSO 酸性溶液可制得MnO ,请写出电解法制备MnO 时阳极反应
4 2 2
式 。MnO 可用做碱性锌锰电池电极材料,该电池的工作原理为:
2
Zn+2MnO +2H O=2MnO(OH)+Zn(OH) ,电池放电时正极反应式为 。
2 2 2
19.(20分)汞及其化合物在工业生产中具有重要应用。但汞具有一定毒性,需对含汞的废水、
废气进行安全处理。
(1)Hg不慎洒落时,可用S将其覆盖生成难溶的HgS。HgS在水中的沉淀溶解平衡方程式
为 。
(2)Hg可与NO 反应,实现含Hg废气的处理,其反应机理为:
2
反应Ⅰ.HggNO g HgNO g ΔH
2 2 1
反应Ⅱ.HgNO gNO g HgONO g ΔH
2 2 2 2
①反应Ⅲ.Hgg2NO g HgONO g ΔH = (用ΔH 和ΔH 表示)。
2 2 3 1 2
②恒温恒容下,通入一定量Hg(g)和NO (g)发生反应Ⅲ,下列说法正确的是 。
2
A.混合气体的密度保持不变时,说明体系已达平衡状态
B.增大NO 的浓度,可提高Hg(g)的平衡脱除率
2
C.向容器中充入少量氦气可缩短到达平衡的时间
D.加入催化剂,可降低反应活化能,提高Hg的脱除速率
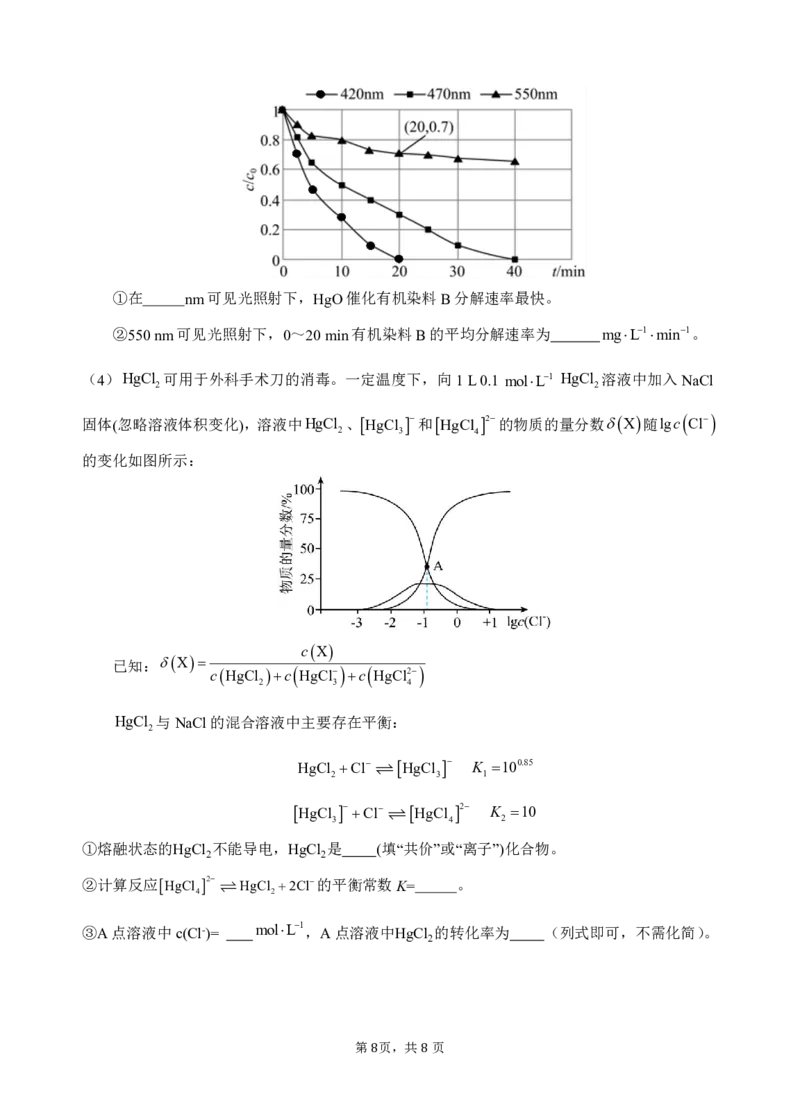
(3)光照条件下,HgO可催化有机染料分解。向三组100mL12mgL1的有机染料B溶液中分
别加入0.075gHgO,在不同波长的可见光照射下进行光催化活性测试,溶液中c/c (某时刻B的
0
浓度c与初始浓度c 的比值)随光照时间t的变化如图所示:
0
第 页,共 页
7 8①在 nm可见光照射下,HgO催化有机染料B分解速率最快。
②550nm可见光照射下,0~20min有机染料B的平均分解速率为 mgL1min1。
(4)HgCl 可用于外科手术刀的消毒。一定温度下,向1L0.1 molL1 HgCl 溶液中加入NaCl
2 2
固体(忽略溶液体积变化),溶液中HgCl 、HgCl 和HgCl 2的物质的量分数X随lgc Cl
2 3 4
的变化如图所示:
cX
已知:X
cHgCl c HgCl c HgCl2
2 3 4
HgCl 与NaCl的混合溶液中主要存在平衡:
2
HgCl Cl HgCl K 100.85
2 3 1
HgCl Cl HgCl 2 K 10
3 4 2
①熔融状态的HgCl 不能导电,HgCl 是 (填“共价”或“离子”)化合物。
2 2
②计算反应HgCl 2 HgCl 2Cl的平衡常数K= 。
4 2
③A点溶液中c(Cl-)=
molL1,A点溶液中HgCl
的转化率为 (列式即可,不需化简)。
2
第 页,共 页
8 8