文档内容
丽水、湖州、衢州 2024 年 4 月三地市高三教学质量检测
化学试题卷
考生须知:
1.本卷满分100分,考试时间90分钟;
2.答题前,在答题卷指定区域填写班级、姓名、试场号、座位号及准考证号;
3.所有答案必须写在答题卷上,写在试卷上无效;
4.考试结束后,只需上交答题卷。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 S-32 Ca-40
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项中只有
一个是符合题目要求的,不选、多选、错选均不得分)
1. 下列物质中属于强电解质且水溶液显酸性的是
A.C H B.NaHSO C.NaHCO D.CH COOH
2 2 4 3 3
2. 下列有关明矾[KAl(SO 4 ) 2 ·12H 2 O]的说法不 . 正 . 确 . 的是
A. 明矾水溶液呈酸性
B.钾元素位于周期表的 s 区
C.SO2-空间结构名称为正四面体形
4
D.自来水厂常用明矾来杀菌消毒
3. 下列化学用语正确的是
A.氮原子2p轨道的电子云轮廓图: B.HCN的电子式:
H
H3C
C.反-2-丁烯的结构简式为:
C C
D.HClO的结构式:H—C1—O
H CH3
4. 已知过氧化铬(CrO )的结构式如右图所示,CrO 溶于稀硫酸的化学方程式为:
5 5
4CrO 5 +6H 2 SO 4 =2Cr 2 (SO 4 ) 3 +7O 2 ↑+6H 2 O,有关该反应说法不 . 正 . 确 . 的是
A.Cr在元素周期表中的位置为第四周期第ⅥB族
B.CrO 既作氧化剂,又作还原剂
5
C.氧化产物与还原产物的物质的量之比为7:8 第4题图
D.若有1molCrO 发生该反应,则反应中共转移3.5N 个电子
5 A
5.下列各组离子在指定条件下可能大量共存的是
A.含有SiO2-的溶液中:Al3+、NH+、NO-、SO2-
3 4 3 4
B.能使甲基橙变红的溶液中:Na+、Mg2+、Cl-、CrO2-
4
C.水电离出的c(H+)=1.0×10-12mol·L-1的溶液中:Al3+、NH+、Cl-、SO2-
4 4
c(H+)
D. =1×1012的溶液中:[Ag(NH ) ]+、Na+、NO-、Br-
c(OH-) 3 2 3
高三化学 第1页 共8页
{#{QQABLQCEoggAAIBAARgCEQHACEAQkBACACoGRFAEsAIBSAFABAA=}#}6. 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO2-以及泥沙等杂质,某同学设计了一种制备精盐
4
的实验方案,步骤如图 用于沉淀的试剂稍过量 ,有关说法正确的是
称取粗盐 溶解 BaCl 2 N ( aOH Na 2 CO 3 过滤 滤)液 适量盐酸 蒸发、结晶、烘干 精盐
① ② ③ ④ ⑤ ⑥ ⑦
A. 步骤①:根据粗盐的质量和溶解度来确定烧杯和量筒的规格
B. 步骤②~④:BaCl 、NaOH和Na CO 的滴加“顺序”和“量”不可调整
2 2 3
C. 步骤⑥:用玻璃棒搅拌滤液,直到没有气泡冒出,且pH试纸检验滤液呈碱性
D. 步骤①~⑦:需要的实验用品有分液漏斗、蒸发皿、玻璃棒、陶土网和胶头滴管
7. 下列关于材料说法不 . 正 . 确 . 的是
改变了金属原子有规则的层状排列,
A 在纯金属中加入其他元素形成合金
硬度变大
B 石墨通过化学剥离法制得石墨烯 石墨烯的导电性、导热性更好
C 在涤纶纤维中混纺天然纤维 增强了透气性和吸湿性
D 顺丁橡胶硫化 硫化程度越高,强度越大,弹性越好
在元素周期表中,某些主族元素与右下方的主族元素的有
些性质是相似的,如Be和Al。BeCl 和AlCl 在气态时通常以
2 3
二聚体的形式存在,Al Cl 的结构如图所示。硼酸晶体有类似
2 6
于石墨的片层状结构。请根据以上信息,回答第8~10题。
8. 下列说法不 . 正 . 确 . 的是
A.Al Cl 中含有配位键 B.[Be(OH) ]2-中Be的杂化方式为sp3
2 6 4
C.SiO 中的键角∠OSiO为120° D.HBO 晶体中存在作用力为共价键、氢键和范德华力
2 3 3
9. 下列方程式不 . 正 . 确 . 的是
A. 氢氧化铍溶于强碱:Be(OH) +2OH- =[Be(OH) ]2-
2 4
B. 可溶性铝盐净水原理:Al3++3H O Al(OH) +3H+
2 3
C. 硅与氢氧化钠溶液反应:Si+2NaOH+H O=Na SiO +2H ↑
2 2 3 2
D. 硼酸的电离方程式: H BO =3H++BO3-
3 3 3
10. 下列说法不 . 正 . 确 . 的是
A. 氧化铍熔点较高,可用作耐火材料
B. 电解熔融氯化铍制备铍单质
C. 用碳原子取代晶体硅中部分原子,硬度变大
D. 不慎将碱液沾到皮肤上,立即用大量水冲洗,再涂上1%的硼酸
高三化学 第2页 共8页
{#{QQABLQCEoggAAIBAARgCEQHACEAQkBACACoGRFAEsAIBSAFABAA=}#}11. 下列说法不 . 正 . 确 . 的是
A.可用新制氢氧化铜悬浊液鉴别乙醇、乙醛和乙酸溶液
B.可用溴的四氯化碳溶液除去乙烷中混有的乙烯
C.可用X射线衍射技术测定青蒿素的分子结构
D.将有机溶剂与粉碎后的玫瑰花瓣混合,进行搅拌和浸泡,该提取方法为萃取
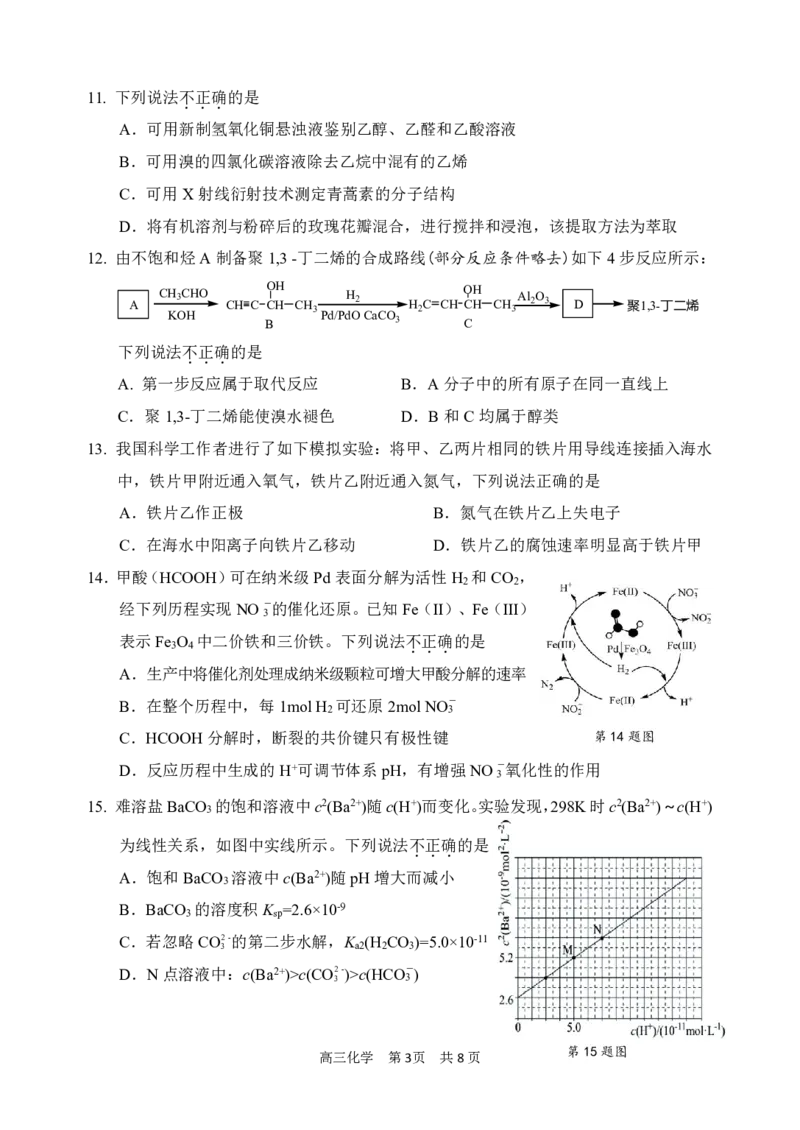
12. 由不饱和烃A制备聚1,3-丁二烯的合成路线(部分反应条件略去)如下4步反应所示:
A CH 3 CHO CH C C O H H CH 3 H 2 H 2 C CH O CH H CH 3 Al 2 O 3 D 聚1,3-丁二烯
KOH Pd/PdO CaCO
B 3 C
下列说法不正确的是
...
A. 第一步反应属于取代反应 B.A分子中的所有原子在同一直线上
C.聚1,3-丁二烯能使溴水褪色 D.B和C均属于醇类
13. 我国科学工作者进行了如下模拟实验:将甲、乙两片相同的铁片用导线连接插入海水
中,铁片甲附近通入氧气,铁片乙附近通入氮气,下列说法正确的是
A.铁片乙作正极 B.氮气在铁片乙上失电子
C.在海水中阳离子向铁片乙移动 D.铁片乙的腐蚀速率明显高于铁片甲
14.甲酸(HCOOH)可在纳米级Pd表面分解为活性H 和CO ,
2 2
经下列历程实现NO-的催化还原。已知Fe(II)、Fe(III)
3
表示Fe 3 O 4 中二价铁和三价铁。下列说法不 . 正 . 确 . 的是
A.生产中将催化剂处理成纳米级颗粒可增大甲酸分解的速率
B.在整个历程中,每1molH 可还原2molNO-
2 3
C.HCOOH分解时,断裂的共价键只有极性键 第14题图
D.反应历程中生成的H+可调节体系pH,有增强NO-氧化性的作用
3
15. 难溶盐BaCO 的饱和溶液中c2(Ba2+)随c(H+)而变化。实验发现,298K时c2(Ba2+)~c(H+)
3
为线性关系,如图中实线所示。下列说法不正确的是
...
A.饱和BaCO 溶液中c(Ba2+)随pH增大而减小
3
B.BaCO 的溶度积K =2.6×10-9
3 sp
C.若忽略CO2-的第二步水解,K (H CO )=5.0×10-11
3 a2 2 3
D.N点溶液中:c(Ba2+)>c(CO2-)>c(HCO-)
3 3
第15题图
高三化学 第3页 共8页
{#{QQABLQCEoggAAIBAARgCEQHACEAQkBACACoGRFAEsAIBSAFABAA=}#}16.根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不
.
正
.
确
.
的是
实验目的 方案设计 现象 结论
①浸泡在热水中①升高温度,NO 的
2
的烧瓶内红棕色浓度增大,平衡逆向
探 究 温 度 对
加深 移动;
A 2NO N O 化学
2 2 4
②浸泡在冷水中②降低温度,NO 的
2
平衡的影响
的烧瓶内红棕色浓度减小,平衡正向
变浅 移动
Na CO 溶液pH
2 3
验证CO2-的水解 CO2-的水解程度比
B 3 大于NaHCO 溶 3
3
程度比HCO-大 HCO-大
3 3
液
检验CH =CHCHO CH =CHCHO有碳碳
2 2
C 溴水褪色
有碳碳双键 双键
圆底烧瓶中形成 氨气极易溶于水,氨
D 探究NH 的性质
3
喷泉,溶液显红色水显碱性
二、非选择题(本大题共5小题,52分)
17.(10分)氮、磷、铁及其化合物在工农业生产、生活和科研中有着广泛的应用。回答下
列问题:
(1)基态Fe3+的价层电子轨道表示式为 。
(2)NO-、CO、CN-等易形成配合物,NO-的空间结构名称为 。
3 3
(3)已知 HSCN 的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定
结构(无配位键),请画出沸点高的分子的结构式 。
(4)下列关于N、P及其化合物结构与性质的论述正确的是 。
A.N 与P 均为正四面体型的分子晶体,都难以分解和氧化
4 4
B.N的电负性比P的大,可推断NCl 分子的极性比PCl 的大
3 3
C.NH 和PH 分子的VSEPR模型为四面体形,PH 中键角∠HPH大于NH 中∠HNH
3 3 3 3
D.研究发现固态PCl 中含有[PCl ]+和[PCl ]-,而PBr 中则含有[PBr ]+和Br-,存
5 4 6 5 4
在差异的原因是Br-半径大
高三化学 第4页 共8页
{#{QQABLQCEoggAAIBAARgCEQHACEAQkBACACoGRFAEsAIBSAFABAA=}#}(5)Fe与N形成的某化合物晶体的晶胞如图,该化合物
的化学式为 。
(6)苯分子中含有大π键,可记为π6(右下角“6”表示
6
6个原子,右上角“6”表示6个共用电子),杂环化合物咪唑结构如图,
其分子中的大π键可表示为π6,则其结合质子能力更强的氮原子是
5
(填“①”或“②”),其原因是 。
18.(10分)NH 是重要的化工原料,可发生如下转化:
3
NaClO
化合物A N 2 H 4
IV
III
I II
(NH ) SO NH HNO
4 2 4 3 3
V
空气中
[Cu(NH ) ]+ 深蓝色溶液
3 2
VI
O
① C + H 2 O CO 2 ↑+2HCl↑; ② [Cu(NH 3 ) 2 ]+(无色)容易被空气氧化
Cl Cl
(1)氨气溶于水后,经途径I吸收硫酸工业尾气中的SO ,可得到氮肥硫酸铵,写出该反
2
应的化学方程式____________________________。
(2)氨气可经途径II的多步反应制得硝酸,下列有关说法正确的是_____________。
A.工业生产得到的浓硝酸,常因溶解了Fe3+而略显黄色
B.氨气先经过催化氧化得到NO ,NO 再与水反应生成硝酸
2 2
C.浓硝酸与甘油在一定条件下反应生成C H (ONO ) ,该反应为酯化反应
3 5 2 3
D. 工业上常用铁罐车或铝罐车运送浓硝酸,是因为常温下它们和浓硝酸不反应
(3)醋酸(熔点16.6℃)、硝酸(熔点-51.49℃)这两种相对分子质量相近的分子熔沸点
相差较大的主要原因是__________________________________________。
(4)N H 与NH 性质相似,写出足量N H 与稀硫酸反应所得产物的化学式_____________。
2 4 3 2 4
(5)途径Ⅴ中NH 过量,用离子方程式解释途径VI中溶液颜色变化的原因______________。
3
(6)NH 可与COCl 反应得到化合物A和一种无机盐,设计实验验证产物中分离出的化
3 2
合物A中含有氮元素_____________________________________________________。
高三化学 第5页 共8页
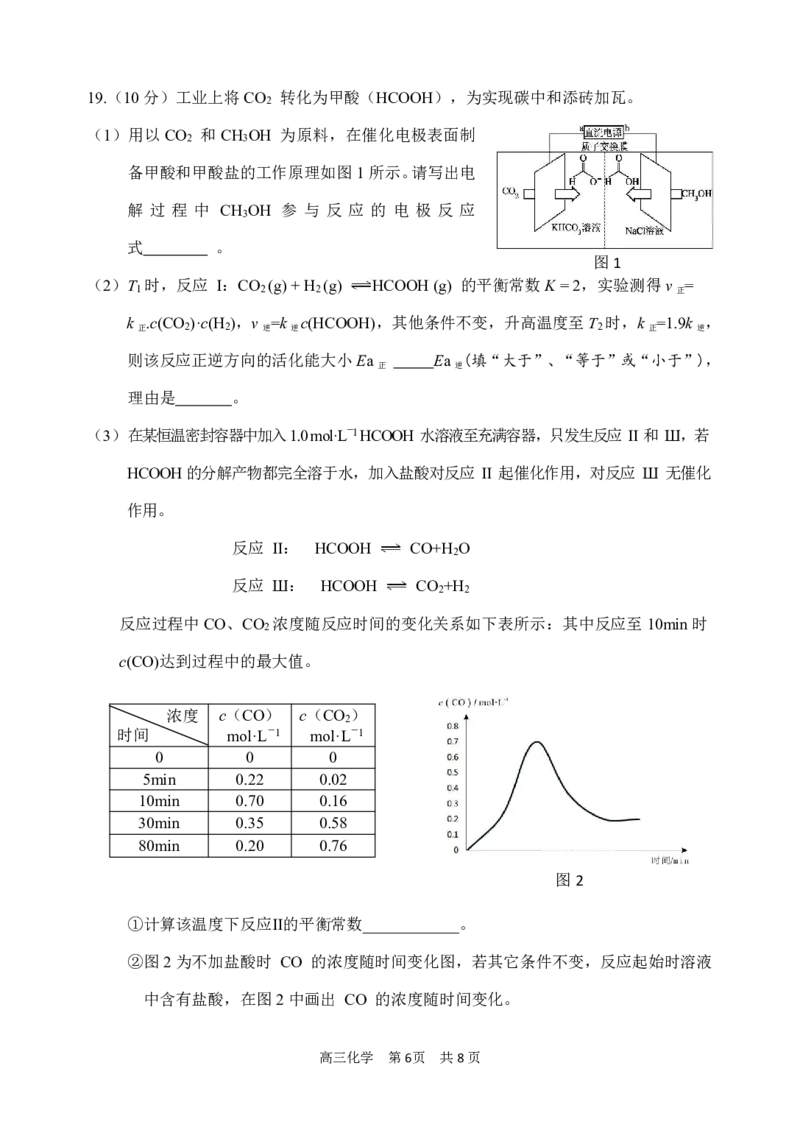
{#{QQABLQCEoggAAIBAARgCEQHACEAQkBACACoGRFAEsAIBSAFABAA=}#}19.(10分)工业上将CO 转化为甲酸(HCOOH),为实现碳中和添砖加瓦。
2
(1)用以CO 和CH OH 为原料,在催化电极表面制
2 3
备甲酸和甲酸盐的工作原理如图1所示。请写出电
解 过 程 中 CH OH 参 与 反 应 的 电 极 反 应
3
式 。
图1
(2)T 时,反应 I:CO (g)+H (g) HCOOH(g) 的平衡常数K=2,实验测得v =
1 2 2 正
k .c(CO )·c(H ),v =k c(HCOOH),其他条件不变,升高温度至T 时,k =1.9k ,
正 2 2 逆 逆 2 正 逆
则该反应正逆方向的活化能大小Ea Ea (填“大于”、“等于”或“小于”),
正 逆
理由是 。
(3)在某恒温密封容器中加入1.0mol·L-1HCOOH 水溶液至充满容器,只发生反应 Ⅱ 和 Ш,若
HCOOH的分解产物都完全溶于水,加入盐酸对反应 Ⅱ 起催化作用,对反应 Ш 无催化
作用。
反应 Ⅱ: HCOOH CO+H O
2
反应 Ш: HCOOH CO +H
2 2
反应过程中CO、CO 浓度随反应时间的变化关系如下表所示:其中反应至10min时
2
c(CO)达到过程中的最大值。
浓度 c(CO) c(CO )
2
时间 mol·L-1 mol·L-1
0 0 0
5min 0.22 0.02
10min 0.70 0.16
30min 0.35 0.58
80min 0.20 0.76
图2
①计算该温度下反应Ⅱ的平衡常数____________。
②图2为不加盐酸时 CO 的浓度随时间变化图,若其它条件不变,反应起始时溶液
中含有盐酸,在图2中画出 CO 的浓度随时间变化。
高三化学 第6页 共8页
{#{QQABLQCEoggAAIBAARgCEQHACEAQkBACACoGRFAEsAIBSAFABAA=}#}20.(10分)某研究小组以白云石(主要成分为CaMg(CO ) )为原料制备无水碳酸镁,流
3 2
程如下:
滤液1
研磨 ① 溶解 ② MgCl 2 ·6H 2 O 过滤
白云石 粉样
煅烧 90℃,1h 足量CO 2
滤渣 重镁水溶液
I II 20℃,1h
III
60℃ 过滤 MgCO 3 ·3H 2 O 一系列操作 MgCO 3
热解2h
IV Ⅴ
(1)步骤Ⅰ煅烧过程中盛放样品的容器名称是 ,步骤III,重镁水溶液中主要溶质
的化学式是________。
(2)下列说法正确的是 。
A.步骤II,在溶解过程中可加入硫酸,加入MgCl·6HO可适当除去原料中的钙元素
2 2
B.步骤IV产生的CO 和滤液可循环利用
2
C.步骤Ⅳ热解过程中通入空气的目的是除去体系中溶解的CO ,促进反应正向进行
2
D.步骤Ⅴ,可通过直接加热的方式制得无水碳酸镁
(3)步骤III过程中需将温度控制在20℃,原因是 。
(4)为测定产品中微量的钙元素含量,可用已知浓度为cmol/L的EDTA标准溶液进行滴
定。从下列选项中选择合理的仪器和操作,补全如下步骤[“____”上填写一件最关
....
键仪器,“( )”内填写一种操作,均用字母表示]。
... ....
用分析天平(称量mg产品)→用烧杯( )→用______(配制250mL的溶液
A)→用移液管( )→在______中( )→用______(盛装EDTA溶
液滴定Ca2+,消耗V mL)
1
仪器:a.烧杯;b.滴定管;c.容量瓶;d.锥形瓶
操作:e.加水溶解;f.加盐酸溶解;g.加入三乙醇胺、NaOH和钙指示剂;h. 量取25.00mL
溶液A
(5)如要测定产品中Mg2+含量,还需继续以下实验:量取25.00mL溶液A,稀释至250
mL得到溶液B,另取25.00mL溶液B于锥形瓶中,加入三乙醇胺、缓冲溶液与铬
黑T指示剂后,用上述EDTA标准溶液滴定Ca2+、Mg2+总量(Ca2+、Mg2+与EDTA按
物质的量 1:1 反应),消耗 V mL,根据本次实验计算产品中镁元素的质量分数
2
_____________。
高三化学 第7页 共8页
{#{QQABLQCEoggAAIBAARgCEQHACEAQkBACACoGRFAEsAIBSAFABAA=}#}21.(12分)盐酸芬戈莫德(H)是一种治疗多发性硬化症的新型免疫抑制剂,以下是其中
一种合成路线(部分反应条件已简化)。
O NO
2
Cl NO 2 C H NO (C 2 H 5 ) 3 SiH C H NO 试剂X OH
9 9 3 9 11 2
AlCl 3 /CH 2 Cl 2 B 三氟甲磺酸 C 碱性条件 OH
D
A
NH
2
O
O O C 14 H 19 NO 4 Cl C 22 H 33 NO 5 H 2 /Pd-C O O
催化剂 E AlCl /CH Cl F 催化剂 6
3 2 2 G
NH
2
OH
(1)HCl/CH OH ·HCl
3
OH
(2)HCl 6
H
OH
O O O 碱性条件 NO
一定条件 R' + R'CH 2 NO 2 R 2
已知:① R Cl + R'OH R O ②R H R'
请回答:
(1)化合物G的官能团名称是 。
(2)已知C→D过程中原子利用率为100%,化合物X的结构简式是 。
(3)下列说法正确的是 。
A.B→C的反应为取代反应
B.设计D→E的目的是为了保护羟基
C.H的分子式是C H ClNO
14 24 2
D.G→H第 (2) 步中加HCl的目的是为了增大产物的水溶性
(4)写出由D生成E的化学方程式 。
(5)写出所有同时符合下列条件的化合物C的同分异构体的结构简式 。
①含有苯环和硝基;
②1H-NMR谱显示有四组峰,峰面积之比为6∶2∶2∶1。
(6)设计以苯甲醇和CH NO 为原料,合成 的路线(用流程图表示,无机试
3 2
剂任选)
高三化学 第8页 共8页
{#{QQABLQCEoggAAIBAARgCEQHACEAQkBACACoGRFAEsAIBSAFABAA=}#}