文档内容
阳朔中学等校 2024-2025 学年高二上学期 10 月检测化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
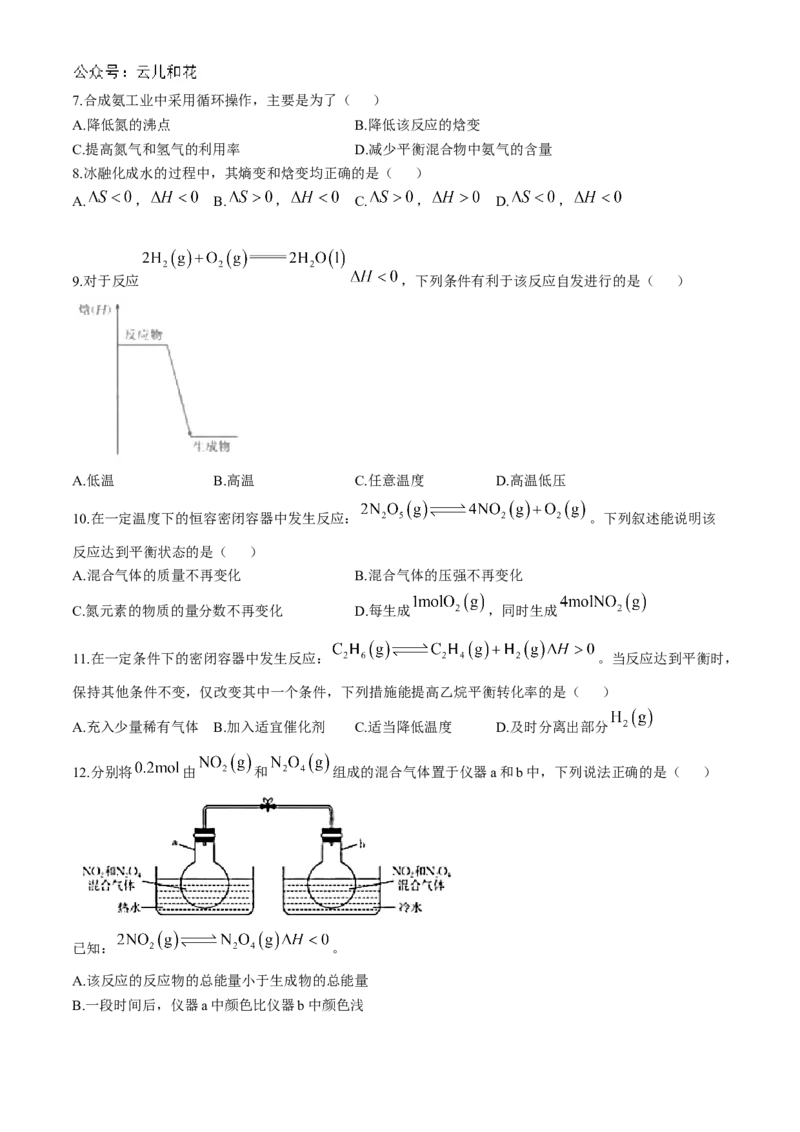
4.本试卷主要考试内容:人教版选择性必修1第一章至第二章。
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.增大下列过程的化学反应速率对人类有益的是( )
A.氨的合成 B.钢铁的腐蚀 C.废旧电池的焚烧 D.肉质食品的腐败
2.一定条件下,在密闭容器中发生可逆反应 ,该反应的平衡常数表达式
为( )
A. B. C. D.
3.下列措施不能增大化学反应速率的是( )
A.燃煤时,将块状煤粉碎
B. 与稀盐酸反应生成 时,适当升高温度
C. 分解制取 时,添加少量
D.常温下,铁与稀硫酸反应制氢气时,将稀硫酸换成同质量的浓硫酸
4.下列关于平衡状态的叙述错误的是( )
A.达到平衡时,正、逆反应速率均为零
B.达到平衡时,反应物和生成物的总质量不再发生变化
C.在给定条件下,达到平衡时可逆反应完成程度达到最大
D.化学平衡是所有可逆反应都存在的一种状态
5.下列反应的能量变化与图示能量变化相符合的是( )
A.石灰石煅烧的反应 B.金属铝与稀硫酸的反应
C.稀盐酸与碳酸氢钠的反应 D.氯化铵与氢氧化钡的反应
6.下列日常生活中的做法,与调控反应速率无关的是( )
A.食品抽真空包装 B.在铁制品表面刷油漆
C.向门窗合页里注油 D.用冰箱冷藏食物7.合成氨工业中采用循环操作,主要是为了( )
A.降低氮的沸点 B.降低该反应的焓变
C.提高氮气和氢气的利用率 D.减少平衡混合物中氨气的含量
8.冰融化成水的过程中,其熵变和焓变均正确的是( )
A. , B. , C. , D. ,
9.对于反应 ,下列条件有利于该反应自发进行的是( )
A.低温 B.高温 C.任意温度 D.高温低压
10.在一定温度下的恒容密闭容器中发生反应: 。下列叙述能说明该
反应达到平衡状态的是( )
A.混合气体的质量不再变化 B.混合气体的压强不再变化
C.氮元素的物质的量分数不再变化 D.每生成 ,同时生成
11.在一定条件下的密闭容器中发生反应: 。当反应达到平衡时,
保持其他条件不变,仅改变其中一个条件,下列措施能提高乙烷平衡转化率的是( )
A.充入少量稀有气体 B.加入适宜催化剂 C.适当降低温度 D.及时分离出部分
12.分别将 由 和 组成的混合气体置于仪器a和b中,下列说法正确的是( )
已知: 。
A.该反应的反应物的总能量小于生成物的总能量
B.一段时间后,仪器a中颜色比仪器b中颜色浅C.反应达到平衡后,仪器b中可得到
D.标准状况下, 的质量不是
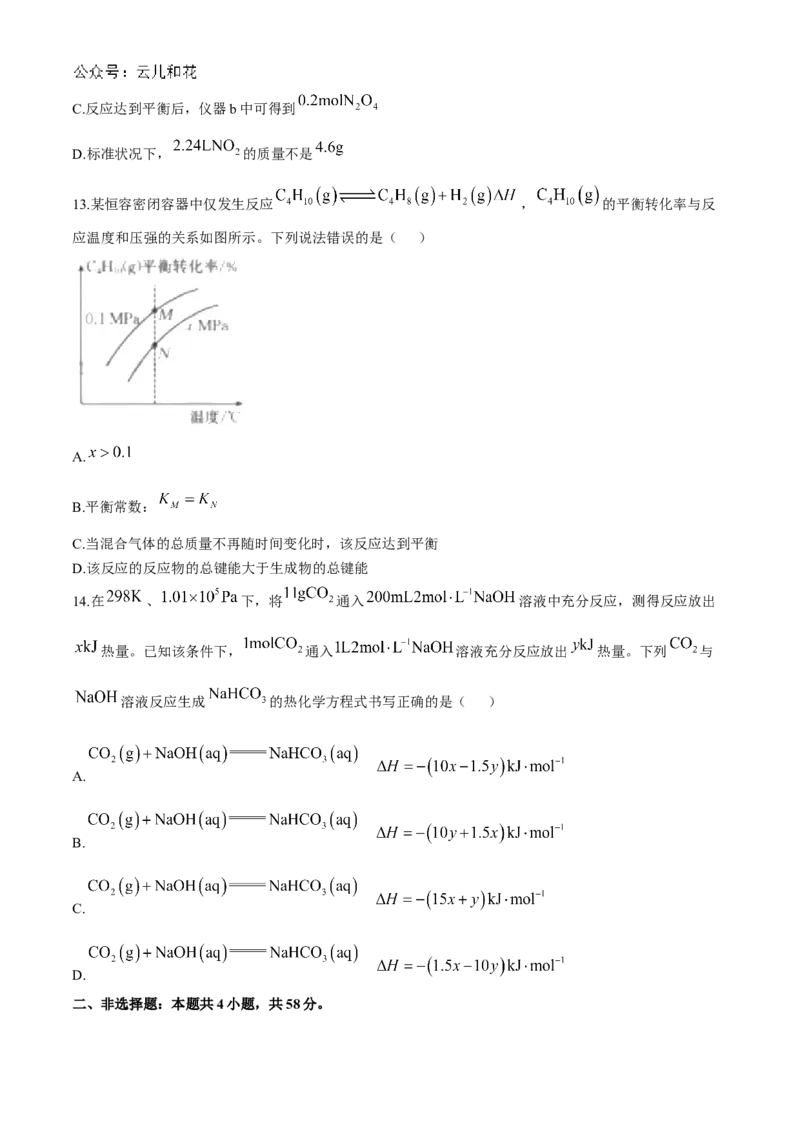
13.某恒容密闭容器中仅发生反应 , 的平衡转化率与反
应温度和压强的关系如图所示。下列说法错误的是( )
A.
B.平衡常数:
C.当混合气体的总质量不再随时间变化时,该反应达到平衡
D.该反应的反应物的总键能大于生成物的总键能
14.在 、 下,将 通入 溶液中充分反应,测得反应放出
热量。已知该条件下, 通入 溶液充分反应放出 热量。下列 与
溶液反应生成 的热化学方程式书写正确的是( )
A.
B.
C.
D.
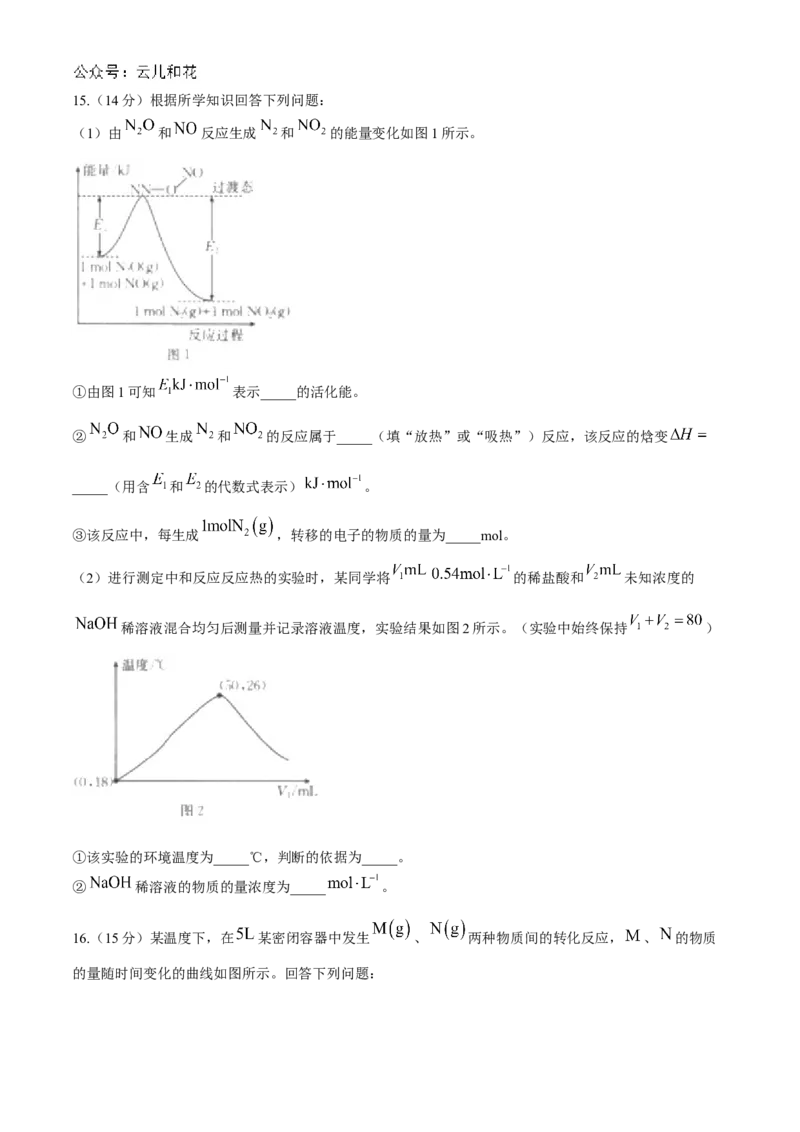
二、非选择题:本题共4小题,共58分。15.(14分)根据所学知识回答下列问题:
(1)由 和 反应生成 和 的能量变化如图1所示。
①由图1可知 表示_____的活化能。
② 和 生成 和 的反应属于_____(填“放热”或“吸热”)反应,该反应的焓变
_____(用含 和 的代数式表示) 。
③该反应中,每生成 ,转移的电子的物质的量为_____mol。
(2)进行测定中和反应反应热的实验时,某同学将 的稀盐酸和 未知浓度的
稀溶液混合均匀后测量并记录溶液温度,实验结果如图2所示。(实验中始终保持 )
①该实验的环境温度为_____℃,判断的依据为_____。
② 稀溶液的物质的量浓度为_____ 。
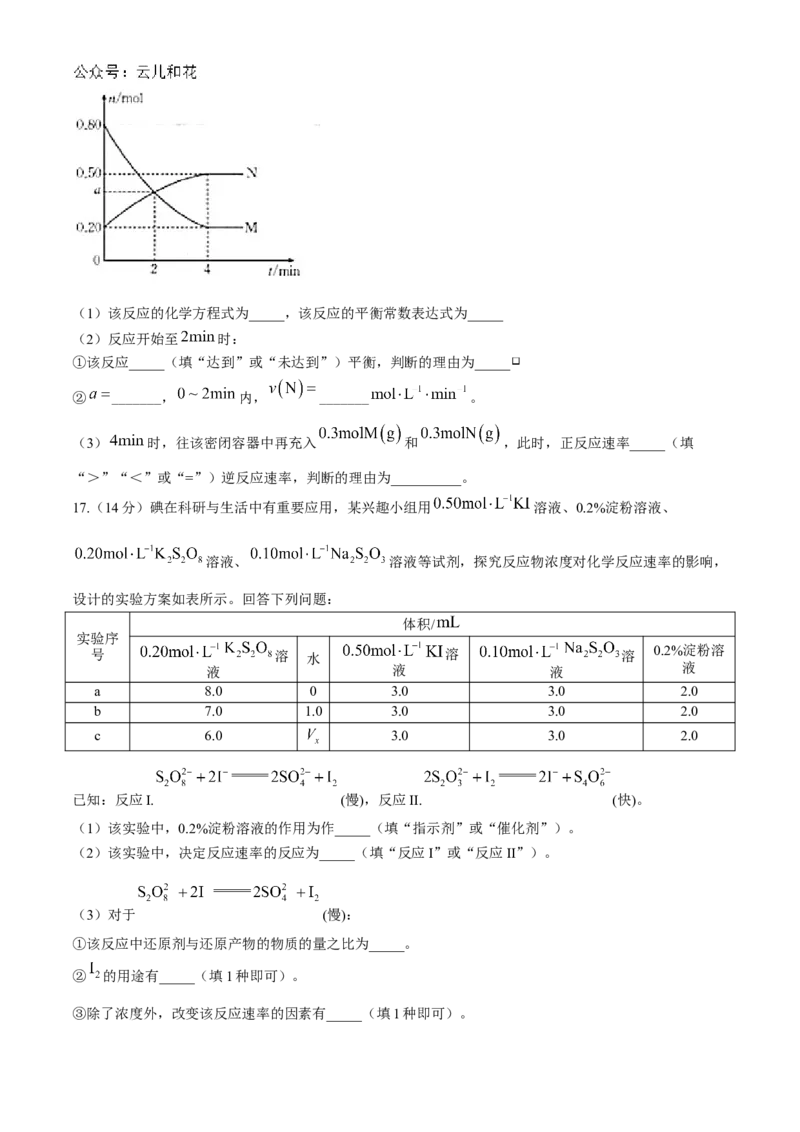
16.(15分)某温度下,在 某密闭容器中发生 、 两种物质间的转化反应, 、 的物质
的量随时间变化的曲线如图所示。回答下列问题:(1)该反应的化学方程式为_____,该反应的平衡常数表达式为_____
(2)反应开始至 时:
①该反应_____(填“达到”或“未达到”)平衡,判断的理由为_____
② _______, 内, _______ 。
(3) 时,往该密闭容器中再充入 和 ,此时,正反应速率_____(填
“>”“<”或“=”)逆反应速率,判断的理由为__________。
17.(14分)碘在科研与生活中有重要应用,某兴趣小组用 溶液、0.2%淀粉溶液、
溶液、 溶液等试剂,探究反应物浓度对化学反应速率的影响,
设计的实验方案如表所示。回答下列问题:
体积/
实验序
号 溶 水 溶 溶 0.2%淀粉溶
液 液 液 液
a 8.0 0 3.0 3.0 2.0
b 7.0 1.0 3.0 3.0 2.0
c 6.0 3.0 3.0 2.0
已知:反应I. (慢),反应II. (快)。
(1)该实验中,0.2%淀粉溶液的作用为作_____(填“指示剂”或“催化剂”)。
(2)该实验中,决定反应速率的反应为_____(填“反应I”或“反应II”)。
(3)对于 (慢):
①该反应中还原剂与还原产物的物质的量之比为_____。
② 的用途有_____(填1种即可)。
③除了浓度外,改变该反应速率的因素有_____(填1种即可)。(4)该实验中,当 耗尽后,溶液颜色将由_____色变为_____色。
(5)由表中数据可知, _____,理由为_______________________。
18.(15分)二氧化碳的回收利用是环保和能源领域研究的热点课题,回答下列问题:
已知:反应i.
反应ii.
(1)常温下,用氨水吸收 可获得 溶液。
①该反应的化学方程式为_____。
②反应 的平衡常数表达式为 _____。
(2)反应iii. ,则 (用含 和 的代
数式表示), _____(用含 和 的代数式表示)。
(3)一定条件下,在 恒容密闭容器中充入 和 ,发生主反应
和副反应 。
测得温度对 、 平衡产率的影响如图所示。
① _____(填“>”或“<”)0。
②反应达到平衡后,保持温度和体积不变,向密闭容器中充入少量的稀有气体,则 _____(填
“增大”“减小”或“不变”),副反应的化学平衡______(填“向正反应方向”“向逆反应方向”或
“不”)移动。③ 时,反应达到平衡,此时测得 的物质的量为 、 的物质的量为 ,
则副反应的 _____。