文档内容
2024-2025 学年第二学期六校联合体 3 月调研测试
高二 化学
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
一、单项选择题:共 13 小题,每题 3 分,共 39 分。每题只有一个选项最符合
题意。
1. 化学与生产、生活、环境等密切相关。下列有关说法不正确的是
A.可燃冰(CH·8H O)中 CH 与 HO 存在分子间氢键
4 2 4 2
B.中国天眼(FAST)使用的 SiC 是新型无机非金属材料
C.聚乙炔可用于制备导电高分子材料
D.大力开发利用化石能源不利于实现“碳中和”
2.反应 可用于处理不慎沾到皮肤
上的白磷。下列说法正确的是
A. 分子中的键角为 109°28′ B. 的空间构型为直线形
C. 的结构示意图为 D.基态 的价层电子排布式为
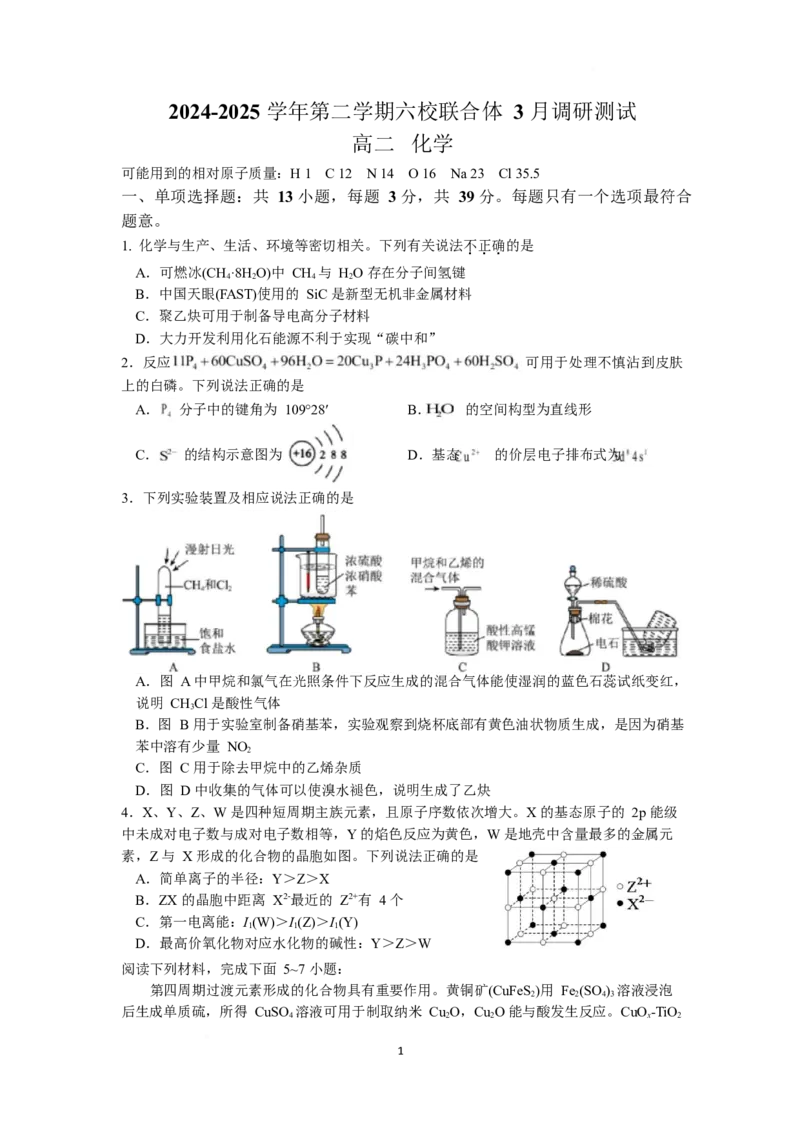
3.下列实验装置及相应说法正确的是
A.图 A 中甲烷和氯气在光照条件下反应生成的混合气体能使湿润的蓝色石蕊试纸变红,
说明 CHCl 是酸性气体
3
B.图 B 用于实验室制备硝基苯,实验观察到烧杯底部有黄色油状物质生成,是因为硝基
苯中溶有少量 NO
2
C.图 C 用于除去甲烷中的乙烯杂质
D.图 D 中收集的气体可以使溴水褪色,说明生成了乙炔
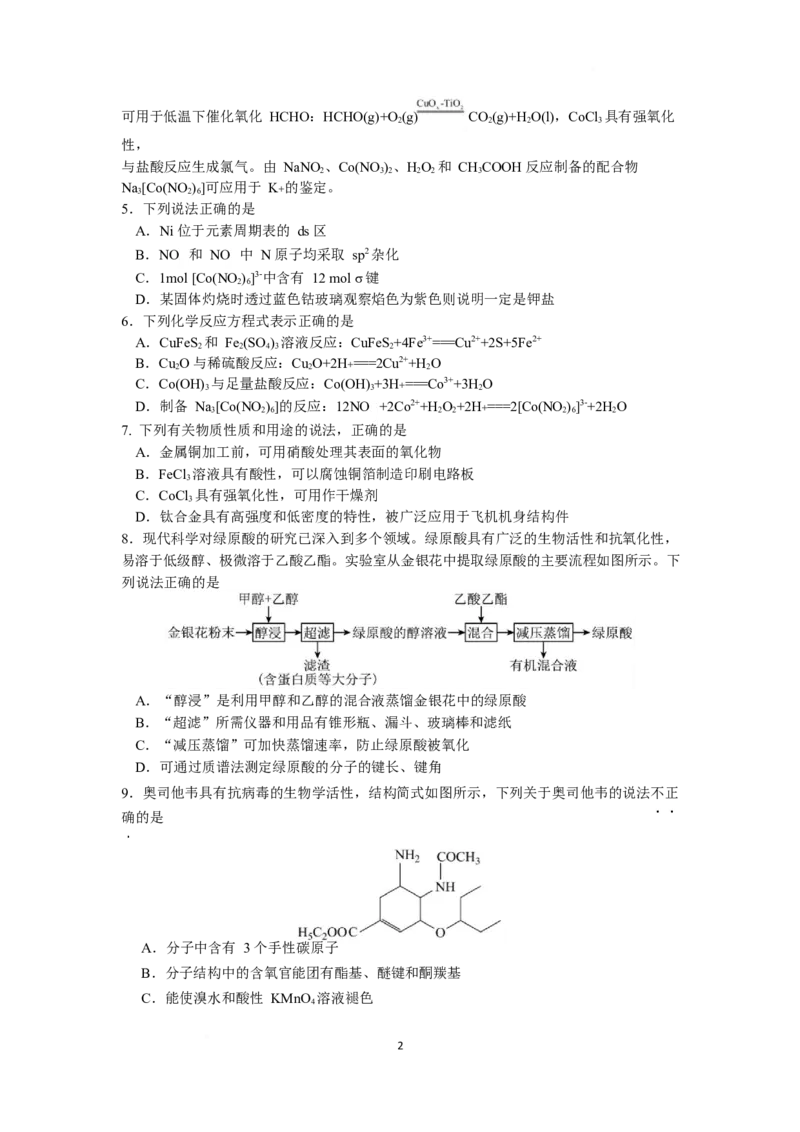
4.X、Y、Z、W 是四种短周期主族元素,且原子序数依次增大。X 的基态原子的 2p 能级
中未成对电子数与成对电子数相等,Y 的焰色反应为黄色,W 是地壳中含量最多的金属元
素,Z 与 X 形成的化合物的晶胞如图。下列说法正确的是
A.简单离子的半径:Y>Z>X
B.ZX 的晶胞中距离 X2-最近的 Z2+有 4 个
C.第一电离能:I(W)>I(Z)>I(Y)
1 1 1
D.最高价氧化物对应水化物的碱性:Y>Z>W
阅读下列材料,完成下面 5~7 小题:
第四周期过渡元素形成的化合物具有重要作用。黄铜矿(CuFeS)用 Fe (SO ) 溶液浸泡
2 2 4 3
后生成单质硫,所得 CuSO 溶液可用于制取纳米 Cu O,Cu O 能与酸发生反应。CuO-TiO
4 2 2 x 2
1可用于低温下催化氧化 HCHO:HCHO(g)+O(g) CO(g)+HO(l),CoCl 具有强氧化
2 2 2 3
性,
与盐酸反应生成氯气。由 NaNO 、Co(NO )、HO 和 CHCOOH 反应制备的配合物
2 3 2 2 2 3
Na
3
[Co(NO
2
)
6
]可应用于 K+ 的鉴定。
5.下列说法正确的是
A.Ni 位于元素周期表的 ds 区
B.NO 和 NO 中 N 原子均采取 sp2 杂化
C.1mol [Co(NO )]3-中含有 12 mol σ键
2 6
D.某固体灼烧时透过蓝色钴玻璃观察焰色为紫色则说明一定是钾盐
6.下列化学反应方程式表示正确的是
A.CuFeS 和 Fe (SO ) 溶液反应:CuFeS+4Fe3+===Cu2++2S+5Fe2+
2 2 4 3 2
B.Cu
2
O 与稀硫酸反应:Cu
2
O+2H+===2Cu2++H
2
O
C.Co(OH)
3
与足量盐酸反应:Co(OH)
3
+3H+===Co3++3H
2
O
D.制备 Na
3
[Co(NO
2
)
6
]的反应:12NO +2Co2++H
2
O
2
+2H+===2[Co(NO
2
)
6
]3-+2H
2
O
7. 下列有关物质性质和用途的说法,正确的是
A.金属铜加工前,可用硝酸处理其表面的氧化物
B.FeCl 溶液具有酸性,可以腐蚀铜箔制造印刷电路板
3
C.CoCl 具有强氧化性,可用作干燥剂
3
D.钛合金具有高强度和低密度的特性,被广泛应用于飞机机身结构件
8.现代科学对绿原酸的研究已深入到多个领域。绿原酸具有广泛的生物活性和抗氧化性,
易溶于低级醇、极微溶于乙酸乙酯。实验室从金银花中提取绿原酸的主要流程如图所示。下
列说法正确的是
A.“醇浸”是利用甲醇和乙醇的混合液蒸馏金银花中的绿原酸
B.“超滤”所需仪器和用品有锥形瓶、漏斗、玻璃棒和滤纸
C.“减压蒸馏”可加快蒸馏速率,防止绿原酸被氧化
D.可通过质谱法测定绿原酸的分子的键长、键角
9.奥司他韦具有抗病毒的生物学活性,结构简式如图所示,下列关于奥司他韦的说法不正
确的是
A.分子中含有 3 个手性碳原子
B.分子结构中的含氧官能团有酯基、醚键和酮羰基
C.能使溴水和酸性 KMnO 溶液褪色
4
2D.分子中所有原子不可能共平面
10. 用如图所示的新型电池可以处理含 的碱性废水,同时还可以淡化海水。
下列说法正确的是
A.a 极电极反应式:2CN—+10e—+12OH—===2CO2-3+N ↑+
2
6HO
2
B.电池工作一段时间后,右室溶液的 减小
C.若将含有 的废水完全处理,理论上可除去 的质
量为
D.交换膜Ⅰ为阳离子交换膜,交换膜Ⅱ为阴离子交换膜
11.下列实验操作对应的实验现象及解释或结论都正确的是
选项 实验操作 实验现象 解释或结论
浓度均为 的 溶液和 前者溶液变浅红 水解,而
A
溶液中滴加几滴酚酞试剂 色,后者不变色 不水解
将苯和液溴反应后的气体直接通入硝
B 产生淡黄色沉淀 反应生成了
酸酸化的 AgNO 溶液中
3 HBr
向 2 支均盛有 的 一支试管无明显现
<
C 溶液的试管中,分别加入 2 滴浓度均 象,另一支出现红
为 的 和 溶液 褐色沉淀
向两支分别盛有 2mL 苯和 2mL 甲苯
侧链受苯环影响,
D 的试管中各加入几滴酸性高锰酸钾溶 后者振荡后褪色
易被氧化
液,用力振荡
A.A B.B C.C D.D
12.室温下: , , ,
。实验室进行多组实验测定某些酸、碱、盐性质,相关实验记录如下:
实验 实验操作和现象
1 测定 溶液的 pH 约为 8
2 HCN 与 NaOH 溶液等体积混合,测得混合溶液的 pH>7
3 向 NaClO 溶液中通入少量的 ,测得 pH 降低
4 向 溶液中加入等体积 溶液,产生白色沉淀
下列所得结论正确的是
A.实验 1 溶液中存在:
B.由实验 2 可得
C.实验 3 反应的离子方程式:
D.实验 4 所得上层清液中的 (忽略混合前后溶液体积的变化)
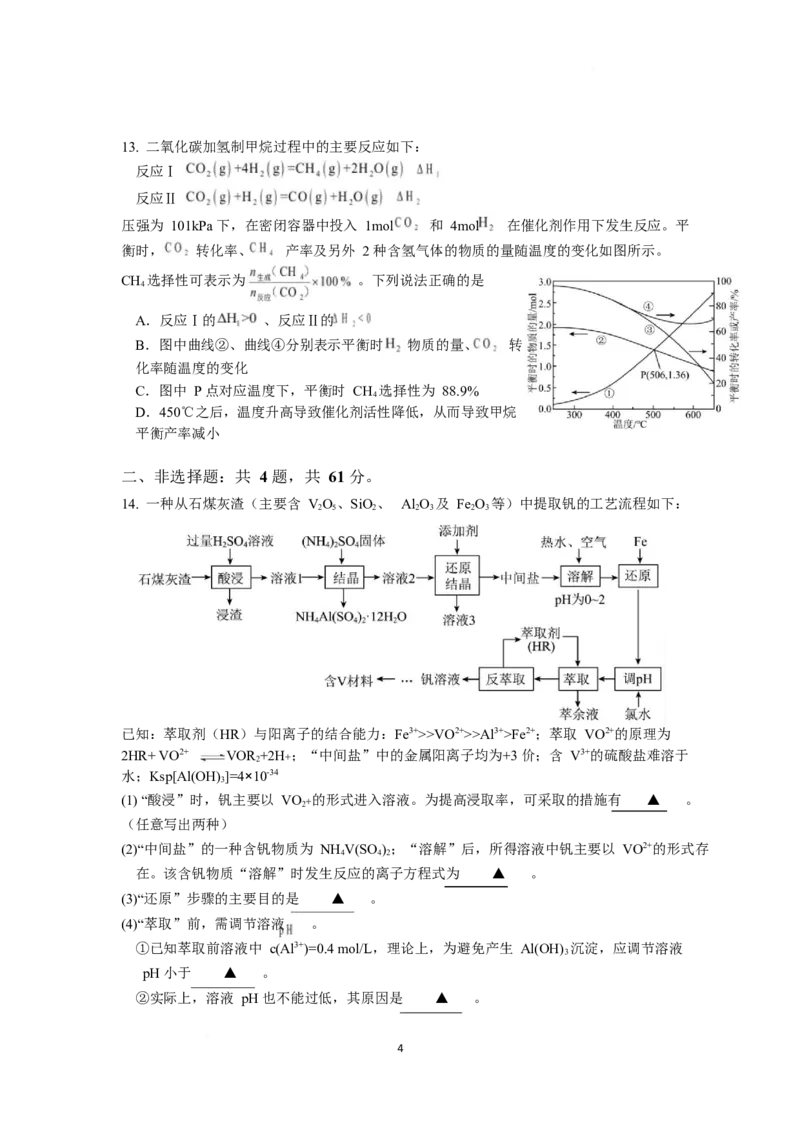
313. 二氧化碳加氢制甲烷过程中的主要反应如下:
反应Ⅰ
反应Ⅱ
压强为 101kPa 下,在密闭容器中投入 1mol 和 4mol 在催化剂作用下发生反应。平
衡时, 转化率、 产率及另外 2 种含氢气体的物质的量随温度的变化如图所示。
CH 选择性可表示为 。下列说法正确的是
4
A.反应Ⅰ的 、反应Ⅱ的
B.图中曲线②、曲线④分别表示平衡时 物质的量、 转
化率随温度的变化
C.图中 P 点对应温度下,平衡时 CH 选择性为 88.9%
4
D.450℃之后,温度升高导致催化剂活性降低,从而导致甲烷
平衡产率减小
二、非选择题:共 4 题,共 61 分。
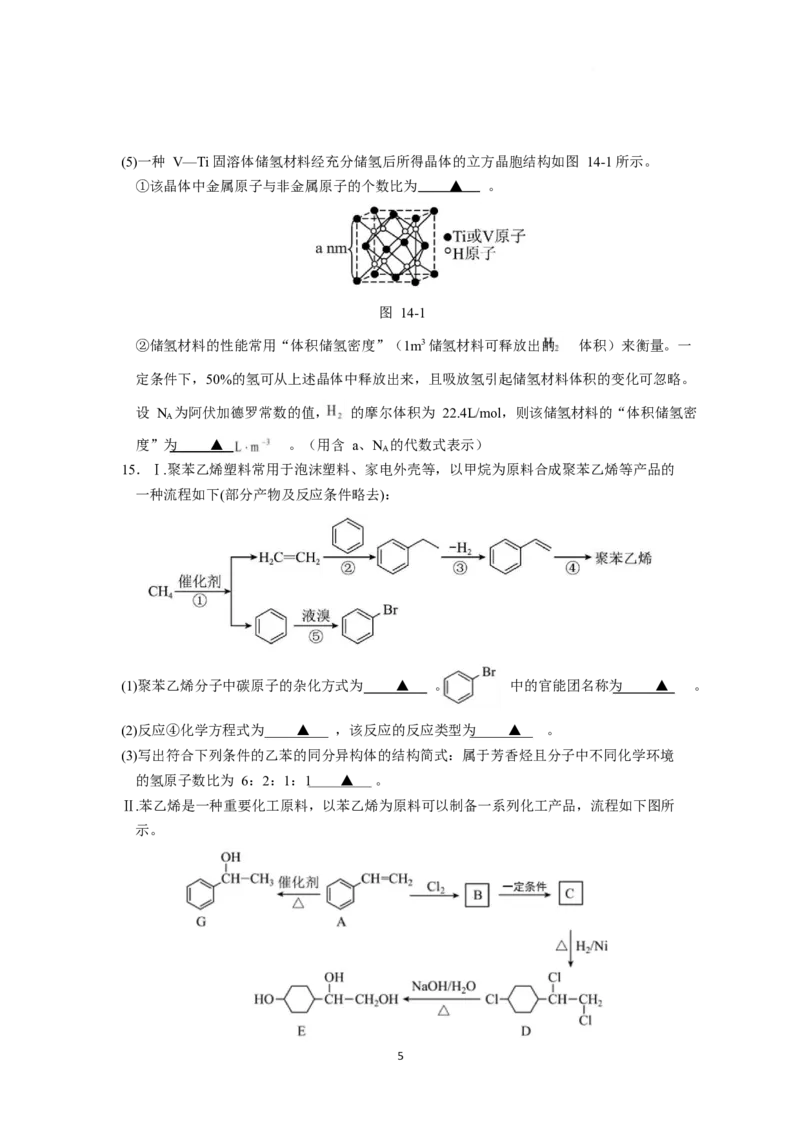
14. 一种从石煤灰渣(主要含 VO、SiO、 Al O 及 Fe O 等)中提取钒的工艺流程如下:
2 5 2 2 3 2 3
已知:萃取剂(HR)与阳离子的结合能力:Fe3+>>VO2+>>Al3+>Fe2+;萃取 VO2+的原理为
2HR+ VO2+ VOR
2
+2H+ ;“中间盐”中的金属阳离子均为+3 价;含 V3+的硫酸盐难溶于
水;Ksp[Al(OH) ]=4×10-34
3
(1) “酸浸”时,钒主要以 VO 2+ 的形式进入溶液。为提高浸取率,可采取的措施有 ▲ 。
(任意写出两种)
(2)“中间盐”的一种含钒物质为 NH V(SO );“溶解”后,所得溶液中钒主要以 VO2+的形式存
4 4 2
在。该含钒物质“溶解”时发生反应的离子方程式为 ▲ 。
(3)“还原”步骤的主要目的是 ▲ 。
(4)“萃取”前,需调节溶液 。
①已知萃取前溶液中 c(Al3+)=0.4 mol/L,理论上,为避免产生 Al(OH) 沉淀,应调节溶液
3
pH 小于 ▲ 。
②实际上,溶液 pH 也不能过低,其原因是 ▲ 。
4(5)一种 V—Ti 固溶体储氢材料经充分储氢后所得晶体的立方晶胞结构如图 14-1 所示。
①该晶体中金属原子与非金属原子的个数比为 ▲ 。
图 14-1
②储氢材料的性能常用“体积储氢密度”(1m3 储氢材料可释放出的 体积)来衡量。一
定条件下,50%的氢可从上述晶体中释放出来,且吸放氢引起储氢材料体积的变化可忽略。
设 N 为阿伏加德罗常数的值, 的摩尔体积为 22.4L/mol,则该储氢材料的“体积储氢密
A
度”为 ▲ 。(用含 a、N 的代数式表示)
A
15.Ⅰ.聚苯乙烯塑料常用于泡沫塑料、家电外壳等,以甲烷为原料合成聚苯乙烯等产品的
一种流程如下(部分产物及反应条件略去):
(1)聚苯乙烯分子中碳原子的杂化方式为 ▲ 。 中的官能团名称为 ▲ 。
(2)反应④化学方程式为 ▲ ,该反应的反应类型为 ▲ 。
(3)写出符合下列条件的乙苯的同分异构体的结构简式:属于芳香烃且分子中不同化学环境
的氢原子数比为 6:2:1:1 ▲ 。
Ⅱ.苯乙烯是一种重要化工原料,以苯乙烯为原料可以制备一系列化工产品,流程如下图所
示。
5(1)写出 B 的结构简式 ▲ 。
(2)实现 B→C 所需的试剂和条件为 ▲ 。
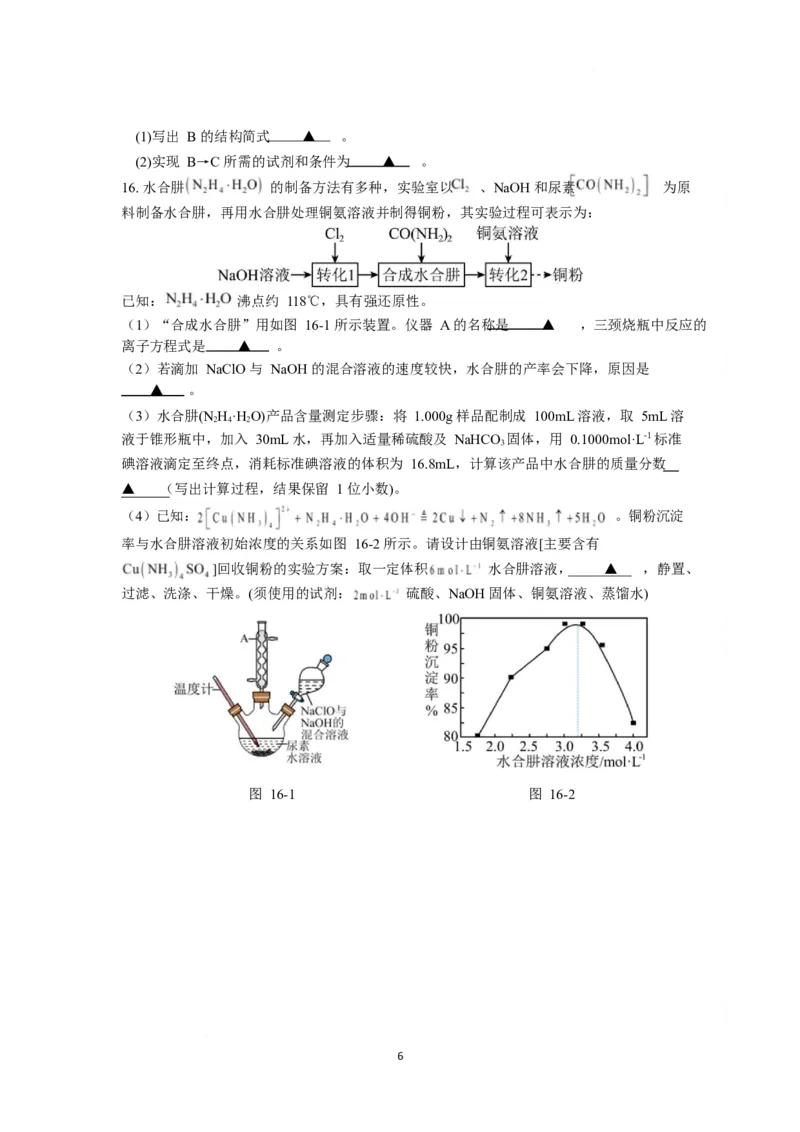
16. 水合肼 的制备方法有多种,实验室以 、NaOH 和尿素 为原
料制备水合肼,再用水合肼处理铜氨溶液并制得铜粉,其实验过程可表示为:
已知: 沸点约 118℃,具有强还原性。
(1)“合成水合肼”用如图 16-1 所示装置。仪器 A 的名称是 ▲ ,三颈烧瓶中反应的
离子方程式是 ▲ 。
(2)若滴加 NaClO 与 NaOH 的混合溶液的速度较快,水合肼的产率会下降,原因是
▲ 。
(3)水合肼(N H·H O)产品含量测定步骤:将 1.000g 样品配制成 100mL 溶液,取 5mL 溶
2 4 2
液于锥形瓶中,加入 30mL 水,再加入适量稀硫酸及 NaHCO 固体,用 0.1000mol·L-1 标准
3
碘溶液滴定至终点,消耗标准碘溶液的体积为 16.8mL,计算该产品中水合肼的质量分数
▲ (写出计算过程,结果保留 1 位小数)。
(4)已知: 。铜粉沉淀
率与水合肼溶液初始浓度的关系如图 16-2 所示。请设计由铜氨溶液[主要含有
]回收铜粉的实验方案:取一定体积 水合肼溶液, ▲ ,静置、
过滤、洗涤、干燥。(须使用的试剂: 硫酸、NaOH 固体、铜氨溶液、蒸馏水)
图 16-1 图 16-2
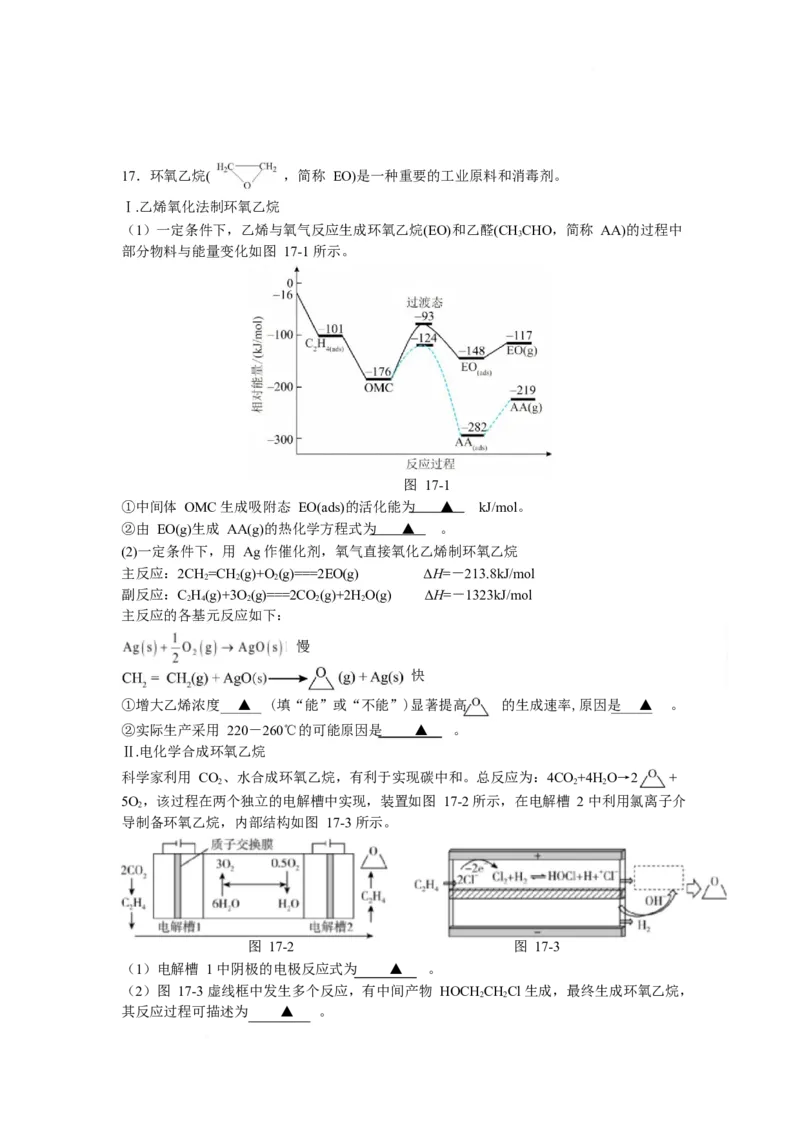
617.环氧乙烷( ,简称 EO)是一种重要的工业原料和消毒剂。
Ⅰ.乙烯氧化法制环氧乙烷
(1)一定条件下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(CHCHO,简称 AA)的过程中
3
部分物料与能量变化如图 17-1 所示。
图 17-1
①中间体 OMC 生成吸附态 EO(ads)的活化能为 ▲ kJ/mol。
②由 EO(g)生成 AA(g)的热化学方程式为 ▲ 。
(2)一定条件下,用 Ag 作催化剂,氧气直接氧化乙烯制环氧乙烷
主反应:2CH=CH (g)+O(g)===2EO(g) ΔH=-213.8kJ/mol
2 2 2
副反应:C H(g)+3O(g)===2CO(g)+2HO(g) ΔH=-1323kJ/mol
2 4 2 2 2
主反应的各基元反应如下:
慢
快
①增大乙烯浓度 ▲ (填“能”或“不能”)显著提高 的生成速率,原因是 ▲ 。
②实际生产采用 220-260℃的可能原因是 ▲ 。
Ⅱ.电化学合成环氧乙烷
科学家利用 CO、水合成环氧乙烷,有利于实现碳中和。总反应为:4CO+4H O→2 +
2 2 2
5O,该过程在两个独立的电解槽中实现,装置如图 17-2 所示,在电解槽 2 中利用氯离子介
2
导制备环氧乙烷,内部结构如图 17-3 所示。
图 17-2 图 17-3
(1)电解槽 1 中阴极的电极反应式为 ▲ 。
(2)图 17-3 虚线框中发生多个反应,有中间产物 HOCH CHCl 生成,最终生成环氧乙烷,
2 2
其反应过程可描述为 ▲ 。参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13
A C B D B A D C B C D D C
二、非选择题
14.(16 分)(1) “适当升温”“搅拌”“将灰渣进一步粉碎”“适当增加酸的浓度”等。 (2 分)
(2)4NH
4
V(SO
4
)
2
+O
2
+H
2
O△4VO2+4H++4NH
++8SO 42- (3 分)
4
(3)将 转化为 ,避免 影响 的萃取 (2 分)
(4)① 3 (2 分) ② 过低,即 浓度过大,会导致萃取反应 2HR+ VO2+
VOR
2
+2H+ 的平衡逆向移动,不利于 进入有机相(2 分)
(5) ①1:2 (2 分) ② (3 分)
15.( 15 分)Ⅰ.(1) 、 ;(2 分) 碳溴键。(2 分)
(2) (3 分),加聚反应(2 分)
(3) (2 分)
Ⅱ. (1) (2 分)
(2)Cl、FeCl (或 Cl、催化剂)(2 分)
2 3 2
16.(1)球形冷凝管 (2 分) (3 分)
(2) 易被 NaClO 氧化(2 分)
(3)(4 分)设 5mL 溶液中含 NH·H O 的物质的量为 xmol;
2 4 2
x=0.00084mol;
该产品中水合肼的质量分数
(4)加入等体积蒸馏水稀释水合肼溶液(或加蒸馏水稀释水合肼溶液浓度至 3.0
~3.25mol/L),加入适量 NaOH 固体,边搅拌边逐滴加入铜氨废液,加热使其充分反应,同时用 2mol/L 硫酸吸收反应中放出的 NH ,直至溶液中无气泡产生,停止滴加(4 分)
3
17. Ⅰ.(1) ①83 (2 分)
②EO(g)=AA(g) ΔH=-102kJ/mol (或 (g)=CH CHO(g) ΔH=-102kJ/mol)(2 分
3
)
(2)①不能(1 分),因为乙烯参加的反应为快反应,而整个化学反应的速率取决于慢反应
(2 分)
②温度低于 220℃,反应太慢;温度高于 260℃,催化剂活性降低(2 分)
Ⅱ.(1) (3 分)
(2)由图可知,乙烯和 HOCl 生成中间产物 HOCH CHCl,HOCH CHCl 发生成环反应得
2 2 2 2
到环氧乙烷和 HCl,其反应过程可描述为 CH=CH +HOCl→HOCH CHCl,HOCH CHCl
2 2 2 2 2 2
→ +HCl。(语言描述或用化学方程式表达均可)(3 分)