文档内容
绝密★启用前
安徽2024—2025学年高三12月联考
化学
考生注意:
1 .答题前,考生务必将•自己的姓名、考生号填写在试卷和答题卡上,并将考生号条影码粘
贴在答题卡上的指定位置。
2 .回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂思。如常
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在卷题卡
上。写在本试卷上无效。
3 .考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:Hl C 12 N 14 0 16 Na 23 Si 28 Ti 48 Ge 73
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1.围绕化学家的突出贡献,下列叙述错误的是
蛊斯代表作品: 门捷列夫代表作品: 侯德榜发明了
皴维:农业化学的开创者
《纯化学基础》 《化学原理》 联合制做法
A.磷、氮和硫的相关化合物在农业化学领域应用广泛
B.盖斯提出的盖斯定律,为化学动力学发展奠定了基础
C.门捷列夫按照相对原子质疑由小到大的顺序编制了第一张元素周期表
D.联合制碱法是向溶有NH3的饱和 NaCl 溶液中通入足量的CO2
2 ,下列化学用语表述正确的是
a. hcio的空间填充模型:
B.S2c12的结构式: Cl—S=S—C1
C. NH3 的 VSEPR 模型
D.用电子式表示HC1的形成过程:W + -C1: ―>H ♦[:&:「
• • • •3.下列各组物质的提纯、鉴别或检验方法中,可行的是
A.检验S02中的CO2;澄清石灰水
B.鉴别N02和Br2蒸气:AgN()3溶液
C.除去酒精中的少见水:加 CaO、过滤
D.除去CU中的HC1:通过饱和NaHCOj溶液、洗气
4 .设M表示阿伏加德罗常数的值,下列叙述正确的是
A.1.8 g重水他0)中所含中子数为外
B.标准状况下,22.4 L CH3C1中含有p-sp3cr键数为必
C.l LI mol-L-1 Na.SO4溶液中所含Na♦和 SO:数均为M
D.30 g Si02晶体中,含有[SiOj四面体结构单元数为M
5 .下列各组物质间的转化,在指定条件下均能一步实现的是
A. Ca(CIO?)溶液③HC10 gHC1
B.Ag
蟀看
Ag(NH3)2]♦.AgCl
C.N2 " 01 —— 微电 >no2 — H,0 >hno3 D.A1 NnOH 溶液, Na[ r( 。用 J AaIA
阅读下列材料,完成6 ~7题。
硫单质及其化合物在生产、生活、科研等方面应用广泛。是破单质中
故稳定的,可用于制作锂硫电池(锂硫电池的总反应为16U + S, 才8弭$);硫的重要化合
物还包括HjS'CH3sH(甲魏静)、Na2s()3、Na2s2O3、N,S2()式然亚硫酸钠)、Na2sA(过二硫
酸钠)、Na2s2 。式连二亚硫酸钠,俗称保险粉)等。
6 .下列有关电极反应式或离子方程式书写正确的是
A,锂硫电池的负极反应式;16Li-16e・ +S& -8Li2s
B.将过jfi的 H2S 通入 NaOH 溶液中:H2s +20H-= S2' +21^0
C.向Na2s2 。3溶液中通入过量氯气海。;-+4C" +560==2S0: +8CK +10H*
D.AgNOs溶液和碱性Na2s2 。4溶液混合制纳米级银粉:2Ag* +S2a- +40H,==2Ag +
2S0f +2耳0
7 .下列有关物质结构或性质的说法错误的是
A.键角:大于H2s
B .沸点: CH30H 高于 CH3sH
C・%在OS?中的溶解度大于在乙醉中的溶解度
D.SOr中硫原子的杂化方式为sp?
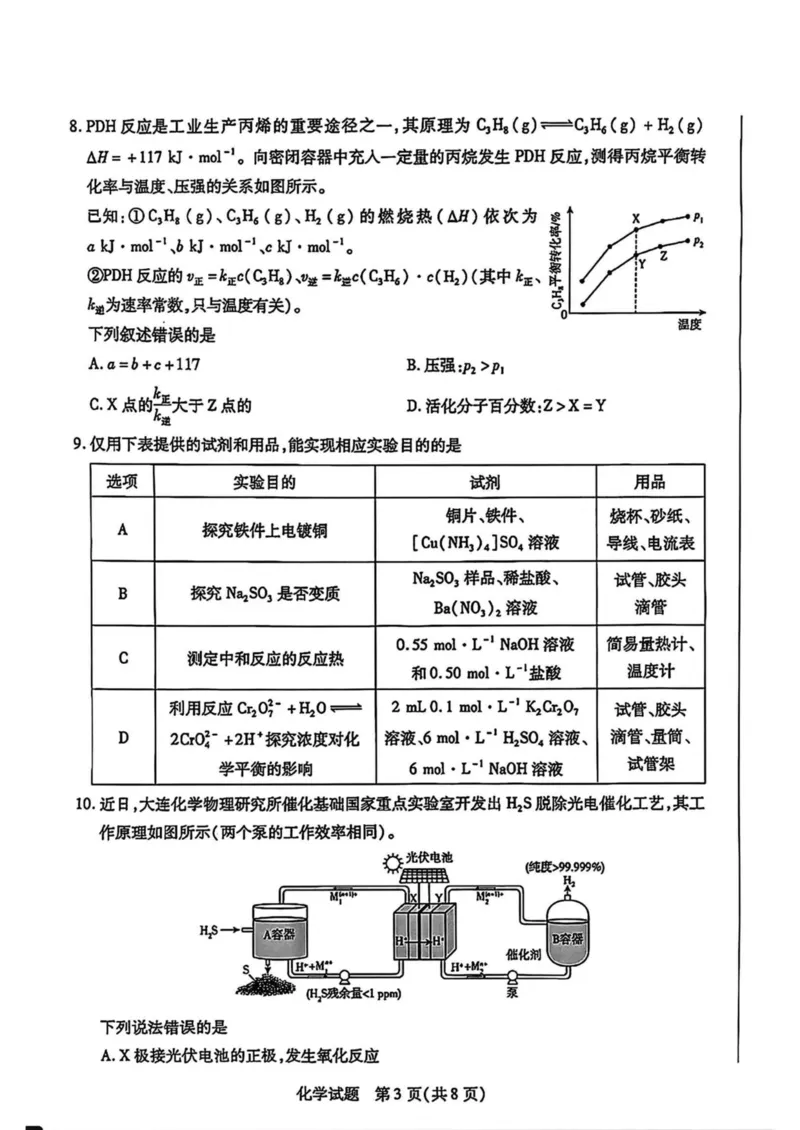
化学试题第2页(共8页)8. PDH反应是工业生产丙烯的重要途径之一,其原理为(g) -C3H6 ( g) + % (g)
AH= +117 kJ - mol-1向密闭容器中充入一定量的丙烷发生PDH反应,测得丙烷平衡转
化率与温度、压强的关系如图所示。
已知:①c3H8(g)、C3H6(g)、HUg)的燃烧热(AH)依次为
a kJ • mol_1、 b kJ • mol-1、c kJ • moL。
②PDH 反应的“正 n/HGR)、陛二%c(C3H6)-c(H2)(其中 “、
%为速率常数,只与温度有关)。
下列叙述错误的是
A.a = 6+c + 117 B.压强:pz>Pi
C. X 点的詈大于Z点的 D.活化分子百分数:Z>X = Y
9,仅用下表提供的试剂和用品,能实现相应实验目的的是
选项 实验目的 试剂 用品
铜片、铁件、 烧杯、砂纸、
A
探究铁件上电镀铜
[Cu(NH3)4]S04
溶液 导线、电流表
gso?样品、稀盐酸、
试管、胶头
B 探究Na2s。3是否变质
Ba(N(\)2 溶液 滴管
0.55 mol - L'* NaOH 溶液 简易量热计、
C
测定中和反应的反应热
和0.50 mol・L' 盐酸 温度计
利用反应“oF+h20 k— 2 mLO. 1 mol • L-1 KjCi^O?
试管、胶头
D 2CrO; +2H♦探究浓度对化 溶液、6 mol -L-* H2S04 溶液、 滴管、量筒、
学平衡的影响 6 mol L-, NaOH 溶液 试管架
10 .近日,大连化学物理研究所催化基础国家重点实验室开发出H2s脱除光电催化工艺,其工
作原理如图所示(两个泵的工作效率相同)。
由光伏电池
下列说法错误的是
A. X极接光伏电池的正极,发生氧化反应
化学试题第3页(共 8 页)B.随着反应的进行,电解池内部溶液的酸性增强
C. A容器中生成S的离子方程式为H2s +2Mf"*,>> = 2M「+2H+ +S1
D.该装置的显著优点:利用太阳能并获得氢能
11.已知:H2A = H' +HA-、HA-01r +A2-;25 七时,&(HA-) = 10"to,K.,(HzS)=
io-<-9,^(h2s)=io-,X90
下列叙述错误的是
A.0.1 mol - L”的耳A溶液中:c(HD =c(OH-) +c(HA-) +2c(AlO
B.0.1 mol・L的NaHA溶液中:c(Na*)>c(HA-) >c(H+) >c(A2-)
©0.01 mol •!/*的NH4HS溶液中:c(HzS) +c(HS-) +c(S2-) >c(NH;)
D. 0.01 mol •『I 的 Na2s 溶液中:c(S2-)/c(0H-) >1
12 .氨是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,反应原理如下:
[N,f
o在一定条件下模拟处理氨氮废水:将1 L 0.008 mol - L-*
硝氨水(NO;)
的氨水分别和不同直:的NaClO混合,测得溶液中氨去除率、总氮(NH3和NO;的总和)残
余率与NaClO投入量(用力表示)的关系如图所示。下列说法错误的是
2(NaC10)/ool
A.由NHj直接转化为N2的离子方程式:2NH3 +3CKT= N2 ] +3C「+3冉0
B.当,=的时,生成物中的“心):"(NO;) =19:2
C.当”=苞时,整个反应过程中转移电子的物质的量为2.3x10" mol
D.当巧时声越大,生成N2的垃越少
13 .巳知:pX = -1g c(X) [c(X)为c(Cu")或鬻?。常温下,调节CuS04溶液与HA溶液
的PH时,pCb和P翁随PH的变化曲线如图所示(已知北2 =0.3)。
化学试题第4页(共8页)下列叙述正确的是
A.曲线J表示pCu2*随pH的变化
B.K.(HA) =10・3.3 1
C.常温下Cu( 0H)2溶于水所得饱和溶液的pH为7.7 J
D.向100 mL0.2 mol・L HA溶液中加入 0.40 g NaOH固体得到溶液X(不考虑溶液体
积变化),X 溶液中存在:c(Na*) +c(H4)>c(0H-)+c(HA) I
14 .某钾离子电池负极材料的晶胞结构如图1所示,该晶体沿垂直石黑层方向的部分投影珈
■
图2所示。下列说法正确的是 ).(1
O K
• C
A.图1
晶胞是一个立方体
B.该负极材料的组成可表示为KC6
C.晶体中与K ♦紧邻的C的数目为8
D.晶胞底面棱长等于碳碳链长的24倍
二、非选择题:本题共4小题,共58分。
15.(14分)叔化钛(TiN)是一种金黄色固体,熔点高、硬度大,具有较高的导电性和超导性,可
用于制备高温结构材料和超导材料。以富钛矿渣(主要成分为FeTO3^e2O3,SiO2等)为
原料制备氟化钛并获得绿矶(FeSOd・7耳0) 的流程如图所示:
硫酸 适抗铁松
富钛tJ 降流液11乖叫■»[平卜滤液2市讯fTiO, •现0爆』
竹
800
式炉一箝'
3赐
潮曲 FeS04 « 711,0
已知:①辄化性:Fe3+ >TK 卢>
②酸浸后,溶液中钛元索主婴以TiO"形式存在,Ti()2♦能水解。
请回答下列问题:
(】)基态Ti3♦第三能层电子排布式为 0
(2)在“肢浸”工序巾FeTiO,参与反应的化学方程式为、
(3)向“救浸”后的浊液1中加入适血铁粉的原因是
化学试题第5页(共8
页)(4)FeS04 -7H2O的结构示意图如图所示。
FeS04 -7H2O中H20与Fe2\H2O与SOb的作用力类型依次是、。
(5)实验室进行“敢洗”、“水洗”操作时,用到的玻璃仪常有。
(6)生成TiN的化学方程式为°
(7) 氮化钛的立方晶胞结构如图所示,与网原子距南掖近且相等的双原子的数目为 0
若晶胞参数为a nm, M表示阿伏加德罗希数的值,则该晶体的密度"=g・cm”
(用含。、M的代数式表示)。
16. (15分)二僦化错(戊。2)在医药、电子工<、化工、光谱分析材料等众多领域拥有广阔的应用
前景。实验室以二氧化错粗品(含GeO2和As2O3等)为原料制备GeO2并测定产品纯度。
已知:①GeCL熔点为-51.5七,沸点为 86.6七;易水解。
②Ge。2与NaOH溶液反应生成Na2Ge()3
。
③A®03与 NaOH溶液反应生成NaAsO21NaAsO2与盐酸反应生成剧毒的AsCU(沸点为
130.2 七)。
@H3AsO4的沸点为 160 七。
请回答下列问题:
I.制备GeCL
(2)在满加浓盐政之前,先通人一定址的级气,其目的为;实验
室可用漂白粉和浓盐酸反应制氯气,该反应的化学方程式为<,
化学试题第6页(共8页)(3)“蒸像”过程中生成Get,的化学方程式为 o
H •水解法制GeO?
将b装置收集的GeQ通过水解进一步制得Ge02- 2H20晶体,再加热干燥制得纯度较高
的 GeOz 。
(4)产品中二氧化错的含量常采用碘酸钾(KI。、)滴定法进行泅定。步骤如下:
a.称取0.380 g产品,加入NaOH溶液充分溶解,再加入NaH2p溶液使铸元素以
城•形斯在;
b.加入适量稀破酸将溶液pH 调为酸性,滴加几滴淀粉溶液;
c.用0.050 mol・L”的KI0 、标准溶液滴定,达到滴定终点时,消耗KI0,标准溶液的
体积为24.00 mLo
已知0的却+10; +6H♦- 3G?. +「+3比0;样品中的杂质不参与反应,NaH2PO2
与KIO3和 k 均不反应,滴定过程中「消耗的IO;忽略不计。
①滴定时 W3标准溶液应盛放在(填“酸”或“碱”)式滴定管中。
②漓定终点的标志为 o
③此样品中二氧化楮的质量分数是 % (保留小数点后一位)O
O
④下列操作中会导致所测二氧化楮的含量偏低的是____________(填字母)
a.滴定管在滴定前有气泡,滴定后气泡消失
b.滴定管用蒸储水洗涤后未用KI03标准溶液润洗就直接注入标准溶液
c.读取标准溶液体积时,开始时仰视读数,滴定结束时俯视读数
17.(15分)1907年拉希格(R-aschig)发明了以氢和次氯酸钠反应制备游(N2HJ的方法。
请回答下列问题:
(1)氨气和次氯酸钠的反应分两步进行:
①叫 + CIO -= NH2cl + OH 一 (蛔应)
(DNHj +NH2C1 + OH'= N2H4 + cr +乩0(慢反应)
控速反应是(填“①”或“②",下同);活化能较小的反应是 O
(2)所既可以作单齿配体(提供1个配位原子),又可以作双齿配体(提供2个配位原子),
与过渡金属离子形成配合物。已知在配合物①[比(9)2(此印)〕仁和
②[Pt(N0z)2(N2HJ]中,Pt?♦的配位数是其电荷数的2倍,则N2H4作双齿配体的配
合物是 侬“①”或"②” )O
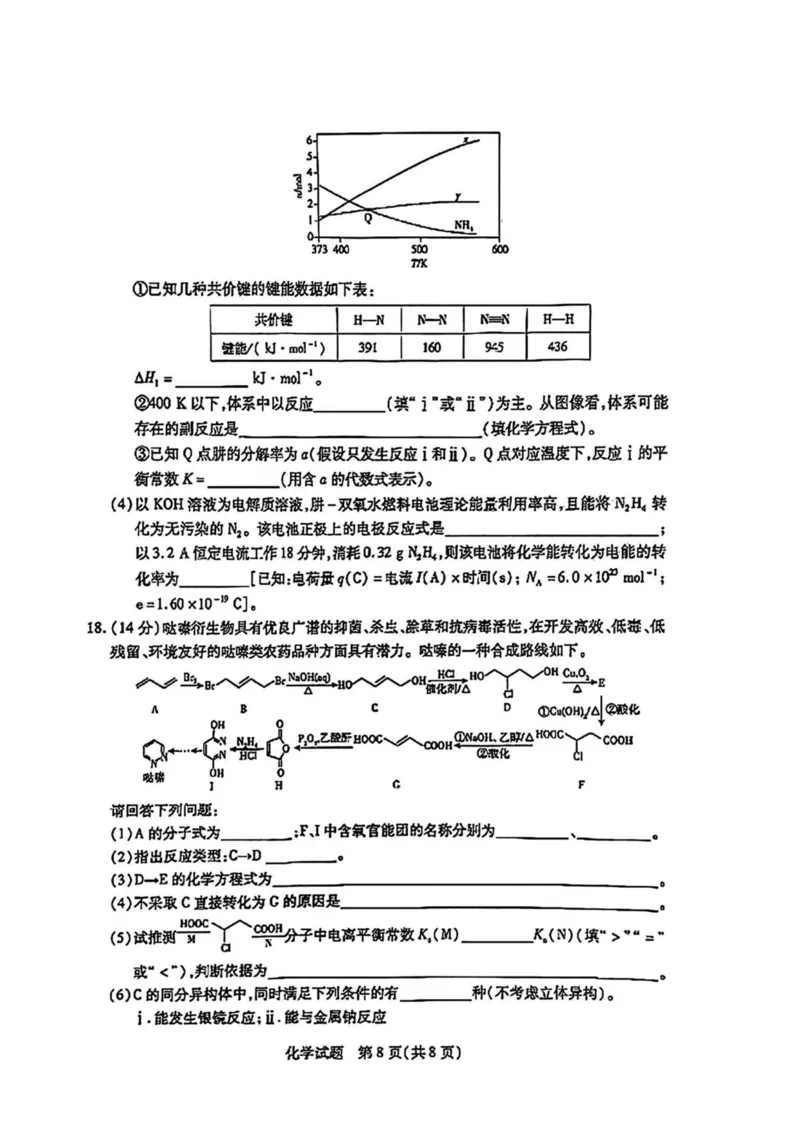
(3)游是一种储氢材料。向1 L恒容密闭容摆中加入3 mol此儿(6),一定条件下体系中
存在如下平衡:
i.N2H4(g)—N2(g)+2H2(g) AH,
il・3N2H4(s)0N?(g)+4NH3(g).
不同温度下达到平衡时,分解产物的物质的城如图所示。①已知几种共价键的键能辘如下表:
H—N N-N H—H
391 160 945 436
②WO K以下,体系中以反应___________ (填" i n或为主。从国像看,体系可能
存在的副反应是(填化学方程式)O
③已知Q点腓的分解率为“假设只发生反应i和近)。Q点对应温度下,反应i的平
K a
衡常数 二(用含 的他式表示)。
(4)以KOH溶液为电解质溶液,廨-双氧水燃料电泡麦论能危利用率高,且能将凡乩转
化为无污染的附。该电池正极上的电极反应式是;
以3.2 A恒定电流工作18分钟,消耗。.32 g耳Ho则该电池将化学能转化为电能的转
化率为[已知:电荷*g(C)=电流,(A)x时间(6); /VA =6,0x100 mor1;
e = 1.60xl0-'9 C]o
18.(14分)哒案衍生物具有优良广谱的抑苗、杀虫、除草和抗病毒活住,在开发^效、低毒、保
残留、环境友好的哒嗪类农药品种方面具有潜力。欢嗪的一种合成路线如下。
A B D d)Cu(OHV-
中得 型吧 黑烂心『
OH 0
Q- 0 0H COOH
OH 0
1 H
请回答下列问题:
(1)A的分子式为,;FJ中含氧官能团的名称分别为、。
(2)指出反应类型: CtD 。
(3)D―E的化学方程式为^_________________________________________________________________
(4)不采取C直接燹化为C的原因是_
⑸试推测竽丫、智分子中电离平衡布数K,(M)4(N)(填“ >”“二”
或“ <”),判断依据为___________________________________________________________一。
(6) C的同分异构体中,同时满足下列条件的有 种(不考度立体异构)。
i .能发生银疑反应;ii .能与金属钠反应
化学试题第8页(共8页)