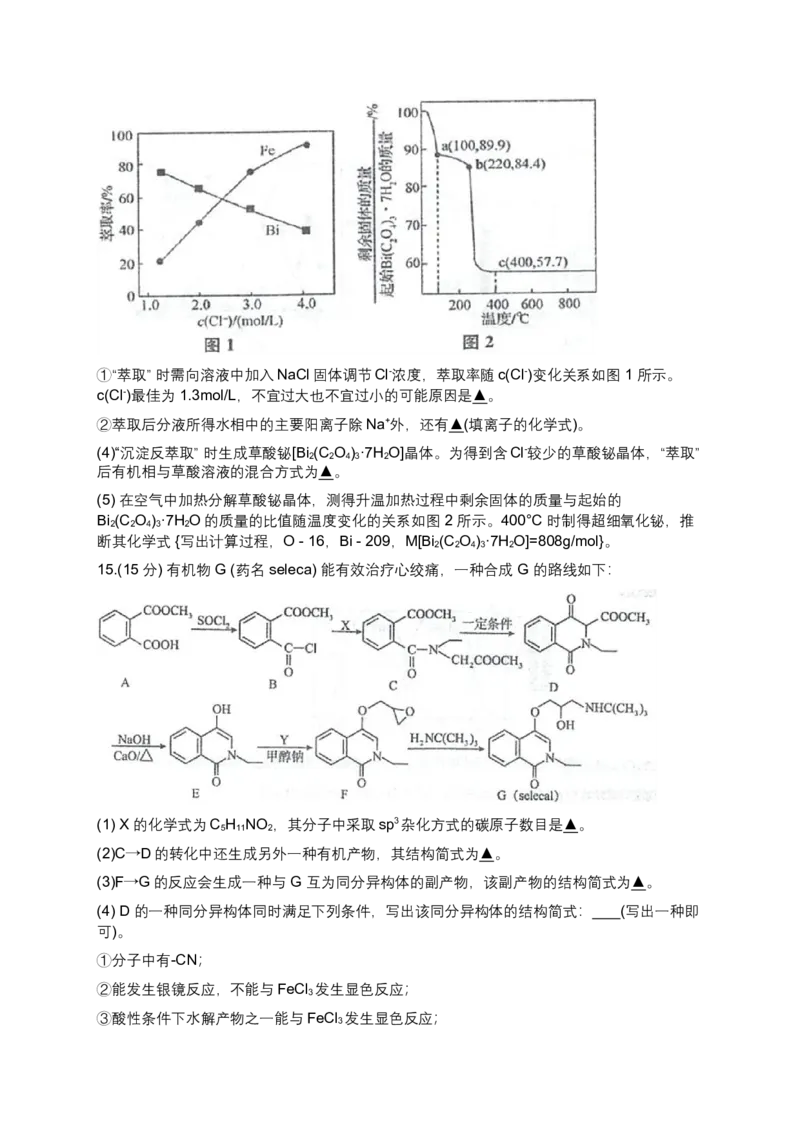
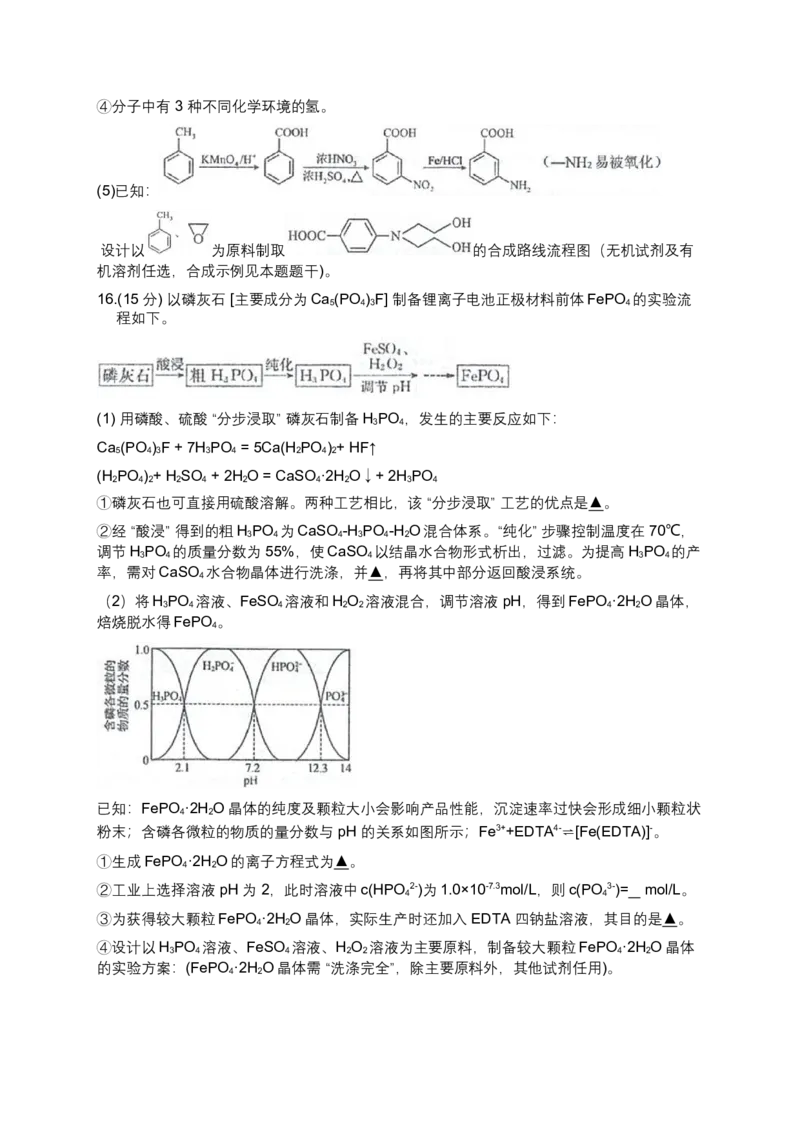
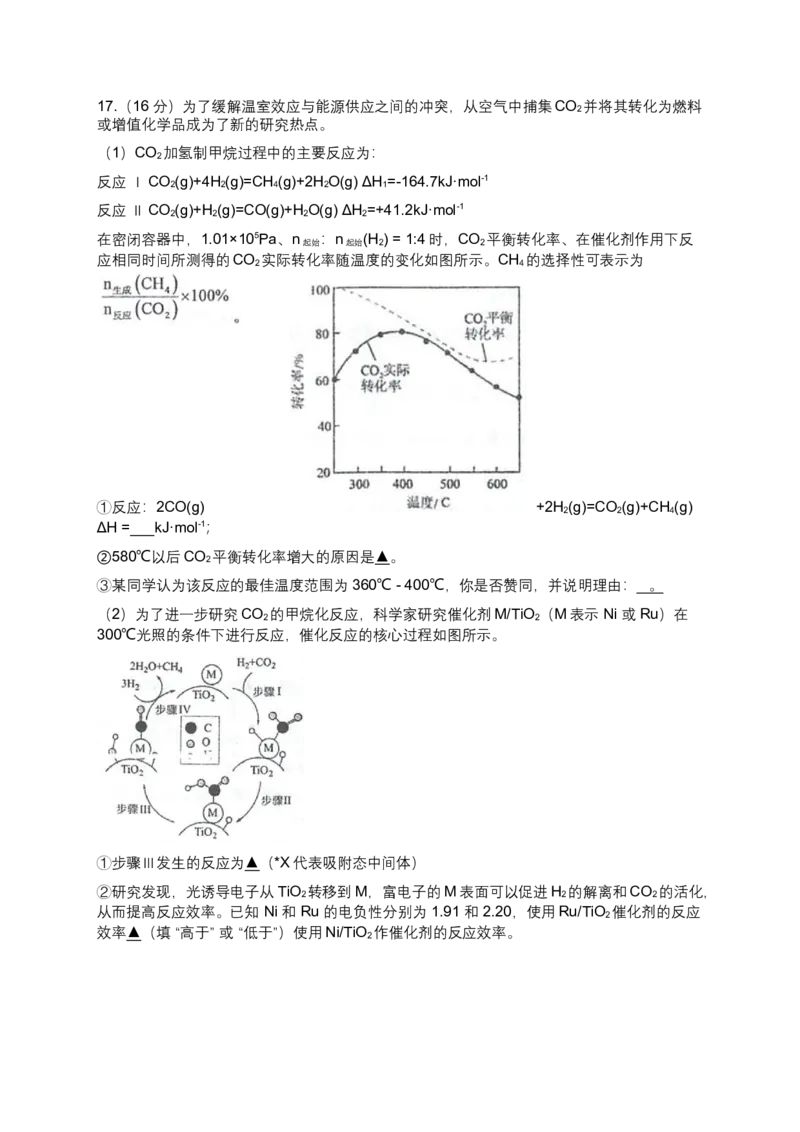
文档内容
江苏省泰州中学 2024~2025 学年度第二学期期中考试
高二化学试题
(考试时间:75 分钟;总分:100 分)
一、选择题:(本题共 13 小题,每小题 3 分,共 39 分,每题只
有一个选项最符合题意。)
1.2024 年中国 “六五环境日” 主题为 “全面推进美丽中国建设”。下列做法不应提倡的是( )
A. 大力发展火力发电
B. 开发使用清洁能源
C. 植树造林增加绿色植被
D. 健全生态环境治理体系
2.反应 NH Cl + NaNO = NaCl + N ↑+ 2H O应用于石油开采。下列说法正确的是( )
4 2 2 2
A. 基态氮原子的电子排布式为
B. B. Cl-的结构示意图为
C. NO -中 N 原子杂化类型为sp2
2
D. H O的空间填充模型为
2
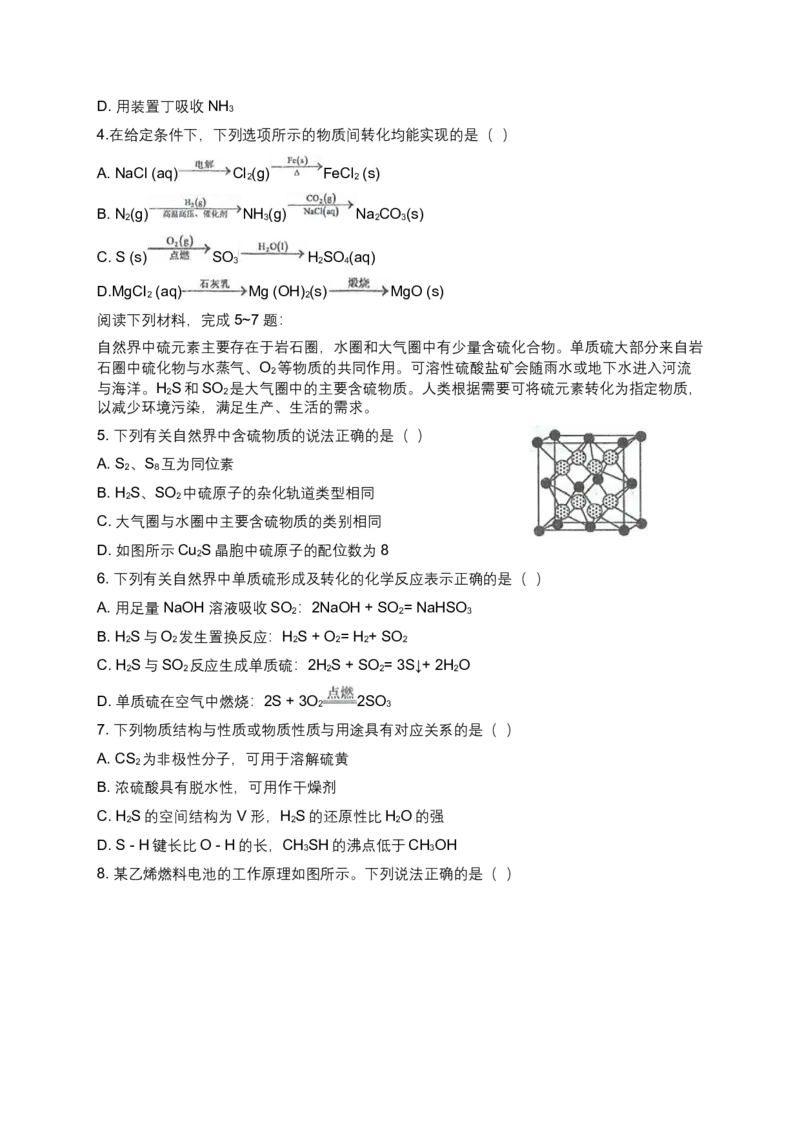
3.实验室制取少量NH 的装置如图所示。下列实验装置不能达到目的的是( )
3
A. 用装置甲制得NH
3
B. 用装置乙干燥NH
3
C. 用装置丙收集NH
3D. 用装置丁吸收NH
3
4.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl (aq) Cl (g) FeCl (s)
2 2
B. N (g) NH (g) Na CO (s)
2 3 2 3
C. S (s) SO H SO (aq)
3 2 4
D.MgCI (aq) Mg (OH) (s) MgO (s)
2 2
阅读下列材料,完成 5~7 题:
自然界中硫元素主要存在于岩石圈,水圈和大气圈中有少量含硫化合物。单质硫大部分来自岩
石圈中硫化物与水蒸气、O 等物质的共同作用。可溶性硫酸盐矿会随雨水或地下水进入河流
2
与海洋。H S和SO 是大气圈中的主要含硫物质。人类根据需要可将硫元素转化为指定物质,
2 2
以减少环境污染,满足生产、生活的需求。
5. 下列有关自然界中含硫物质的说法正确的是( )
A. S 、S 互为同位素
2 8
B. H S、SO 中硫原子的杂化轨道类型相同
2 2
C. 大气圈与水圈中主要含硫物质的类别相同
D. 如图所示Cu S晶胞中硫原子的配位数为 8
2
6. 下列有关自然界中单质硫形成及转化的化学反应表示正确的是( )
A. 用足量 NaOH 溶液吸收SO :2NaOH + SO = NaHSO
2 2 3
B. H S与O 发生置换反应:H S + O = H + SO
2 2 2 2 2 2
C. H S与SO 反应生成单质硫:2H S + SO = 3S↓+ 2H O
2 2 2 2 2
D. 单质硫在空气中燃烧:2S + 3O 2SO
2 3
7. 下列物质结构与性质或物质性质与用途具有对应关系的是( )
A. CS 为非极性分子,可用于溶解硫黄
2
B. 浓硫酸具有脱水性,可用作干燥剂
C. H S的空间结构为 V 形,H S的还原性比H O的强
2 2 2
D. S - H键长比O - H的长,CH SH的沸点低于CH OH
3 3
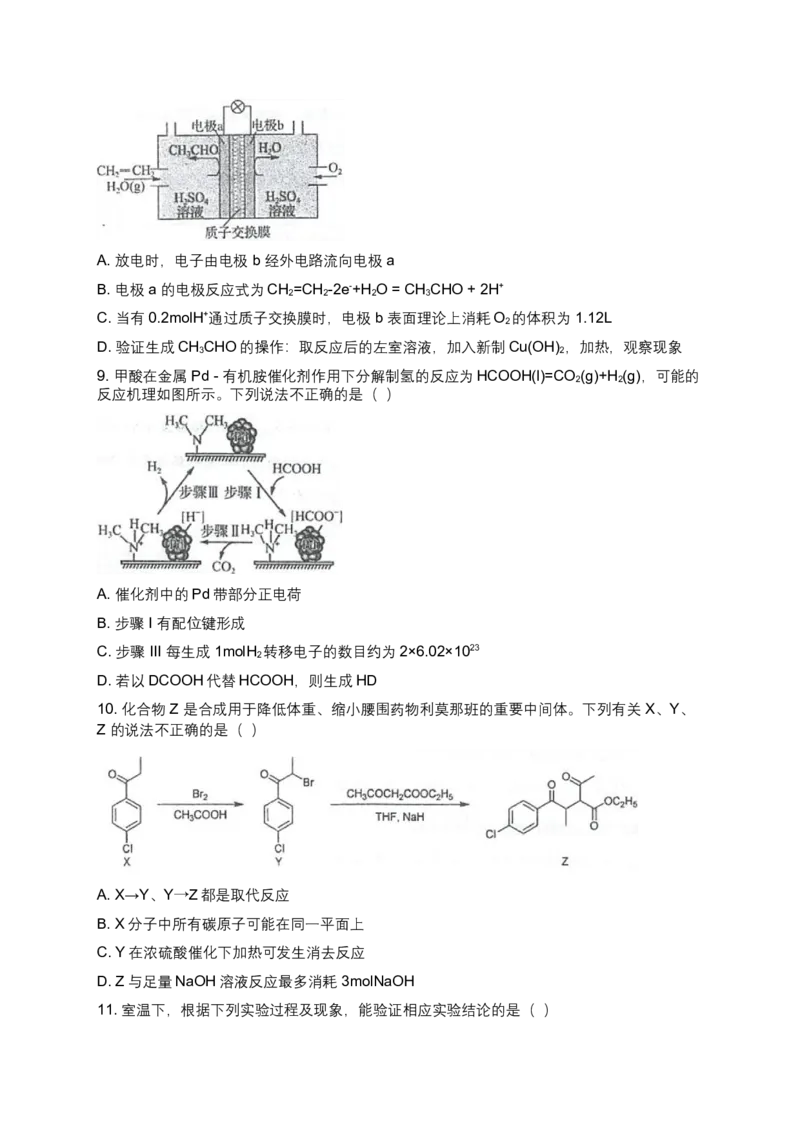
8. 某乙烯燃料电池的工作原理如图所示。下列说法正确的是( )A. 放电时,电子由电极 b 经外电路流向电极 a
B. 电极 a 的电极反应式为CH =CH -2e-+H O = CH CHO + 2H+
2 2 2 3
C. 当有0.2molH+通过质子交换膜时,电极 b 表面理论上消耗O 的体积为 1.12L
2
D. 验证生成CH CHO的操作:取反应后的左室溶液,加入新制Cu(OH) ,加热,观察现象
3 2
9. 甲酸在金属 Pd - 有机胺催化剂作用下分解制氢的反应为HCOOH(l)=CO (g)+H (g),可能的
2 2
反应机理如图所示。下列说法不正确的是( )
A. 催化剂中的Pd带部分正电荷
B. 步骤 I 有配位键形成
C. 步骤 III 每生成 1molH 转移电子的数目约为2×6.02×1023
2
D. 若以DCOOH代替HCOOH,则生成HD
10. 化合物 Z 是合成用于降低体重、缩小腰围药物利莫那班的重要中间体。下列有关 X、Y、
Z 的说法不正确的是( )
A. X→Y、Y→Z都是取代反应
B. X分子中所有碳原子可能在同一平面上
C. Y在浓硫酸催化下加热可发生消去反应
D. Z与足量NaOH溶液反应最多消耗 3molNaOH
11. 室温下,根据下列实验过程及现象,能验证相应实验结论的是( )选项 实验过程及现象 实验结论
A 室温下,用pH计分别测 CH COO-比ClO-结合
3
量CH COONa溶液和 H+的能力弱
3
NaClO溶液的pH,前者
小于后者
B 向乙醇中加入绿豆大小的 乙醇中有水
钠块,有气泡产生
C 向5mL0.1mol·L-1FeCl 溶 FeCl 和KI反应为可逆反
3 3
液中滴加 应
1mL0.1mol·L-1KI溶液,
再滴加几滴KSCN溶液,
溶液变为红色
D 用pH计测量 c(C O 2-)>c(H C O )
2 4 2 2 4
0.1mol·L-1KHC O 溶液的
2 4
pH = 2.70
12.室温下,通过下列实验探究Na S溶液的性质。
2
实验 1:用pH计测量0.1mol·L-1Na S溶液的pH,测得pH为 12.65。
2
实验 2:向0.1mol·L-1的Na S溶液中通入HCl气体至pH = 7(忽略溶液体积的变化及H S的
2 2
挥发)。
实验 3:向1mL0.1mol·L-1的Na S溶液中加入1mL0.1mol·L-1H S溶液。
2 2
已知:K (H S)=9.1×10-8,K (H S)=1.0×10-12,K (H CO )=4.3×10-7,K (H CO )=5.6×10-
a1 2 a2 2 a1 2 3 a2 2 3
11。下列说法正确的是( )
A. 实验 1 所得溶液中:c(S2-)