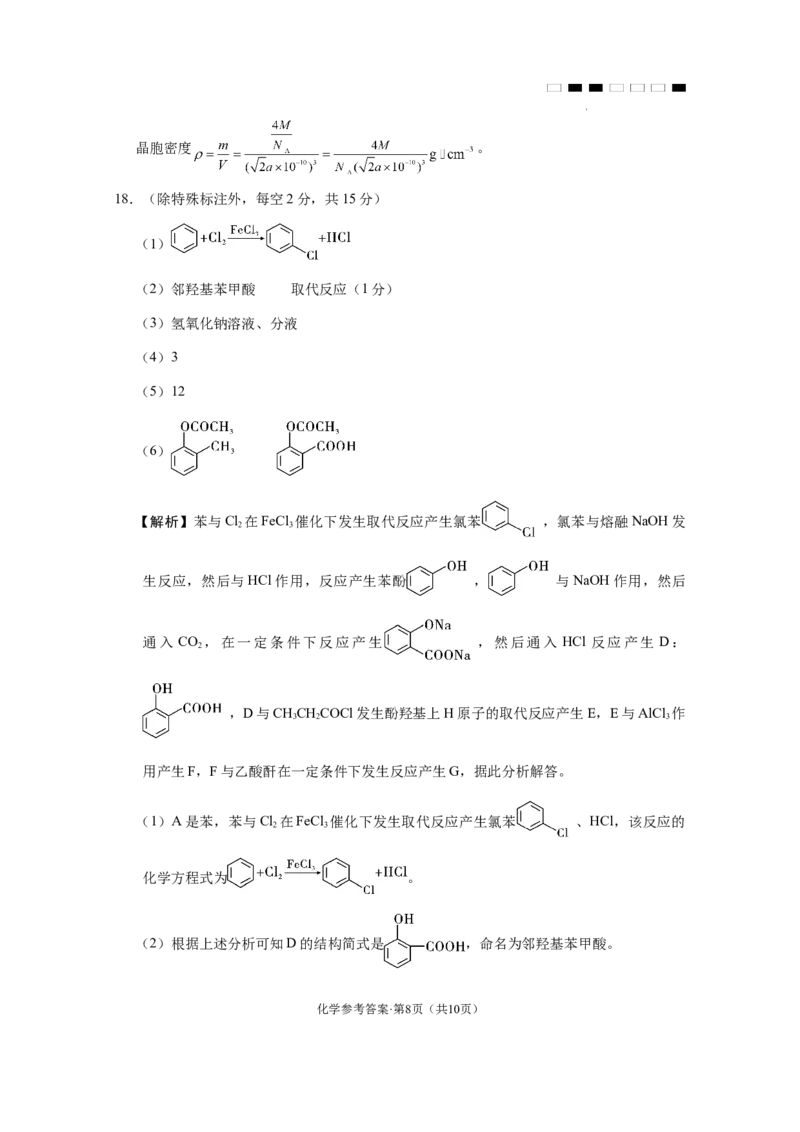
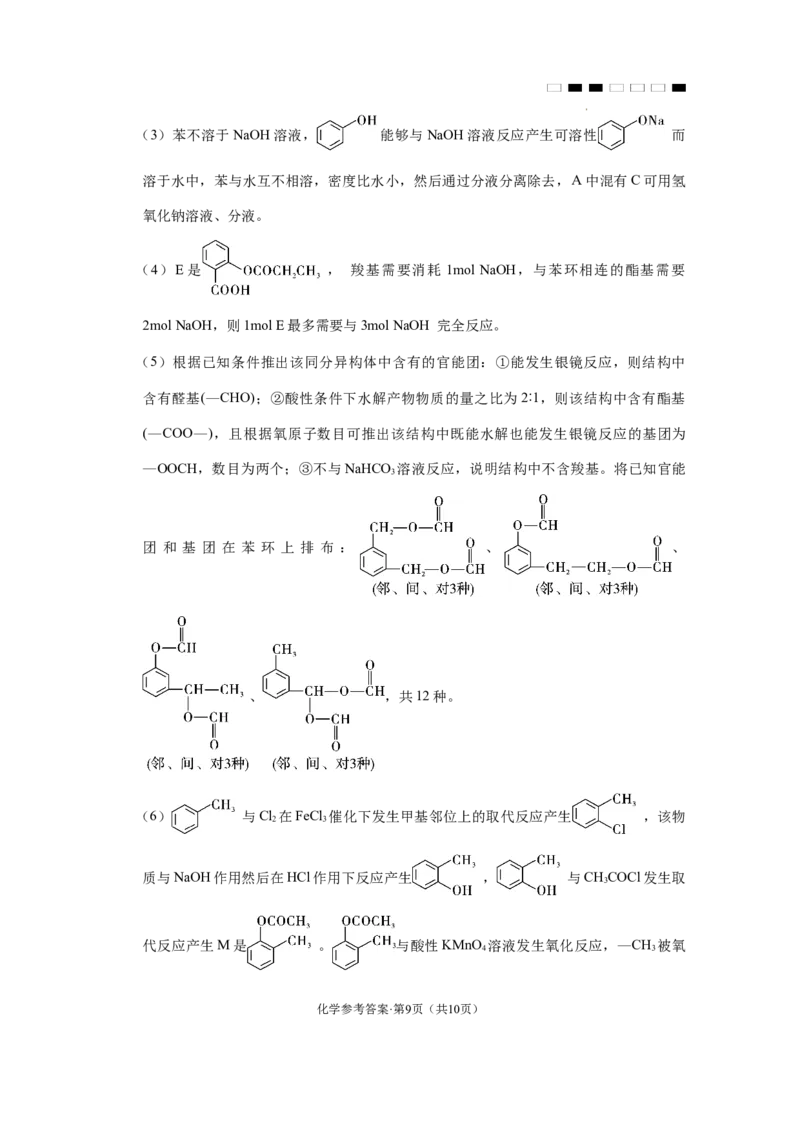
文档内容
贵阳第一中学 2024 届高考适应性月考卷(八)
化学参考答案
一、选择题:本题共14小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
题号 1 2 3 4 5 6 7
答案 B B D B C A D
题号 8 9 10 11 12 13 14
答案 C B C C A D D
【解析】
1.聚四氟乙烯是合成塑料,是合成有机高分子材料,但不含碳碳不饱和键,不能使溴水褪
色,A错误。采用光伏发电技术绿色供电,减少了二氧化碳的排放,有利于实现低碳管理
目标,B正确。铝合金是金属材料,而玻璃钢是玻璃纤维与合成材料复合而成的一种特殊
材料,属于复合材料,C错误。生产普通玻璃的主要原料是石灰石、纯碱和石英,D错误。
2.CO 中C原子为sp杂化,则杂化轨道电子云轮廓图: ,A错误。BF−中有一
2 4
个配位键,故结构式为 ,B正确。 的电子云图为哑铃形: ,
其中的黑点不代表核外电子的运动轨迹,表示电子出现的几率的多少,小黑点越密集的
地方,电子出现的几率越高,小黑点越稀薄的地方,电子出现的几率越小,C错误。硼元
素的原子序数为5,基态原子的电子排布图为 ,D错误。
3.1.0mol NO和0.5mol O 混合充分反应后生成1.0mol NO ,NO 又会发生 ,
2 2 2
气 体 分 子 总 数 小 于 1.0N , A 错 误 。 反 应 ΔH
A
=−92.4kJ/mol,若放出热量92.4kJ,则参加反应的N 的物质的量为 ,生成NH 的数目
2 3
等于2N ,B错误。1L pH=1的HSO 溶液中n(H+)=0.1mol/L×1L=0.1mol,但HSO 溶液中
A 2 4 2 4
由水电离出H+的数目等于溶液中OH−的数目为10−13N ,C错误。在石墨中,每个碳原子
A
实际占化学键为1.5个,12g石墨即1mol所含碳碳键数目为1.5N ,D正确。
A
4.NaS与少量FeCl 反应,正确的离子方程式为3S2−+2Fe3+=2FeS↓+S↓,A错误。足量
2 3
化学参考答案·第1页(共10页)
学科网(北京)股份有限公司CO 通入饱和 NaCO 溶液中,会生成碳酸氢钠沉淀,离子方程式为 2Na++
2 2 3
+CO +H O= ,B正确。HF为弱酸,在离子方程式中不能拆分,需保留
2 2
化学式,C错误。碳酸的酸性强于HS,所以不能发生上述反应,正确的离子方程式为
2
HS+ = +HS−,D错误。
2
5.石墨晶体中层与层之间存在分子间作用力,层内存在大π键,层内存在自由移动的电子,
具有导电性,A错误。甲醛能与酚类物质发生聚合反应,可用于制备酚醛树脂,B错误。
SiC中原子以共价键形成空间网状结构,熔点高、硬度大,可用作砂轮、砂纸的磨料,C
正确。氢键是H原子与N、O、F等原子之间形成的分子间作用力, 离子间不能
形成氢键,D错误。
6.胆矾中加入浓硫酸,可观察到蓝色晶体变为白色,即其失去水,体现了浓硫酸的吸水性,
能够达到实验目的,A正确。导气管应该伸到试管底部,B错误。浓盐酸与漂白粉制备氯
气,氯气与氯化亚铁反应生成氯化铁,氯化铁、氯气均可氧化KI,则图中装置不能比较
Fe3+、I 的氧化性,C错误。装置丁为启普发生器的简易装置,启普发生器适用于块状固
2
体与液体在不加热条件下制备大量气体(如 、 、 等),不能用于剧烈反应或
放出大量热的反应。饱和食盐水和电石反应生成的氢氧化钙易堵塞多孔塑料板,生成气
体过多时易发生爆炸,D错误。
7.L−酪氨酸中含有氨基、羟基和羧基,没有酰胺基,A错误。—OH的邻、对位可发生取代
反应,—OH可以发生氧化反应,但无法发生消去反应,B错误。由结构简式可知该物质
中除苯环外不含其他不饱和价键,而酰胺基中含有碳氧双键,因此不存在含有酰胺基的
芳香族化合物,C错误。肾上腺素是一种脂溶性激素,在水中溶解度不大,加入盐酸后,
可形成盐,使其具有更好的溶解性,D正确。
8.X、Y、Z、R、Q是原子序数依次增大的短周期非金属元素,其中X原子的最外层电子中
未成对电子数目与成对电子数目相同,可知X元素为C元素,结合Z元素的成键情况,
可推断Z元素为O元素,则Y元素为N元素,结合R形成一个共价键可推断R元素为F
元素,结合Q元素形成六个共价键推断Q元素为S元素。同周期从左到右,金属性减弱,
非金属性变强,元素的电负性变强。同主族由上而下,金属性增强,非金属性逐渐减弱,
元素电负性减弱。电负性:F>O>S,A错误。电子层数越多半径越大,电子层数相同时,
核电荷数越大,半径越小。简单离子半径:S2−>N3−>O2−,B错误。五种元素形成的简单
氢化物中沸点最高的是氧元素形成的水,水常温下为液态,其他均为气体,C正确。该
阴离子中,S—N—S的中心N原子最外层存在孤电子对,对成键电子有排斥作用,所以
化学参考答案·第2页(共10页)
学科网(北京)股份有限公司∠S—N—S小于180°,D错误。
9.A中浓盐酸与二氧化锰反应生成氯气,氯气中有氯化氢、水等杂质,先用B中饱和食盐水
除氯化氢,再用C中浓硫酸干燥,氯气与铝在D中加热条件下反应制得氯化铝,反应的
尾气中有氯气用氢氧化钠吸收,为防止氯化铝与氢氧化钠溶液中的水蒸气反应,所以在
收集装置和尾气吸收装置之间加一干燥装置F,E为收集瓶,以此解答该题。B用于除去
氯化氢,应为饱和食盐水,A错误。反应开始时,应先点燃A处酒精灯开始反应,待观
察到装置中充满黄绿色气体时,最后点燃D处酒精灯,B正确。若D中生成的AlCl 凝华
3
堵塞导管,B中压强增大,可观察到的现象为长颈漏斗中液面上升,C错误。无水氯化钙
不能吸收氯气,不能起到尾气处理作用,D错误。
10.实验探究应遵循单一变量原则,CuSO 溶液和FeCl 溶液中阴离子不同,A错误。非金属
4 3
性要通过比较最高价氧化物对应水化物的酸性强弱,B错误。鸡蛋清溶液中含大量蛋白
质,加入浓硝酸,使蛋白质变性,溶解度降低,产生白色沉淀。加热后,浓硝酸与蛋白
质作用沉淀变黄,发生显色反应,C正确。石蜡油受热分解产生的不饱和烃能与Br 发生
2
加成反应,但不能证明不饱和烃是乙烯,D错误。
11.放电时为原电池装置,a为负极,b为正极。充电时为电解池装置,a为阴极,b为阳极。
放电时,a极为负极,发生氧化反应,A错误。分子筛分离出氧气,属于物理变化,没
有发生化学变化,B错误。充电时,b极为阳极,过氧根离子发生氧化反应生成氧气,C
正确。充电时,a极为阴极,电极反应式为 ,阴极减少质量等
于脱去过氧根离子质量,阴极净减 ,相当于脱离 ,根据电极方程式中的
计量关系,电路中应有0.2mol电子转移,D错误。
12.盐酸羟胺( )化学性质类似 ,所以此化合物中氯的化合价是−1价,氧是
−2价,氢是+1,根据化合价之和为零,N的化合价−1,NO→NH OHCl,N元素化合价
3
由+2降低为−1,A错误。铁作为金属有导电作用,同时在反应中参与反应,前后质量不
变,作为催化剂使用,B正确。由题意可知,NH OH具有和氨气类似的弱碱性,可以和
2
盐酸生成盐酸羟胺 ,所以缺少的一步反应为NH OH+H+=NH OH+,没
2 3
有电子的转移,所以A为H+,B为 ,C正确。NO和H+反应生成 ,这
个过程中涉及N—O键的断裂和N—H键生成,D正确。
13.Fe2+的电子排布式为1s22s22p63s23p63d6,核外电子填充了14个原子轨道,A错误。与N
原子距离相等且第二近的N原子位于面对角线,数目应该有12个,B错误。N原子位于
化学参考答案·第3页(共10页)
学科网(北京)股份有限公司Fe原子形成的八面体空隙中,C错误。每个晶胞中含有Fe原子的个数为 个,
含 N 原子的个数为 ,晶胞的棱长为(2a+2b)cm,所以晶体的空间利用率
, ,D正确。
14.由b、c两点对应数据可比较出K [Fe(OH) ]与K [Cu(OH) ]的大小,K [Fe(OH) ]=
sp 3 sp 2 sp 3
c(Fe3+)·c3(OH−)=c(Fe3+)·(10−12.7)3 , K [Cu(OH) ]=c(Cu2+)·c2(OH−)=c(Cu2+)·c(10−9.6)2 , 因
sp 2
c(Fe3+)=c(Cu2+),故K [Fe(OH) ]