文档内容
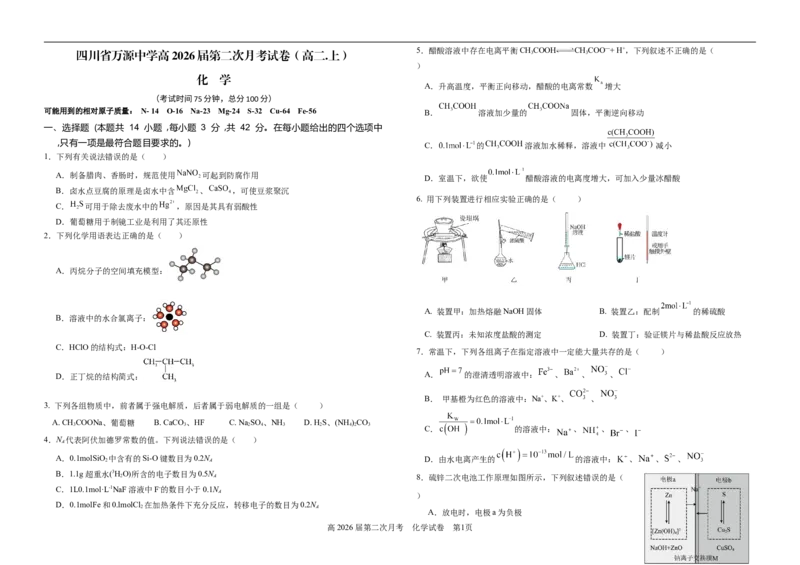
5.醋酸溶液中存在电离平衡CHCOOH CHCOO—+ H+,下列叙述不正确的是(
四川省万源中学高2026届第二次月考试卷(高二.上) 3 3
)
化 学
A.升高温度,平衡正向移动,醋酸的电离常数 增大
(考试时间75分钟,总分100分)
可能用到的相对原子质量: N- 14 O-16 Na-23 Mg-24 S-32 Cu-64 Fe-56 B. 溶液加少量的 固体,平衡逆向移动
一、选择题 (本题共 14 小题 ,每小题 3 分 ,共 42 分。在每小题给出的四个选项中
,只有一项是最符合题目要求的。)
C. 的 溶液加水稀释,溶液中 减小
1.下列有关说法错误的是( )
A.制备腊肉、香肠时,规范使用 可起到防腐作用
D.室温下,欲使 醋酸溶液的电离度增大,可加入少量冰醋酸
B.卤水点豆腐的原理是卤水中含 、 ,可使豆浆聚沉
6. 用下列装置进行相应实验正确的是( )
C. 可用于除去废水中的 ,原因是其具有弱酸性
D.葡萄糖用于制镜工业是利用了其还原性
2.下列化学用语表达正确的是( )
A.丙烷分子的空间填充模型:
A. 装置甲:加热熔融NaOH固体 B. 装置乙:配制 的稀硫酸
B.溶液中的水合氯离子:
C. 装置丙:未知浓度盐酸的测定 D. 装置丁:验证镁片与稀盐酸反应放热
C.HClO的结构式:H-O-Cl
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
D.正丁烷的结构简式: A. 的澄清透明溶液中: 、 、 、
B. 甲基橙为红色的溶液中:Na+、K+、 、
3. 下列各组物质中,前者属于强电解质,后者属于弱电解质的一组是( )
A. CH COONa、葡萄糖 B. CaCO 、HF C. Na SO 、NH D. H S、(NH )CO
3 3 2 4 3 2 4 2 3
C. 的溶液中: 、 、 、
4.N 代表阿伏加德罗常数的值。下列说法错误的是( )
A
A.0.1molSiO 中含有的Si-O键数目为0.2N D.由水电离产生的 的溶液中: 、 、 、
2 A
B.1.1g超重水(3HO)所含的电子数目为0.5N
2 A 8.硫锌二次电池工作原理如图所示,下列叙述错误的是(
C.1L0.1mol·L-1NaF溶液中F-的数目小于0.1N
A
)
D.0.1molFe和0.lmolCl 在加热条件下充分反应,转移电子的数目为0.2N
2 A
A.放电时,电极a为负极
高2026届第二次月考 化学试卷 第1页B.充电时,电极b与电源正极连接
比较 和 向 溶液加入 溶液,再向
A
C.放电时,电极a上的电极反应式为 的 大小 溶液加入几滴
B 制备无水 将氯化铁溶液在HCl的氛围中蒸发结晶
D.充电时, 完全反应时向电极a迁移
测定 的电离和水
C 用pH计测定 溶液的酸碱性
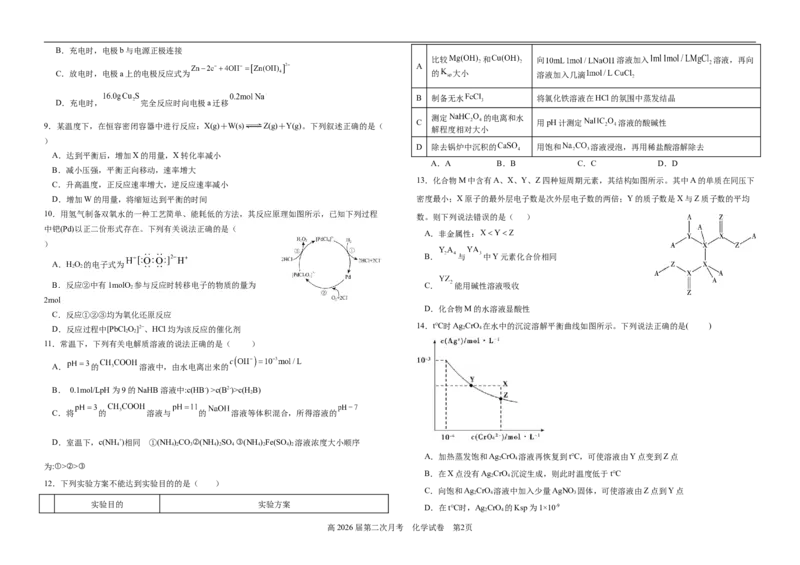
9.某温度下,在恒容密闭容器中进行反应:X(g)+W(s) Z(g)+Y(g)。下列叙述正确的是(
解程度相对大小
)
D 除去锅炉中沉积的 用饱和 溶液浸泡,再用稀盐酸溶解除去
A.达到平衡后,增加X的用量,X转化率减小
A.A B.B C.C D.D
B.减小压强,平衡正向移动,速率增大
13.化合物M中含有A、X、Y、Z四种短周期元素,其结构如图所示。其中A的单质在同压下
C.升高温度,正反应速率增大,逆反应速率减小
D.增加W的用量,将缩短达到平衡的时间 密度最小;X原子的最外层电子数是次外层电子数的两倍;Y的质子数是X与Z质子数的平均
10.用氢气制备双氧水的一种工艺简单、能耗低的方法,其反应原理如图所示,已知下列过程
数。则下列说法错误的是( )
中钯(Pd)以正二价形式存在。下列有关说法正确的是(
A.非金属性:
)
B. 与 中Y元素化合价相同
A.HO 的电子式为
2 2
B.反应②中有1molO 参与反应时转移电子的物质的量为 C. 能用碱性溶液吸收
2
2mol
D.化合物M的水溶液显酸性
C.反应①②③均为氧化还原反应
14.t℃时Ag CrO 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
D.反应过程中[PbCl O]2−、HCl均为该反应的催化剂 2 4
2 2
11.常温下,下列有关电解质溶液的说法正确的是( )
A. 的 溶液中,由水电离出来的
B. 0.1mol/LpH 为9 的NaHB 溶液中:c(HB-) >c(B2-)>c(H B)
2
C.将 的 溶液与 的 溶液等体积混合,所得溶液的
的
D.室温下,c(NH +)相同 ①(NH )CO②(NH )SO ③(NH )Fe(SO ) 溶液浓度大小顺序
4 4 2 3 4 2 4 4 2 4 2
A.加热蒸发饱和Ag CrO 溶液再恢复到t℃,可使溶液由Y点变到Z点
2 4
为:①>②>③
B.在X点没有Ag CrO 沉淀生成,则此时温度低于t℃
2 4
12.下列实验方案不能达到实验目的的是( )
C.向饱和Ag CrO 溶液中加入少量AgNO 固体,可使溶液由Z点到Y点
2 4 3
实验目的 实验方案
D.在t℃时,Ag CrO 的Ksp为1×10-9
2 4
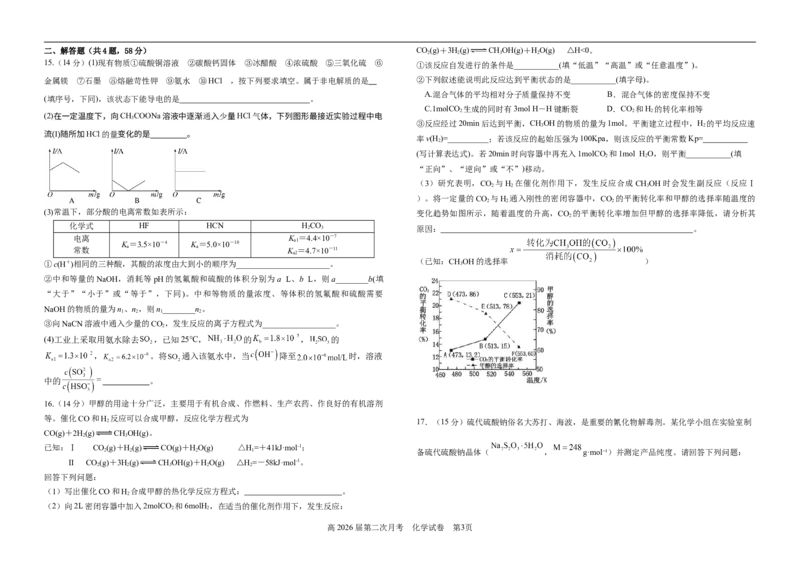
高2026届第二次月考 化学试卷 第2页二、解答题(共4题,58分) CO(g)+3H(g) CHOH(g)+HO(g) △H<0。
2 2 3 2
15.(14分)(1)现有物质①硫酸铜溶液 ②碳酸钙固体 ③冰醋酸 ④浓硫酸 ⑤三氧化硫 ⑥
①该反应自发进行的条件是___________(填“低温”“高温”或“任意温度”)。
金属镁 ⑦石墨 ⑧熔融苛性钾 ⑨氨水 ⑩HCl ,按下列要求填空。属于非电解质的是 ②下列叙述能说明此反应达到平衡状态的是___________(填字母)。
A.混合气体的平均相对分子质量保持不变 B.混合气体的密度保持不变
(填序号,下同),该状态下能导电的是 。
C.1molCO 生成的同时有3mol H-H键断裂 D.CO 和H 的转化率相等
2 2 2
(2)在一定温度下,向CHCOONa溶液中逐渐通入少量HCl气体,下列图形最接近实验过程中电
3
③反应经过20min后达到平衡,CHOH的物质的量为1mol。平衡建立过程中,H 的平均反应速
3 2
流(I)随所加HCl的量变化的是 。
率v(H )=__________;若该反应的起始压强为100Kpa,则该反应的平衡常数Kp=
2
(写计算表达式)。若20min时向容器中再充入1molCO 和1mol HO,则平衡___________(填
2 2
“正向”、“逆向”或“不”)移动。
(3)研究表明,CO 与H 在催化剂作用下,发生反应合成CHOH时会发生副反应(反应Ⅰ
2 2 3
)。将一定量的CO 与H 通入刚性的密闭容器中,CO 的平衡转化率和甲醇的选择率随温度的
2 2 2
(3)常温下,部分酸的电离常数如表所示: 变化趋势如图所示,随着温度的升高,CO 的平衡转化率增加但甲醇的选择率降低,请分析其
2
化学式 HF HCN HCO
2 3 原因: 。
电离 K =4.4×10-7
K=3.5×10-4 K=5.0×10-10 a1
常数 a a K =4.7×10-11
a2
①c(H+)相同的三种酸,其酸的浓度由大到小的顺序为_______________________。 (已知:CH 3 OH的选择率 )
②中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为a L、b L,则a________b(填
“大于”“小于”或“等于”,下同)。中和等物质的量浓度、等体积的氢氟酸和硫酸需要
NaOH的物质的量为n、n,则n________n。
1 2 1 2
③向NaCN溶液中通入少量的CO,发生反应的离子方程式为__________________。
2
(4)工业上采取用氨水除去 ,已知25℃, 的 , 的
, 。将 通入该氨水中,当 降至 时,溶液
中的 。
16.(14分)甲醇的用途十分广泛,主要用于有机合成、作燃料、生产农药、作良好的有机溶剂
等。催化CO和H 反应可以合成甲醇,反应化学方程式为
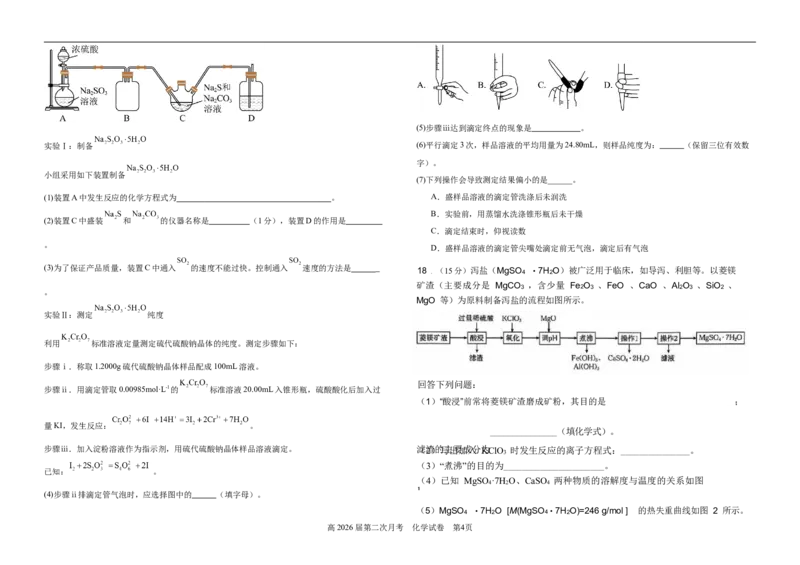
2 17.(15分)硫代硫酸钠俗名大苏打、海波,是重要的氰化物解毒剂。某化学小组在实验室制
CO(g)+2H(g) CHOH(g)。
2 3
已知:Ⅰ CO(g)+H(g) CO(g)+HO(g) △H=+41kJ·mol-1;
2 2 2 1 备硫代硫酸钠晶体( , g·mol⁻¹)并测定产品纯度。请回答下列问题:
Ⅱ CO(g)+3H(g) CHOH(g)+HO(g) △H=-58kJ·mol-1。
2 2 3 2 2
回答下列问题:
(1)写出催化CO和H 合成甲醇的热化学反应方程式: 。
2
(2)向2L密闭容器中加入2molCO 和6molH ,在适当的催化剂作用下,发生反应:
2 2
高2026届第二次月考 化学试卷 第3页(5)步骤ⅲ达到滴定终点的现象是 。
实验Ⅰ:制备 (6)平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为: (保留三位有效数
字)。
小组采用如下装置制备
(7)下列操作会导致测定结果偏小的是______。
(1)装置A中发生反应的化学方程式为 。 A.盛样品溶液的滴定管洗涤后未润洗
B.实验前,用蒸馏水洗涤锥形瓶后未干燥
(2)装置C中盛装 和 的仪器名称是 (1分),装置D的作用是
C.滴定结束时,仰视读数
。
D.盛样品溶液的滴定管尖嘴处滴定前无气泡,滴定后有气泡
(3)为了保证产品质量,装置C中通入 的速度不能过快。控制通入 速度的方法是 18.(15分)泻盐(MgSO
4
·7H
2
O)被广泛用于临床,如导泻、利胆等。以菱镁
矿渣(主要成分是 MgCO ,含少量 Fe O 、FeO 、CaO 、Al O 、SiO 、
3 2 3 2 3 2
。
MgO 等)为原料制备泻盐的流程如图所示。
实验Ⅱ:测定 纯度
利用 标准溶液定量测定硫代硫酸钠晶体的纯度。测定步骤如下:
步骤ⅰ.称取1.2000g硫代硫酸钠晶体样品配成100mL溶液。
回答下列问题:
步骤ⅱ.用滴定管取0.00985mol·L-1的 标准溶液20.00mL入锥形瓶,硫酸酸化后加入过
(1)“酸浸”前常将菱镁矿渣磨成矿粉,其目的是 ;
量KI,发生反应: 。
_______________(填化学式)。
步骤ⅲ.加入淀粉溶液作为指示剂,用硫代硫酸钠晶体样品溶液滴定。 滤(渣2)的写主出要加成入分 为KClO 时发生反应的离子方程式:_______________。
3
(3)“煮沸”的目的为______________________。
已知: 。
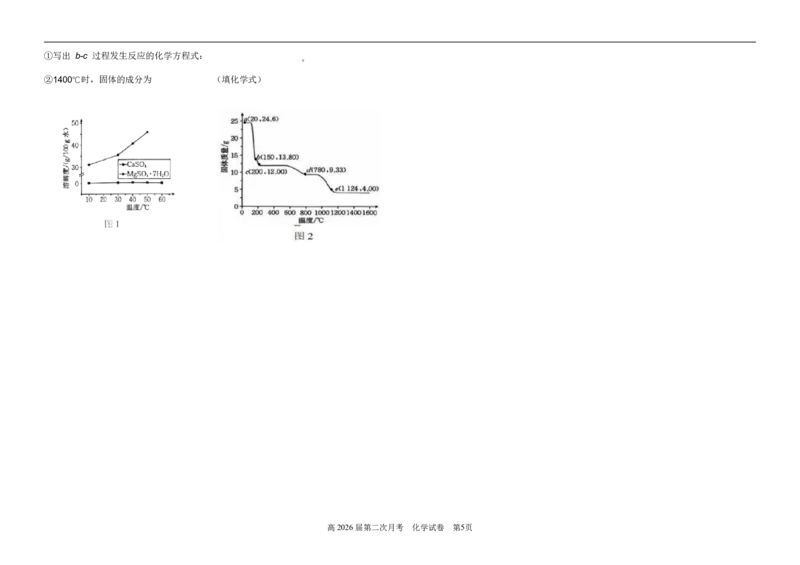
(4)已知 MgSO ·7H O、CaSO 两种物质的溶解度与温度的关系如图
4 2 4
1
(4)步骤ⅱ排滴定管气泡时,应选择图中的 (填字母)。
(5)MgSO
4
·7H
2
O [M(MgSO 4·7H
2
O)=246 g/mol ] 的热失重曲线如图 2 所示。
高2026届第二次月考 化学试卷 第4页①写出 b-c 过程发生反应的化学方程式: 。
②1400℃时,固体的成分为 (填化学式)
.
.
.
.
.
高2026届第二次月考 化学试卷 第5页