文档内容
大庆铁人中学2024级高二年级上学期期中考试
化学
2025.11
注意事项:
1.答题前,考生先将自己的姓名、班级、考场号/座位号填写在答题卡上,如有条形码,认
真核对条形码上的姓名、准考证号,并将条形码粘贴在答题卡的指定位置上。
2.选择题答案使用2B铅笔填涂,如需改动,用橡皮擦干净后,再选涂其它答案的标号;非
选择题答案使用0.5毫米黑色中性(签字)笔或碳素笔书写,字体工整,笔迹清楚。
3.请按照题号在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效。
4.保持卷面及答题卡清洁,不折叠,不破损,不准使用涂改液、修正带、刮纸刀。
一、选择题(本题共15小题,每小题3分,共45分,在每小题给出的四个选项中,只有一项符
合题目要求。)
1.下列化学用语正确的是
A.基态Al原子最高能级电子云轮廓图:
B.在电子云图中,用小黑点表示绕核做高速圆周运动的电子
C.总共含有3个能级的能层符号:L
D.基态Ti原子的轨道表示式为1s22s22p63s23p63d24s2
2.下列关于原子结构的说法不正确的是
A.基态Cr原子的电子排布式[Ar]3d54s1遵循能量最低原理
B.光是电子跃迁吸收能量的重要形式
C.基态C原子的轨道表示式为 ,违反了洪特规则
D.基态Sc原子的电子排布式1s22s22p63s23p9违反了泡利原理
3.下列电离方程式或离子方程式书写正确的是
A.NaHCO 溶液中的水解方程式:HCO+H O HO++CO
3 2 3
B.HSO 的电离方程式:HSO 2H++SO
2 3 2 3
C.用HS处理含Hg2+的废水:Hg2++S2-=HgS↓
2
D.加NaC O 实现沉淀转化:CaSO(s)+C O(aq) CaC O(s)+SO(aq)
2 2 4 4 2 2 4
4.化学是一门以实验为基础的学科,下列有关实验涉及的说法正确的是
大庆铁人中学2025届高二年级期中考试 第 1 页 共 7 页A.酸式滴定管使用前检查是否漏水的操作:关闭旋塞后加少量水,若旋塞处不漏水即可
B.制备氢氧化铁胶体实验涉及的图标有:
C.酸碱中和滴定接近终点时,使半滴溶液悬于管口,用锥形瓶内壁将其靠下来,并用蒸馏水
将其冲入锥形瓶内
D.pH试纸在使用时,一定不能润湿后使用
5.下列各组离子一定能大量共存的是
A. 的溶液:Cl-、Na+、Cu2+、K+
B.在澄清透明溶液中:Fe3+、SO、HCO、Na+
C.使甲基橙变红色的溶液:NH、Fe3+、[Al(OH) ]-、SiO
4
D.水电离出的c(H+)=1.0×10-12 mol·L-1的溶液中:NO、Fe2+、NH、Cl-
6.设N 为阿伏加德罗常数的值。下列说法错误的是
A
A.0.5 mol·L-1氨水中含有OH-的数目小于0.5N
A
B.标准状况下,Cl 与足量水充分反应,当生成1 molHCl时转移电子数为N
2 A
C.136 gCaSO 与KHSO 的固体混合物中含有的阳离子数目为N
4 4 A
D.1.0 LpH=1的HSO 溶液中H+的数目为0.1N
2 4 A
7.常温下,下列溶液中水电离出的c(H+)最大的是
A.pH=1的盐酸
B.pH=13的NaOH溶液
C.pH=7的NaCl溶液
D.pH=13的CHCOONa溶液
3
8.下列关于盐类水解的应用中,说法正确的是
A.用热的纯碱溶液洗去油污:加热有利于碳酸钠直接与油污反应
B.为除去CuCl 溶液中混有的Fe3+,可加入CuO调节pH
2
C.泡沫灭火器原理:3CO +2Al3++3H O=2Al(OH) ↓+3CO ↑
2 3 2
D.将硫酸铝溶液加热蒸干,灼烧,可以得到氧化铝固体
9.下列有关AgCl沉淀溶解平衡的说法中,正确的是
A.升高温度,AgCl沉淀的溶解度增大
大庆铁人中学2025届高二年级期中考试 第 2 页 共 7 页B.AgCl沉淀溶解达到平衡时,Ag+和Cl-浓度一定相等且保持不变
C.向AgCl饱和溶液中加水,AgCl的溶解度和K 均增大
sp
D.向AgCl悬浊液中加入NaCl固体,AgCl的溶解度增大
10.下列有关沉淀溶解平衡应用的说法错误的是
A.施加适量石膏降低盐碱地(含NaCO)土壤的碱性
2 3
B.用碳酸钠溶液使锅炉水垢中的CaSO 转化成疏松、易溶于酸的碳酸钙
4
C.误食可溶性钡盐可尽快用5%的NaCO 溶液洗胃
2 3
D.含氟牙膏能预防龋齿是因为发生了沉淀的转化反应
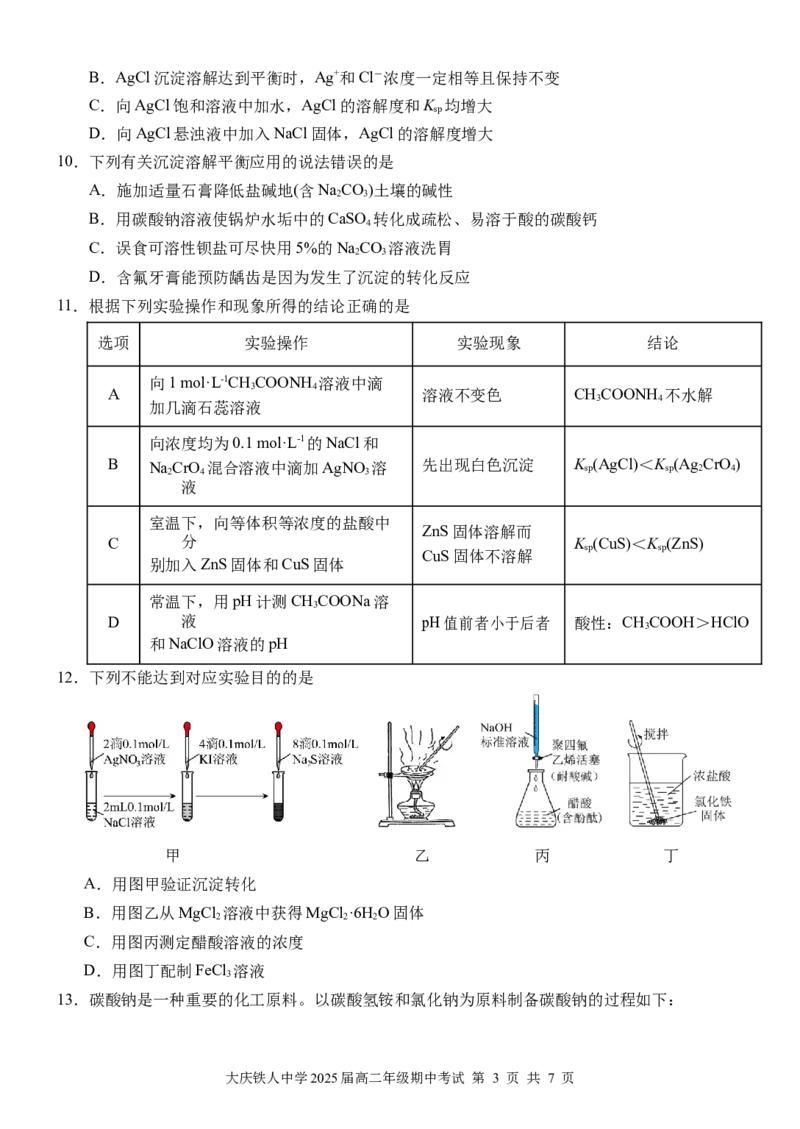
11.根据下列实验操作和现象所得的结论正确的是
选项 实验操作 实验现象 结论
向1 mol·L-1CHCOONH 溶液中滴
3 4
A 溶液不变色 CHCOONH 不水解
3 4
加几滴石蕊溶液
向浓度均为0.1 mol·L-1的NaCl和
B Na 2 CrO 4 混合溶液中滴加AgNO 3 溶 先出现白色沉淀 K sp (AgCl)<K sp (Ag 2 CrO 4 )
液
室温下,向等体积等浓度的盐酸中
ZnS固体溶解而
C 分 K (CuS)<K (ZnS)
sp sp
CuS固体不溶解
别加入ZnS固体和CuS固体
常温下,用pH计测CHCOONa溶
3
D 液 pH值前者小于后者 酸性:CHCOOH>HClO
3
和NaClO溶液的pH
12.下列不能达到对应实验目的的是
甲 乙 丙 丁
A.用图甲验证沉淀转化
B.用图乙从MgCl 溶液中获得MgCl ·6HO固体
2 2 2
C.用图丙测定醋酸溶液的浓度
D.用图丁配制FeCl 溶液
3
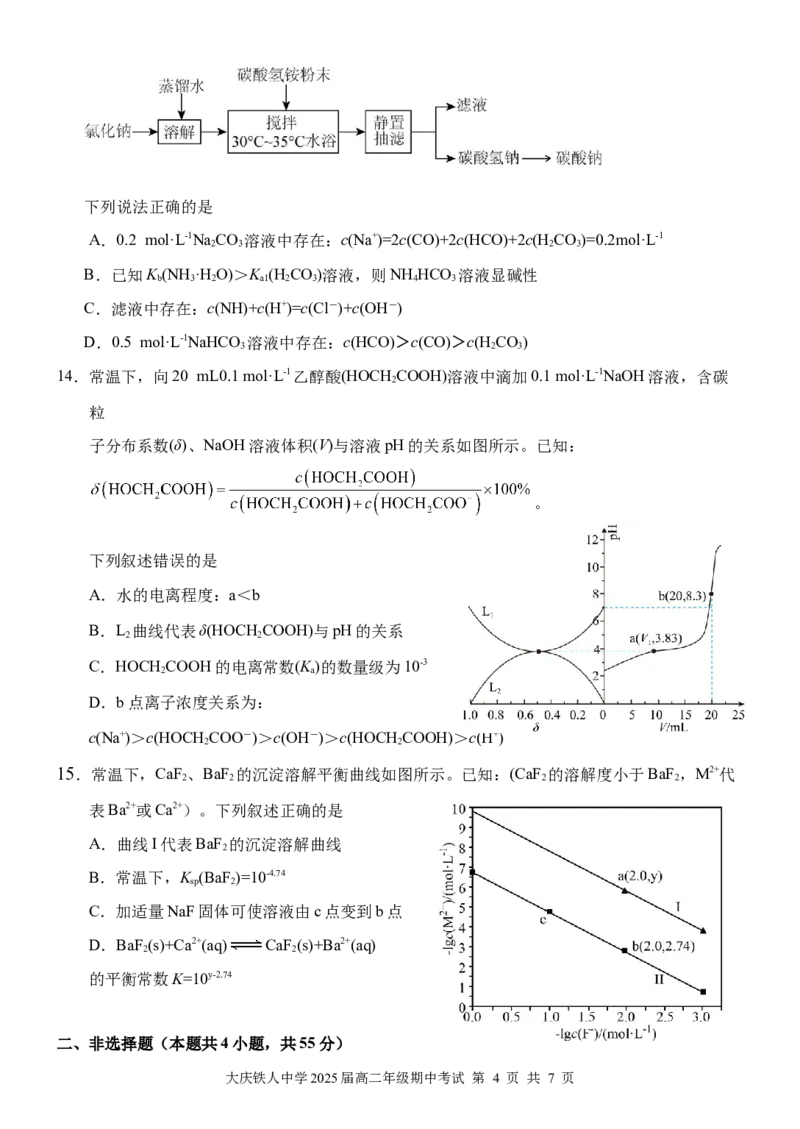
13.碳酸钠是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠的过程如下:
大庆铁人中学2025届高二年级期中考试 第 3 页 共 7 页下列说法正确的是
A.0.2 mol·L-1NaCO 溶液中存在:c(Na+)=2c(CO)+2c(HCO)+2c(HCO)=0.2mol·L-1
2 3 2 3
B.已知K (NH ·HO)>K (HCO)溶液,则NH HCO 溶液显碱性
b 3 2 a1 2 3 4 3
C.滤液中存在:c(NH)+c(H+)=c(Cl-)+c(OH-)
D.0.5 mol·L-1NaHCO 溶液中存在:c(HCO)>c(CO)>c(HCO)
3 2 3
14.常温下,向20 mL0.1 mol·L-1乙醇酸(HOCH COOH)溶液中滴加0.1 mol·L-1NaOH溶液,含碳
2
粒
子分布系数(δ)、NaOH溶液体积(V)与溶液pH的关系如图所示。已知:
。
下列叙述错误的是
A.水的电离程度:a<b
B.L 曲线代表δ(HOCHCOOH)与pH的关系
2 2
C.HOCH COOH的电离常数(K)的数量级为10-3
2 a
D.b点离子浓度关系为:
c(Na+)>c(HOCHCOO-)>c(OH-)>c(HOCHCOOH)>c(H+)
2 2
15.常温下,CaF 、BaF 的沉淀溶解平衡曲线如图所示。已知:(CaF 的溶解度小于BaF ,M2+代
2 2 2 2
表Ba2+或Ca2+)。下列叙述正确的是
A.曲线I代表BaF 的沉淀溶解曲线
2
B.常温下,K (BaF )=10-4.74
sp 2
C.加适量NaF固体可使溶液由c点变到b点
D.BaF (s)+Ca2+(aq) CaF (s)+Ba2+(aq)
2 2
的平衡常数K=10y-2.74
二、非选择题(本题共4小题,共55分)
大庆铁人中学2025届高二年级期中考试 第 4 页 共 7 页16.(14分)已知元素X、Y、Z、W为前四周期原子序数依次增大的元素,其原子结构相关信息如
下:
① X的基态原子核外有3个未成对电子,且电子占据的最高能级为2p。
② Y与X位于不同周期,且Y的基态原子中,s能级电子数等于p能级电子数。
③ Z的基态原子失去3个电子后3d轨道半充满。
④ W的基态原子最外层只有1个电子,且内层轨道全部充满。
根据以上信息回答下列问题:
(1)X的基态原子核外电子排布式为______,其轨道表示式中,空间运动状态不同的电子有
______种。
(2)Y的基态原子核外电子占据的最高能级的原子轨道的形状为______。
(3)Z的基态原子中,未成对电子数为______,该元素的符号为______。
(4)W的基态原子核外有______种不同能量的电子,其价层电子轨道表示式为__________。
17.(14分)盐类的水解在日常生活和工农业生产中有很重要的应用。根据所学知识,回答下列问
题:
(1)氟化钠溶液在实验室保存时使用 (“玻璃”或“塑料”)瓶。
(2)向盛有10 mL水的锥形瓶中滴加几滴亚硫酰氯(SOCl ),可观察到剧烈反应,液面上有白
2
雾形成,并有带刺激性气味的气体逸出,根据实验现象,写出 SOCl 与水反应的化学方程式
2
。将SOCl 与AlCl ·6H O混合加热,可得到无水
2 3 2
AlCl ,试用化学方程式解释原因: 。
3
(3)实验室配制SnCl 溶液时,取SnCl 粉末先溶于适量 中进行溶解,请用平衡移
2 2
动原理解释原因
[已知:SnCl 水解生成Sn(OH)Cl]。
2
(4)明矾可用于净水,原因是 (用离子方程式表
示)。
(5)同时对农作物施用含 N、P、K 的三种化肥,现有下列化肥:① KCO ② KCl
2 3
③Ca(HPO )
2 4 2
④(NH
4
)
2
SO
4
⑤NH
3
·H
2
O,其中最合理的组合方式是 (填序号)。
18.(14分)草酸晶体(H C O·2H O)在100 ℃时开始升华,157 ℃时大量升华并开始分解;草酸蒸气
2 2 4 2
能使澄清石灰水变浑浊,在低温下迅速冷凝为固体;草酸钙不溶于水。
Ⅰ.草酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO 和HO。
2 2
大庆铁人中学2025届高二年级期中考试 第 5 页 共 7 页(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:
浓硫酸 NaOH 澄清
溶液 石灰水
A B C D E F G
①装置的连接顺序为:A→D→B→G→____→___→C→G。
②B装置中冰水混合物的作用是 。
③整套装置存在不合理之处 。
Ⅱ.草酸的弱酸性:
(2)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的的是 。
A.草酸易溶于水,可以在水中电离出H+和C O
2
B.1 L 0.1 mol·L-1草酸溶液恰好与1 L 0.2 mol·L-1NaOH溶液中和
C.25 ℃时,pH=2的草酸溶液稀释至100倍后pH<4
D.将草酸溶液加入NaCO 溶液中,有CO 放出
2 3 2
Ⅲ.草酸的还原性:
(3)该小组同学向酸性KMnO 溶液中滴入过量的草酸溶液,发现酸性KMnO 溶液褪色,从而
4 4
判断草酸具有较强的还原性,利用该性质测草酸浓度。取草酸溶液置于锥形瓶中,加入适量
稀
硫酸,用浓度为0.1 mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
标准KMnO 溶液体积(mL)
4
滴定次数 待测液体积(mL)
滴定前读数 滴定后读数
第一次 25.00 0.50 20.40
第二次 25.00 3.00 23.00
第三次 25.00 1.00 22.50
第四次 25.00 4.00 24.10
①滴定时,KMnO 溶液应装在 式滴定管中,滴定终点时的现象是 。
4
②该草酸溶液的浓度为 。
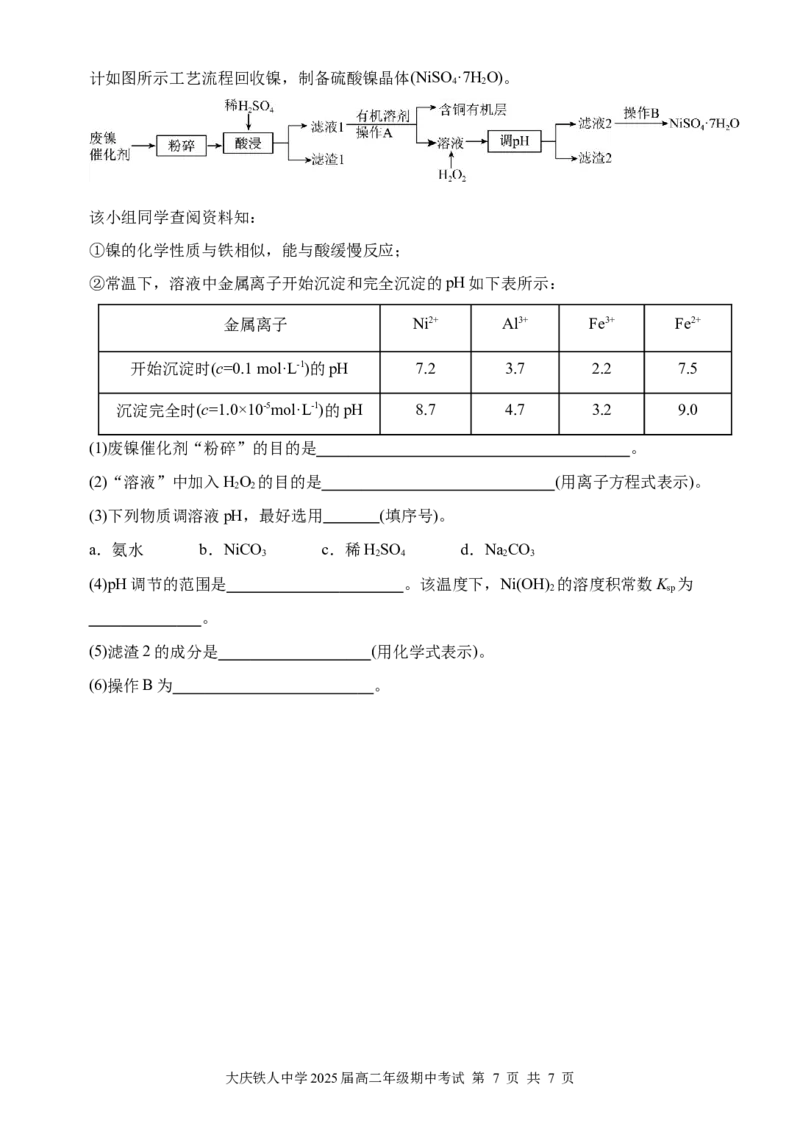
19.(13分)废镍催化剂主要含Ni,还有少量Cu、Fe、Al及其氧化物、SiO。某研究性学习小组设
2
大庆铁人中学2025届高二年级期中考试 第 6 页 共 7 页计如图所示工艺流程回收镍,制备硫酸镍晶体(NiSO ·7HO)。
4 2
该小组同学查阅资料知:
①镍的化学性质与铁相似,能与酸缓慢反应;
②常温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.1 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10-5mol·L-1)的pH 8.7 4.7 3.2 9.0
(1)废镍催化剂“粉碎”的目的是 。
(2)“溶液”中加入HO 的目的是 (用离子方程式表示)。
2 2
(3)下列物质调溶液pH,最好选用 (填序号)。
a.氨水 b.NiCO c.稀HSO d.NaCO
3 2 4 2 3
(4)pH调节的范围是 。该温度下,Ni(OH) 的溶度积常数K 为
2 sp
。
(5)滤渣2的成分是 (用化学式表示)。
(6)操作B为 。
大庆铁人中学2025届高二年级期中考试 第 7 页 共 7 页