文档内容
莆田第二十五中学 2023-2024 学年上学期期中考试卷
高三化学
考试时间:75分钟
一、选择题(每题4分,共10题,40分)
1. 化学与生活密切相关,下列说法正确的是
A. 苯甲酸钠可作为食品防腐剂是由于其具有酸性
B. 豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
C. SO 可用于丝织品漂白 是由于其能氧化丝织品中有色成分
2
D. 维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化
2. 藿香蓟具有清热解毒功效,其有效成分结构如右。下列有关该
物质的说法错误的是
A. 可以发生水解反应 B. 所有碳原子处于同一平面
C. 含有2种含氧官能团 D. 能与溴水发生加成反应
3.X、Y、Z、M是原子序数依次增大的短周期主族元素。X和M处于同一主族,Y原子的最外
层电子数为3,Z是非金属性最强的元素,X、Y和M可组成MYX 化合物,其结构如图所示。
4
下列说法错误的是( )
A.YZ 中每个原子最外层电子均达到8
3
B.MYX 能与H O发生氧化还原反应生成H
4 2 2
C.MX、XZ晶体中含有不同的化学键
D.原子半径由大到小顺序为M>Y>Z>X
4. 为阿伏加德罗常数的值。下列叙述正确的是
A. 异丁烷分子中共价键的数目为
B. 标准状况下, 中电子的数目为
C. 的 溶液中 的数目为
D. 的 溶液中 的数目为
5.下列根据实验操作和实验现象所得出的结论中,正确的是( )
选项 实验操作 现象 结论
25 ℃,分别测定等浓度的 K SO 、
2 3
A pH:K SO > KCl 非金属性:Cl>S
2 3
KCl溶液的pH
加热,铝片表面无明显
打磨后的铝片投入水中,加热至沸
B 现象;用光照射溶液 铝与热水发生了反应
腾。取出铝片,用一束光照射溶液
时,有一条光亮的“通
1
学科网(北京)股份有限公司路”
将木炭和浓硫酸共热生成的气体通
C 澄清石灰水变浑浊 该气体只含CO
2
入澄清石灰水中
向Cu(OH) 沉淀中分别滴加盐酸和氨
2
D 沉淀皆溶解 Cu(OH) 为两性氢氧化物
2
水
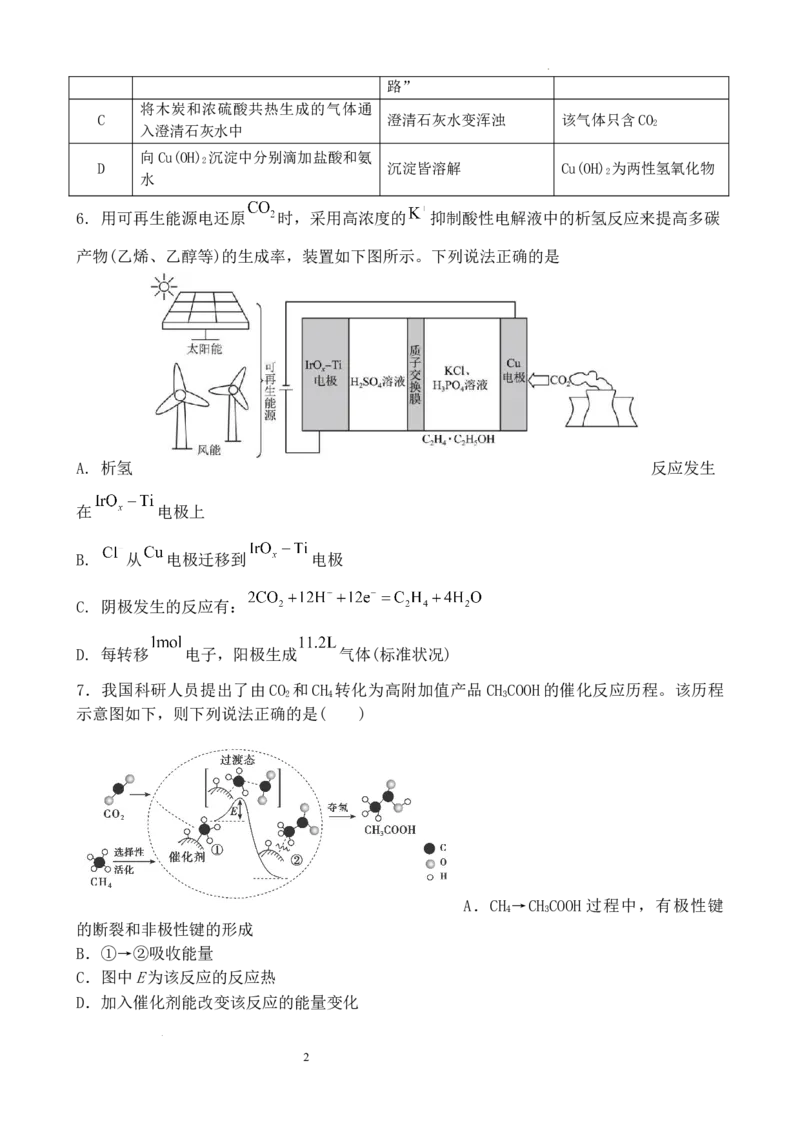
6. 用可再生能源电还原 时,采用高浓度的 抑制酸性电解液中的析氢反应来提高多碳
产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是
A. 析氢 反应发生
在 电极上
B. 从 电极迁移到 电极
C. 阴极发生的反应有:
D. 每转移 电子,阳极生成 气体(标准状况)
7.我国科研人员提出了由CO 和CH 转化为高附加值产品CH COOH的催化反应历程。该历程
2 4 3
示意图如下,则下列说法正确的是( )
A.CH →CH COOH 过程中,有极性键
4 3
的断裂和非极性键的形成
B.①→②吸收能量
C.图中E为该反应的反应热
D.加入催化剂能改变该反应的能量变化
2
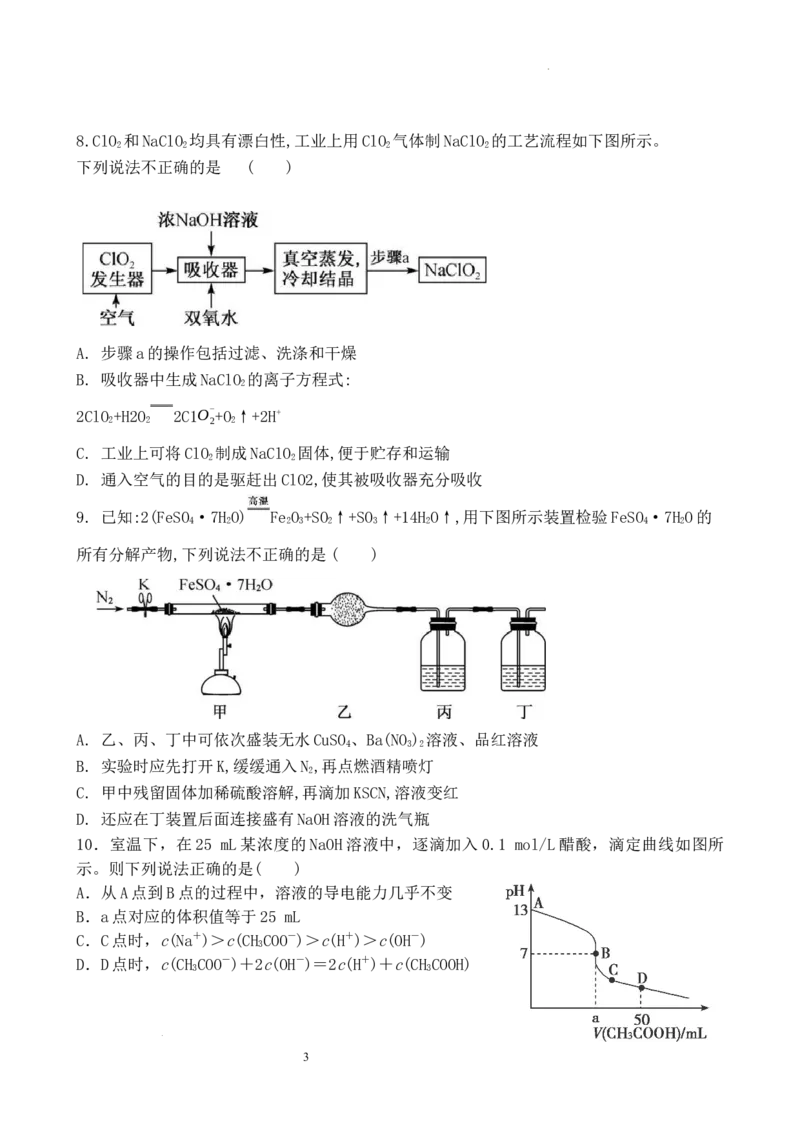
学科网(北京)股份有限公司8.ClO 和NaClO 均具有漂白性,工业上用ClO 气体制NaClO 的工艺流程如下图所示。
2 2 2 2
下列说法不正确的是 ( )
A. 步骤a的操作包括过滤、洗涤和干燥
B. 吸收器中生成NaClO 的离子方程式:
2
2ClO +H2O 2C1O- +O ↑+2H+
2 2 2 2
C. 工业上可将ClO 制成NaClO 固体,便于贮存和运输
2 2
D. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
9. 已知:2(FeSO ·7H O) Fe O +SO ↑+SO ↑+14H O↑,用下图所示装置检验FeSO ·7H O的
4 2 2 3 2 3 2 4 2
所有分解产物,下列说法不正确的是( )
A. 乙、丙、丁中可依次盛装无水CuSO 、Ba(NO ) 溶液、品红溶液
4 3 2
B. 实验时应先打开K,缓缓通入N ,再点燃酒精喷灯
2
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
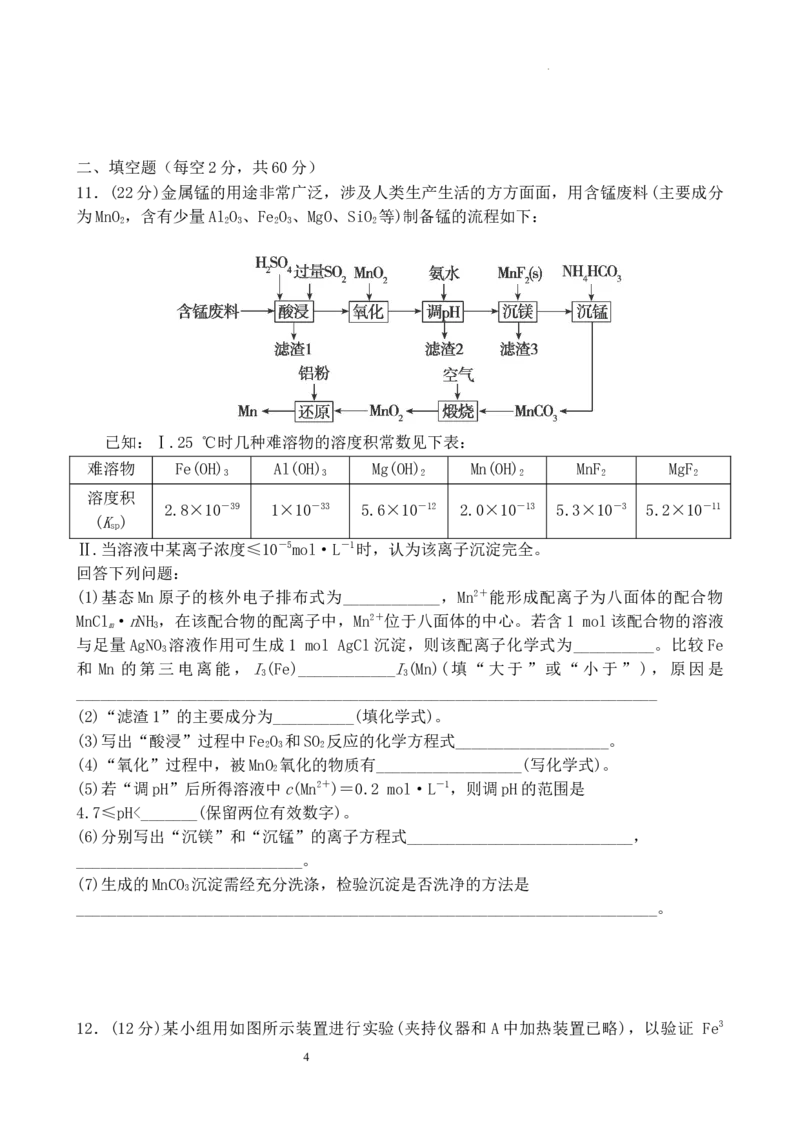
10.室温下,在25 mL某浓度的NaOH溶液中,逐滴加入0.1 mol/L醋酸,滴定曲线如图所
示。则下列说法正确的是( )
A.从A点到B点的过程中,溶液的导电能力几乎不变
B.a点对应的体积值等于25 mL
C.C点时,c(Na+)>c(CH COO-)>c(H+)>c(OH-)
3
D.D点时,c(CH COO-)+2c(OH-)=2c(H+)+c(CH COOH)
3 3
3
学科网(北京)股份有限公司二、填空题(每空2分,共60分)
11.(22分)金属锰的用途非常广泛,涉及人类生产生活的方方面面,用含锰废料(主要成分
为MnO ,含有少量Al O 、Fe O 、MgO、SiO 等)制备锰的流程如下:
2 2 3 2 3 2
已知:Ⅰ.25 ℃时几种难溶物的溶度积常数见下表:
难溶物 Fe(OH) Al(OH) Mg(OH) Mn(OH) MnF MgF
3 3 2 2 2 2
溶度积
2.8×10-39 1×10-33 5.6×10-12 2.0×10-13 5.3×10-3 5.2×10-11
(K )
sp
Ⅱ.当溶液中某离子浓度≤10-5mol·L-1时,认为该离子沉淀完全。
回答下列问题:
(1)基态Mn原子的核外电子排布式为____________,Mn2+能形成配离子为八面体的配合物
MnCl ·nNH ,在该配合物的配离子中,Mn2+位于八面体的中心。若含1 mol该配合物的溶液
m 3
与足量AgNO 溶液作用可生成 1 mol AgCl沉淀,则该配离子化学式为__________。比较Fe
3
和 Mn 的第三电离能,I(Fe)____________I(Mn)(填“大于”或“小于”),原因是
3 3
________________________________________________________________________
(2)“滤渣1”的主要成分为__________(填化学式)。
(3)写出“酸浸”过程中Fe O 和SO 反应的化学方程式___________________。
2 3 2
(4)“氧化”过程中,被MnO 氧化的物质有__________________(写化学式)。
2
(5)若“调pH”后所得溶液中c(Mn2+)=0.2 mol·L-1,则调pH的范围是
4.7≤pH<_______(保留两位有效数字)。
(6)分别写出“沉镁”和“沉锰”的离子方程式____________________________,
____________________________。
(7)生成的MnCO 沉淀需经充分洗涤,检验沉淀是否洗净的方法是
3
________________________________________________________________________。
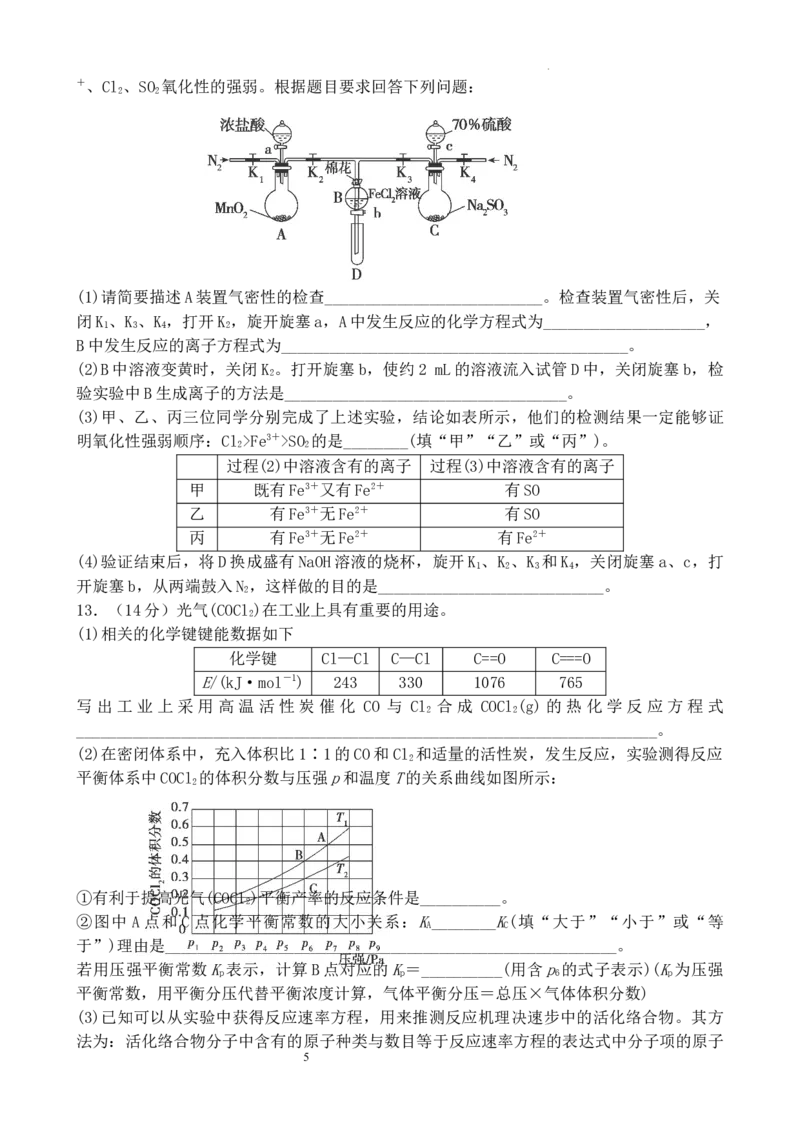
12.(12分)某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略),以验证 Fe3
4
学科网(北京)股份有限公司+、Cl 、SO 氧化性的强弱。根据题目要求回答下列问题:
2 2
(1)请简要描述A装置气密性的检查___________________________。检查装置气密性后,关
闭K 、K 、K ,打开K ,旋开旋塞a,A中发生反应的化学方程式为____________________,
1 3 4 2
B中发生反应的离子方程式为___________________________________________。
(2)B中溶液变黄时,关闭K 。打开旋塞b,使约2 mL的溶液流入试管D中,关闭旋塞b,检
2
验实验中B生成离子的方法是___________________________________。
(3)甲、乙、丙三位同学分别完成了上述实验,结论如表所示,他们的检测结果一定能够证
明氧化性强弱顺序:Cl >Fe3+>SO 的是________(填“甲”“乙”或“丙”)。
2 2
过程(2)中溶液含有的离子 过程(3)中溶液含有的离子
甲 既有Fe3+又有Fe2+ 有SO
乙 有Fe3+无Fe2+ 有SO
丙 有Fe3+无Fe2+ 有Fe2+
(4)验证结束后,将D换成盛有NaOH溶液的烧杯,旋开K 、K 、K 和K ,关闭旋塞a、c,打
1 2 3 4
开旋塞b,从两端鼓入N ,这样做的目的是____________________________。
2
13.(14分)光气(COCl )在工业上具有重要的用途。
2
(1)相关的化学键键能数据如下
化学键 Cl—Cl C—Cl C==O C===O
E/(kJ·mol-1) 243 330 1076 765
写 出 工 业 上 采 用 高 温 活 性 炭 催 化 CO 与 Cl 合 成 COCl (g) 的 热 化 学 反 应 方 程 式
2 2
________________________________________________________________________。
(2)在密闭体系中,充入体积比1∶1的CO和Cl 和适量的活性炭,发生反应,实验测得反应
2
平衡体系中COCl 的体积分数与压强p和温度T的关系曲线如图所示:
2
①有利于提高光气(COCl )平衡产率的反应条件是__________。
2
②图中 A 点和 C 点化学平衡常数的大小关系:K________K(填“大于”“小于”或“等
A C
于”)理由是________________________________________________________。
若用压强平衡常数K表示,计算B点对应的K=__________(用含p的式子表示)(K为压强
p p 6 p
平衡常数,用平衡分压代替平衡浓度计算,气体平衡分压=总压×气体体积分数)
(3)已知可以从实验中获得反应速率方程,用来推测反应机理决速步中的活化络合物。其方
法为:活化络合物分子中含有的原子种类与数目等于反应速率方程的表达式中分子项的原子
5
学科网(北京)股份有限公司数目减去分母项的原子数目。例如:以H +Cl ===2HCl的历程为例,其反应速率方程为:v
2 2
=kc(Cl )c(H ),可推测反应决速步中活化络合物的可能存在形式为 ClH 或H Cl或者H +
2 2 2 2 2
Cl。
Cl ===2Cl 反应Ⅰ
2
Cl+CO===COCl 反应Ⅱ
COCl+Cl ===COCl +Cl 反应Ⅲ
2 2
①该反应的活化络合物应为__________。
②CO与Cl 合成COCl 的决速步为__________(“反应Ⅰ”“反应Ⅱ”或“反应Ⅲ”)
2 2
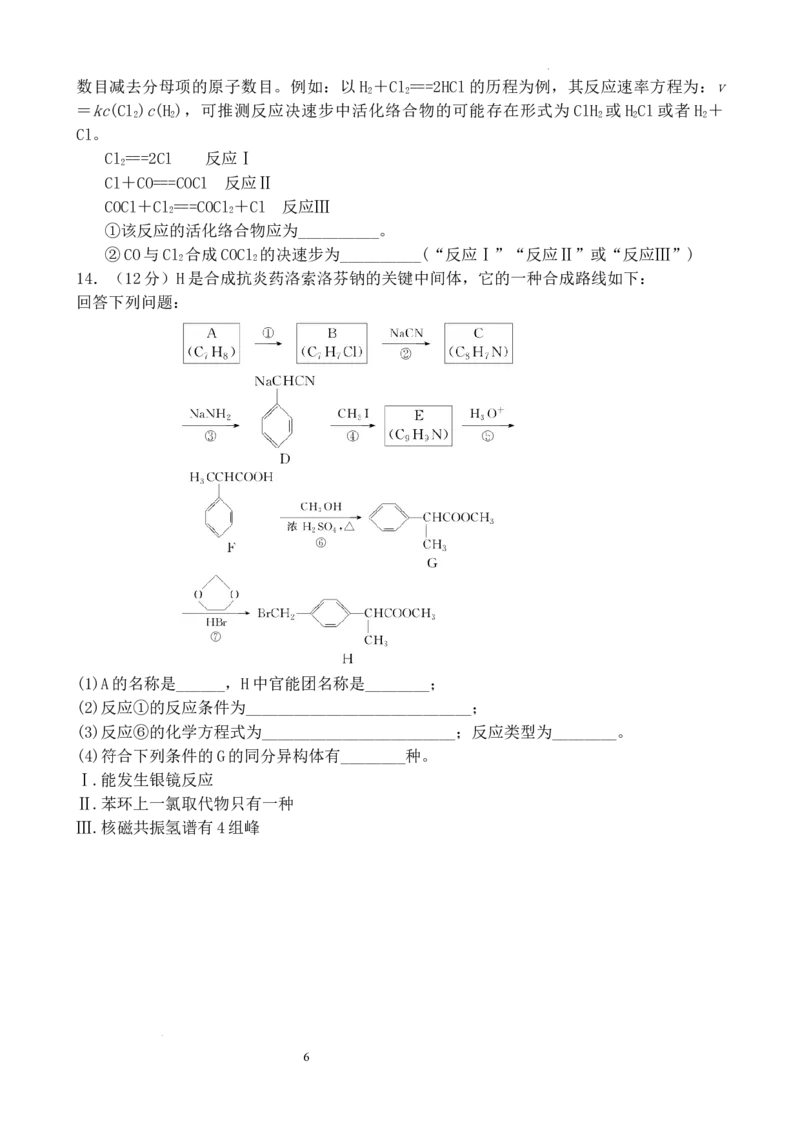
14.(12分)H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
回答下列问题:
(1)A的名称是______,H中官能团名称是________;
(2)反应①的反应条件为____________________________;
(3)反应⑥的化学方程式为________________________;反应类型为________。
(4)符合下列条件的G的同分异构体有________种。
Ⅰ.能发生银镜反应
Ⅱ.苯环上一氯取代物只有一种
Ⅲ.核磁共振氢谱有4组峰
6
学科网(北京)股份有限公司