文档内容
高二年级七月份考试
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版必修第一册第一章至第二章。
5.可能用到的相对原子质量:H 1 Li 7 C 12 O 16 S 32 Ca 40 Fe 56
Cu 64 I 127 Ba 137
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.燕赵大地历史悠久,文化灿烂。下列有关博物馆馆藏文物的说法错误的是( )
A.石质浮雕的主要成分是碳酸钙,碳酸钙属于钙盐
B.透雕白玉壁的主要成分是硅酸盐,常温下, 易溶于水
C.青花釉里红瓷盖罐的主要成分是硅酸盐,硅酸钠的电离方程式为
D.青铜铺首的主要成分是铜锡合金,直径为50nm的铜粉形成的分散系,可产生丁达尔效应
2.下列表述正确的是( )
A.金属锂通常保存在煤油中
B.可用如图所示装置来制备
C.浓盐酸具有腐蚀性和挥发性,使用时应注意防护和通风
D.为了加快 在水中的溶解速率,可用铝棒搅拌
3.在同一溶液中,下列离子能大量共存的是( )
A. 、 、 、 B. 、 、 、C. 、 、 、 D. 、 、 、
4.超氧化钾( )可用作潜水或航天装置的 吸收剂和氧化剂,反应为
, 为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下, 所含的质子总数为
B. 的 溶液中,所含的 数为
C.等物质的量的 和 ,所含的氧原子数均为
D.常温下, 与足量的 反应,可生成
5. 是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:
。下列说法正确的是( )
A.金刚石与石墨互为同位素
B. 可用作制冷剂,也可用于人工降雨
C.题述反应中,氧化产物与还原产物的物质的量之比为1:1
D.题述反应中,每转移0.8mol电子,消耗氧化剂的物质的量为0.1mol
6.图示装置不能完成相应气体的发生和收集实验的是(加热、除杂和尾气处理装置任选)( )
选项 气体 试剂
A
固体+浓盐酸
B
固体+ 固体
C 粒+稀硫酸
D 固体+浓硫酸
7.侯氏制碱法工艺流程中的主要反应为 ,下列说法错误的是( )
A. 属于酸性氧化物
B. 灼烧时发出黄色的火焰
C.稳定性:
D. 的盐酸能使紫色石蕊试液变红
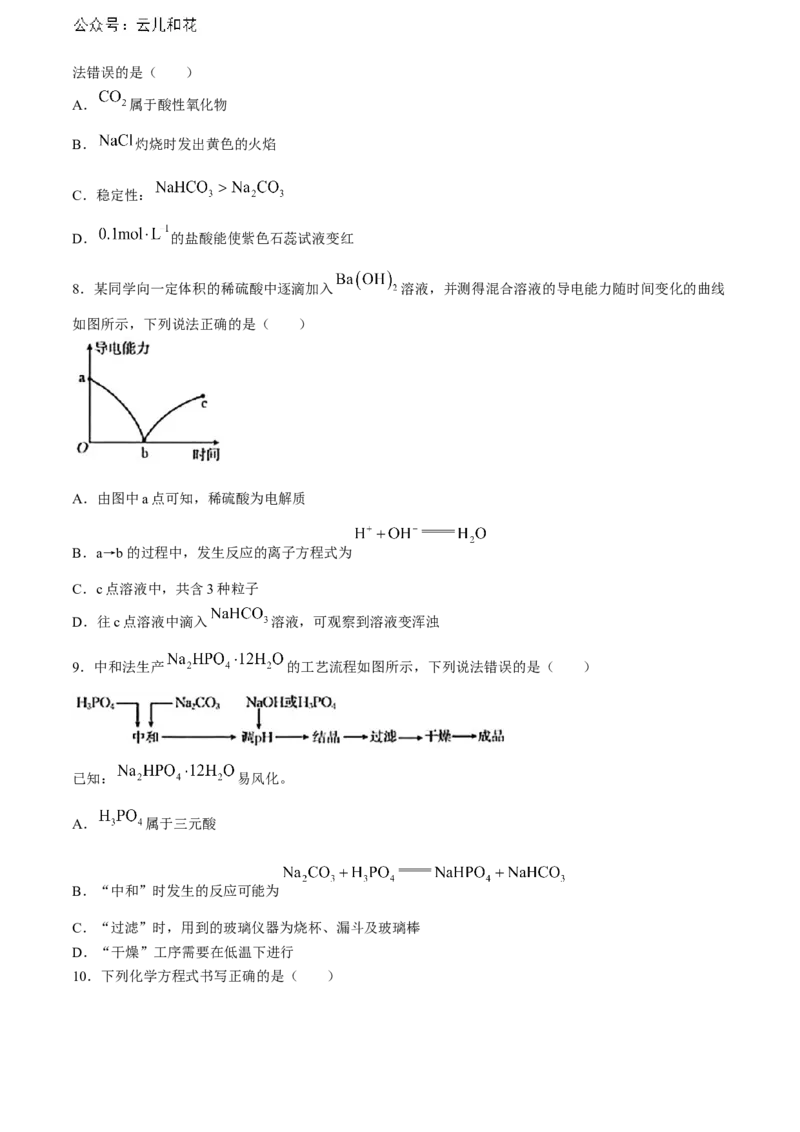
8.某同学向一定体积的稀硫酸中逐滴加入 溶液,并测得混合溶液的导电能力随时间变化的曲线
如图所示,下列说法正确的是( )
A.由图中a点可知,稀硫酸为电解质
B.a→b的过程中,发生反应的离子方程式为
C.c点溶液中,共含3种粒子
D.往c点溶液中滴入 溶液,可观察到溶液变浑浊
9.中和法生产 的工艺流程如图所示,下列说法错误的是( )
已知: 易风化。
A. 属于三元酸
B.“中和”时发生的反应可能为
C.“过滤”时,用到的玻璃仪器为烧杯、漏斗及玻璃棒
D.“干燥”工序需要在低温下进行
10.下列化学方程式书写正确的是( )A.少量的稀盐酸滴入 溶液中:
B.少量 通入 溶液中:
C.少量 通入澄清石灰水中:
D.少量 通入氯化亚铁溶液中:
eNH
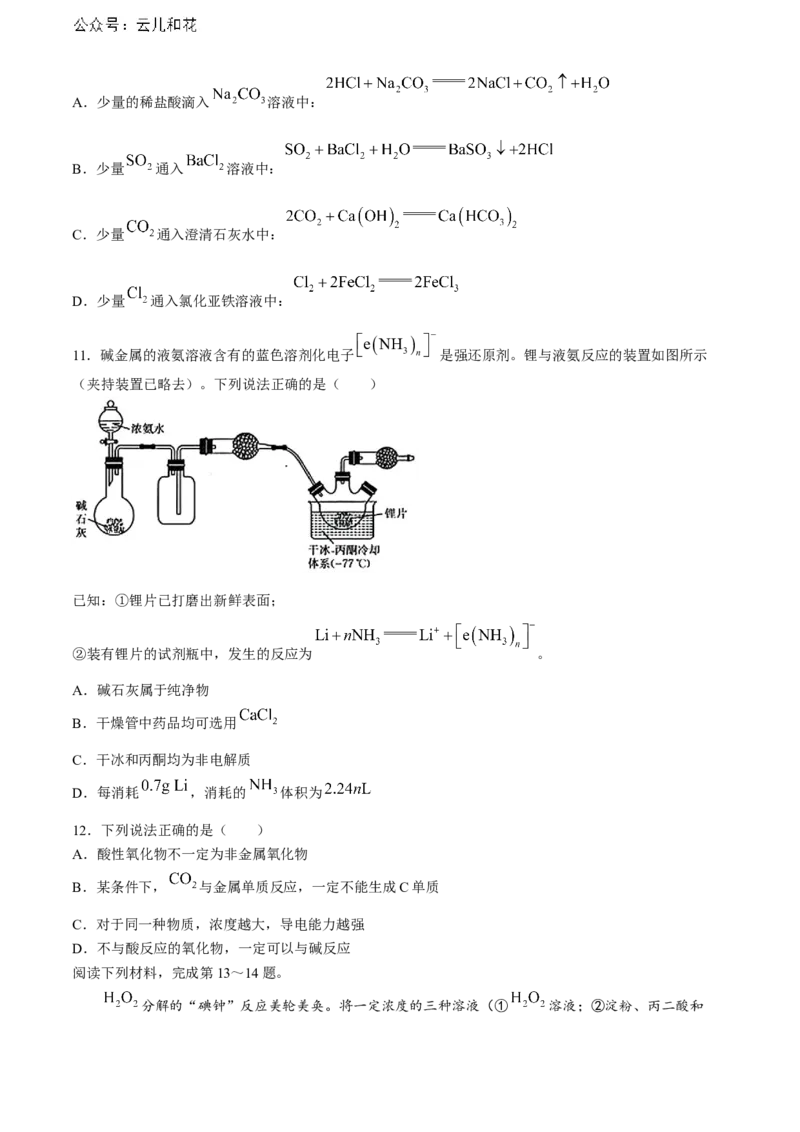
11.碱金属的液氨溶液含有的蓝色溶剂化电子 3 n 是强还原剂。锂与液氨反应的装置如图所示
(夹持装置已略去)。下列说法正确的是( )
已知:①锂片已打磨出新鲜表面;
②装有锂片的试剂瓶中,发生的反应为 。
A.碱石灰属于纯净物
B.干燥管中药品均可选用
C.干冰和丙酮均为非电解质
D.每消耗 ,消耗的 体积为
12.下列说法正确的是( )
A.酸性氧化物不一定为非金属氧化物
B.某条件下, 与金属单质反应,一定不能生成C单质
C.对于同一种物质,浓度越大,导电能力越强
D.不与酸反应的氧化物,一定可以与碱反应
阅读下列材料,完成第13~14题。
分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(① 溶液;②淀粉、丙二酸和溶液;③ 和稀硫酸)混合,溶液颜色在无色和蓝色之间来回变化,周期性变色;几分钟后,
稳定为蓝色。
13.下列说法错误的是( )
A.生活中, 溶液常用作消毒剂
B.食用加碘盐中,所加的“碘”为
C.溶液混合过程中,一定有 的生成
D. 在上述反应的过程中,只体现了还原性
14.查阅资料可知,丙二酸在溶液混合过程中,会生成 ,下列说法正确的是( )
A.酸性:乙二酸>丙二酸
B. 的摩尔质量为186
C.丙二酸的电离方程式为
D.往 溶液中滴入 ,可观察到有淡黄色沉淀产生
二、非选择题:本题共4小题,共58分。
15.(15分)工业上制取 一般不采用 与 反应,主要采用电解饱和食盐水的方法,过去
也曾采用 与 反应的方法。回答下列问题:
(1) 与 反应的化学方程式为_________。
(2)电解饱和食盐水时,反应方程式为 :
①纯净的 在 中安静地燃烧,发出_________火焰,该反应中的氧化剂为_________(填化学名称)。
②对于反应 ,该反应的离子方程式为_________。
③实验室制氯气时,常用 溶液来吸收尾气中的氯气,若发生的反应为
,则该反应中氧化产物与还原产物的物质的量之比为
_________。(3) 的俗名为_________,其电离方程式为_________。
(4) 在农业上的用途为_________。
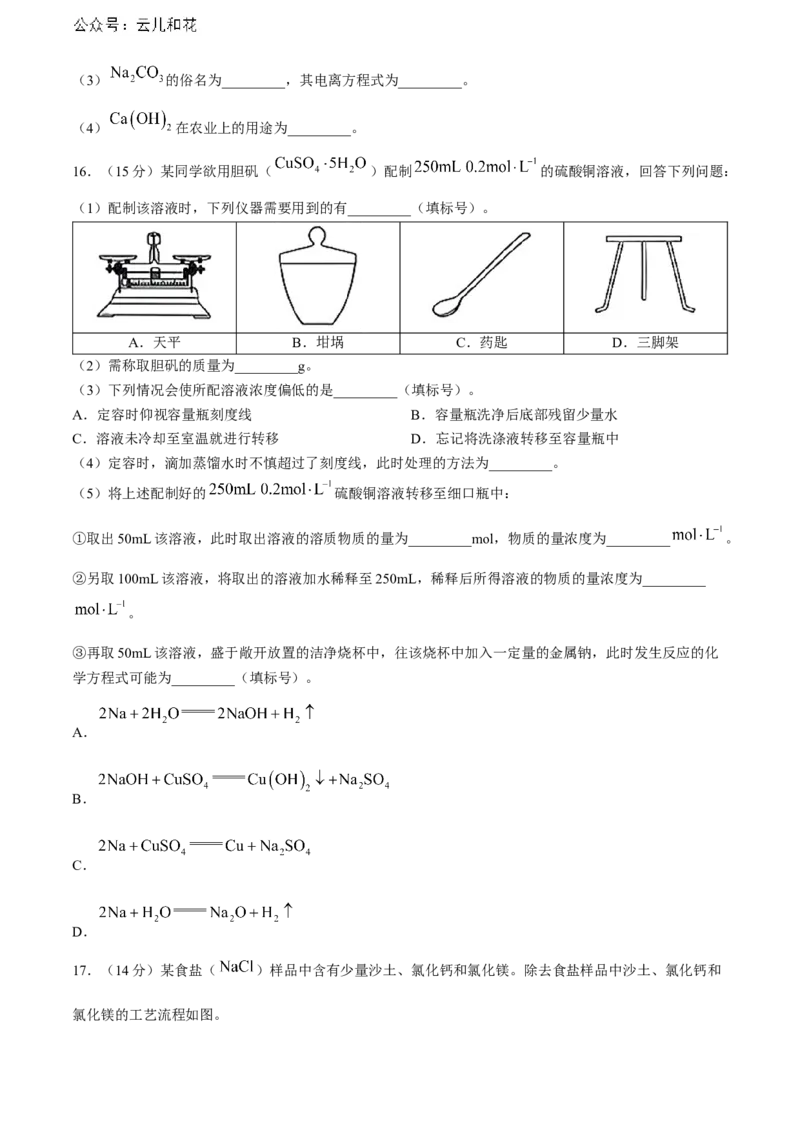
16.(15分)某同学欲用胆矾( )配制 的硫酸铜溶液,回答下列问题:
(1)配制该溶液时,下列仪器需要用到的有_________(填标号)。
A.天平 B.坩埚 C.药匙 D.三脚架
(2)需称取胆矾的质量为_________g。
(3)下列情况会使所配溶液浓度偏低的是_________(填标号)。
A.定容时仰视容量瓶刻度线 B.容量瓶洗净后底部残留少量水
C.溶液未冷却至室温就进行转移 D.忘记将洗涤液转移至容量瓶中
(4)定容时,滴加蒸馏水时不慎超过了刻度线,此时处理的方法为_________。
(5)将上述配制好的 硫酸铜溶液转移至细口瓶中:
①取出50mL该溶液,此时取出溶液的溶质物质的量为_________mol,物质的量浓度为_________ 。
②另取100mL该溶液,将取出的溶液加水稀释至250mL,稀释后所得溶液的物质的量浓度为_________
。
③再取50mL该溶液,盛于敞开放置的洁净烧杯中,往该烧杯中加入一定量的金属钠,此时发生反应的化
学方程式可能为_________(填标号)。
A.
B.
C.
D.
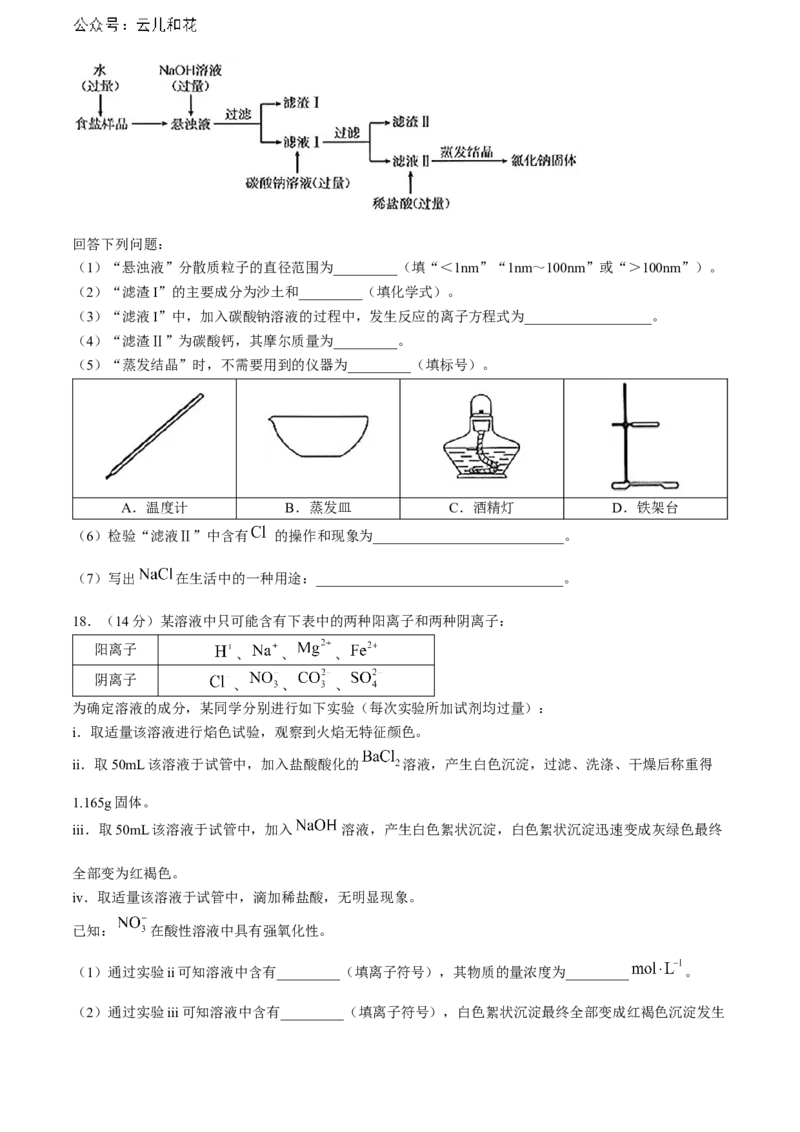
17.(14分)某食盐( )样品中含有少量沙土、氯化钙和氯化镁。除去食盐样品中沙土、氯化钙和
氯化镁的工艺流程如图。回答下列问题:
(1)“悬浊液”分散质粒子的直径范围为_________(填“<1nm”“1nm~100nm”或“>100nm”)。
(2)“滤渣I”的主要成分为沙土和_________(填化学式)。
(3)“滤液I”中,加入碳酸钠溶液的过程中,发生反应的离子方程式为__________________。
(4)“滤渣Ⅱ”为碳酸钙,其摩尔质量为_________。
(5)“蒸发结晶”时,不需要用到的仪器为_________(填标号)。
A.温度计 B.蒸发皿 C.酒精灯 D.铁架台
(6)检验“滤液Ⅱ”中含有 的操作和现象为___________________________。
(7)写出 在生活中的一种用途:___________________________________。
18.(14分)某溶液中只可能含有下表中的两种阳离子和两种阴离子:
阳离子
、 、 、
阴离子
、 、 、
为确定溶液的成分,某同学分别进行如下实验(每次实验所加试剂均过量):
i.取适量该溶液进行焰色试验,观察到火焰无特征颜色。
ii.取50mL该溶液于试管中,加入盐酸酸化的 溶液,产生白色沉淀,过滤、洗涤、干燥后称重得
1.165g固体。
iii.取50mL该溶液于试管中,加入 溶液,产生白色絮状沉淀,白色絮状沉淀迅速变成灰绿色最终
全部变为红褐色。
iv.取适量该溶液于试管中,滴加稀盐酸,无明显现象。
已知: 在酸性溶液中具有强氧化性。
(1)通过实验ii可知溶液中含有_________(填离子符号),其物质的量浓度为_________ 。
(2)通过实验iii可知溶液中含有_________(填离子符号),白色絮状沉淀最终全部变成红褐色沉淀发生反应的化学方程式为_____________________________________________。
(3)该同学通过实验iv推测溶液中一定不含有 ,理由是__________________。
(4)综合分析,该溶液中含有的离子为_________(填离子符号);该同学将实验iii所得的红褐色沉淀过
滤、洗涤、常温干燥,称重得固体质量为2.14g,若将2.14g该固体充分加热,则最终所得固体的质量为
_________g。
化学参考答案
1.B 2.C 3.D 4.A 5.D 6.B 7.C 8.D 9.B 10.D
11.C 12.A 13.D 14.A
15.(1) (2分)
(2)①苍白色(2分);氯气(2分)
② (2分)
③1:5(2分)
(3)苏打(或纯碱,1分); (2分)
(4)改良酸性土壤(或其他合理答案,2分)
16.(1)AC(2分) (2)12.5(2分) (3)AD(2分)
(4)重新配制(2分)
(5)①0.01(1分);0.2(2分) ②0.08(2分) ③AB(2分)
17.(1)>100nm(2分)
(2) 和 [少写 不扣分,2分]
(3) (2分)
(4) (2分)
(5)A(2分)
(6)取少许“滤液Ⅱ”中的上层清液,加入适量的稀硝酸,再向其中滴入 溶液,出现白色沉淀,
则有 ,反之,则无(2分)
(7)作厨房调味品或用于腌制腊肉(或其他合理答案,2分)
18.(1) (2分);0.1(2分)(2) (2分); (2分)
(3)若含有 ,加入稀盐酸后会将 氧化成 ,会有明显的颜色变化(答案合理即可,2分)
(4) 、 、 、 (2分);1.6(2分)