文档内容
2026 届高二年级 TOP 二十名校 5 月调研考试化学
可能用到的相对原子质量:H 1 C 12 O 16 Zn 65 Ag 108
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的)
1.“文物凝岁月精魂,文化铸文明根脉”。下列相关叙述正确的是( )
A.修复古文物所用的熟石膏是CaO
B.清朝康熙青花山水图瓷制笔筒的材质是硅酸盐
C.绢(蚕丝)画是古代重要的绘画形式,绢的主要成分是纤维素
D.石绿是重要的颜料,其成分中的 属于碱
2.下列化学用语或图示表述错误的是( )
A. 的电子式:
B.异丙基的结构简式:
C. 的化学名称:1,2, 三甲基苯
D.聚丙烯腈的结构简式:
3.“光荣属于劳动者,幸福属于劳动者”。下列劳动项目与所述化学知识没有关联的是( )
选 劳动项目 化学知识
项
A 利用铝热反应焊接铁轨 铝与氧化铁反应生成铁并放出大量热
B 用苯酚水溶液进行环境消毒 苯酚易溶于水
C 施肥时铵态氮肥和草木灰不能同时使用
碱性条件下 会转化为氨气而损失
D 我国科学家首次由石墨合成六方金刚石 同素异形体之间的转化
A.A B.B C.C D.D
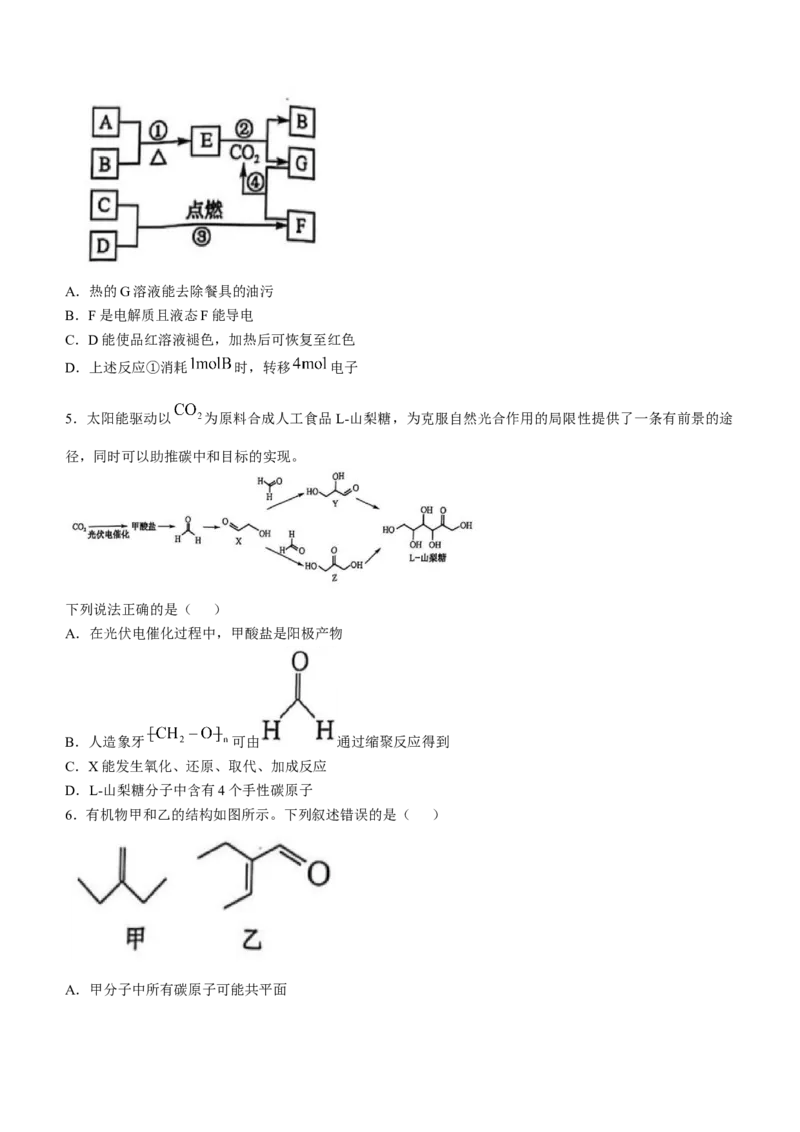
4.部分短周期元素的常见单质及化合物(或其溶液)的转化关系如图所示(部分反应物与生成物已省略)。
其中A是金属单质,通常状况下B、C、D均是气态非金属单质,G的焰色呈黄色,D能使品红溶液褪色。下
列叙述正确的是( )A.热的G溶液能去除餐具的油污
B.F是电解质且液态F能导电
C.D能使品红溶液褪色,加热后可恢复至红色
D.上述反应①消耗 时,转移 电子
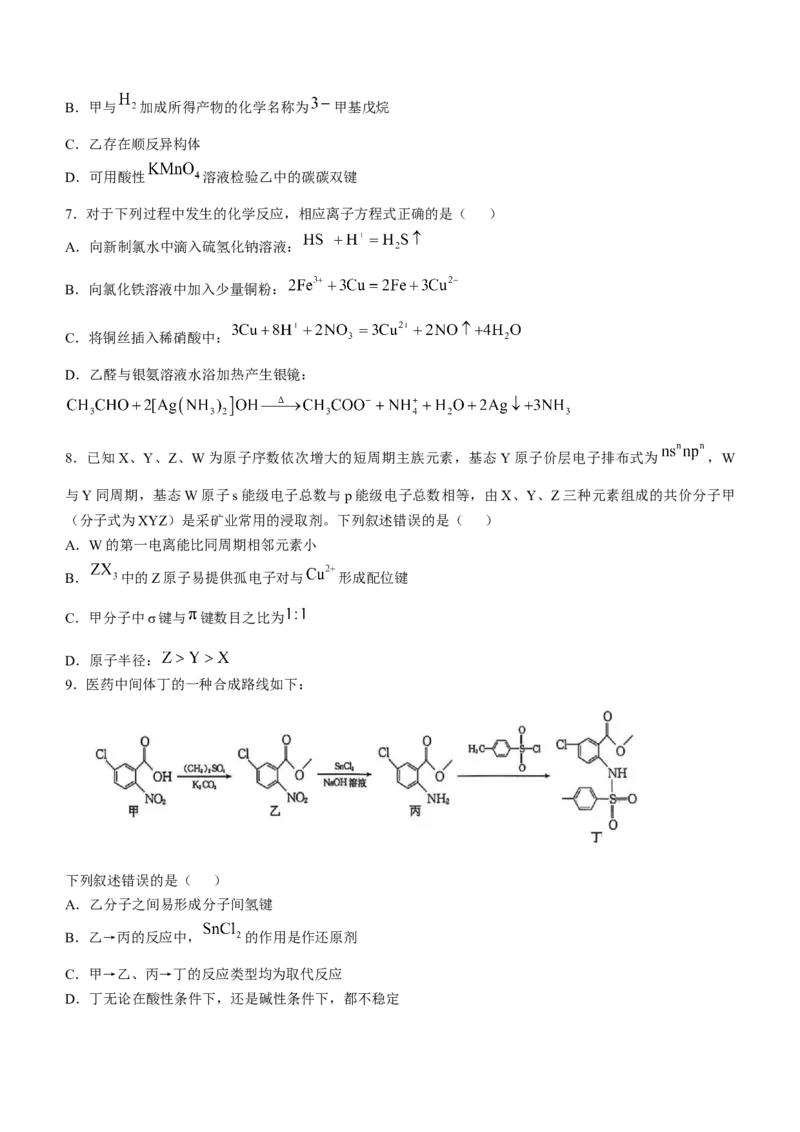
5.太阳能驱动以 为原料合成人工食品L-山梨糖,为克服自然光合作用的局限性提供了一条有前景的途
径,同时可以助推碳中和目标的实现。
下列说法正确的是( )
A.在光伏电催化过程中,甲酸盐是阳极产物
B.人造象牙 可由 通过缩聚反应得到
C.X能发生氧化、还原、取代、加成反应
D.L-山梨糖分子中含有4个手性碳原子
6.有机物甲和乙的结构如图所示。下列叙述错误的是( )
A.甲分子中所有碳原子可能共平面B.甲与 加成所得产物的化学名称为 甲基戊烷
C.乙存在顺反异构体
D.可用酸性 溶液检验乙中的碳碳双键
7.对于下列过程中发生的化学反应,相应离子方程式正确的是( )
A.向新制氯水中滴入硫氢化钠溶液:
B.向氯化铁溶液中加入少量铜粉:
C.将铜丝插入稀硝酸中:
D.乙醛与银氨溶液水浴加热产生银镜:
8.已知X、Y、Z、W为原子序数依次增大的短周期主族元素,基态Y原子价层电子排布式为 ,W
与Y同周期,基态W原子s能级电子总数与p能级电子总数相等,由X、Y、Z三种元素组成的共价分子甲
(分子式为XYZ)是采矿业常用的浸取剂。下列叙述错误的是( )
A.W的第一电离能比同周期相邻元素小
B. 中的Z原子易提供孤电子对与 形成配位键
C.甲分子中σ键与 键数目之比为
D.原子半径:
9.医药中间体丁的一种合成路线如下:
下列叙述错误的是( )
A.乙分子之间易形成分子间氢键
B.乙→丙的反应中, 的作用是作还原剂
C.甲→乙、丙→丁的反应类型均为取代反应
D.丁无论在酸性条件下,还是碱性条件下,都不稳定10.氨硼烷(分子式: ,熔点:104.7℃)是一种新型的储氢材料,具有超高的质量储氢密度,其
合成方法之一为 。 的晶胞结构
与参数如图所示.下列叙述正确的是( )
A. 的晶体类型为共价晶体
B. 与 的VSEPR模型不同
C. 晶体中 的配位数为8
D. 组成元素的电负性:
11.化学变化一定伴随着能量变化。下列有关说法中正确的是( )
A.将 盐酸滴入 溶液中测定中和反应反应热
B.反应 的 数值等于 的燃烧热
C.工业制取粗硅时,加入过量焦炭使 与C反应生成CO的目的之一是增大反应的
D.由于 ,工业合成氨时,降低反应温度一定有利于提高单位时间内
的产率
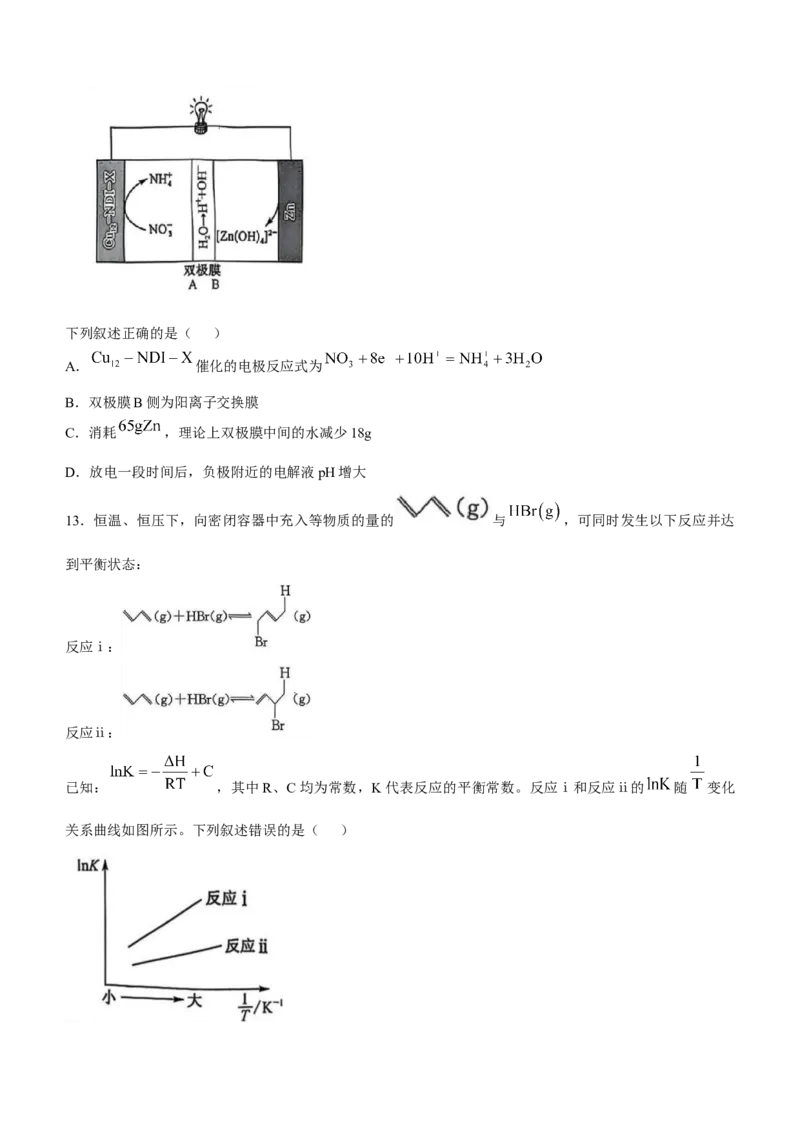
12.以 为催化剂的 电池具有较高的产铵率和长期的稳定性,其原理示意图如下
[双极膜(膜A、膜B)中间层中的 可解离为 和 ]:下列叙述正确的是( )
A. 催化的电极反应式为
B.双极膜B侧为阳离子交换膜
C.消耗 ,理论上双极膜中间的水减少18g
D.放电一段时间后,负极附近的电解液pH增大
13.恒温、恒压下,向密闭容器中充入等物质的量的 与 ,可同时发生以下反应并达
到平衡状态:
反应ⅰ:
反应ⅱ:
已知: ,其中R、C均为常数,K代表反应的平衡常数。反应ⅰ和反应ⅱ的 随 变化
关系曲线如图所示。下列叙述错误的是( )A.反应ⅰ和反应ⅱ均为放热反应
B.相同条件下, 比 稳定
C.保持温度不变,再向平衡体系中充入少量 , 的平衡转化率减小
D.保持容器容积不变,升高温度,平衡体系n( )/n( )比值不变
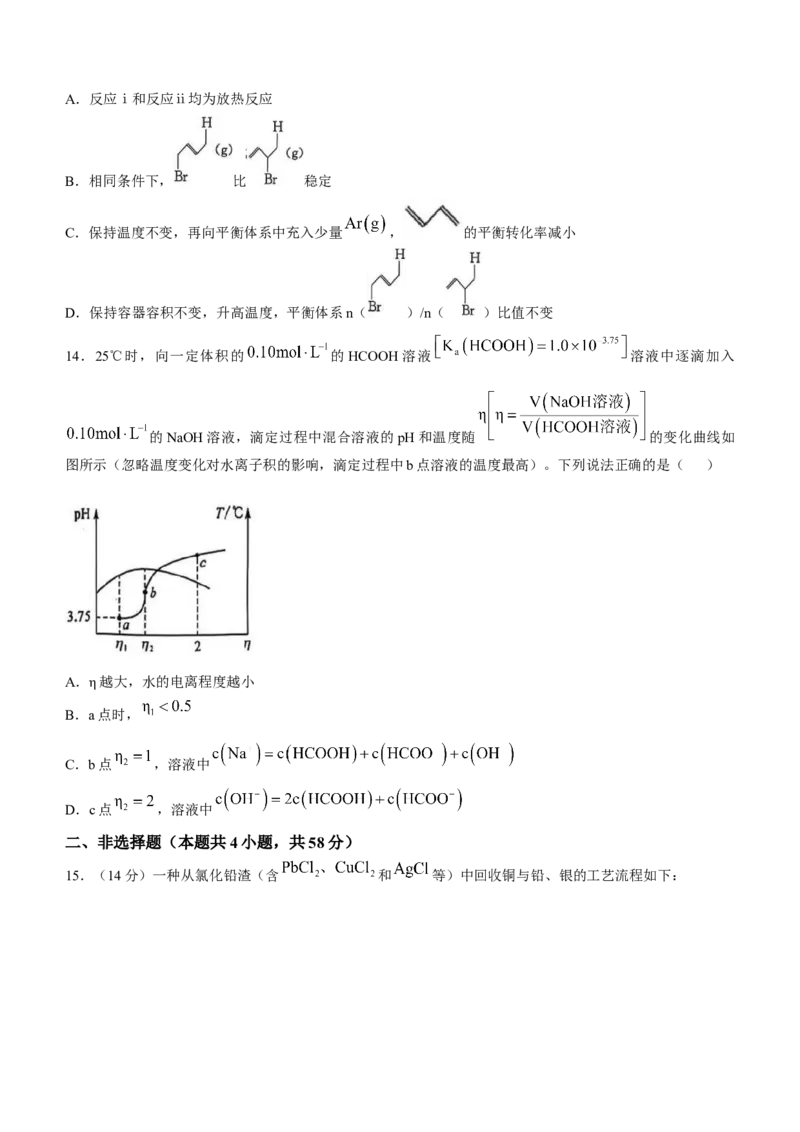
14.25℃时,向一定体积的 的HCOOH溶液 溶液中逐滴加入
的NaOH溶液,滴定过程中混合溶液的pH和温度随 的变化曲线如
图所示(忽略温度变化对水离子积的影响,滴定过程中b点溶液的温度最高)。下列说法正确的是( )
A.η越大,水的电离程度越小
B.a点时,
C.b点 ,溶液中
D.c点 ,溶液中
二、非选择题(本题共4小题,共58分)
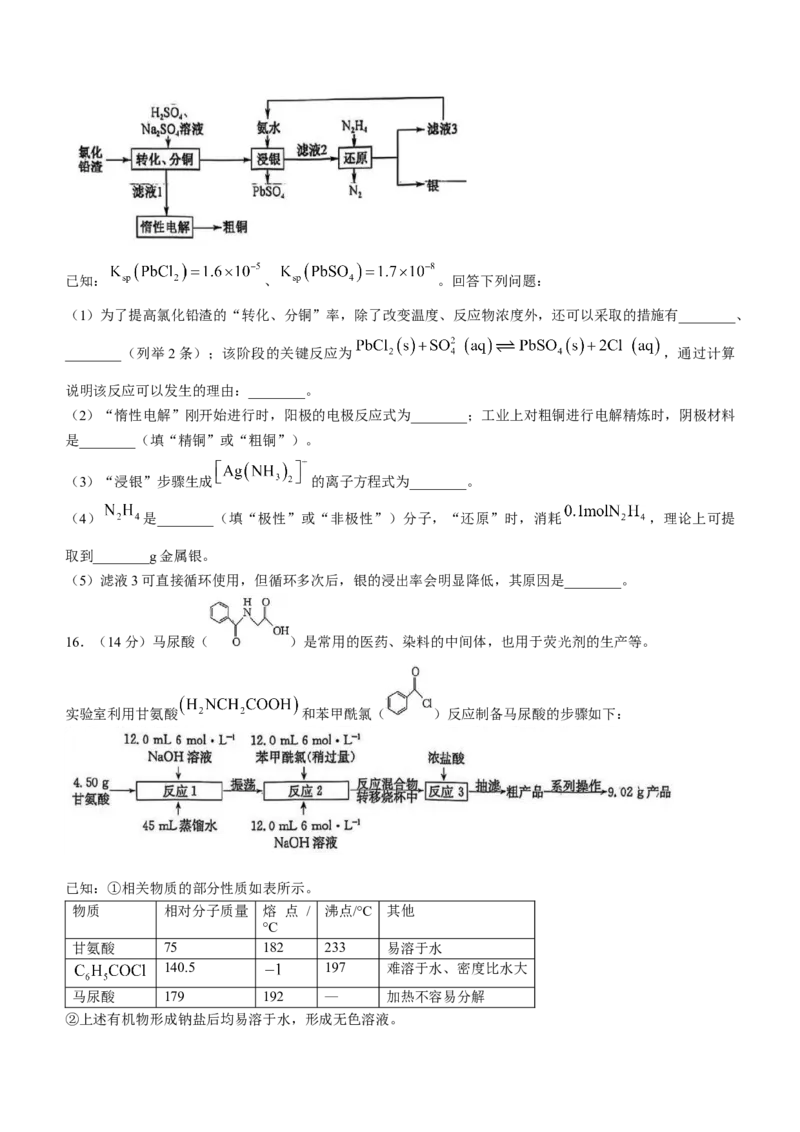
15.(14分)一种从氯化铅渣(含 和 等)中回收铜与铅、银的工艺流程如下:已知: 、 。回答下列问题:
(1)为了提高氯化铅渣的“转化、分铜”率,除了改变温度、反应物浓度外,还可以采取的措施有________、
________(列举2条);该阶段的关键反应为 ,通过计算
说明该反应可以发生的理由:________。
(2)“惰性电解”刚开始进行时,阳极的电极反应式为________;工业上对粗铜进行电解精炼时,阴极材料
是________(填“精铜”或“粗铜”)。
(3)“浸银”步骤生成 的离子方程式为________。
(4) 是________(填“极性”或“非极性”)分子,“还原”时,消耗 ,理论上可提
取到________g金属银。
(5)滤液3可直接循环使用,但循环多次后,银的浸出率会明显降低,其原因是________。
16.(14分)马尿酸( )是常用的医药、染料的中间体,也用于荧光剂的生产等。
实验室利用甘氨酸 和苯甲酰氯( )反应制备马尿酸的步骤如下:
已知:①相关物质的部分性质如表所示。
物质 相对分子质量 熔 点 / 沸点/°C 其他
°C
甘氨酸 75 182 233 易溶于水
140.5 197 难溶于水、密度比水大
马尿酸 179 192 — 加热不容易分解
②上述有机物形成钠盐后均易溶于水,形成无色溶液。回答下列问题:
(1)反应1和反应2均在三颈烧瓶里进行,三颈烧瓶的最适宜规格为________(填字母)。
A.50mL C.200mL B.100mL D.250mL
(2)若甘氨酸分子中“ ”上的氢原子被氟取代 ,则氨基结合 的能力会减弱,其
原因是________。
(3)在反应2中,需在30℃以下,同时向三颈烧瓶中滴入苯甲酰氯( )及氢氧化钠溶液,使反应液
始终呈碱性,写出该反应的化学方程式:________;该步骤操作中逐滴加入NaOH溶液而不是一次性加入的
原因是________;反应完成的现象:静置后,________。
(4)抽滤装置如图所示。抽滤的优点是________。
(5)本实验产率约为________(以甘氨酸计,保留2位有效数字)。
17.(15分) 的转化和利用是实现碳中和的有效途径,其中利用 制取甲醛的热化学方程式为
。回答下列问题:
(1)若该反应的逆反应活化能表示为 ,则a________(填字母)。
A.小于1.9 B.等于1.9 C.大于1.9 D.无法确定
(2)已知 , 的燃烧热 为 ,则
燃烧热 为________ 。
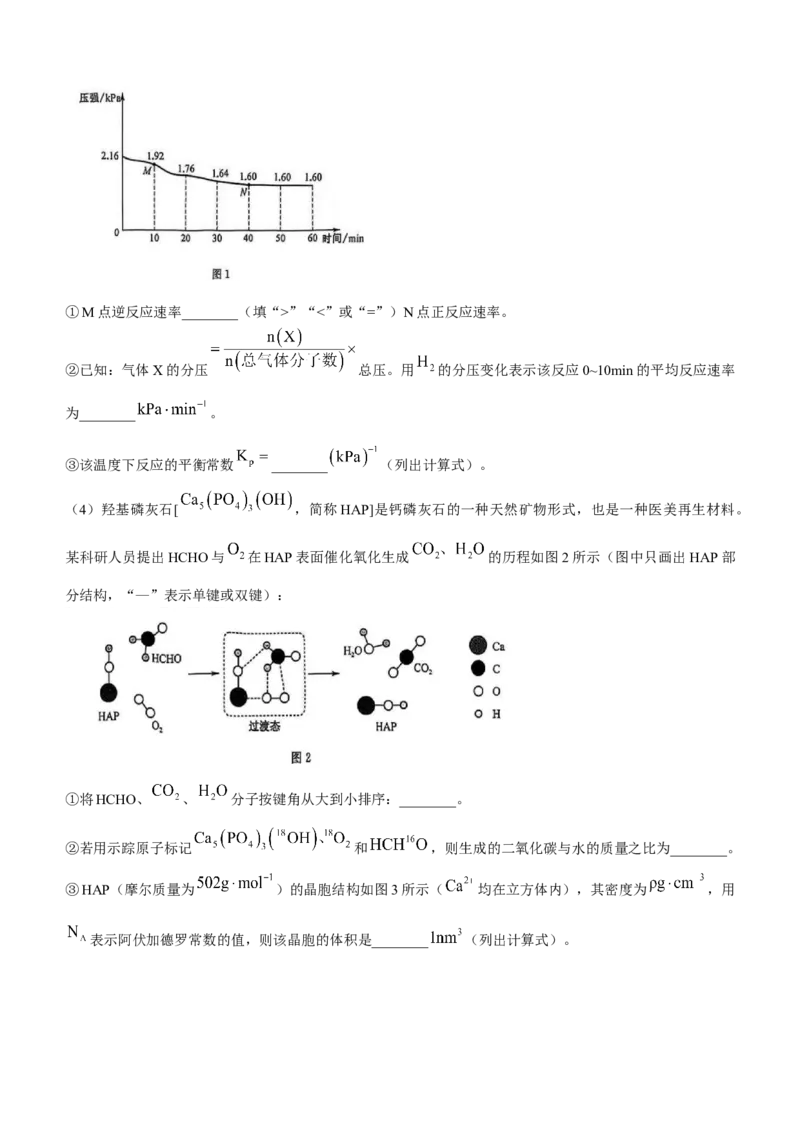
(3)一定温度下,将体积比为 的 和 混合气体充入恒容密闭容器中发生反应:
,测得容器内气体压强如图1所示:①M点逆反应速率________(填“>”“<”或“=”)N点正反应速率。
②已知:气体X的分压 总压。用 的分压变化表示该反应0~10min的平均反应速率
为________ 。
③该温度下反应的平衡常数 ________ (列出计算式)。
(4)羟基磷灰石[ ,简称HAP]是钙磷灰石的一种天然矿物形式,也是一种医美再生材料。
某科研人员提出HCHO与 在HAP表面催化氧化生成 的历程如图2所示(图中只画出HAP部
分结构,“—”表示单键或双键):
①将HCHO、 、 分子按键角从大到小排序:________。
②若用示踪原子标记 和 ,则生成的二氧化碳与水的质量之比为________。
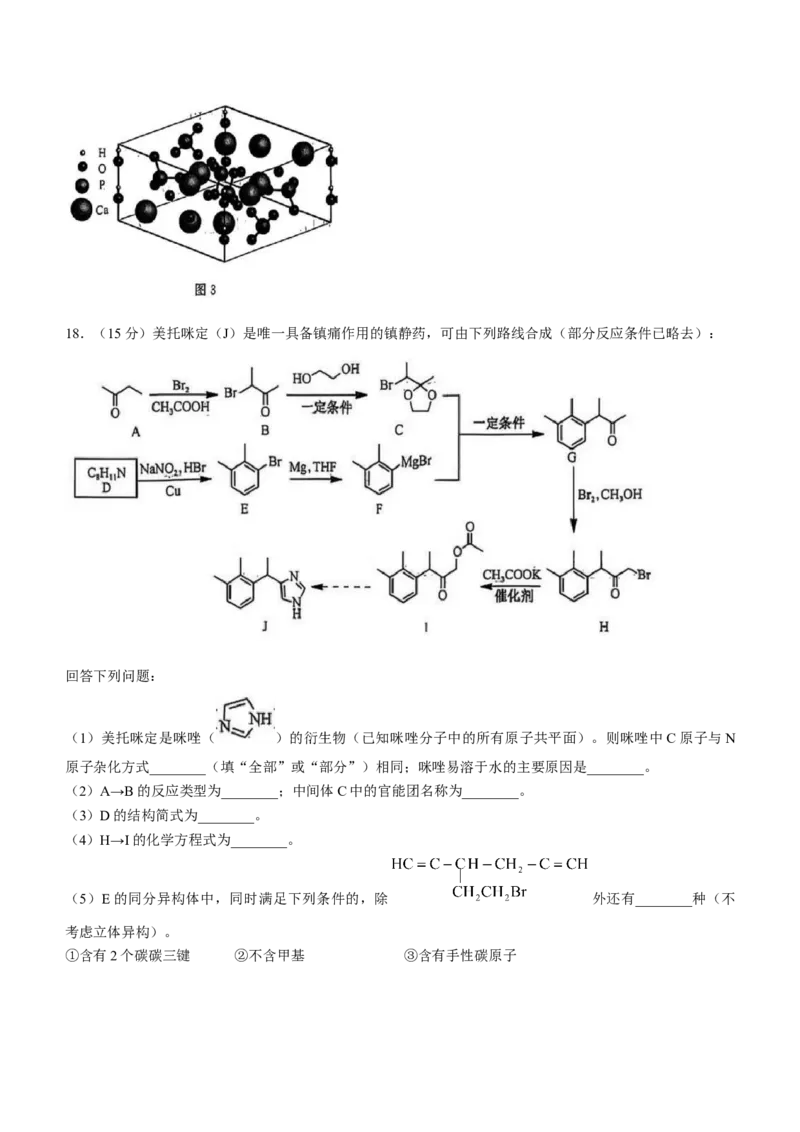
③HAP(摩尔质量为 )的晶胞结构如图3所示( 均在立方体内),其密度为 ,用
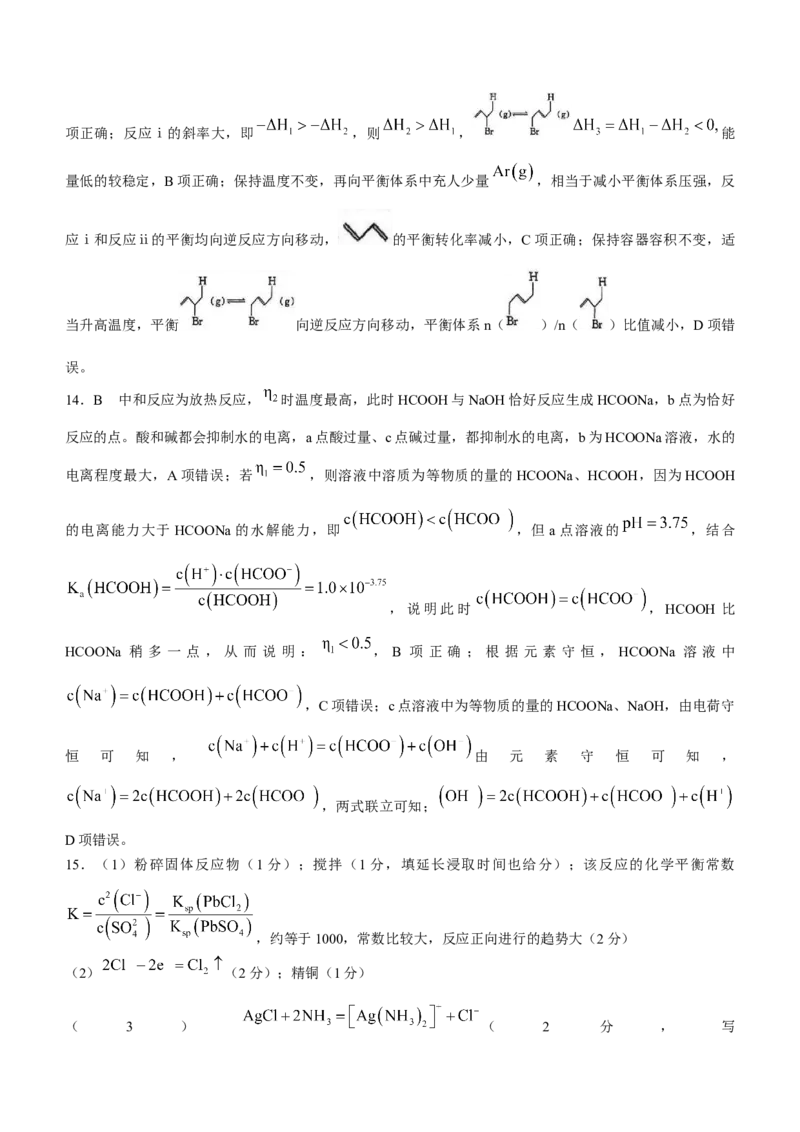
表示阿伏加德罗常数的值,则该晶胞的体积是________ (列出计算式)。18.(15分)美托咪定(J)是唯一具备镇痛作用的镇静药,可由下列路线合成(部分反应条件已略去):
回答下列问题:
(1)美托咪定是咪唑( )的衍生物(已知咪唑分子中的所有原子共平面)。则咪唑中C原子与N
原子杂化方式________(填“全部”或“部分”)相同;咪唑易溶于水的主要原因是________。
(2)A→B的反应类型为________;中间体C中的官能团名称为________。
(3)D的结构简式为________。
(4)H→I的化学方程式为________。
(5)E的同分异构体中,同时满足下列条件的,除 外还有________种(不
考虑立体异构)。
①含有2个碳碳三键 ②不含甲基 ③含有手性碳原子参考答案、提示及评分细则
1.B 熟石膏是 ,CaO的俗名是生石灰,A项错误;清朝康熙青花山水图瓷制笔筒的材质是
硅酸盐(青花瓷),B项正确;蚕丝的主要成分是蛋白质,C项错误; 属于碱式盐,D项错
误。
2.D 聚丙烯腈的结构简式为 ,D项错误。
3.B 用苯酚水溶液进行环境消毒,是因为苯酚能使蛋白质变性,B项符合题意。
4.A 依题意推测,A是钠、B是氧气、C是氢气、D是氯气、E是过氧化钠、F是氯化氢、G是碳酸钠。碳
酸钠溶液中碳酸根离子水解使溶液显碱性,能使油脂水解,水解是吸热反应,加热促进水解,溶液的碱性增
强,可用于去除餐具的油污,A项正确;氯化氢的水溶液能导电,是因为氯化氢在水中发生电离,氯化氢是
电解质,氯化氢是共价化合物,液态氯化氢不导电,B项错误;氯气与水反应生成的次氯酸具有漂白性,但
褪色的品红溶液不能恢复至红色,C项错误;当反应 消耗 时,转移2mol
电子,D项错误。
5.C 在光伏电催化过程中,碳元素化合价降低,甲酸盐是阴极产物,A项错误;由结构可知,甲醛分子含
有碳氧双键,通过加聚反应生成 ,B项错误;X能发生氧化、还原、取代、加成反应,C项正
确; 山梨糖分子中只有3个手性碳原子,D项错误。
6.D 甲中两个乙基和一个 杂化的碳原子相连,故甲分子中所有碳原子可能共平面,A项正确;甲与
加成所得产物的化学名称为 甲基戊烷,B项正确;乙分子中碳碳双键两端连接的原子或原子团全不同,
乙存在顺反异构体,C项正确;乙中的醛基也能使酸性 溶液褪色,D项错误。
7.C 向新制氯水中滴入硫氢化钠溶液,正确的离子方程式为 ,A项错误;向
氯化铁溶液中加入少量铜粉,正确的离子方程式为 ,B项错误;乙醛与银氨溶液
水 浴 加 热 产 生 银 镜 , 正 确 的 离 子 方 程 式 为
,D项错误。
8.D 依题意推测,X是氢、Y是碳、Z是氮、W是氧,甲的分子组成为HCN,则甲的结构式为 。第一电离能: 、 ,A项正确; 中的N原子易提供孤电子对与 形成配位键,即铜氨离
子,B项正确;氰基 里有2个π键,故HCN分子中σ键与π键数目之比为 ,C项正确;原子半径:
,D项错误。
9.A 乙分子中的氧原子上没有H,不能形成分子间氢键,A项错误;乙→丙的反应中,硝基被还原为氨基,
的作用是作还原剂,B项正确;观察结构变化,甲→乙、丙→丁的反应类型均为取代反应,C项正确;
丁中含有酯基等官能团,丁无论在酸性条件下,还是碱性条件下,都不稳定,D项正确。
10.C 的晶体类型为分子晶体,A项错误; 与 的价层电子对数均为4且无孤电子对,
故VSEPR模型均是四面体形,B项错误;观察晶胞结构, 晶体中 的配位数为8(以面心 为
研究对象),则 的配位数也为8,C项正确;由题意可以判断, 中的硼元素显 价,氢元素显
价,则组成元素的电负性: ,D项错误。
11.C 测定中和反应反应热时要将反应物快速混合,A项错误; 不能代表其燃烧热,B
项错误; 与C生成CO比生成 的 更大,C项正确;温度低时反应速率慢,不利于提高单位时间
内 的产率,D项错误。
12.A 催化的电极反应式为 ,A项正确;由题意可判
断,Zn为负极,放电过程中, 解离出 和 分别向正极和负极迁移,故双极膜B侧应为阴离子交
换膜,B项错误;消耗 ,转移 电子,理论上双极膜中间的水减少 ( 解离出
和 ),C项错误;Zn极电极反应式为 ,迁入的
少于消耗的 ,放电一段时间后,Zn极附近的电解液pH减小,D项错误。
13.D 由题干图示信息可知,反应ⅰ和反应ⅱ的 随 增大而增大,反应ⅰ和反应ⅱ均为放热反应,A项正确;反应ⅰ的斜率大,即 ,则 , 能
量低的较稳定,B项正确;保持温度不变,再向平衡体系中充人少量 ,相当于减小平衡体系压强,反
应ⅰ和反应ⅱ的平衡均向逆反应方向移动, 的平衡转化率减小,C项正确;保持容器容积不变,适
当升高温度,平衡 向逆反应方向移动,平衡体系n( )/n( )比值减小,D项错
误。
14.B 中和反应为放热反应, 时温度最高,此时HCOOH与NaOH恰好反应生成HCOONa,b点为恰好
反应的点。酸和碱都会抑制水的电离,a点酸过量、c点碱过量,都抑制水的电离,b为HCOONa溶液,水的
电离程度最大,A项错误;若 ,则溶液中溶质为等物质的量的HCOONa、HCOOH,因为HCOOH
的电离能力大于 HCOONa的水解能力,即 ,但a点溶液的 ,结合
,说明此时 ,HCOOH 比
HCOONa 稍 多 一 点 , 从 而 说 明 : , B 项 正 确 ; 根 据 元 素 守 恒 , HCOONa 溶 液 中
,C项错误;c点溶液中为等物质的量的HCOONa、NaOH,由电荷守
恒 可 知 , 由 元 素 守 恒 可 知 ,
,两式联立可知;
D项错误。
15.(1)粉碎固体反应物(1分);搅拌(1分,填延长浸取时间也给分);该反应的化学平衡常数
,约等于1000,常数比较大,反应正向进行的趋势大(2分)
(2) (2分);精铜(1分)
( 3 ) ( 2 分 , 写也给分)
(4)极性(1分);43.2(2分)
(5)回收液中 或 减小,同时积累了 , 与 络合被抑制(2分)
【解析】(1)依题意,温度一定、反应物浓度一定,故提高“转化、分铜”率的方法有粉碎固体、搅拌以及
延长浸取时间。
(2)“惰性电解”的电解液中的溶质主要是氯化铜、氯化钠,因此电解的初始阶段,阳极氯离子先放电,电
极反应式为 。
(4) 分子中每个氮原子具有一对孤电子对,导致其正、负电荷中心不重合,故 是极性分子;由
题意可知, 的氧化产物是 ,理论上消耗 时,反应转移 0.4mol 电子,应析出
,其质量为43.2g。
(5)“还原”反应为 循环多次后,
回收液中 增大、 或 减小,不利于 反
应正向进行。
16.(1)C
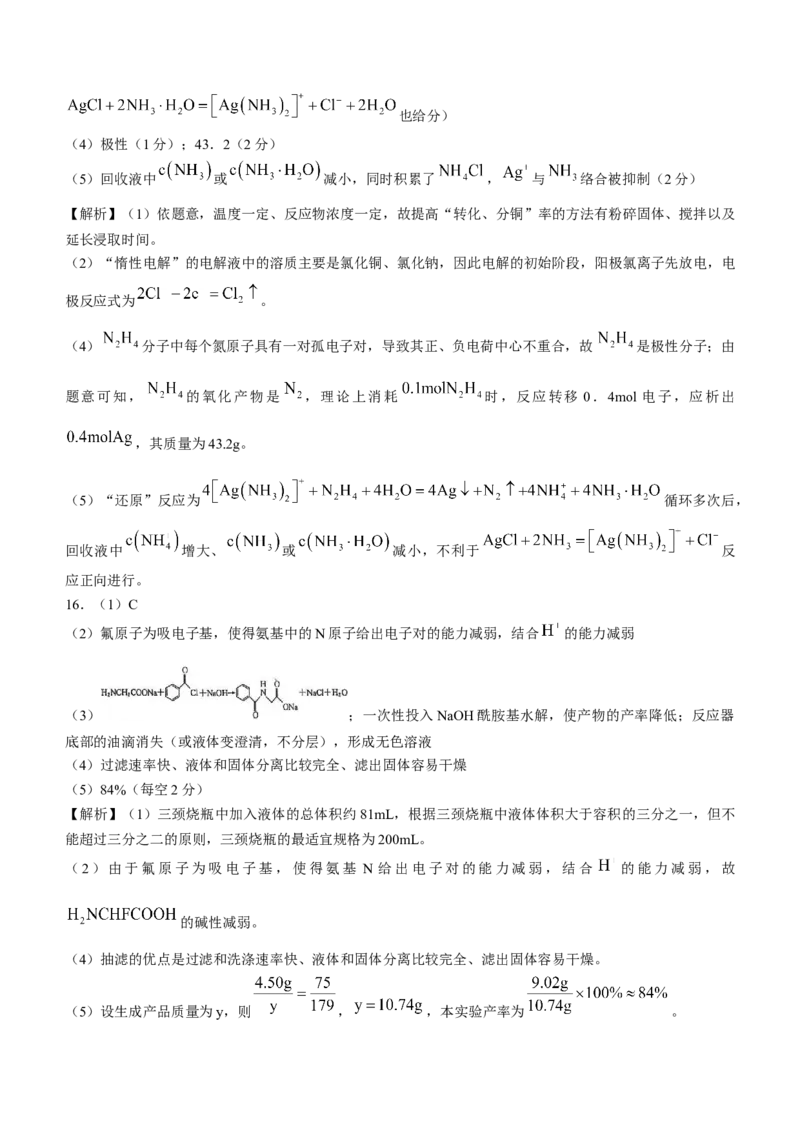
(2)氟原子为吸电子基,使得氨基中的N原子给出电子对的能力减弱,结合 的能力减弱
(3) ;一次性投入NaOH酰胺基水解,使产物的产率降低;反应器
底部的油滴消失(或液体变澄清,不分层),形成无色溶液
(4)过滤速率快、液体和固体分离比较完全、滤出固体容易干燥
(5)84%(每空2分)
【解析】(1)三颈烧瓶中加入液体的总体积约81mL,根据三颈烧瓶中液体体积大于容积的三分之一,但不
能超过三分之二的原则,三颈烧瓶的最适宜规格为200mL。
(2)由于氟原子为吸电子基,使得氨基 N 给出电子对的能力减弱,结合 的能力减弱,故
的碱性减弱。
(4)抽滤的优点是过滤和洗涤速率快、液体和固体分离比较完全、滤出固体容易干燥。
(5)设生成产品质量为y,则 , ,本实验产率为 。17.(1)C(1分)
(2) (2分)
(3)①<(2分)
②0.048(2分)
③ (2分)
(4)① (2分)
② (2分)
③ (2分)
【解析】(1) 正反应活化能-逆反应活化能 ,则逆反应活化能 正反应活
化能 ,故a大于1.9。
(2)已知:
根据盖斯定律可得: 。
(3)① 根据建立化学平衡的图像,M点逆反应速率小于N点正反应
速率。
②依方程式可判断 , ,则0~10min末,用 的压强变化表示该反应的平均反应速率为
③
。
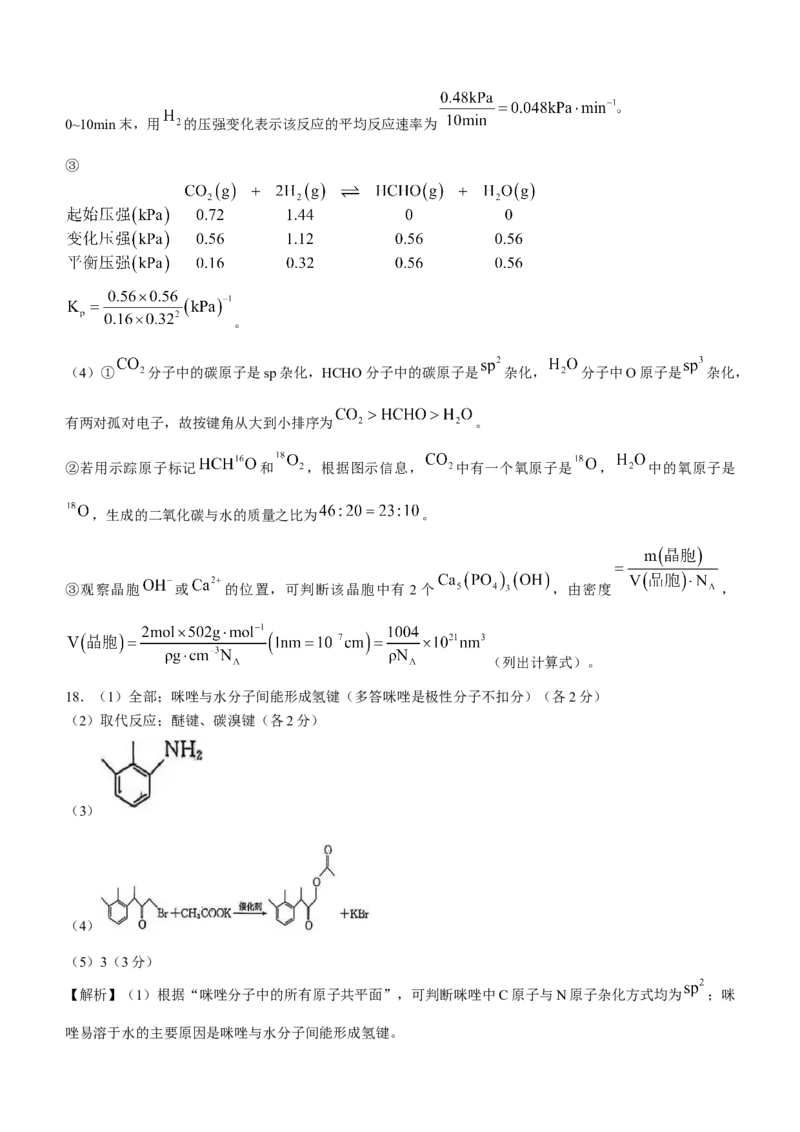
(4)① 分子中的碳原子是sp杂化,HCHO分子中的碳原子是 杂化, 分子中O原子是 杂化,
有两对孤对电子,故按键角从大到小排序为 。
②若用示踪原子标记 和 ,根据图示信息, 中有一个氧原子是 , 中的氧原子是
,生成的二氧化碳与水的质量之比为 。
③观察晶胞 或 的位置,可判断该晶胞中有 2个 ,由密度 ,
(列出计算式)。
18.(1)全部;咪唑与水分子间能形成氢键(多答咪唑是极性分子不扣分)(各2分)
(2)取代反应;醚键、碳溴键(各2分)
(3)
(4)
(5)3(3分)
【解析】(1)根据“咪唑分子中的所有原子共平面”,可判断咪唑中C原子与N原子杂化方式均为 ;咪
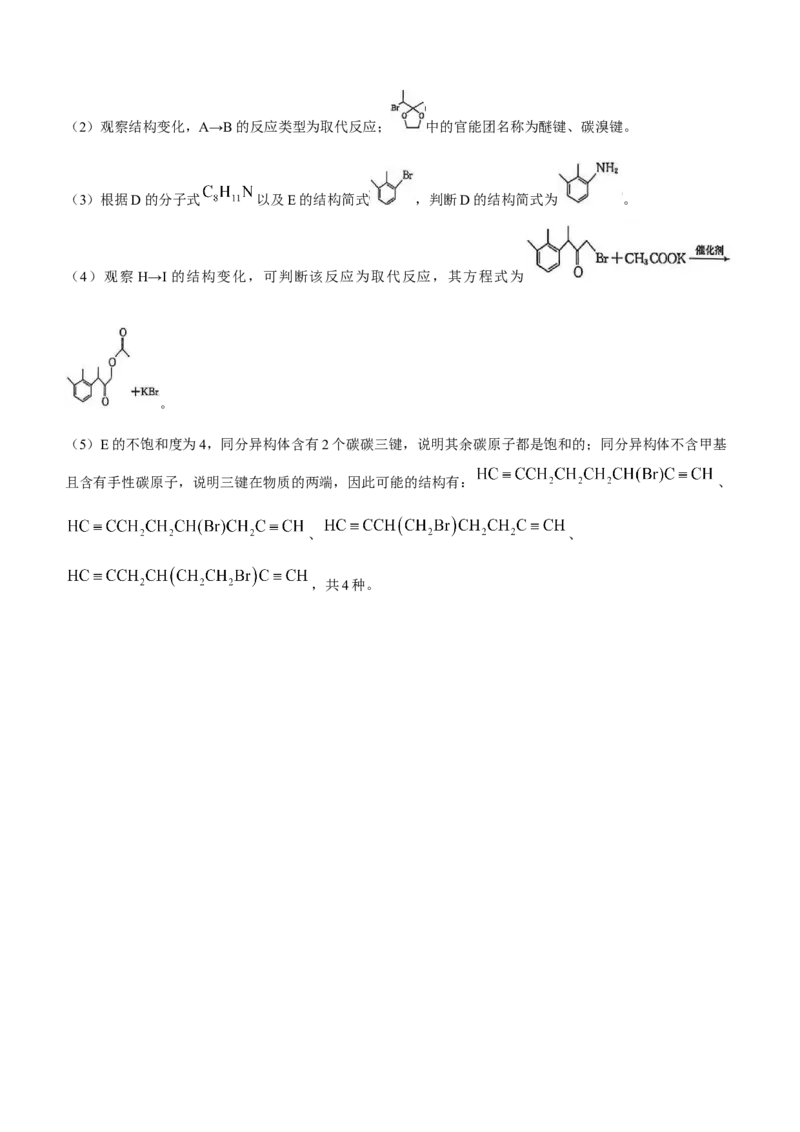
唑易溶于水的主要原因是咪唑与水分子间能形成氢键。(2)观察结构变化,A→B的反应类型为取代反应; 中的官能团名称为醚键、碳溴键。
(3)根据D的分子式 以及E的结构简式 ,判断D的结构简式为 。
(4)观察 H→I 的结构变化,可判断该反应为取代反应,其方程式为
。
(5)E的不饱和度为4,同分异构体含有2个碳碳三键,说明其余碳原子都是饱和的;同分异构体不含甲基
且含有手性碳原子,说明三键在物质的两端,因此可能的结构有: 、
、 、
,共4种。