文档内容
四川省德阳市 2020 年初中学业水平考试与高中阶段学校招生考试
理科综合试卷(化学试卷)
可能用到的相对原子质量:H-1 C-12 O-16 S-32 K-39 Mn-55 Zn-65
第Ⅰ卷(选择题 24分)
一、选择题:
1.下列生活中的有关做法不涉及化学变化的是( )
A. 服用碱性药物治疗胃酸过多
B. “新冠”疫情期间出门佩戴口罩
C. 用食醋清洗水壶中的水垢
D. 燃烧天然气和柴火煮饭、烧菜
2.目前,防治环境污染已成为保证人类健康生存、保障社会持续发展的全球性大事。下列有关说法错误的
是( )
A. 废旧电池随意丢弃,不会造成环境污染
的
B. 废弃 聚乙烯塑料随意丢弃会造成“白色污染”
C. pH<5.6的降水称为酸雨,汽车尾气是导致酸雨的原因之一
D. 水污染主要缘于工业废水、农业废水和生活污水的任意排放
3.化学能指导我们更好地认识、改造和应用物质。从物质分类角度分析,下列属于纯净物的是( )
A. 空气 B. 牛奶 C. 蒸馏水 D. 粗盐
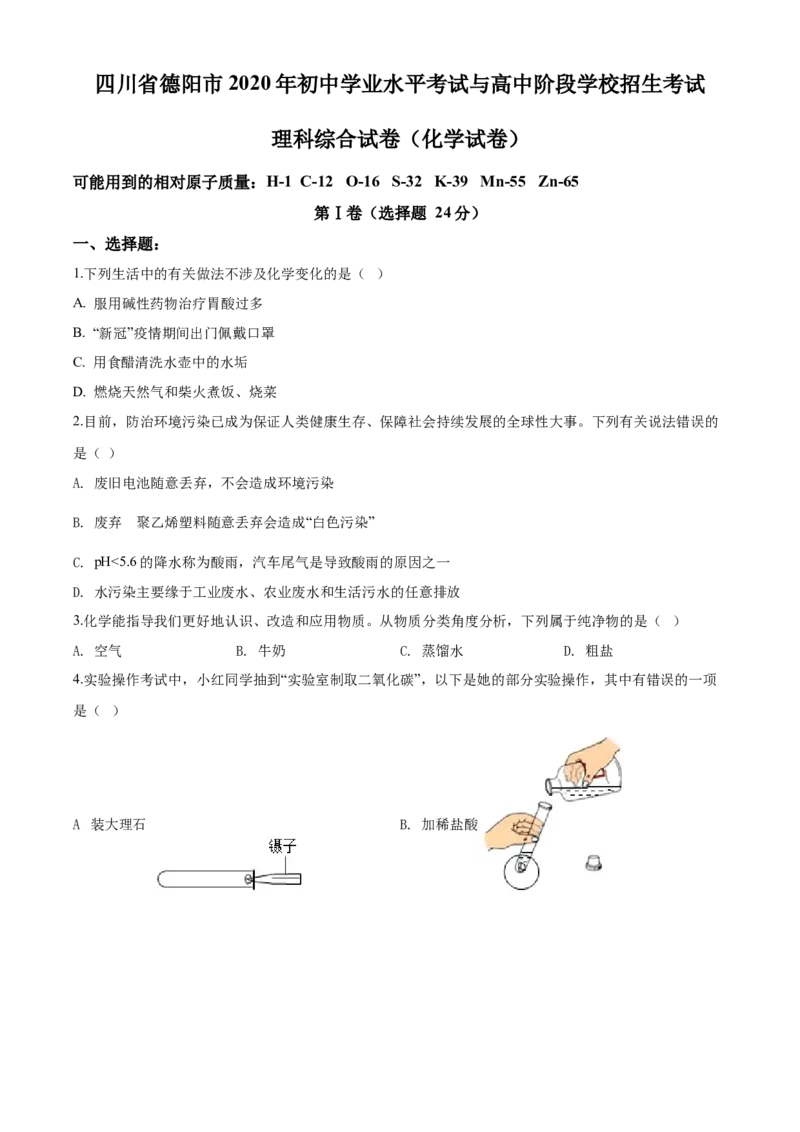
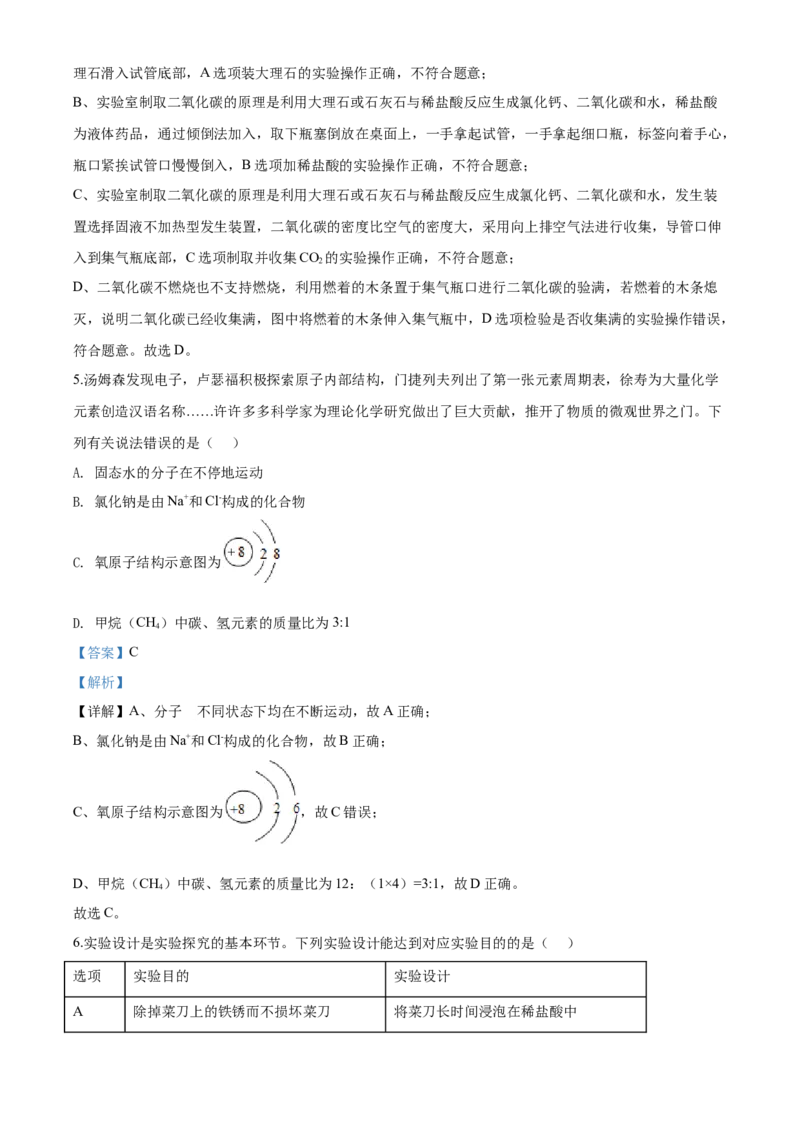
4.实验操作考试中,小红同学抽到“实验室制取二氧化碳”,以下是她的部分实验操作,其中有错误的一项
是( )
.
A 装大理石 B. 加稀盐酸C. 制取并收集CO D. 检验是否收集满
2
5.汤姆森发现电子,卢瑟福积极探索原子内部结构,门捷列夫列出了第一张元素周期表,徐寿为大量化学
元素创造汉语名称……许许多多科学家为理论化学研究做出了巨大贡献,推开了物质的微观世界之门。下
列有关说法错误的是( )
A. 固态水的分子在不停地运动
B. 氯化钠是由Na+和Cl-构成的化合物
C. 氧原子结构示意图为
D. 甲烷(CH)中碳、氢元素的质量比为3:1
4
6.实验设计是实验探究的基本环节。下列实验设计能达到对应实验目的的是( )
选项 实验目的 实验设计
A 除掉菜刀上的铁锈而不损坏菜刀 将菜刀长时间浸泡在稀盐酸中
B 区分NaOH溶液与Ca(OH) 溶液 分别取少量,滴加NaCO 溶液
2 2 3
C 除去CO 中的CO气体 将气体通过NaOH溶液
2
D 鉴别氮肥NH NO 与(NH )SO 取样,分别加入熟石灰研磨
4 3 4 2 4
A. A B. B C. C D. D
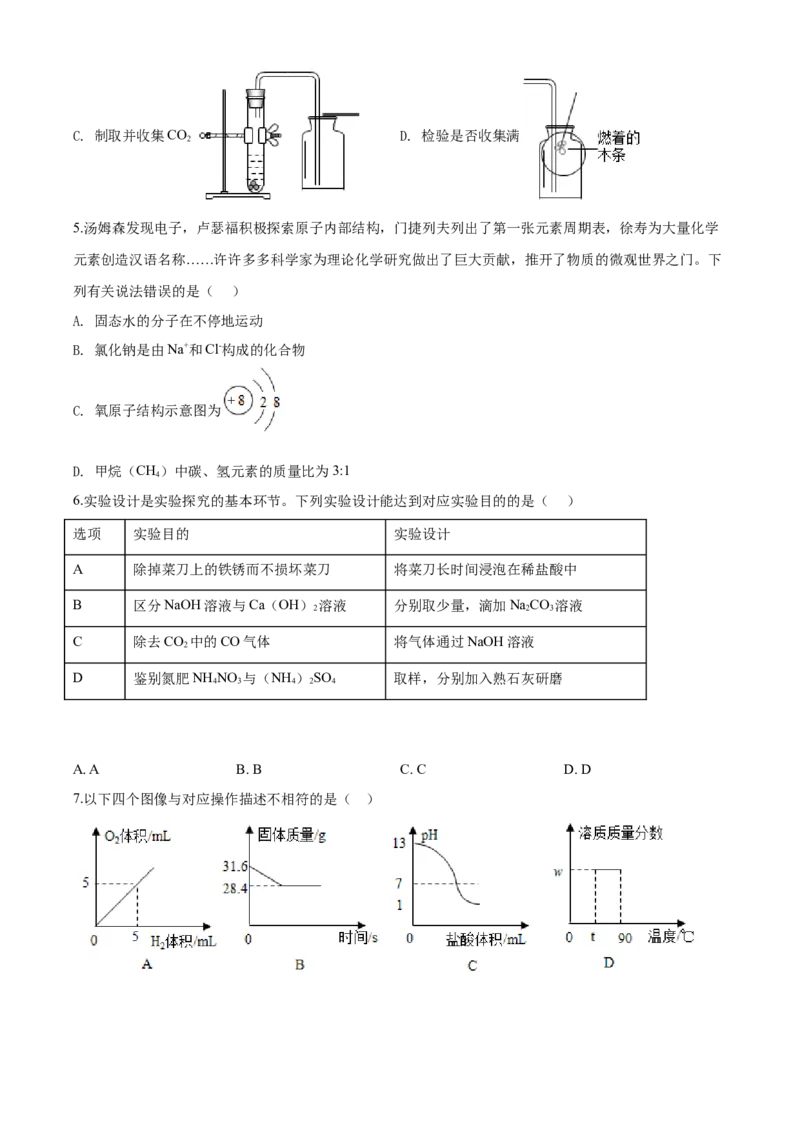
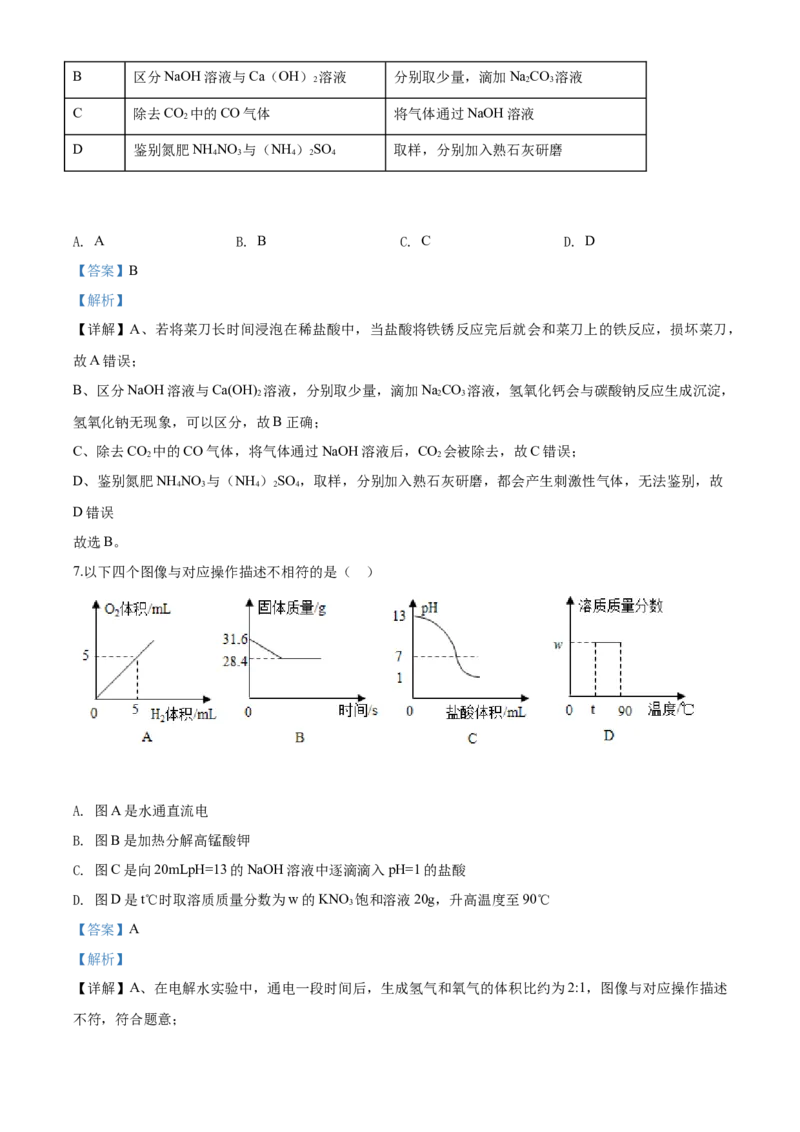
7.以下四个图像与对应操作描述不相符的是( )A. 图A是水通直流电
B. 图B是加热分解高锰酸钾
C. 图C是向20mLpH=13的NaOH溶液中逐滴滴入pH=1的盐酸
D. 图D是t℃时取溶质质量分数为w的KNO 饱和溶液20g,升高温度至90℃
3
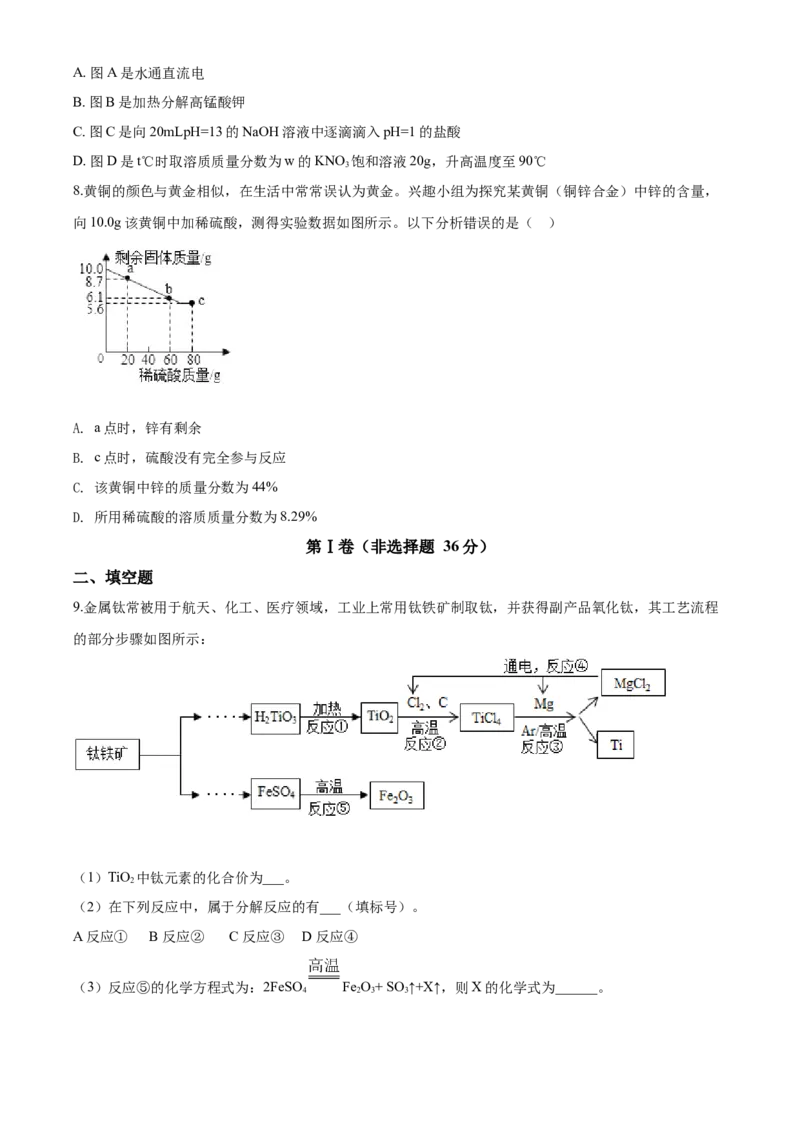
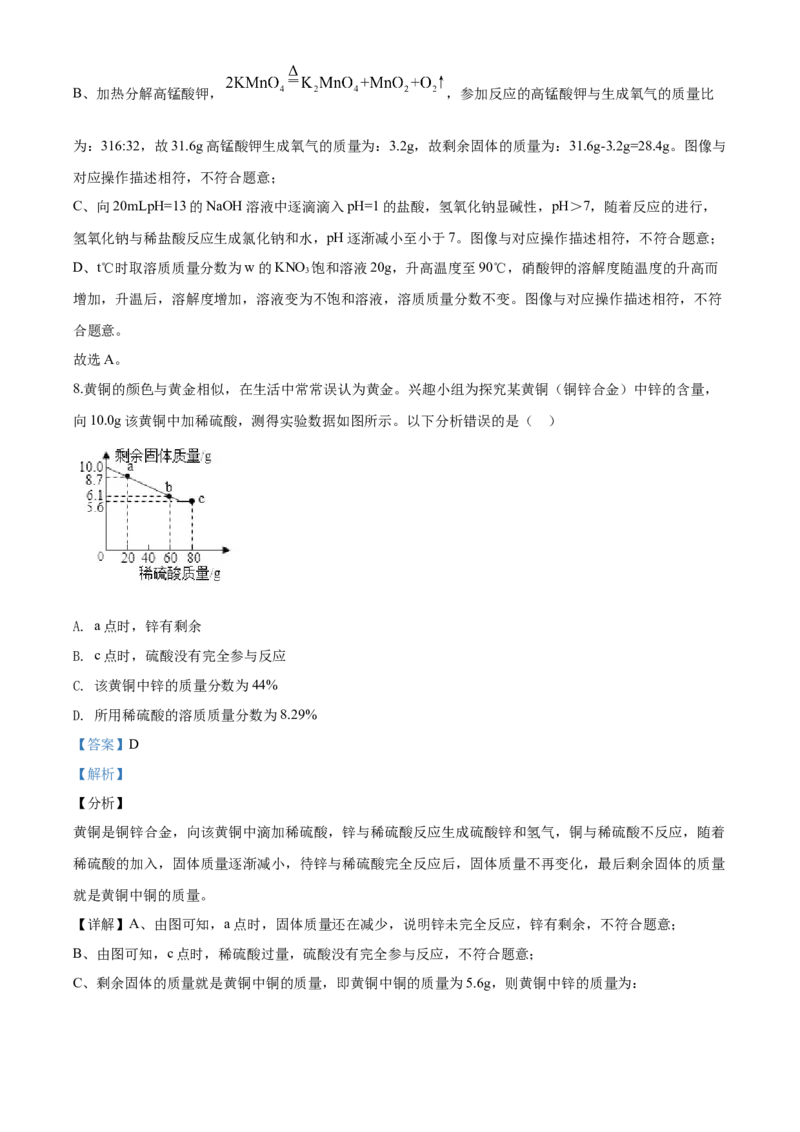
8.黄铜的颜色与黄金相似,在生活中常常误认为黄金。兴趣小组为探究某黄铜(铜锌合金)中锌的含量,
向10.0g该黄铜中加稀硫酸,测得实验数据如图所示。以下分析错误的是( )
A. a点时,锌有剩余
B. c点时,硫酸没有完全参与反应
C. 该黄铜中锌的质量分数为44%
D. 所用稀硫酸的溶质质量分数为8.29%
第Ⅰ卷(非选择题 36分)
二、填空题
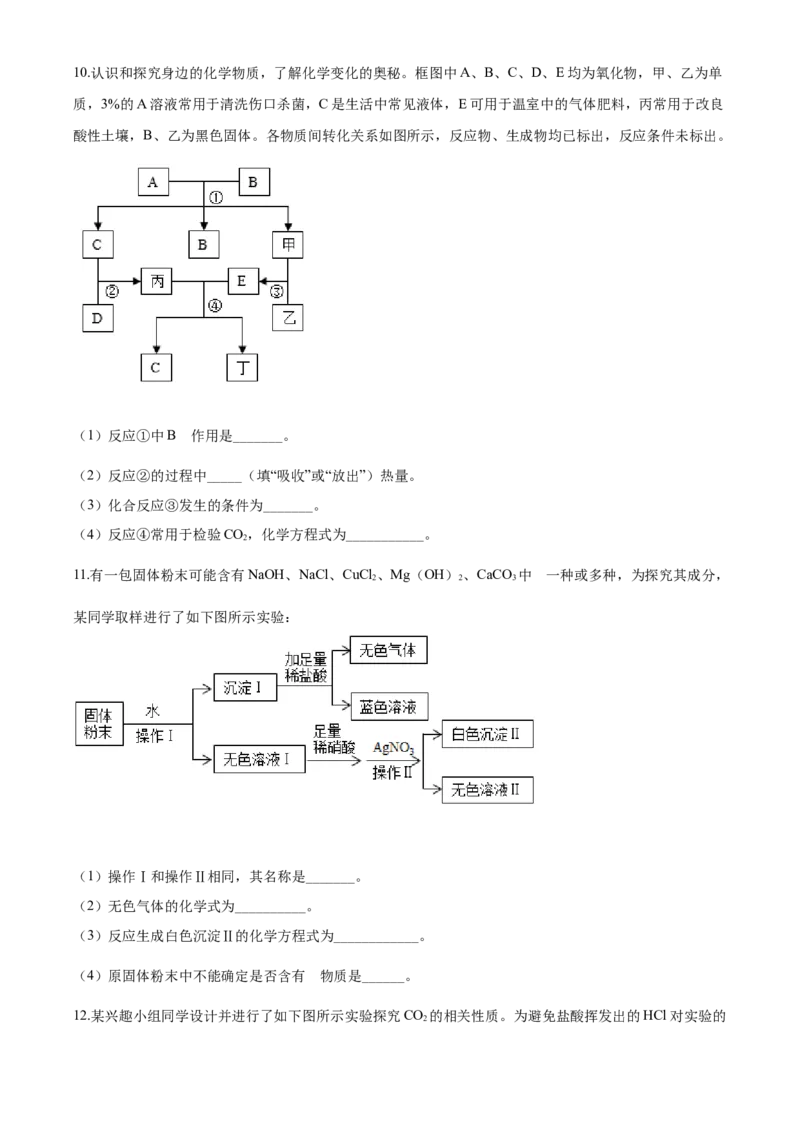
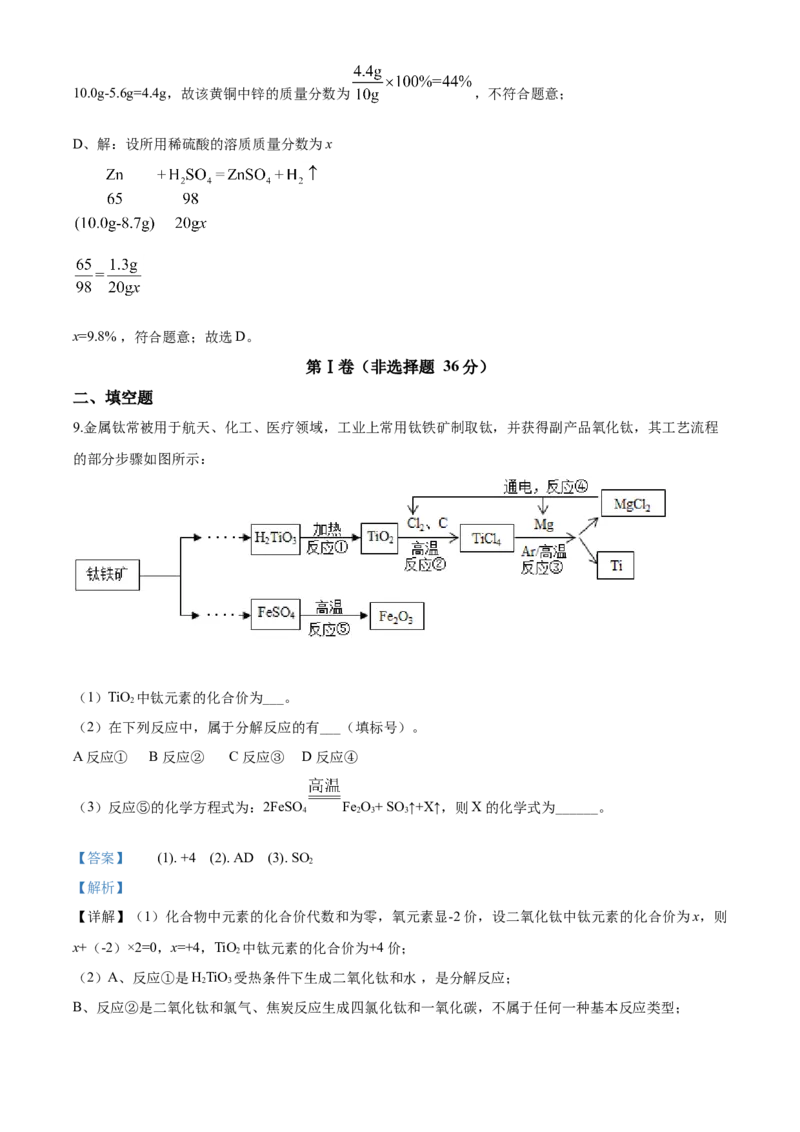
9.金属钛常被用于航天、化工、医疗领域,工业上常用钛铁矿制取钛,并获得副产品氧化钛,其工艺流程
的部分步骤如图所示:
(1)TiO 中钛元素的化合价为___。
2
(2)在下列反应中,属于分解反应的有___(填标号)。
A 反应① B 反应② C 反应③ D 反应④
(3)反应⑤的化学方程式为:2FeSO Fe O+ SO ↑+X↑,则X的化学式为______。
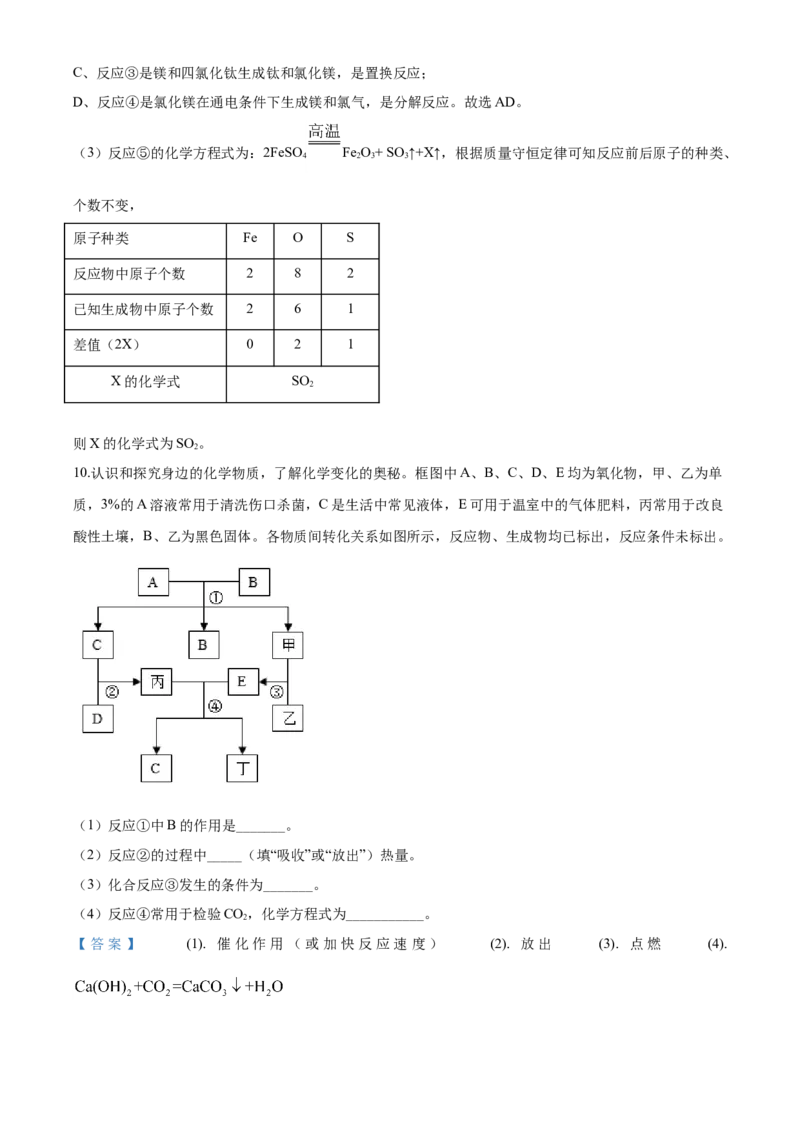
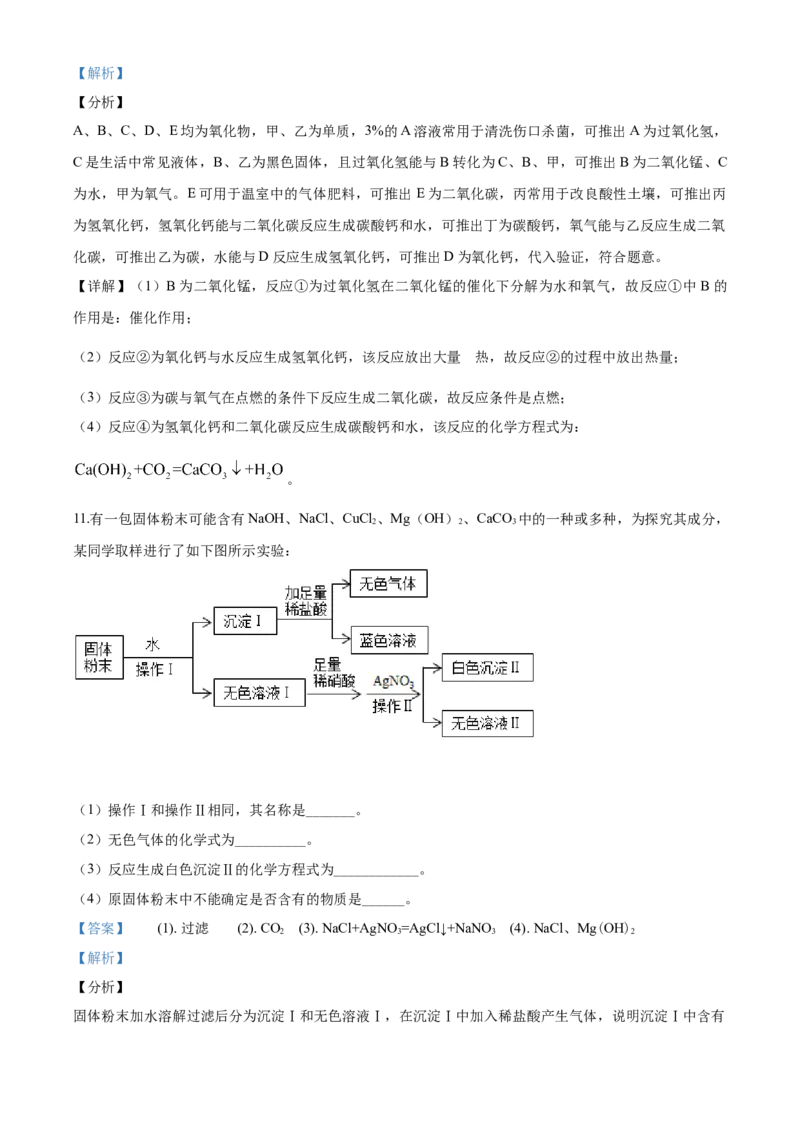
4 2 3 310.认识和探究身边的化学物质,了解化学变化的奥秘。框图中A、B、C、D、E均为氧化物,甲、乙为单
质,3%的A溶液常用于清洗伤口杀菌,C是生活中常见液体,E可用于温室中的气体肥料,丙常用于改良
酸性土壤,B、乙为黑色固体。各物质间转化关系如图所示,反应物、生成物均已标出,反应条件未标出。
的
(1)反应①中B 作用是_______。
(2)反应②的过程中_____(填“吸收”或“放出”)热量。
(3)化合反应③发生的条件为_______。
(4)反应④常用于检验CO,化学方程式为___________。
2
的
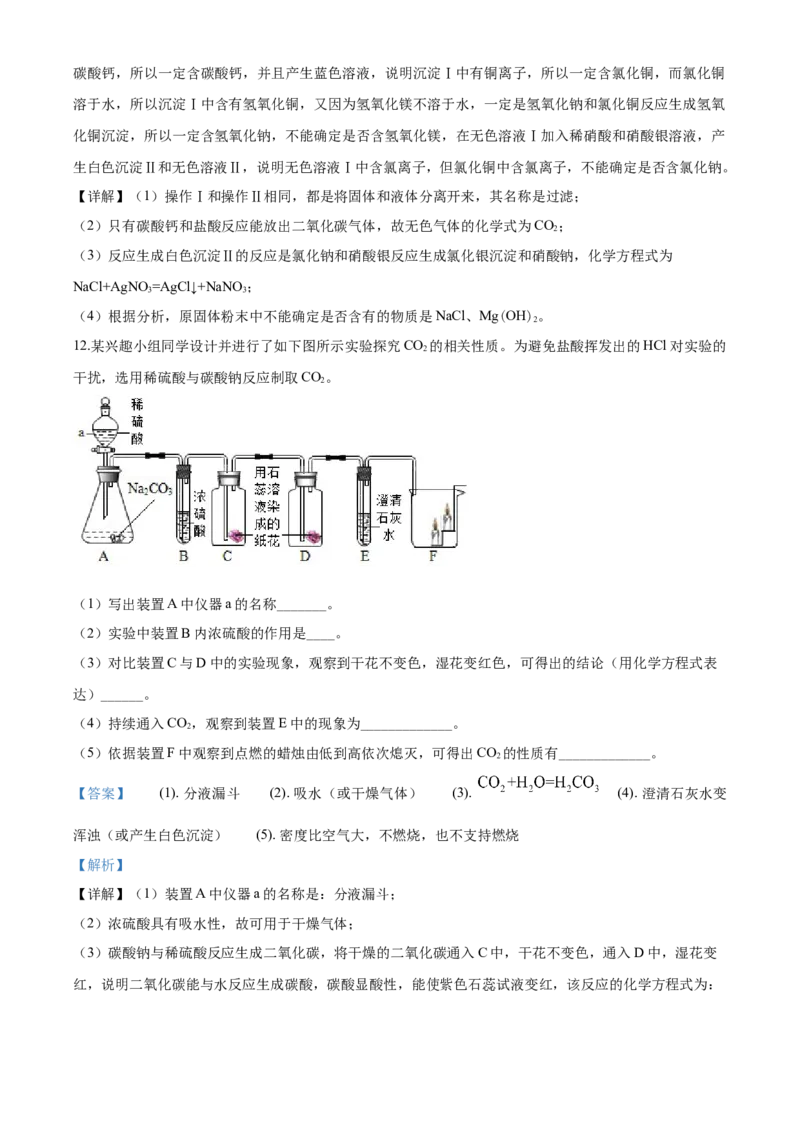
11.有一包固体粉末可能含有NaOH、NaCl、CuCl 、Mg(OH)、CaCO 中 一种或多种,为探究其成分,
2 2 3
某同学取样进行了如下图所示实验:
(1)操作Ⅰ和操作Ⅱ相同,其名称是_______。
(2)无色气体的化学式为__________。
(3)反应生成白色沉淀Ⅱ的化学方程式为____________。
的
(4)原固体粉末中不能确定是否含有 物质是______。
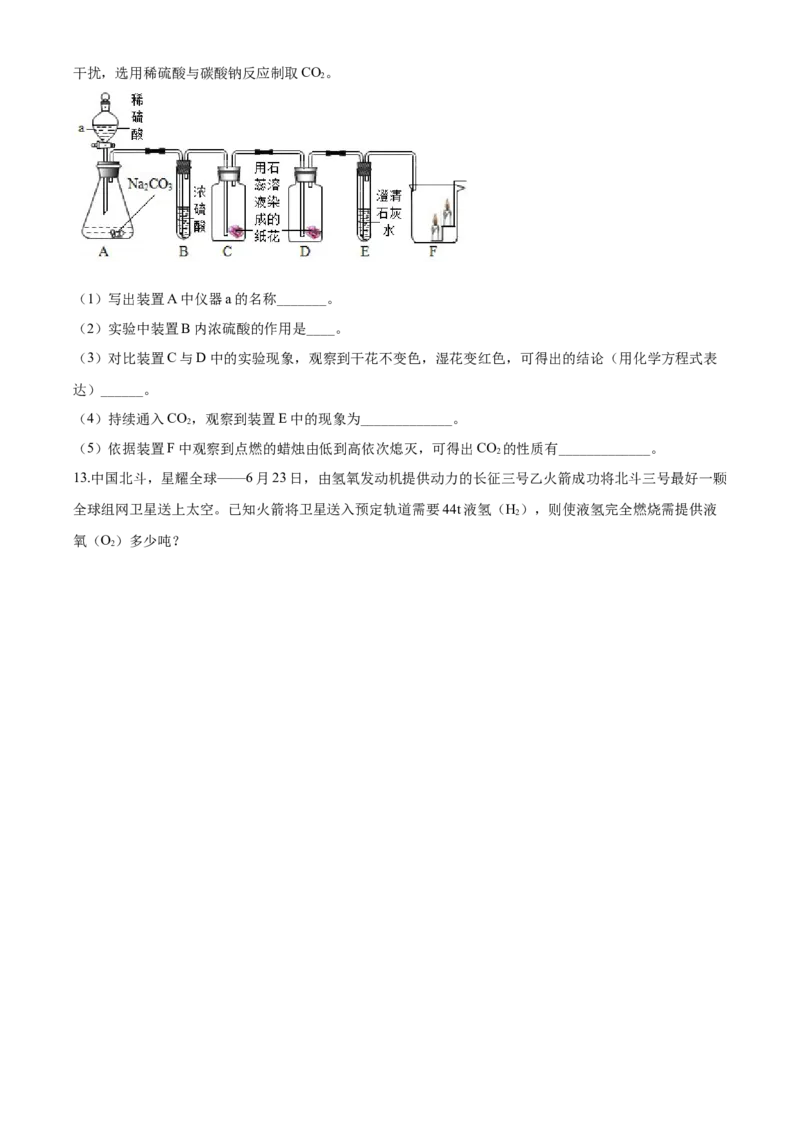
12.某兴趣小组同学设计并进行了如下图所示实验探究CO 的相关性质。为避免盐酸挥发出的HCl对实验的
2干扰,选用稀硫酸与碳酸钠反应制取CO。
2
(1)写出装置A中仪器a的名称_______。
(2)实验中装置B内浓硫酸的作用是____。
(3)对比装置C与D中的实验现象,观察到干花不变色,湿花变红色,可得出的结论(用化学方程式表
达)______。
(4)持续通入CO,观察到装置E中的现象为_____________。
2
(5)依据装置F中观察到点燃的蜡烛由低到高依次熄灭,可得出CO 的性质有_____________。
2
13.中国北斗,星耀全球——6月23日,由氢氧发动机提供动力的长征三号乙火箭成功将北斗三号最好一颗
全球组网卫星送上太空。已知火箭将卫星送入预定轨道需要44t液氢(H),则使液氢完全燃烧需提供液
2
氧(O)多少吨?
2四川省德阳市 2020 年初中学业水平考试与高中阶段学校招生考试
理科综合试卷(化学试卷)
可能用到的相对原子质量:H-1 C-12 O-16 S-32 K-39 Mn-55 Zn-65
第Ⅰ卷(选择题 24分)
一、选择题:
的
1.下列生活中 有关做法不涉及化学变化的是( )
A. 服用碱性药物治疗胃酸过多
B. “新冠”疫情期间出门佩戴口罩
C. 用食醋清洗水壶中的水垢
D. 燃烧天然气和柴火煮饭、烧菜
【答案】B
【解析】
【分析】
区别物理变化和化学变化的唯一标志是有无新物质生成。物理变化发生时没有新物质生成,化学变化发生
时有新物质生成。
【详解】A、服用碱性药物治疗胃酸过多过程中,碱性药物与胃酸中的盐酸反应,有新物质生成,属于化
学变化,故A错误;
B、“新冠”疫情期间出门佩戴口罩没有新物质生成,属于物理变化,故B正确;
C、用食醋除去水壶中的水垢是利用食醋与碳酸钙反应,把水垢除掉,生成了新物质,发生了化学变化,
故C错误;
D、燃烧天然气和柴火煮饭、烧菜过程中产生了二氧化碳等新物质,属于化学变化,故D错误。
故选B。
2.目前,防治环境污染已成为保证人类健康生存、保障社会持续发展的全球性大事。下列有关说法错误的
是( )
A. 废旧电池随意丢弃,不会造成环境污染
B. 废弃的聚乙烯塑料随意丢弃会造成“白色污染”
C. pH<5.6的降水称为酸雨,汽车尾气是导致酸雨的原因之一
D. 水污染主要缘于工业废水、农业废水和生活污水的任意排放
【答案】A【解析】
【详解】A、废旧电池中含有汞、镉等重金属,随意丢弃,会造成土壤污染和水污染,符合题意;
B、塑料随意丢弃会造成“白色污染”,说法正确,不符合题意;
C、pH<5.6的降水称为酸雨,汽车尾气中含有二氧化硫、二氧化氮等污染物,会造成酸雨,不符合题意;
D、水体污染的来源主要有工业污染、农业污染和生活污染,不符合题意。
故选A。
3.化学能指导我们更好地认识、改造和应用物质。从物质分类角度分析,下列属于纯净物的是( )
A. 空气 B. 牛奶 C. 蒸馏水 D. 粗盐
【答案】C
【解析】
【详解】A、空气是由氮气、氧气、二氧化碳等两种以上物质混合而成,属于混合物,不符合题意;
B、牛奶是由水、蛋白质等两种以上物质混合而成,属于混合物, 不符合题意;
C、蒸馏水是由水一种物质组成,属于纯净物,符合题意;
D、粗盐是由氯化钠、氯化镁等两种以上物质混合而成,属于混合物,不符合题意。
故选C。
4.实验操作考试中,小红同学抽到“实验室制取二氧化碳”,以下是她的部分实验操作,其中有错误的一项
是( )
A. 装大理石 B. 加稀盐酸
C. 制取并收集CO D. 检验是否收集满
2
【答案】D
【解析】
【详解】A、实验室制取二氧化碳的原理是利用大理石或石灰石与稀盐酸反应生成氯化钙、二氧化碳和水,
大理石为固体颗粒状药品,取用时先将试管横放,用镊子夹取大理石置于试管口,再缓缓竖起试管,使大理石滑入试管底部,A选项装大理石的实验操作正确,不符合题意;
B、实验室制取二氧化碳的原理是利用大理石或石灰石与稀盐酸反应生成氯化钙、二氧化碳和水,稀盐酸
为液体药品,通过倾倒法加入,取下瓶塞倒放在桌面上,一手拿起试管,一手拿起细口瓶,标签向着手心,
瓶口紧挨试管口慢慢倒入,B选项加稀盐酸的实验操作正确,不符合题意;
C、实验室制取二氧化碳的原理是利用大理石或石灰石与稀盐酸反应生成氯化钙、二氧化碳和水,发生装
置选择固液不加热型发生装置,二氧化碳的密度比空气的密度大,采用向上排空气法进行收集,导管口伸
入到集气瓶底部,C选项制取并收集CO 的实验操作正确,不符合题意;
2
D、二氧化碳不燃烧也不支持燃烧,利用燃着的木条置于集气瓶口进行二氧化碳的验满,若燃着的木条熄
灭,说明二氧化碳已经收集满,图中将燃着的木条伸入集气瓶中,D选项检验是否收集满的实验操作错误,
符合题意。故选D。
5.汤姆森发现电子,卢瑟福积极探索原子内部结构,门捷列夫列出了第一张元素周期表,徐寿为大量化学
元素创造汉语名称……许许多多科学家为理论化学研究做出了巨大贡献,推开了物质的微观世界之门。下
列有关说法错误的是( )
A. 固态水的分子在不停地运动
B. 氯化钠是由Na+和Cl-构成的化合物
C. 氧原子结构示意图为
D. 甲烷(CH)中碳、氢元素的质量比为3:1
4
【答案】C
【解析】
【详解】A、分子 在不同状态下均在不断运动,故A正确;
B、氯化钠是由Na+和Cl-构成的化合物,故B正确;
C、氧原子结构示意图为 ,故C错误;
D、甲烷(CH)中碳、氢元素的质量比为12:(1×4)=3:1,故D正确。
4
故选C。
6.实验设计是实验探究的基本环节。下列实验设计能达到对应实验目的的是( )
选项 实验目的 实验设计
A 除掉菜刀上的铁锈而不损坏菜刀 将菜刀长时间浸泡在稀盐酸中B 区分NaOH溶液与Ca(OH) 溶液 分别取少量,滴加NaCO 溶液
2 2 3
C 除去CO 中的CO气体 将气体通过NaOH溶液
2
D 鉴别氮肥NH NO 与(NH )SO 取样,分别加入熟石灰研磨
4 3 4 2 4
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A、若将菜刀长时间浸泡在稀盐酸中,当盐酸将铁锈反应完后就会和菜刀上的铁反应,损坏菜刀,
故A错误;
B、区分NaOH溶液与Ca(OH) 溶液,分别取少量,滴加NaCO 溶液,氢氧化钙会与碳酸钠反应生成沉淀,
2 2 3
氢氧化钠无现象,可以区分,故B正确;
C、除去CO 中的CO气体,将气体通过NaOH溶液后,CO 会被除去,故C错误;
2 2
D、鉴别氮肥NH NO 与(NH )SO ,取样,分别加入熟石灰研磨,都会产生刺激性气体,无法鉴别,故
4 3 4 2 4
。
D错误
故选B。
7.以下四个图像与对应操作描述不相符的是( )
A. 图A是水通直流电
B. 图B是加热分解高锰酸钾
C. 图C是向20mLpH=13的NaOH溶液中逐滴滴入pH=1的盐酸
D. 图D是t℃时取溶质质量分数为w的KNO 饱和溶液20g,升高温度至90℃
3
【答案】A
【解析】
【详解】A、在电解水实验中,通电一段时间后,生成氢气和氧气的体积比约为2:1,图像与对应操作描述
不符,符合题意;B、加热分解高锰酸钾, ,参加反应的高锰酸钾与生成氧气的质量比
为:316:32,故31.6g高锰酸钾生成氧气的质量为:3.2g,故剩余固体的质量为:31.6g-3.2g=28.4g。图像与
对应操作描述相符,不符合题意;
C、向20mLpH=13的NaOH溶液中逐滴滴入pH=1的盐酸,氢氧化钠显碱性,pH>7,随着反应的进行,
氢氧化钠与稀盐酸反应生成氯化钠和水,pH逐渐减小至小于7。图像与对应操作描述相符,不符合题意;
D、t℃时取溶质质量分数为w的KNO 饱和溶液20g,升高温度至90℃,硝酸钾的溶解度随温度的升高而
3
增加,升温后,溶解度增加,溶液变为不饱和溶液,溶质质量分数不变。图像与对应操作描述相符,不符
合题意。
故选A。
8.黄铜的颜色与黄金相似,在生活中常常误认为黄金。兴趣小组为探究某黄铜(铜锌合金)中锌的含量,
向10.0g该黄铜中加稀硫酸,测得实验数据如图所示。以下分析错误的是( )
A. a点时,锌有剩余
B. c点时,硫酸没有完全参与反应
C. 该黄铜中锌的质量分数为44%
D. 所用稀硫酸的溶质质量分数为8.29%
【答案】D
【解析】
【分析】
黄铜是铜锌合金,向该黄铜中滴加稀硫酸,锌与稀硫酸反应生成硫酸锌和氢气,铜与稀硫酸不反应,随着
稀硫酸的加入,固体质量逐渐减小,待锌与稀硫酸完全反应后,固体质量不再变化,最后剩余固体的质量
就是黄铜中铜的质量。
【详解】A、由图可知,a点时,固体质量还在减少,说明锌未完全反应,锌有剩余,不符合题意;
B、由图可知,c点时,稀硫酸过量,硫酸没有完全参与反应,不符合题意;
C、剩余固体的质量就是黄铜中铜的质量,即黄铜中铜的质量为5.6g,则黄铜中锌的质量为:10.0g-5.6g=4.4g,故该黄铜中锌的质量分数为 ,不符合题意;
D、解:设所用稀硫酸的溶质质量分数为x
x=9.8% ,符合题意;故选D。
第Ⅰ卷(非选择题 36分)
二、填空题
9.金属钛常被用于航天、化工、医疗领域,工业上常用钛铁矿制取钛,并获得副产品氧化钛,其工艺流程
的部分步骤如图所示:
(1)TiO 中钛元素的化合价为___。
2
(2)在下列反应中,属于分解反应的有___(填标号)。
A 反应① B 反应② C 反应③ D 反应④
(3)反应⑤的化学方程式为:2FeSO Fe O+ SO ↑+X↑,则X的化学式为______。
4 2 3 3
【答案】 (1). +4 (2). AD (3). SO
2
【解析】
【详解】(1)化合物中元素的化合价代数和为零,氧元素显-2价,设二氧化钛中钛元素的化合价为x,则
x+(-2)×2=0,x=+4,TiO 中钛元素的化合价为+4价;
2
(2)A、反应①是HTiO 受热条件下生成二氧化钛和水 ,是分解反应;
2 3
B、反应②是二氧化钛和氯气、焦炭反应生成四氯化钛和一氧化碳,不属于任何一种基本反应类型;C、反应③是镁和四氯化钛生成钛和氯化镁,是置换反应;
D、反应④是氯化镁在通电条件下生成镁和氯气,是分解反应。故选AD。
(3)反应⑤的化学方程式为:2FeSO Fe O+ SO ↑+X↑,根据质量守恒定律可知反应前后原子的种类、
4 2 3 3
个数不变,
原子种类 Fe O S
反应物中原子个数 2 8 2
已知生成物中原子个数 2 6 1
差值(2X) 0 2 1
X的化学式 SO
2
则X的化学式为SO 。
2
10.认识和探究身边的化学物质,了解化学变化的奥秘。框图中A、B、C、D、E均为氧化物,甲、乙为单
质,3%的A溶液常用于清洗伤口杀菌,C是生活中常见液体,E可用于温室中的气体肥料,丙常用于改良
酸性土壤,B、乙为黑色固体。各物质间转化关系如图所示,反应物、生成物均已标出,反应条件未标出。
(1)反应①中B的作用是_______。
(2)反应②的过程中_____(填“吸收”或“放出”)热量。
(3)化合反应③发生的条件为_______。
(4)反应④常用于检验CO,化学方程式为___________。
2
【答案】 (1). 催化作用(或加快反应速度) (2). 放出 (3). 点燃 (4).【解析】
【分析】
A、B、C、D、E均为氧化物,甲、乙为单质,3%的A溶液常用于清洗伤口杀菌,可推出A为过氧化氢,
C是生活中常见液体,B、乙为黑色固体,且过氧化氢能与B转化为C、B、甲,可推出B为二氧化锰、C
为水,甲为氧气。E可用于温室中的气体肥料,可推出E为二氧化碳,丙常用于改良酸性土壤,可推出丙
为氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水,可推出丁为碳酸钙,氧气能与乙反应生成二氧
化碳,可推出乙为碳,水能与D反应生成氢氧化钙,可推出D为氧化钙,代入验证,符合题意。
【详解】(1)B为二氧化锰,反应①为过氧化氢在二氧化锰的催化下分解为水和氧气,故反应①中 B的
作用是:催化作用;
的
(2)反应②为氧化钙与水反应生成氢氧化钙,该反应放出大量 热,故反应②的过程中放出热量;
(3)反应③为碳与氧气在点燃的条件下反应生成二氧化碳,故反应条件是点燃;
(4)反应④为氢氧化钙和二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:
。
11.有一包固体粉末可能含有NaOH、NaCl、CuCl 、Mg(OH)、CaCO 中的一种或多种,为探究其成分,
2 2 3
某同学取样进行了如下图所示实验:
(1)操作Ⅰ和操作Ⅱ相同,其名称是_______。
(2)无色气体的化学式为__________。
(3)反应生成白色沉淀Ⅱ的化学方程式为____________。
(4)原固体粉末中不能确定是否含有的物质是______。
【答案】 (1). 过滤 (2). CO (3). NaCl+AgNO =AgCl↓+NaNO (4). NaCl、Mg(OH)
2 3 3 2
【解析】
【分析】
固体粉末加水溶解过滤后分为沉淀Ⅰ和无色溶液Ⅰ,在沉淀Ⅰ中加入稀盐酸产生气体,说明沉淀Ⅰ中含有碳酸钙,所以一定含碳酸钙,并且产生蓝色溶液,说明沉淀Ⅰ中有铜离子,所以一定含氯化铜,而氯化铜
溶于水,所以沉淀Ⅰ中含有氢氧化铜,又因为氢氧化镁不溶于水,一定是氢氧化钠和氯化铜反应生成氢氧
化铜沉淀,所以一定含氢氧化钠,不能确定是否含氢氧化镁,在无色溶液Ⅰ加入稀硝酸和硝酸银溶液,产
生白色沉淀Ⅱ和无色溶液Ⅱ,说明无色溶液Ⅰ中含氯离子,但氯化铜中含氯离子,不能确定是否含氯化钠。
【详解】(1)操作Ⅰ和操作Ⅱ相同,都是将固体和液体分离开来,其名称是过滤;
(2)只有碳酸钙和盐酸反应能放出二氧化碳气体,故无色气体的化学式为CO;
2
(3)反应生成白色沉淀Ⅱ的反应是氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,化学方程式为
NaCl+AgNO =AgCl↓+NaNO ;
3 3
(4)根据分析,原固体粉末中不能确定是否含有的物质是NaCl、Mg(OH)。
2
12.某兴趣小组同学设计并进行了如下图所示实验探究CO 的相关性质。为避免盐酸挥发出的HCl对实验的
2
干扰,选用稀硫酸与碳酸钠反应制取CO。
2
(1)写出装置A中仪器a的名称_______。
(2)实验中装置B内浓硫酸的作用是____。
(3)对比装置C与D中的实验现象,观察到干花不变色,湿花变红色,可得出的结论(用化学方程式表
达)______。
(4)持续通入CO,观察到装置E中的现象为_____________。
2
(5)依据装置F中观察到点燃的蜡烛由低到高依次熄灭,可得出CO 的性质有_____________。
2
【答案】 (1). 分液漏斗 (2). 吸水(或干燥气体) (3). (4). 澄清石灰水变
浑浊(或产生白色沉淀) (5). 密度比空气大,不燃烧,也不支持燃烧
【解析】
【详解】(1)装置A中仪器a的名称是:分液漏斗;
(2)浓硫酸具有吸水性,故可用于干燥气体;
(3)碳酸钠与稀硫酸反应生成二氧化碳,将干燥的二氧化碳通入C中,干花不变色,通入D中,湿花变
红,说明二氧化碳能与水反应生成碳酸,碳酸显酸性,能使紫色石蕊试液变红,该反应的化学方程式为:;
(4)持续通入二氧化碳,二氧化碳能与氢氧化钙反应生成碳酸钙和水,故观察到装置E中的现象为:澄
清石灰水变浑浊(或产生白色沉淀);
的
(5)装置F中观察到点燃 蜡烛由低到高依次熄灭,蜡烛熄灭,说明二氧化碳不燃烧,也不支持燃烧,
蜡烛由低到高依次熄灭,说明二氧化碳的密度比空气大。
13.中国北斗,星耀全球——6月23日,由氢氧发动机提供动力的长征三号乙火箭成功将北斗三号最好一颗
全球组网卫星送上太空。已知火箭将卫星送入预定轨道需要44t液氢(H),则使液氢完全燃烧需提供液
2
氧(O)多少吨?
2
【答案】352t
【解析】
【详解】解:设需要提供液氧的质量为x
x=352t
答:需要提供液氧的质量为352t。