文档内容
2020年四川省绵阳市中考化学试卷(教师版)
一、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项最符合题目要求)
1.(4分)下列诗句或俗语中,涉及化学反应的是( )
A.吹尽黄沙始见金 B.爝火燃回春浩浩
C.酒香不怕巷子深 D.铁杵磨成绣花针
【微点】化学变化和物理变化的判别.
【思路】本题考查学生对物理变化和化学变化的确定。判断一个变化是物理变化还是化学
变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成
其他物质的是物理变化。
【解析】解:A、吹尽黄沙始见金只是黄沙被吹走,金子露出来,没有新物质生成,属于物理
变化,故A错;
B、爝火燃回春浩浩,包含着物质燃烧,属于化学变化,故B正确;
C、酒香不怕巷子深,是酒精分子在不断运动的结果,因为分子在做永不停息的无规则运
动,与人的嗅觉细胞接触,人就能闻到味,属于物理变化,故C错;
D、铁杵磨成绣花针,只是将其磨细,没有其它物质生成,属于物理变化,故D错。
故选:B。
【点拨】搞清楚物理变化和化学变化的本质区别是解答本类习题的关键。判断的标准是看
在变化中有没有生成其他物质。一般地,物理变化有物质的固、液、气三态变化和物质形
状的变化。
2.(4分)2020年5月12日是第十二个全国防灾减灾日,为预防森林火灾,应张贴的标志是(
)
A. B.
C. D.
【微点】几种常见的与化学有关的图标.
第 1 页 / 共 14 页【思路】根据图标所表示的含义来考虑,并结合进入森林应注意的事项来回答本题。
【解析】解:森林火灾是一种突发性强、破坏性大、处置救助较为困难的自然灾害。故进入
森林要严禁携带火种。
A、图中所示标志是可循环使用标志,故不应张贴。
B、图中所示标志是有毒品标志,故不应张贴。
C、图中所示标志是节约用水标志,故不应张贴。
D、图中所示标志是禁止携带火种标志,故应张贴。
故选:D。
【点拨】本题难度不大,了解各个标志所代表的含义是解答此类题的关键。
3.(4分)“关爱生命,拥抱健康”是人类永恒的主题,下 列说法科学的是( )
A.甲醛有防腐作用,但不能用于浸泡食材
B.铁强化酱油因添加了铁单质可预防贫血病
C.纤维素不能被人体消化,因此对人体健康无益
D.医用酒精用于防疫消毒,其中乙醇的质量分数为75%
【微点】甲烷、乙醇等常见有机物的性质和用途;人体的元素组成与元素对人体健康的重
要作用;生命活动与六大营养素;亚硝酸钠、甲醛等化学品的性质与人体健康.
【思路】A、根据甲醛能够破坏人体中的蛋白质进行分析;
B、根据食用铁强化酱油中含有微量元素铁进行分析;
C、根据纤维素的作用解析分析;
D、根据医用酒精的配制方法分析判断。
【解析】解:A、甲醛能够破坏人体中的蛋白质,对人体有害,不能浸泡食材,故A正确;
B、食用铁强化酱油中含有微量元素铁,所以可预防缺铁性贫血,但这里的铁指的是含亚
铁离子的化合物,故B不正确;
C、纤维素不能被人体消化,但能助于食物的消化,故C不正确;
D、医用酒精用于防疫消毒,其中乙醇的体积(而不是质量)分数为75%,故D不正确。
故选:A。
【点拨】化学来源于生产生活,也服务于生产生活,知识考查时,与生产生活实际相关的情
景题已渐渐成为新宠。
4.(4分)今年我国将发射火星探测器。以下是关于火星的部分已知信息:
其橘红色外表是因为地表被赤铁矿覆盖;
①火星上无液态水,但有大量冰;
②
第 2 页 / 共 14 页火星大气的成分为二氧化碳95.3%、氮气2.7%、氩气1.6%、氧气和水汽0.4%。
③下列说法正确的是( )
A.赤铁矿的主要成分是四氧化三铁
B.火星上的冰转化为液态水要放出热量
C.未来在火星上可用CO获取铁单质
D.蜡烛在火星大气中可以燃烧
【微点】空气的成分及各成分的体积分数;一氧化碳的化学性质;金属元素的存在及常见
的金属矿物.
【思路】A.根据铁矿石的主要成分来分析;
B.根据水的三态变化来分析;
C.根据一氧化碳的还原性来分析;
D.根据燃烧的条件来分析。
【解析】解:A.赤铁矿的主要成分是氧化铁,选项说法错误;
B.冰转化为液态水要吸收热量,选项说法错误;
C.一氧化碳具有还原性,在高温的条件下,能将氧化铁还原为铁的单质,选项说法正确;
D.火星大气中氧气的含量很低,不能支持蜡烛的燃烧,所以蜡烛在火星大气中不能燃烧,
选项说法错误。
故选:C。
【点拨】本题考查了铁矿石的成分、物质的三态变化、一氧化碳的还原性以及燃烧的条件
等,难度不大。
5.(4分)实验室用KMnO 制氧气并验证氧气的性质,下列操作正确的是( )
4
A. 检查装置气密性
B. 加热KMnO 制O
4 2
第 3 页 / 共 14 页C. 验证O 已集满
2
D. 硫在O 中燃烧
2
【微点】制取氧气的操作步骤和注意点.
【思路】A.检查装置气密性的方法进行分析;
B.根据用高锰酸钾制取氧气的注意事项进行分析;
C.根据氧气验满的方法进行分析;
D.根据二氧化硫有毒不能直接排入空气,要用水吸收进行分析。
【解析】解:A.检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若
导管口有气泡冒出,装置不漏气,故A操作正确;
B.用高锰酸钾制取氧气时,为了防止加热时高锰酸钾进入导管,要在试管口放一团棉花,
故B操作错误;
C.氧气的密度比空气大,具有助燃性,用向上排空气法收集氧气验满的方法是:把带火星
的木条放在集气瓶口,若木条复燃则集满,故C操作错误;
D.生成的二氧化硫有毒,为了防止排入空气污染环境,要在集气瓶底部预留少量的水吸
收生成的二氧化硫,故D操作错误。
故选:A。
【点拨】本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操
作的注意事项是解答此类试题的关键。
6.(4分)我国科学家成功实现了用CO 和CH 合成醋酸,其反应的微观示意图如图,下列说
2 4
法错误的是( )
A.反应物、生成物均为有机物
第 4 页 / 共 14 页B.反应前后保持不变的粒子是原子
C.醋酸可使紫色石蕊溶液变成红色
D.反应前后催化剂的质量和化学性质无变化
【微点】有机物与无机物的区别;微粒观点及模型图的应用.
【思路】A、根据物质的组成分析;
B、根据微粒的变化分析;
C、根据醋酸的性质分析;
D、根据催化剂的特点分析。
【解析】解:A、由物质的组成可知,反应物二氧化碳不属于有机物,甲烷和醋酸属于有机物,
故A说法错误;
B、由微粒的变化可知,原子在化学反应中没有再分,反应前后保持不变的粒子是原子,故
B说法正确;
C、醋酸是一种酸,可使紫色石蕊溶液变成红色,故C说法正确;
D、由催化剂的特点可知,反应前后催化剂的质量和化学性质无变化,故D说法正确。
故选:A。
【点拨】本题主要考查了化学反应中微观粒子方面的知识,明确每个模型表示的含义,这
是解决这类题目的关键。
7.(4分)对下列事实的解释错误的是( )
选项 事实 解释
A 涂抹碱性溶液可减轻蚊虫叮咬的痛痒 碱性物质可中和蚊虫分泌的蚁酸
B 废旧电池属于有害垃圾,不可随意丢弃 电池中的铅汞等会造成水体和土壤污
染
C 制糖工业中常用活性炭脱色制白糖 活性炭可与有色物质发生化学反应
D 灯泡中充氮气以延长使用寿命 氮气的化学性质不活泼,可作保护气
A.A B.B C.C D.D
【微点】常见气体的用途;中和反应及其应用;碳单质的物理性质及用途;常见污染物的来
源、危害及治理.
【思路】A、根据蚊虫分泌的蚁酸显酸性,可以依据中和反应的原理,涂抹显碱性的物质,进
行分析判断。
B、根据废旧电池中的汞、铅、镉等重金属溶出会污染地下水和土壤,进行分析判断。
C、根据活性炭具有吸附性,进行分析判断。
D、根据氮气的化学性质不活泼,进行分析判断。
第 5 页 / 共 14 页【解析】解:A、蚊虫分泌的蚁酸显酸性,可涂抹碱性溶液可减轻蚊虫叮咬的痛痒,是因为碱
性物质可中和蚊虫分泌的蚁酸,故选项说法正确。
B、废旧电池中的汞、铅、镉等重金属溶出会污染地下水和土壤,废旧电池属于有害垃圾,
不可随意丢弃,故选项说法正确。
C、制糖工业中常用活性炭脱色制白糖,是因为活性炭具有吸附性,能吸附异味和色素,故
选项说法错误。
D、氮气的化学性质不活泼,可作保护气,灯泡中充氮气能延长使用寿命,故选项说法正确。
故选:C。
【点拨】本题难度不大,掌握中和反应的原理、氮气的化学性质不活泼、活性炭具有吸附性
等是正确解答本题的关键。
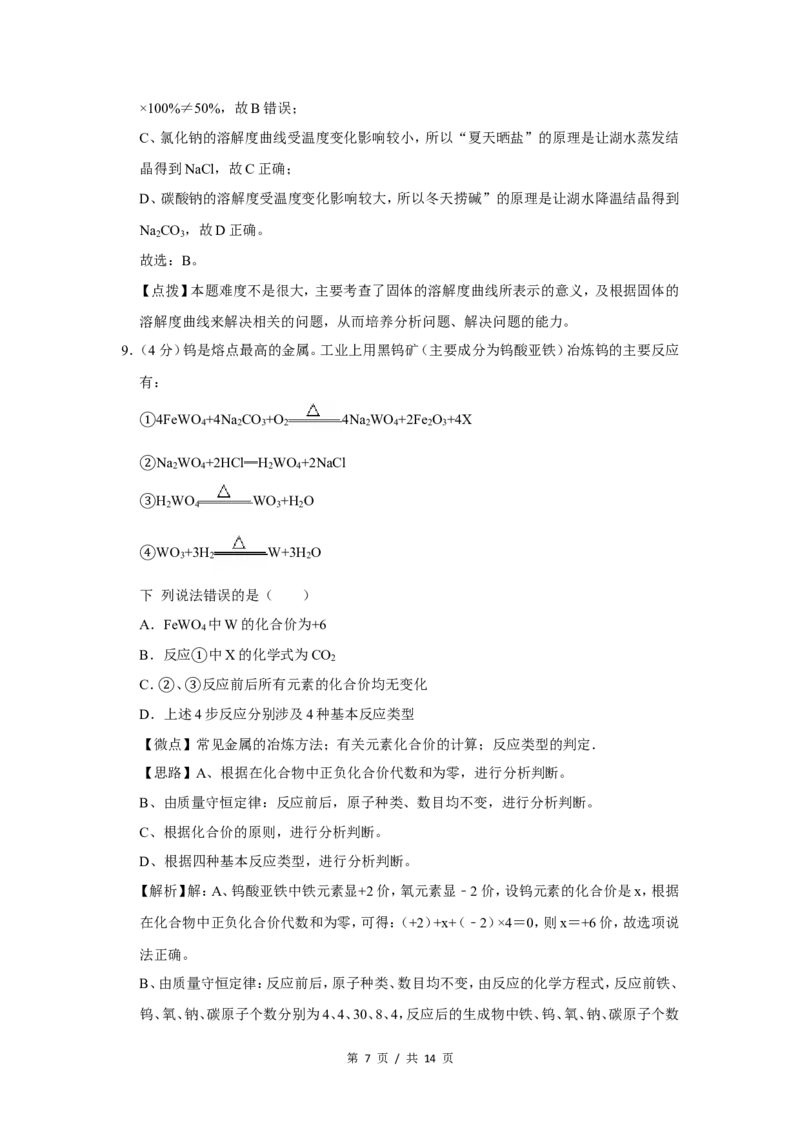
8.(4分)盐湖地区人们常采用“夏天晒盐,冬天捞碱”的方法来获取NaCl和Na CO .结合
2 3
溶解度曲线判断,下 列说法错误的是( )
A.NaCl的溶解度随温度变化不大
B.44℃时Na CO 饱和溶液的质量分数为50%
2 3
C.“夏天晒盐”的原理是让湖水蒸发结晶得到NaCl
D.“冬天捞碱”的原理是让湖水降温结晶得到Na CO
2 3
【微点】结晶的原理、方法及其应用;固体溶解度曲线及其作用.
【思路】根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定饱和
溶液的质量分数;判断物质的溶解度随温度变化的变化情况,从而判断从饱和溶液中得到
晶体的方法。
【解析】解:A、氯化钠的溶解度曲线比较平缓,所以NaCl的溶解度随温度变化不大,故A
正确;
B、44℃时,碳酸钠的溶解度是 50g,所以 Na CO 饱和溶液的质量分数为
2 3
第 6 页 / 共 14 页×100%≠50%,故B错误;
C、氯化钠的溶解度曲线受温度变化影响较小,所以“夏天晒盐”的原理是让湖水蒸发结
晶得到NaCl,故C正确;
D、碳酸钠的溶解度受温度变化影响较大,所以冬天捞碱”的原理是让湖水降温结晶得到
Na CO ,故D正确。
2 3
故选:B。
【点拨】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的
溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
9.(4分)钨是熔点最高的金属。工业上用黑钨矿(主要成分为钨酸亚铁)冶炼钨的主要反应
有:
4FeWO +4Na CO +O 4Na WO +2Fe O +4X
4 2 3 2 2 4 2 3
①
Na WO +2HCl═H WO +2NaCl
2 4 2 4
②
H WO WO +H O
2 4 3 2
③
WO +3H W+3H O
3 2 2
④
下 列说法错误的是( )
A.FeWO 中W的化合价为+6
4
B.反应 中X的化学式为CO
2
C. 、①反应前后所有元素的化合价均无变化
D.②上述③4步反应分别涉及4种基本反应类型
【微点】常见金属的冶炼方法;有关元素化合价的计算;反应类型的判定.
【思路】A、根据在化合物中正负化合价代数和为零,进行分析判断。
B、由质量守恒定律:反应前后,原子种类、数目均不变,进行分析判断。
C、根据化合价的原则,进行分析判断。
D、根据四种基本反应类型,进行分析判断。
【解析】解:A、钨酸亚铁中铁元素显+2价,氧元素显﹣2价,设钨元素的化合价是x,根据
在化合物中正负化合价代数和为零,可得:(+2)+x+(﹣2)×4=0,则x=+6价,故选项说
法正确。
B、由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前铁、
钨、氧、钠、碳原子个数分别为4、4、30、8、4,反应后的生成物中铁、钨、氧、钠、碳原子个数
第 7 页 / 共 14 页分别为4、4、22、8、0;根据反应前后原子种类、数目不变,则4X分子中含有4个碳原子和
8个氧原子,则每个X分子由1个碳原子和2个氧原子构成,则物质X的化学式为CO ,
2
故选项说法正确。
C、由化学方程式涉及的物质可知, 、 反应前后所有元素的化合价均无变化,故选项
说法正确。 ② ③
D、上述4步反应分别涉及复分解反应、分解反应、置换反应3种基本反应类型,故选项说
法错误。
故选:D。
【点拨】本题难度不大,掌握化学反应前后原子守恒、化合物中正负化合价代数和为零、四
种基本反应类型等是正确解答本题的关键。
三、(本题包括2小题,共29分)
10.(14分)2020年6月23日,长征三号乙运载火箭将北斗三号最后一颗组网卫星成功送入
预定轨道,我国北斗导航地位将进一步提升。从化学视角回答下列问题:
(1)卫星制造使用了黄金、钛合金,其中用作天线的是 钛合金 。使用黄金制作卫星的
电子元件,利用了金的什么化学性质? D (填序号)。
A.光泽好
B.耐磨、易加工
C.容易导电
D.很难被氧化
(2)卫星的太阳能电池帆板用先进的砷化镓主板和铝合金边框制成,砷(As)原子的结构
示意图如图,其中x= 5 。铝合金比纯铝具有的优势是 耐腐蚀 (写出1条即可)。
(3)运载火箭用偏二甲肼(C H N )作燃料,N O 作氧化剂。偏二甲肼中C、H、N的质量比
2 8 2 2 4
为 6 : 2 : 7 (填最简整数比)。火箭发射时,燃料与氧化剂剧烈反应放出大量的热,并生
成对空气无污染的两种氧化物和一种单质,这种单质的化学式为 N ,两种氧化物中相
2
对分子质量较大的是 二氧化碳 。
【微点】金属的物理性质及用途;合金与合金的性质;金属的化学性质;原子结构示意图与
第 8 页 / 共 14 页离子结构示意图.
【思路】(1)卫星制造使用了黄金、钛合金,其中用作天线的是钛合金,是因为钛合金具有
记忆功能;
使用黄金制作卫星的电子元件,是因为金很难被氧化。
(2)原子中,核电荷数=核内质子数=核外电子数=原子序数;铝合金比纯铝具有的优势
是耐腐蚀等。
(3)火箭发射时,燃料与氧化剂剧烈反应放出大量的热,并生成对空气无污染的两种氧化
物(水和二氧化碳)和一种单质(氮气)。
【解析】解:(1)卫星制造使用了黄金、钛合金,其中用作天线的是钛合金,是因为钛合金具
有记忆功能;
使用黄金制作卫星的电子元件,是因为金很难被氧化。
故填:钛合金;D。
(2)x=33﹣2﹣8﹣18=5;
铝合金比纯铝具有的优势是耐腐蚀等。
故填:5;耐腐蚀。
(3)偏二甲肼中C、H、N的质量比为:24:8:28=6:2:7;
火箭发射时,燃料与氧化剂剧烈反应放出大量的热,并生成对空气无污染的两种氧化物
(水和二氧化碳)和一种单质(氮气),这种单质的化学式为N ,两种氧化物中相对分子质
2
量较大的是二氧化碳。
故填:6:2:7;N ;二氧化碳。
2
【点拨】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行
分析、判断,从而得出正确的结论。
11.(15分)海水提取粗盐后的母液还可用来提取金属镁,其流程如图:
回答下列问题:
(1)如在实验室进行操作a,使用玻璃棒的目的是 引流 ,沉淀A的化学式是 Mg
( OH ) 。
2
(2)用贝壳生产石灰乳,发生反应的化学方程式有: CaCO CaO+CO ↑ 、
3 2
CaO+H O ═ Ca ( OH ) 。
2 2
第 9 页 / 共 14 页(3)由MgCl 溶液得到MgCl •6H O晶体,需要进行的实验操作有: 蒸发浓缩 、 降温
2 2 2
结晶 、过滤、洗涤。
(4)用203t MgCl •6H O晶体最多能制备金属镁 2 4 t。
2 2
【微点】物质的相互转化和制备.
【思路】(1)操作a能将沉淀与滤液分离,氯化镁能与氢氧化钙反应生成氢氧化镁沉淀和
氯化钙,进行分析解答。
(2)用贝壳生产石灰乳,贝壳的主要成分碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙
与水反应生成氢氧化钙,进行分析解答。
(3)由MgCl 溶液得到MgCl •6H O晶体,可采用降温结晶的方法,进行分析解答。
2 2 2
(4)根据反应前后镁元素的质量不变,进行分析解答。
【解析】解:(1)操作a能将沉淀与滤液分离,是过滤操作,使用玻璃棒的目的是引流;沉淀
A是氯化镁与氢氧化钙反应生成的氢氧化镁沉淀,沉淀A的化学式是Mg(OH) 。
2
(2)用贝壳生产石灰乳,贝壳的主要成分碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙
与水反应生成氢氧化钙,反应的化学方程式分别是 CaCO CaO+CO ↑、
3 2
CaO+H O═Ca(OH) 。
2 2
(3)MgCl •6H O晶体含有结晶水,不能采用蒸发结晶的方法,由MgCl 溶液得到
2 2 2
MgCl •6H O晶体,需要进行的实验操作有蒸发浓缩、降温结晶、过滤、洗涤。
2 2
(4)反应前后镁元素的质量不变,203tMgCl •6H O晶体最多能制备金属镁的质量为203t×
2 2
×100%=24t。
故答案为:
(1)引流;Mg(OH) ;
2
(2)CaCO CaO+CO ↑;CaO+H O═Ca(OH) ;
3 2 2 2
(3)蒸发浓缩;降温结晶;
(4)24。
【点拨】本题有一定难度,理解提取金属镁的流程,掌握酸碱盐的化学性质、结晶的方法等
是正确解答本题的关键。
四、(本题包括2小题,共25分)
12.(12分)文宏同学利用“金属树”趣味实验来验证Zn、Cu、Ag三种金属的活动性顺序。
第 10 页 / 共 14 页(1)为确保实验效果,CuCl 溶液和AgNO 溶液需现配。配制50g质量分数为12%的
2 3
CuCl 溶液,应称量 6 g CuCl ,加水时应选用 5 0 mL的量筒。除量筒外,配制溶液
2 2
还需要的玻璃仪器有 烧杯、玻璃棒、胶头滴管 。
(2)向两个放有宣纸的培养皿中分别滴入适量CuCl 溶液、AgNO 溶液,再放入锌粒,一
2 3
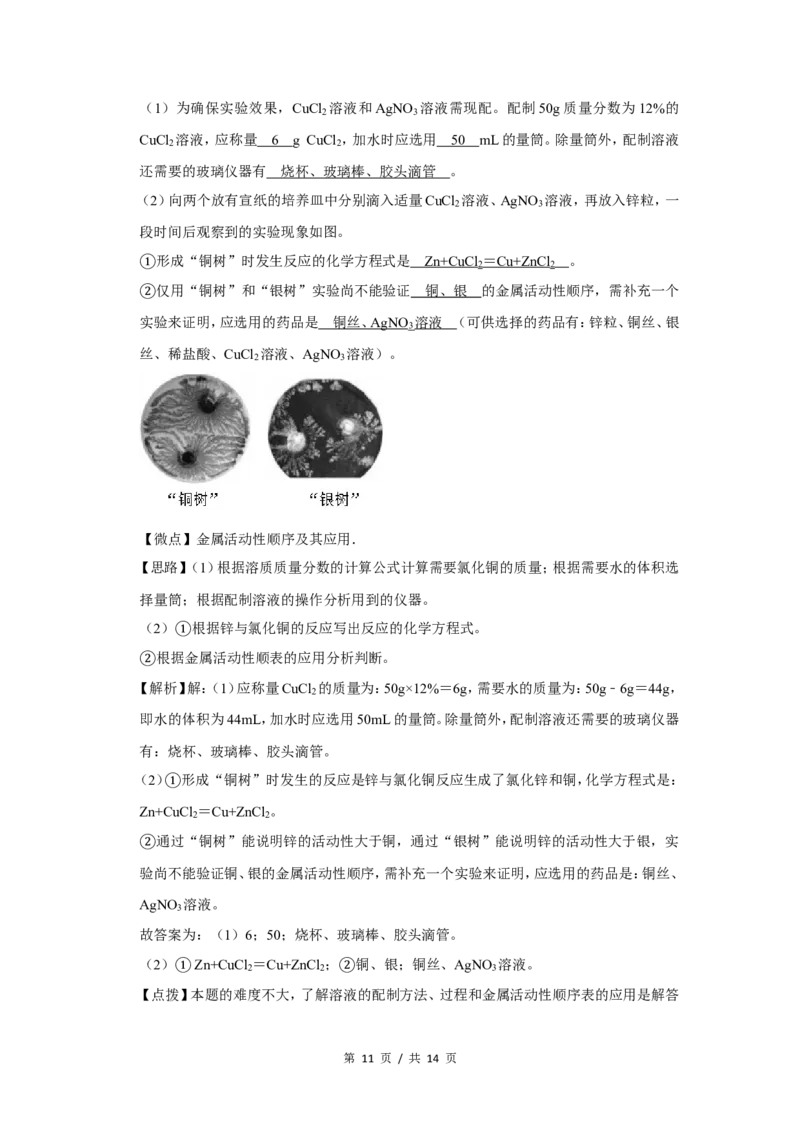
段时间后观察到的实验现象如图。
形成“铜树”时发生反应的化学方程式是 Zn+CuC l = Cu+ZnC l 。
2 2
①仅用“铜树”和“银树”实验尚不能验证 铜、银 的金属活动性顺序,需补充一个
②实验来证明,应选用的药品是 铜丝、 AgNO 溶液 (可供选择的药品有:锌粒、铜丝、银
3
丝、稀盐酸、CuCl 溶液、AgNO 溶液)。
2 3
【微点】金属活动性顺序及其应用.
【思路】(1)根据溶质质量分数的计算公式计算需要氯化铜的质量;根据需要水的体积选
择量筒;根据配制溶液的操作分析用到的仪器。
(2) 根据锌与氯化铜的反应写出反应的化学方程式。
根据①金属活动性顺表的应用分析判断。
【②解析】解:(1)应称量CuCl
2
的质量为:50g×12%=6g,需要水的质量为:50g﹣6g=44g,
即水的体积为44mL,加水时应选用50mL的量筒。除量筒外,配制溶液还需要的玻璃仪器
有:烧杯、玻璃棒、胶头滴管。
(2) 形成“铜树”时发生的反应是锌与氯化铜反应生成了氯化锌和铜,化学方程式是:
Zn+C①uCl =Cu+ZnCl 。
2 2
通过“铜树”能说明锌的活动性大于铜,通过“银树”能说明锌的活动性大于银,实
②验尚不能验证铜、银的金属活动性顺序,需补充一个实验来证明,应选用的药品是:铜丝、
AgNO 溶液。
3
故答案为:(1)6;50;烧杯、玻璃棒、胶头滴管。
(2) Zn+CuCl =Cu+ZnCl ; 铜、银;铜丝、AgNO 溶液。
2 2 3
【点拨①】本题的难度不大,了解溶②液的配制方法、过程和金属活动性顺序表的应用是解答
第 11 页 / 共 14 页本题的基础知识。
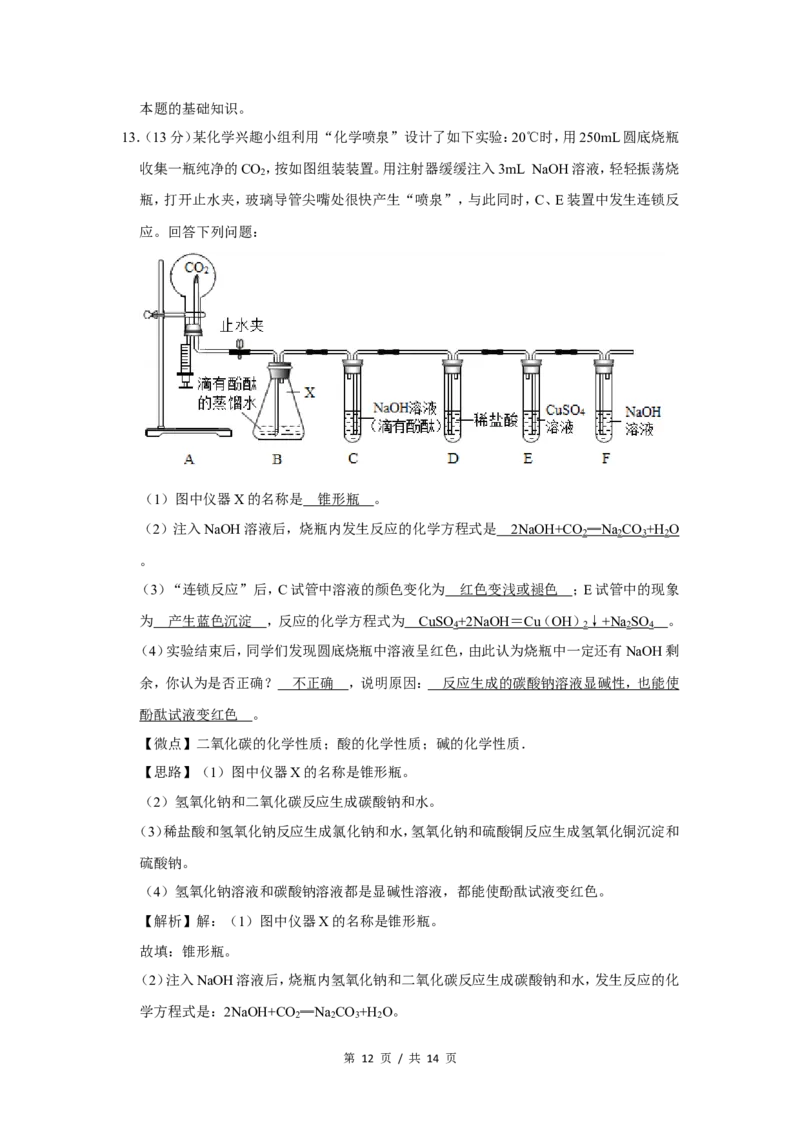
13.(13分)某化学兴趣小组利用“化学喷泉”设计了如下实验:20℃时,用250mL圆底烧瓶
收集一瓶纯净的CO ,按如图组装装置。用注射器缓缓注入3mL NaOH溶液,轻轻振荡烧
2
瓶,打开止水夹,玻璃导管尖嘴处很快产生“喷泉”,与此同时,C、E装置中发生连锁反
应。回答下列问题:
(1)图中仪器X的名称是 锥形瓶 。
(2)注入NaOH溶液后,烧瓶内发生反应的化学方程式是 2NaOH+CO ═ N a CO +H O
2 2 3 2
。
(3)“连锁反应”后,C试管中溶液的颜色变化为 红色变浅或褪色 ;E试管中的现象
为 产生蓝色沉淀 ,反应的化学方程式为 CuSO +2NaOH = Cu ( OH ) ↓ +N a SO 。
4 2 2 4
(4)实验结束后,同学们发现圆底烧瓶中溶液呈红色,由此认为烧瓶中一定还有NaOH剩
余,你认为是否正确? 不正确 ,说明原因: 反应生成的碳酸钠溶液显碱性,也能使
酚酞试液变红色 。
【微点】二氧化碳的化学性质;酸的化学性质;碱的化学性质.
【思路】(1)图中仪器X的名称是锥形瓶。
(2)氢氧化钠和二氧化碳反应生成碳酸钠和水。
(3)稀盐酸和氢氧化钠反应生成氯化钠和水,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和
硫酸钠。
(4)氢氧化钠溶液和碳酸钠溶液都是显碱性溶液,都能使酚酞试液变红色。
【解析】解:(1)图中仪器X的名称是锥形瓶。
故填:锥形瓶。
(2)注入NaOH溶液后,烧瓶内氢氧化钠和二氧化碳反应生成碳酸钠和水,发生反应的化
学方程式是:2NaOH+CO ═Na CO +H O。
2 2 3 2
第 12 页 / 共 14 页故填:2NaOH+CO ═Na CO +H O。
2 2 3 2
(3)“连锁反应”后,C试管中进入稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,溶
液的颜色变化为红色变浅或褪色,E试管中进入氢氧化钠溶液,氢氧化钠和硫酸铜反应生
成氢氧化铜沉淀和硫酸钠,现象为产生蓝色沉淀,反应的化学方程式为:CuSO +2NaOH=
4
Cu(OH) ↓+Na SO 。
2 2 4
故填:红色变浅或褪色;产生蓝色沉淀; CuSO +2NaOH=Cu(OH) ↓+Na SO 。
4 2 2 4
(4)不正确,是因为反应生成的碳酸钠溶液显碱性,也能使酚酞试液变红色。
故填:不正确;反应生成的碳酸钠溶液显碱性,也能使酚酞试液变红色。
【点拨】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行
分析、判断,从而得出正确的结论。
五、(本题包括1小题,共10分)
14.(10分)某袋装食品的脱氧剂由活性炭、铁粉和食盐混合而成,三者质量比为2:2:1.现
用该脱氧剂进行实验,回答下列问题:
(1)将该脱氧剂加入盐酸中,发生反应的化学方程式为 Fe+2HC l ═ FeC l +H ↑ 。
2 2
(2)打开失效的脱氧剂小袋,发现里面出现了红褐色物质,该物质的主要成分是 F e O
2 3
(填化学式)。5.0g未经使用的该脱氧剂最多能够吸收氧气 0.8 6 g。
(3)用电子秤称取7.20g完全失效后的脱氧剂放入烧杯中,加入足量稀硝酸,充分溶解后
过滤,滤渣为黑色粉末。向所得滤液中加入足量AgNO 溶液,充分反应产生的沉淀质量为
3
2.87g。列式计算该失效脱氧剂中NaCl的质量分数(计算结果精确到0.1%)。
【微点】根据化学反应方程式的计算.
【思路】(1)盐酸和铁反应生成氯化亚铁和氢气。
(2)铁锈主要成分是氧化铁。
(3)氯化钠和硝酸银反应生成白色沉淀氯化银和硝酸钠,根据反应的化学方程式及其提供
数据可以进行相关方面的计算。
【解析】解:(1)将该脱氧剂加入盐酸中,盐酸和铁反应生成氯化亚铁和氢气,发生反应的
化学方程式为:Fe+2HCl═FeCl +H ↑。
2 2
故填:Fe+2HCl═FeCl +H ↑。
2 2
(2)打开失效的脱氧剂小袋,发现里面出现了红褐色物质,该物质的主要成分是Fe O ;
2 3
5.0g未经使用的该脱氧剂最多能够吸收氧气质量:5.0g× ÷ × =0.86g。
故填:Fe O ;0.86。
2 3
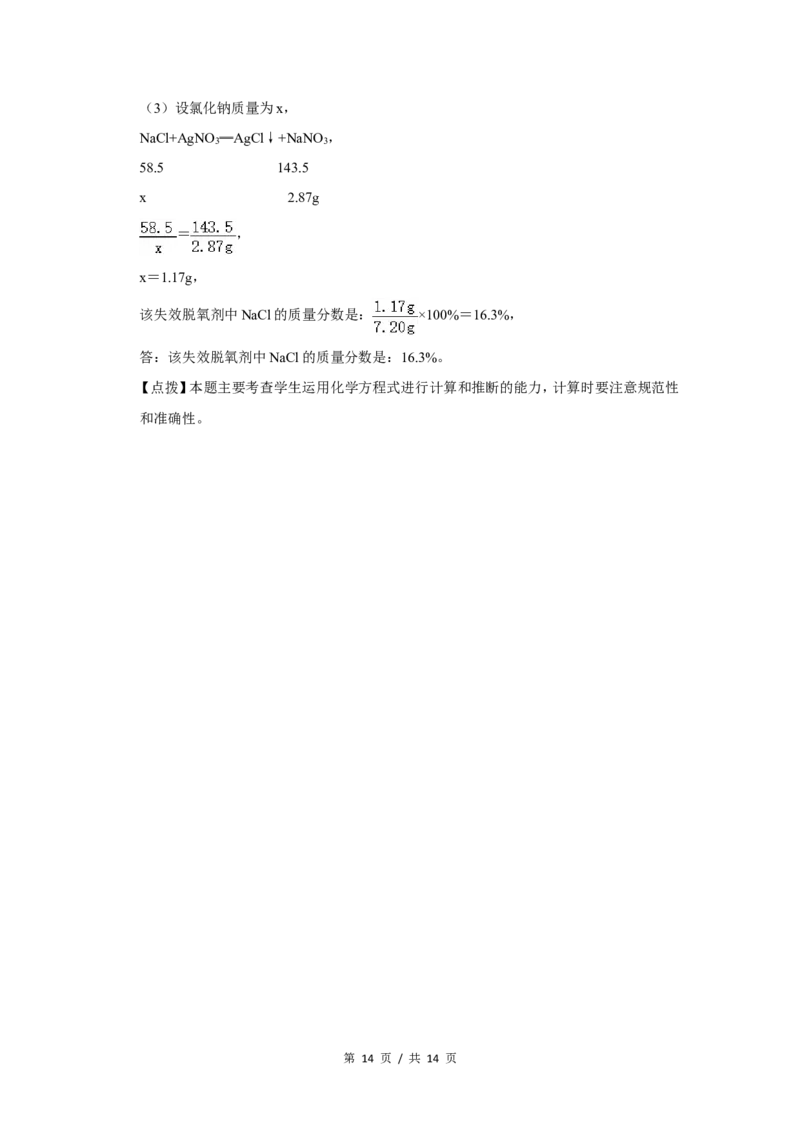
第 13 页 / 共 14 页(3)设氯化钠质量为x,
NaCl+AgNO ═AgCl↓+NaNO ,
3 3
58.5 143.5
x 2.87g
= ,
x=1.17g,
该失效脱氧剂中NaCl的质量分数是: ×100%=16.3%,
答:该失效脱氧剂中NaCl的质量分数是:16.3%。
【点拨】本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性
和准确性。
第 14 页 / 共 14 页