文档内容
2021 年山西中考化学试
卷
第 I 卷 选择题(共 50 分)
化学部份
可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 K—39
一、选择题(本大题共 10 个小题。每小题 2 分,共 20 分。在每小题给出的四个选项中,只有一项符合题目
要求,请选出并在答题卡上将该选项涂黑。)
1. 绿色映底蕴、山水见初心。每年的 3 月 12 日,习近平总书记都身体力行参加义务植树活动。 并诠释
造林绿化、厚植绿色中国的重大意义。造林绿化化最主要的作用是()
A.储备工业原料 B.改善生态环境 C.阻止阳光照射 D.生产农家肥料
2. “天丝”被誉为 21 世纪的绿色纤维,兼具天然纤维和合成纤维的优势,在高新科技方面应用广泛。以
下领域一般不使用"天丝"的是()
A.航空航天 B.新型材料 C.纯棉制造 D.轨道交通
3. 锰元素形成的化合物种类较多。下列化合物中,锰为+2 价的是( )
A.MnO B.KMnO C.K MnO D.MnCl
2 4 2 4 2
4. 袁隆平院士为我国杂交水稻高产稳产做出了突出贡献。水稻是我国主要的粮食作
物、脱壳后产出的大米是餐桌上不可或缺的主食,其富其富含的营养素是( )
A.水 B.糖类
C.油脂 D.维生素 水稻
5. 5 月 15 日,中国天问一号探测器成功着陆火星。火星上有峡谷山群、尘埃风暴, 昼夜温差较大。安全
着陆无需考虑的因素是( )
A.火星地形地貌 B.探测器金属硬度
C.火星岩石成分 D.探测器外壳熔点
6. 开心是一剂良药。人在高兴时,机体会分泌一种叫缩氨酸的荷尔蒙,它由 2~50 个氨基酸构成,能杀死
95%的癌细胞。该物质所含的元素种类有( )
6.1 种:C B.2 种:C、H C.3 种:C、H、O D.4 种:C、H、O、N
7. 拉瓦锡用定量的方法研究了空气的成分。后人仿照其实验原理测定空气中氧气含量(如图)。实验过程
中, 逐渐减少的气体和逐渐增多的物质是( )
A.O 、P O B.P、P O
2 2 5 2 5
C.O 、P D.N 、P O
2 2 2 5
8. 核电设施泄漏产生辐射时,人们需服用非放射性碘片(标签如下),保障
该碘在甲状腺里达到饱和。 以减少放射性碘(相对原子质量为 131)的吸收。有关表述正确的是( )
A.两种碘相对原子质量相等 B.碘片属于纯净物
中文名:碘片
C.标签中 KI 的相对分子质量为 170 D.两种碘对人体影响不同 主要成分:碘化钾KI
碘的相对原子质量:1279. 设计实验方案,分析实验原理,解决实验问题,是化学独特的学科思想。下图所示,当把胶头滴管内液
体全部滴入试管中时,能达到实验目的的是( )
A.验证分子运动 B.处理酸性废水 C.证明反应发生 D.验证质量守恒定律
10.某小组同学在探究过程中,通过观察与实验,推理与判断,如不考虑水分蒸发,最后得出的结论正确的
是( )
温度/℃ 0 20 40 60 80
溶解度/g 熟石灰 0.18 0.16 0.14 0.11 0.09
硫酸铜晶体 14.3 20.7 28.5 40 55
A. ①中溶液的溶质质量分数为 16%
B. ②中加入氢氧化钠的过程中,有氢氧化钙析出
C.③中棉线上析出晶体的质量一定是 34.3g D.④
中加入氢氧化钠前、后均为硫酸铜饱和溶液
第 II 卷 选择题(共 100 分)
化学部份
可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 K—39
三、生活、生产应用题(水大题共 5 个小题。化学方程 5 方程式每空 2 分,其余每空 1 分,共 16 分。)
【关注生活现象】
山西省大力实施文化强省战略,着力推进文旅融合.通过转型跨越,实现经济高质量发展。 下面展示了几
个旅游景点,请运用所学化学知识,就相关问题表达观点完成 21 题~24 题。
图 I—西侯度圣火 图 II—壶口瀑布 图 III—万年冰洞
21.图Ⅰ:西侯度遗址是中国最早的人类用火证据, 曾为全国二青会圣火采集留下了举国关注的佳话。 圣火
采集,选用主要成分为 的天然气作为清洁燃料,圣火燃烧发生反应的化学方程式为
。22.图Ⅱ:壶口瀑布以排山倒海的雄姿著称于世,彰显中华母亲河的博大恢宏。黄河已成为造福百姓的幸福
河,生活诸多方面都离不开她,黄河水在发展经方面可用于 。浑浊的河水给牲畜饮用时,
事先应进行的简单处理是 。
23.图Ⅲ:"万年冰洞"诞生于新生代第四纪冰川时期。冰洞内冰的物质成分用化学式表示为 ,与同
质量的水相比,其体积变 ,分子间的间隔变 。
24.为保护我省地面旅游资源,西侯度遗址上的木制建筑应严禁烟火,理由是 。
为保障壶口瀑布等景点的环境卫生,应做到 。
【关注生产实际】
25.造纸术是中国古代四大发明之一,一直以来,传统工艺不断改进。现阶段,利用方解石(主要成分为 CaCO
3
还含
有少量 MgO、Fe O 、SiO 等杂质)造纸已较为普遍,它取代传统的植物纤维造纸,全程无需用水, 原
2 3 2
料造价仅为传统造纸的 1/3。(已知:SiO 、聚乙烯塑料、 粘合剂均难溶于水,且不与盐酸反应。)分析
2
生产过程,回答下列问题:
(1)将方解石粉碎成纳米级超细粉末的目的是 。
(2)混合器内需要进行的操作是 。
(3)利用方解石作原料生产纸张的优点是 。
(4)从绿色环保的角度分析,对使用的原料需要改进的地方是 。
(5)成品纸张在保存过程中避免与酸接触,若遇到稀盐酸,则可能发生反应的化学方程式为
(写一个)。
四、科普阅读题(本大题共 1 个小题。化学方程式每空 2 分,其余每空 1 分,共 7 分。)
26.26.
气候变化中的海洋
海洋覆盖了地球 70%以上的面积,是世界上最大的生物栖息地,有超过 25 万种生物生活
在其中, 为人类提供了食物、能源和交通,是应对气候变化的忠实"朋友"。
20 世纪 50 年代以来,人类活动产生的温室气体导致地球系统热量不断增加。海洋吸收
了绝大部分全球变暖的热量,还"消化"了 2-3 倍人为排放的二氧化碳,减缓了气候变化速度及
影响。
20 世纪 90 年代初以来,海洋变暖的速度增加了 1 倍。在过去的 20 年里,所有大洋盆地
都观测到了持续数天到数月的极端海洋高温天气,即"海洋高温热浪",它可以延伸数千公里的
范围,深达数百米。热浪频发,易引起更强烈的热带气旋、厄尔尼诺现象等。2006-2015 年,全
球平均海平面每年上升约 3.6mm,为 1901-1990 年期间上升速度的 2.5 倍。海洋在溶解了二
氧化碳后,酸性增强,会影响社蛎、蛤蜊等贝类的外壳或骨骼的形成。
阅读文本,回答问题:
(1)海洋为人类提供的食物有 (举 1 例,下同),能源有 。
(2)海洋吸收热量发生的变化属于 (填"物理变化"或"化学变化")。
(3)海洋"消化二氧化碳"的过程中发生反应的化学方程式为 。(4)"海洋高温热浪"对海洋生物的危害是 。为保护海洋生态系统统,
人类应采取的有效措施是 。
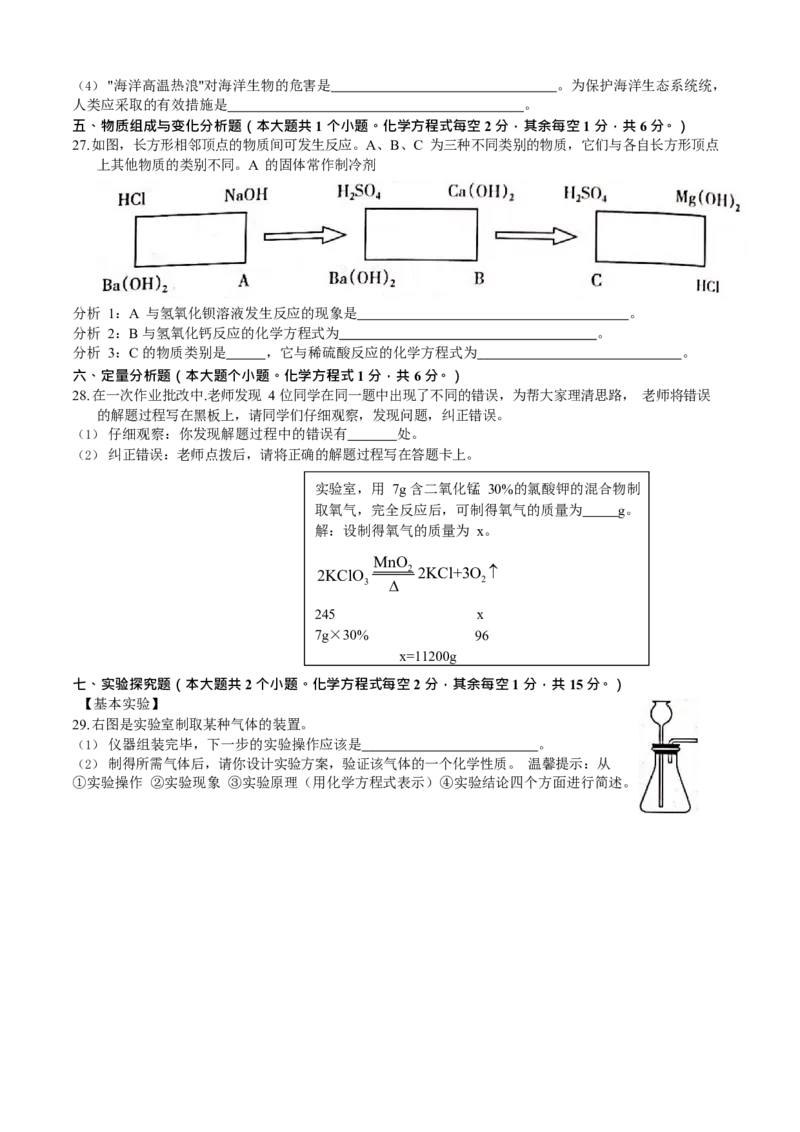
五、物质组成与变化分析题(本大题共 1 个小题。化学方程式每空 2 分,其余每空 1 分,共 6 分。)
27.如图,长方形相邻顶点的物质间可发生反应。A、B、C 为三种不同类别的物质,它们与各自长方形顶点
上其他物质的类别不同。A 的固体常作制冷剂
分析 1:A 与氢氧化钡溶液发生反应的现象是 。
分析 2:B 与氢氧化钙反应的化学方程式为 。
分析 3:C 的物质类别是 ,它与稀硫酸反应的化学方程式为 。
六、定量分析题(本大题个小题。化学方程式 1 分,共 6 分。)
28.在一次作业批改中.老师发现 4 位同学在同一题中出现了不同的错误,为帮大家理清思路, 老师将错误
的解题过程写在黑板上,请同学们仔细观察,发现问题,纠正错误。
(1)仔细观察:你发现解题过程中的错误有 处。
(2)纠正错误:老师点拨后,请将正确的解题过程写在答题卡上。
实验室,用 7g 含二氧化锰 30%的氯酸钾的混合物制
取氧气,完全反应后,可制得氧气的质量为 g。
解:设制得氧气的质量为 x。
MnO
2KClO 2 2KCl+3O
3 2
245 x
7g×30% 96
x=11200g
七、实验探究题(本大题共 2 个小题。化学方程式每空 2 分,其余每空 1 分,共 15 分。)
【基本实验】
29.右图是实验室制取某种气体的装置。
(1)仪器组装完毕,下一步的实验操作应该是 。
(2)制得所需气体后,请你设计实验方案,验证该气体的一个化学性质。 温馨提示:从
①实验操作 ②实验现象 ③实验原理(用化学方程式表示)④实验结论四个方面进行简述。【科学探究】
30. 3 月 16 日,沙尘暴席卷我国西北地区,次日多地又遇到降雨。该地某校环境监测实践小组的同学们,对沙
尘暴的成因、危害、成分、防护、治理以及雨水酸碱度的异常变化产生了浓厚的兴趣,在老师的指导下,他
们紧急立项,开启了项目性学习的探究之旅。
任务一:监测沙尘暴的成因 任务二:分析沙尘暴的危害
同学们参与当地环境监测。他们 1 米高台上, 当人暴露于沙尘天气中时,含有各种有毒的化
利用"风向风速器",测得风速为 10m/s 时, 学 物质、病菌等的尘土可进入到口、鼻、眼、
有大量的沙尘被卷入空中,能见度迅速降低。 耳中引发各种 疾病。除此之外,沙尘暴还会产
引发这一自然现象的根本原因是 生的危害是 (写
(写 1 条)。 1 条)。
任务三:探究沙尘暴的成分
【信息检索】我国西北地区,含有大量钠盐的干涸盐湖和盐碱地总面积约有 50 万平方公里,为沙尘暴的形
成埋下隐患。
【猜想假设】此次沙尘暴中可能含有碳酸钠等碱性物质。
【进行实验】取少量盐碱地的土壤与蒸馏水按 1:5 的质量比在烧杯中混合,充分搅拌后静置, 取上层清液,
用右图装置完成如下实验。
项目 实验步骤 实验现象 实验结论
方案 ①挤压胶头滴管 a,滴入 产生白色沉淀 沙尘暴中含有 Na CO ,
2 3
不含 NaOH
②挤压胶头滴管,滴入几滴酚酞 酚酞溶液不变色
【反思评价】
(1)步骤①中发生反应的化学方程式为 。
(2)自然界的土壤通常不含 NaOH,理由是 。
(3)若加入的 X 是 (填化学式),则只能证明沙尘暴中含有 Na
2
CO
3
,而不能确定是否含有 NaOH。
任务四:评价雨水 pH 异常的原因
【数据监测】小组同学在老师的帮助下,从环保部门获得了当地雨水的 pH 数据。
【表达交流】3 月 17 日,雨水 pH 出现异常的原因是 。
【检查进度】该项目性学习还没有进行的探究项目是 。
测定时间 3 月 5 日 3 月 17 日 3 月 28 日 3 月 31 日
pH 5.57 5.73 5.60 5.59
2021 年山西中考化学试卷
第 I 卷 选择题(共 50 分)
化学部份
可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 K—39
一、选择题(本大题共 10 个小题。每小题 2 分,共 20 分。在每小题给出的四个选项中,只有一项符合题目
要求,请选出并在答题卡上将该选项涂黑。)
11.绿色映底蕴、山水见初心。每年的 3 月 12 日,习近平总书记都身体力行参加义务植树活动。 并诠释
造林绿化、厚植绿色中国的重大意义。造林绿化化最主要的作用是()
A.储备工业原料 B.改善生态环境 C.阻止阳光照射 D.生产农家肥料
【考点】化学与环境
【难度】★
【答案】B
【解析】植物可以改善空气质量,防止水土流失等,所以造林绿化可以改善生态环境
12.“天丝”被誉为 21 世纪的绿色纤维,兼具天然纤维和合成纤维的优势,在高新科技方面应用广泛。以
下领域一般不使用"天丝"的是()
A.航空航天 B.新型材料 C.纯棉制造 D.轨道交通
【考点】材料;性质与用途对应关系
【难度】★
【答案】C
【解析】纯棉制造需要用棉花,“天丝”不是棉花,所以纯棉制造不使用
13.锰元素形成的化合物种类较多。下列化合物中,锰为+2 价的是( )
A.MnO B.KMnO C.K MnO D.MnCl
2 4 2 4 2
【考点】化合价计算
【难度】★★
【答案】D
【解析】化合物中正负化合价的代数和为零。
A、二氧化锰中氧为-2 价,所以锰为+4 价,错误;
B、高锰酸钾中钾是+1 价,氧是-2 价,所以锰是+7 价,错误;
C、锰酸钾中锰元素化合价是+6 价,错误;
D、氯化锰中氯元素是-1 价,所以锰元素是+2 价,正确;
14.袁隆平院士为我国杂交水稻高产稳产做出了突出贡献。水稻是我国主要的粮食作
物、脱壳后产出的大米是餐桌上不可或缺的主食,其富其富含的营养素是( )
A.水 B.糖类
C.油脂 D.维生素 水稻
【考点】六大基本营养素【难度】★
【答案】B
【解析】大米富含淀粉,淀粉属于糖类,故选 B
15.5 月 15 日,中国天问一号探测器成功着陆火星。火星上有峡谷山群、尘埃风暴, 昼夜温差较大。安全
着陆无需考虑的因素是( )
A.火星地形地貌 B.探测器金属硬度
C.火星岩石成分 D.探测器外壳熔点
【考点】性质与用途
【难度】★
【答案】C
【解析】火星岩石成分和安全着陆并无关系,无需考虑
16.开心是一剂良药。人在高兴时,机体会分泌一种叫缩氨酸的荷尔蒙,它由 2~50 个氨基酸构成,能杀死
95%的癌细胞。该物质所含的元素种类有( )
16.1种:C B.2 种:C、H C.3 种:C、H、O D.4 种:C、H、O、N
【考点】氨基酸元素组成
【难度】★
【答案】D
【解析】氨基酸是构成蛋白质的基本单位,主要含有碳氢氧氮四种元素,故选 D
17.拉瓦锡用定量的方法研究了空气的成分。后人仿照其实验原理测定空气中氧气含量(如图)。实验过程
中, 逐渐减少的气体和逐渐增多的物质是( )
A.O 、P O B.P、P O
2 2 5 2 5
C.O 、P D.N 、P O
2 2 2 5
【考点】测定空气中氧气含量实验
【难度】★★
【答案】A
【解析】红磷燃烧消耗氧气,生成五氧化二磷,所以逐渐减少的气体是氧气,逐渐增多的物质是五氧化二磷,
故选 A
18.核电设施泄漏产生辐射时,人们需服用非放射性碘片(标签如下),保障该碘在甲状腺里达到饱和。
以减少放射性碘(相对原子质量为 131)的吸收。有关表述正确的是( )
A.两种碘相对原子质量相等 B.碘片属于纯净物
中文名:碘片
C.标签中 KI 的相对分子质量为 170 D.两种碘对人体影响不同
主要成分:碘化钾KI
碘的相对原子质量:127
【考点】化学式计算;物质分类
【难度】★★
【答案】D
【解析】A、非放射性碘的相对原子质量是 127,放射性碘的相对原子质量是 131,两者不相同,错误; B、
碘片主要成分是碘化钾,还含有其他物质,属于混合物,错误;
C、标签中碘化钾的相对分子质量为 127+39=166,不是 170,错误; D、
两种碘一种有放射性,一种没有,对人体影响不同,正确;
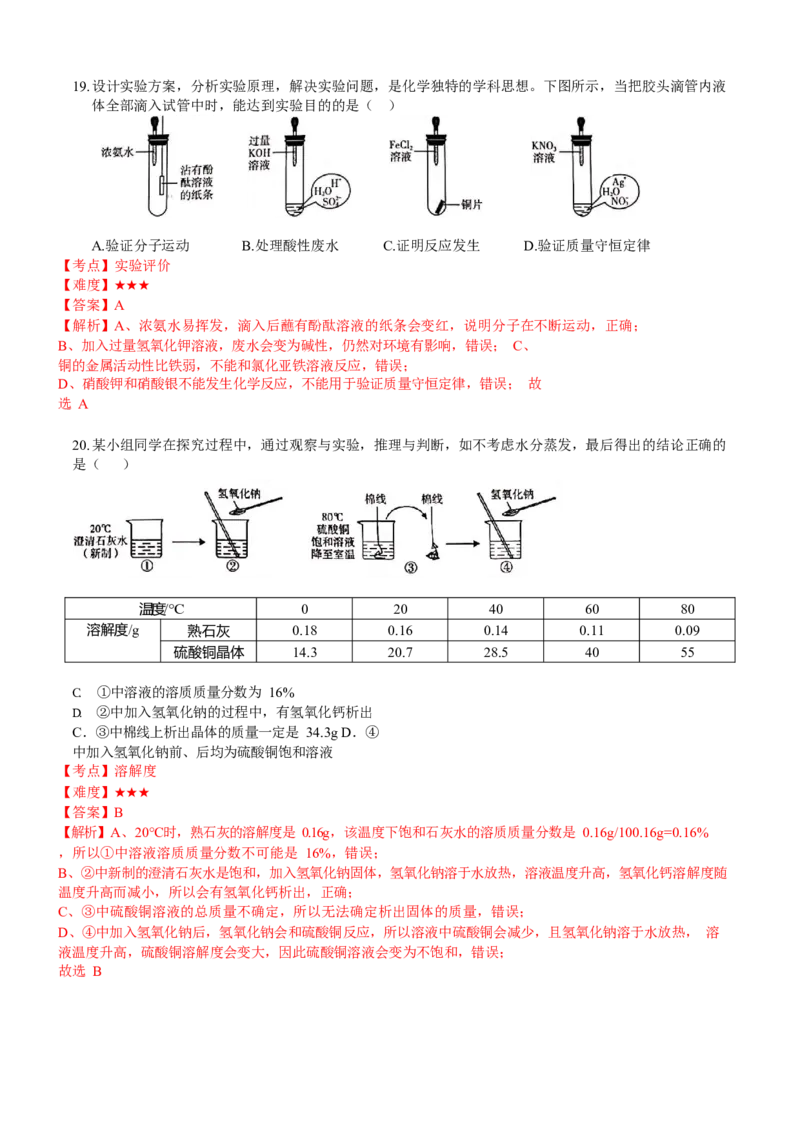
故选 D19.设计实验方案,分析实验原理,解决实验问题,是化学独特的学科思想。下图所示,当把胶头滴管内液
体全部滴入试管中时,能达到实验目的的是( )
A.验证分子运动 B.处理酸性废水 C.证明反应发生 D.验证质量守恒定律
【考点】实验评价
【难度】★★★
【答案】A
【解析】A、浓氨水易挥发,滴入后蘸有酚酞溶液的纸条会变红,说明分子在不断运动,正确;
B、加入过量氢氧化钾溶液,废水会变为碱性,仍然对环境有影响,错误; C、
铜的金属活动性比铁弱,不能和氯化亚铁溶液反应,错误;
D、硝酸钾和硝酸银不能发生化学反应,不能用于验证质量守恒定律,错误; 故
选 A
20.某小组同学在探究过程中,通过观察与实验,推理与判断,如不考虑水分蒸发,最后得出的结论正确的
是( )
温度/℃ 0 20 40 60 80
溶解度/g 熟石灰 0.18 0.16 0.14 0.11 0.09
硫酸铜晶体 14.3 20.7 28.5 40 55
C. ①中溶液的溶质质量分数为 16%
D. ②中加入氢氧化钠的过程中,有氢氧化钙析出
C.③中棉线上析出晶体的质量一定是 34.3g D.④
中加入氢氧化钠前、后均为硫酸铜饱和溶液
【考点】溶解度
【难度】★★★
【答案】B
【解析】A、20℃时,熟石灰的溶解度是 0.16g,该温度下饱和石灰水的溶质质量分数是 0.16g/100.16g=0.16%
,所以①中溶液溶质质量分数不可能是 16%,错误;
B、②中新制的澄清石灰水是饱和,加入氢氧化钠固体,氢氧化钠溶于水放热,溶液温度升高,氢氧化钙溶解度随
温度升高而减小,所以会有氢氧化钙析出,正确;
C、③中硫酸铜溶液的总质量不确定,所以无法确定析出固体的质量,错误;
D、④中加入氢氧化钠后,氢氧化钠会和硫酸铜反应,所以溶液中硫酸铜会减少,且氢氧化钠溶于水放热, 溶
液温度升高,硫酸铜溶解度会变大,因此硫酸铜溶液会变为不饱和,错误;
故选 B第 II 卷 选择题(共 100 分)
化学部份
可能用到的相对原子质量:H—1 C—12 O—16 Cl—35.5 K—39
三、生活、生产应用题(水大题共 5 个小题。化学方程 5 方程式每空 2 分,其余每空 1 分,共 16 分。)
【关注生活现象】
山西省大力实施文化强省战略,着力推进文旅融合.通过转型跨越,实现经济高质量发展。 下面展示了几个
旅游景点,请运用所学化学知识,就相关问题表达观点完成 21 题~24 题。
图 I—西侯度圣火 图 II—壶口瀑布 图 III—万年冰洞
30.图Ⅰ:西侯度遗址是中国最早的人类用火证据, 曾为全国二青会圣火采集留下了举国关注的佳话。 圣火
采集,选用主要成分为 的天然气作为清洁燃料,圣火燃烧发生反应的化学方程式为
。
【考点】天然气;化学方程式书写
【难度】★
【答案】甲烷;
【解析】天然气的主要成分是甲烷,甲烷燃烧生成水和二氧化碳,方程式配平即可;
31.图Ⅱ:壶口瀑布以排山倒海的雄姿著称于世,彰显中华母亲河的博大恢宏。黄河已成为造福百姓的幸福
河,生活诸多方面都离不开她,黄河水在发展经方面可用于 。浑浊的河水给牲畜饮用时,
事先应进行的简单处理是 。
【考点】水资源利用;水的净化
【难度】★
【答案】灌溉/发电;沉降泥沙/静置沉淀
【解析】黄河水可以用于灌溉农作物或者用于水力发电;浑浊的河水含有大量泥沙,可以通过静置沉淀的方法
使泥沙沉降;
32.图Ⅲ:"万年冰洞"诞生于新生代第四纪冰川时期。冰洞内冰的物质成分用化学式表示为 ,与同
质量的水相比,其体积变 ,分子间的间隔变 。
【考点】化学式书写;变化的微观实质
【难度】★
【答案】 ;大;大
【解析】冰是固态的水,和水是同一种物质,所以化学式与水相同,是 ;水结冰后体积会变大,分子间
间隔变大;33.为保护我省地面旅游资源,西侯度遗址上的木制建筑应严禁烟火,理由是 。
为保障壶口瀑布等景点的环境卫生,应做到 。
【考点】燃烧条件;文明行为
【难度】★
【答案】木材是可燃物/木材具有可燃性;不乱扔垃圾/不随地吐痰
【解析】木材属于可燃物,容易燃烧,所以木质建筑应严禁烟火,防止发生火灾;为保障景点环境卫生,
应该做到不乱扔垃圾,不随地吐痰等;
【关注生产实际】
34.造纸术是中国古代四大发明之一,一直以来,传统工艺不断改进。现阶段,利用方解石(主要成分为 CaCO
3
还含
有少量 MgO、Fe O 、SiO 等杂质)造纸已较为普遍,它取代传统的植物纤维造纸,全程无需用水, 原
2 3 2
料造价仅为传统造纸的 1/3。(已知:SiO 、聚乙烯塑料、 粘合剂均难溶于水,且不与盐酸反应。)分析
2
生产过程,回答下列问题:
(6)将方解石粉碎成纳米级超细粉末的目的是 。
(7)混合器内需要进行的操作是 。
(8)利用方解石作原料生产纸张的优点是 。
(9)从绿色环保的角度分析,对使用的原料需要改进的地方是
。(5)成品纸张在保存过程中避免与酸接触,若遇到稀盐酸,则可能发生反应的化学方程式为
(写一个)。
【考点】工业流程
【难度】★★
【答案】(1)提高纸张质量/平整度;(2)搅拌;(3)成本低/节省木材;(4)使用可降解塑料/使用无毒
无害的粘合剂;(5) /
【解析】(1)该流程是通过将方解石粉,聚乙烯塑料粉粘合挤压造纸,将方解石粉碎成纳米级超细粉末可以
提高纸张质量;(2)混合器内需要搅拌使原材料混合均匀;(3)利用方解石作原料造纸取代了植物 纤维造
纸,全程无需用水,造价为传统造纸的三分之一,所以优点是成本低、节省木材,节约水资源等;
(4)使用的原料中的聚乙烯塑料不易降解,容易造成污染,可用可降解塑料代替,粘合剂可能有毒,应使
用无毒无害的粘合剂;(5)方解石的主要成分是碳酸钙,还含少量氧化镁、氧化铁、二氧化硅等杂质
,二氧化硅、聚乙烯塑料、粘合剂均不和盐酸反应,所以成品纸张遇到稀盐酸,碳酸钙、氧化镁、氧化铁
会和盐酸反应,任写一个即可;四、科普阅读题(本大题共 1 个小题。化学方程式每空 2 分,其余每空 1 分,共 7 分。)
35.26.
气候变化中的海洋
海洋覆盖了地球 70%以上的面积,是世界上最大的生物栖息地,有超过 25 万种生物生活
在其中, 为人类提供了食物、能源和交通,是应对气候变化的忠实"朋友"。
20 世纪 50 年代以来,人类活动产生的温室气体导致地球系统热量不断增加。海洋吸收
了绝大部分全球变暖的热量,还"消化"了 2-3 倍人为排放的二氧化碳,减缓了气候变化速度及
影响。
20 世纪 90 年代初以来,海洋变暖的速度增加了 1 倍。在过去的 20 年里,所有大洋盆地
都观测到了持续数天到数月的极端海洋高温天气,即"海洋高温热浪",它可以延伸数千公里的
范围,深达数百米。热浪频发,易引起更强烈的热带气旋、厄尔尼诺现象等。2006-2015 年,全
球平均海平面每年上升约 3.6mm,为 1901-1990 年期间上升速度的 2.5 倍。海洋在溶解了二
氧化碳后,酸性增强,会影响社蛎、蛤蜊等贝类的外壳或骨骼的形成。
阅读文本,回答问题:
(5)海洋为人类提供的食物有 (举 1 例,下同),能源有 。
(6)海洋吸收热量发生的变化属于 (填"物理变化"或"化学变化")。
(7)海洋"消化二氧化碳"的过程中发生反应的化学方程式为 。
(8)"海洋高温热浪"对海洋生物的危害是 。为保护海洋生态系统统
,人类应采取的有效措施是 。
【考点】能源;物质变化;环保
【难度】★★
【答案】(1)海鲜/鱼;潮汐能/风能;(2)物理变化;(3) ;(4)降低生物活性/危
害生物生存;减少化石能源使用/使用清洁能源
【解析】(1)海洋中的鱼类、贝类、藻类等均可作为食物,合理即可;海洋能提供潮汐能,风能等;(2
)海洋吸收热量没有新物质生成,属于物理变化;(3)海洋“消化二氧化碳”是水和二氧化碳反应生成碳酸
从而将二氧化碳吸收;(4)由材料可知,“海洋高温热浪”是指持续数天到数月的极端高温海洋天气,易引起
更强烈的热带气旋、厄尔尼诺现象等,不利于海洋生物生存;人类活动产生的温室气体导致地球系统热量
不断增加,海洋吸收了大部分热量导致温度升高,所以人类应减少温室气体的排放,通过减少化石能源的使
用,使用清洁能源等措施防止海洋变暖;五、物质组成与变化分析题(本大题共 1 个小题。化学方程式每空 2 分,其余每空 1 分,共 6 分。)
36.如图,长方形相邻顶点的物质间可发生反应。A、B、C 为三种不同类别的物质,它们与各自长方形顶点
上其他物质的类别不同。A 的固体常作制冷剂
分析 1:A 与氢氧化钡溶液发生反应的现象是 。
分析 2:B 与氢氧化钙反应的化学方程式为 。
分析 3:C 的物质类别是 ,它与稀硫酸反应的化学方程式为 。
【考点】物质分类;酸碱盐化学性质
【难度】★★★
【答案】分析 1:有白色沉淀生成;溶液变浑浊;
分析 2: /
分析 3:单质/金属; /
【解析】分析 1:A 的固体常作制冷剂,显然 A 是二氧化碳,其固体干冰是常用制冷剂,二氧化碳和氢氧
化钡反应会生成碳酸钡沉淀,所以现象是有白色沉淀生成;
分析 2:A、B、C 为不同类别物质,且与各自长方形顶点上其他物质类别不同,A 是二氧化碳,是氧化物,
第二个长方形顶点上有酸和碱,所以 B 只能是单质或盐,因为长方形相邻顶点间可发生反应,所以 B 可以
和氢氧化钙、氢氧化钡反应,因此 B 应该是可溶性盐,可溶性碳酸盐、铜盐、铁盐、镁盐等均可;
分析 3:A 是氧化物,B 是盐,第三个长方形中已经有酸和碱,所以 C 只能是单质,因为 C 可以和盐酸、
硫酸反应,因此 C 是氢前金属单质,镁、铝、锌、铁等均可;
六、定量分析题(本大题个小题。化学方程式 1 分,共 6 分。)
37.在一次作业批改中.老师发现 4 位同学在同一题中出现了不同的错误,为帮大家理清思路, 老师将错误
的解题过程写在黑板上,请同学们仔细观察,发现问题,纠正错误。
(3)仔细观察:你发现解题过程中的错误有 处。
(4)纠正错误:老师点拨后,请将正确的解题过程写在答题卡上。
实验室,用 7g 含二氧化锰 30%的氯酸钾的混合物制
取氧气,完全反应后,可制得氧气的质量为 g。
解:设制得氧气的质量为 x。
MnO
2KClO 2 2KCl+3O
3 2
【考点】化学方程式计算
245 x
【难度】★★
7g×30% 96
【答案】(1)6;
x=11200g
(2)混合物中氯酸钾的质量为:
设制得氧气质量为 x245 96
4.9g x
x=1.92g
答:制得氧气的质量为 1.92g
【解析】(1)方程式配平错误;氯酸钾质量计算错误;氯酸钾和氧气质量对应关系错误;未列比例式;计算
结果错误;未答。一共 6 处错误
(2)正确求出氯酸钾质量,代入方程式计算即可,注意过程。
七、实验探究题(本大题共 2 个小题。化学方程式每空 2 分,其余每空 1 分,共 15 分。)
【基本实验】
38.右图是实验室制取某种气体的装置。
(3)仪器组装完毕,下一步的实验操作应该是 。
(4)制得所需气体后,请你设计实验方案,验证该气体的一个化学性质。 温馨提示:从
①实验操作 ②实验现象 ③实验原理(用化学方程式表示)④实验结论 四个方面进行简述。
【考点】气体制取;性质验证
【难度】★★
【答案】(1)检查装置气密性;(2)若制取的气体是二氧化碳,①实验操作:将二氧化碳气体通入澄清石
灰水中;②实验现象:澄清石灰水变浑浊;③实验原理: ;④实验结论:
二氧化碳能和氢氧化钙反应/二氧化碳能与碱溶液反应
【解析】(1)制取气体时,仪器组装完毕后应该检查装置气密性;(2)图中所给发生装置是固液常温型
,可以用于分解过氧化氢制氧气,实验室制二氧化碳和实验室制氢气,任选一种气体进行验证即可。如可
以选择氧气验证支持燃烧的性质,可以进行木炭、硫等在氧气中燃烧的实验;也可选择二氧化碳验证其能
和水反应或能和澄清石灰水反应;也可选择氢气验证可燃性,合理即可。
【科学探究】
30. 3 月 16 日,沙尘暴席卷我国西北地区,次日多地又遇到降雨。该地某校环境监测实践小组的同学们
,对沙尘暴的成因、危害、成分、防护、治理以及雨水酸碱度的异常变化产生了浓厚的兴趣,在老师的指导下,
他们紧急立项,开启了项目性学习的探究之旅。
任务一:监测沙尘暴的成因 任务二:分析沙尘暴的危害
同学们参与当地环境监测。他们 1 米高台上, 当人暴露于沙尘天气中时,含有各种有毒的化
利用"风向风速器",测得风速为 10m/s 时, 学 物质、病菌等的尘土可进入到口、鼻、眼、
有大量的沙尘被卷入空中,能见度迅速降低。 耳中引发各种 疾病。除此之外,沙尘暴还会产
引发这一自然现象的根本原因是 生的危害是 (写
(写 1 条)。 1 条)。
任务三:探究沙尘暴的成分
【信息检索】我国西北地区,含有大量钠盐的干涸盐湖和盐碱地总面积约有 50 万平方公里,为沙尘暴的形成埋
下隐患。
【猜想假设】此次沙尘暴中可能含有碳酸钠等碱性物质。【进行实验】取少量盐碱地的土壤与蒸馏水按 1:5 的质量比在烧杯中混合,充分搅拌后静置, 取上层清液,
用右图装置完成如下实验。
项目 实验步骤 实验现象 实验结论
方案 ①挤压胶头滴管 a,滴入 产生白色沉淀 沙尘暴中含有 Na CO ,
2 3
不含 NaOH
②挤压胶头滴管,滴入几滴酚酞 酚酞溶液不变色
【反思评价】
(4)步骤①中发生反应的化学方程式为 。
(5)自然界的土壤通常不含 NaOH,理由是 。
(6)若加入的 X 是 (填化学式),则只能证明沙尘暴中含有 Na
2
CO
3
,而不能确定是否含
有 NaOH。任务四:评价雨水 pH 异常的原因
【数据监测】小组同学在老师的帮助下,从环保部门获得了当地雨水的 pH 数据。
【表达交流】3 月 17 日,雨水 pH 出现异常的原因是
。
【检查测进定度时】间该项目性学习3还月没5有日进行的探 。 3 月 28 日 3 月 31 日
究项目3 月是 17 日
pH
5.57 5.73 5.60 5.59
【考点】物质成分探究
【难度】★★★【答案】任务一:土质疏松/大气层不稳定;任务二:影响出行/影响户外工作任
务三:过量/适量/足量的氯化钙溶液/氯化钡溶液
【反思评价】
(1) /
(2)氢氧化钠易与空气中二氧化碳反应;(3)
任务四:
【表达交流】沙尘暴中含有碳酸钠,引起雨水 pH 增大
【检查进度】防护、治理
【解析】任务一:大量沙尘被风卷入空中说明地表的土质疏松,易被风吹起; 任
务二:沙尘暴降低能见度,影响人们出行,同时户外工作也会受到影响;
任务三:要检验碳酸钠同时排除氢氧化钠,应该先检验并且除去碳酸钠,选择氯化钙、硝酸钙、氯化钡
、硝酸钡溶液均可,加入足量或过量,检验并且除去碳酸钠;
【反思评价】
(1)步骤①中发生的是检验试剂和碳酸钠的反应,根据所选试剂正确写出方程式即可;
(2)氢氧化钠易和空气中氧气反应生成碳酸钠,所以自然界土壤中通常不含氢氧化钠;
(3)若检验碳酸钠时加入氢氧化钙或氢氧化钡,则会和碳酸钠反应生成氢氧化钠,无法确定沙尘暴中是否
含氢氧化钠;
任务四:
【表达交流】正常雨水的 pH 约为 5.6,3 月 17 日雨水pH 明显增大,可能是因为沙尘暴中的碳酸钠溶于雨水
导致的,因为碳酸钠溶于水显碱性;
【检查进度】同学们对沙尘暴成因、危害、成分、防护、治理和雨水酸碱度异常变化产生兴趣进行探究
,其中防护和治理尚未进行探究。