【2026国自然青C模板】APPBP2介导的PRDM16蛋白稳态失衡驱动血管周围脂肪米色身份丢失与高血压血管重构的机制研究

2026年NSFC青年C项目标书方案(深度修改版,>4000字)
项目名称(青年C建议题目,凝练+可检验)APPBP2介导的PRDM16蛋白稳态失衡驱动血管周围脂肪米色身份丢失与高血压血管重构的机制研究
(一)中文摘要(青年C版,约400–600字)
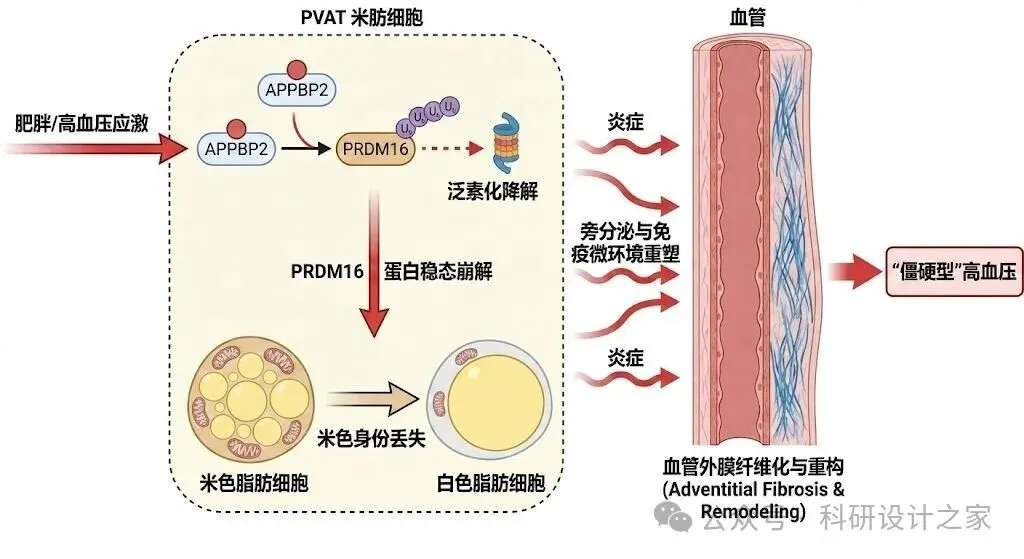
肥胖相关高血压长期被归因于脂肪量增加与全身神经体液异常,但临床促血管/抗炎干预疗效不稳定,提示仍存在关键机制缺口。血管周围脂肪组织(perivascular adipose tissue, PVAT)紧贴血管外膜,是调控血管张力、炎症与结构重塑的核心微环境器官。最新Science研究证明,脂肪细胞特异性缺失Prdm16导致PVAT米色脂肪身份丢失(beige→white),可直接诱发血管周围炎症、血管重构并引起血压升高,且显著增强血管紧张素II诱导的升压反应,提示PVAT米色身份是抵抗重构型高血压的关键保护层。然而,PRDM16作为转录因子本体难以药靶化,限制了转化应用。Nature研究进一步揭示PRDM16蛋白稳态受CUL2–APPBP2泛素化复合体决定,APPBP2促进PRDM16多聚泛素化降解,抑制该复合体可延长PRDM16半衰期并促进beige脂肪生成。据此,本项目提出中心假说:高血压/肥胖应激条件下PVAT中APPBP2异常激活,触发PRDM16蛋白稳态崩解并导致米色身份丢失,进而重塑PVAT旁分泌与免疫微环境,驱动血管外膜纤维化与血管重构,最终形成“僵硬型”高血压表型。本项目拟通过“人群/公开组学关联—动物模型因果验证—PVAT局部靶向干预”的三段式路径,系统阐明APPBP2-PRDM16稳态开关在PVAT-血管重构-血压中的决定性作用,并验证PVAT靶向APPBP2抑制的可行性,为肥胖相关高血压提供新靶点与新策略。
关键词:血管周围脂肪;米色脂肪;APPBP2;PRDM16;蛋白稳态;血管重构;高血压
(二)立项依据(Why:科学问题尖锐 + 缺口明确 + 假说可检验)
1. 研究背景与科学意义
高血压是全球心脑血管事件的首要危险因素,肥胖及代谢综合征显著增加高血压发生风险。传统机制多集中于交感兴奋、RAAS激活、肾钠潴留及系统性炎症,但临床上针对单一通路的长期干预效果有限,提示决定血压病程进展的关键“组织微环境开关”仍未被识别。
PVAT是包绕血管外膜的特殊脂肪库,其解剖位置使其天然具备“就地调控血管壁”的能力:PVAT可分泌脂肪因子、血管活性介质及免疫调节分子,改变血管舒缩、外膜炎症与纤维化进程。近年来PVAT功能障碍被认为是肥胖相关血管病理的重要驱动因素,且“靶向PVAT”的概念正快速升温。综述与实证研究提示,PVAT的分泌谱改变可直接影响血管健康与血管老化过程,肥胖状态下PVAT分泌/表型变化可损害血管功能,甚至神经调控策略(如肾去神经)改善血管重构也与PVAT调控相关。因此,PVAT从“旁观者”转变为“可干预的致病枢纽”,具有重要科学价值与转化潜力。
2. 关键进展:PVAT米色身份丢失是高血压血管重构的因果驱动
PVAT并非单一白脂组织,在生理与损伤应激下可呈现米色化(beiging)特征。Nat Commun研究显示,血管损伤可诱导PVAT米色化以精细调节炎症反应并发挥保护作用,提示米色身份可能是血管修复的内源性适应机制。更关键的是,Science 2026采用脂肪细胞特异性Prdm16敲除小鼠,直接证明PVAT米色身份丢失会引发血管周围炎症、血管重构并导致血压升高,同时增强AngII升压敏感性。该研究把“PVAT米色身份”从相关性提升为血压病理的因果变量,为本领域奠定了新的研究基座。
3. 未解决的关键缺口:PRDM16不可药靶化与“身份丢失如何被锁定”的机制盲区
尽管PRDM16被公认为米色脂肪命运核心转录因子,但转录因子本体难以药靶化,限制了转化策略。同时,“PVAT米色身份丢失”并非简单的基因表达变化,而可能涉及蛋白稳态层面的开关式锁定:一旦关键保护因子被快速降解,PVAT将从可逆代偿走向不可逆外膜纤维化与血管僵硬。
Nature 2022提供了突破性答案:CUL2–APPBP2被鉴定为决定PRDM16蛋白稳定性的E3泛素化复合体,APPBP2介导PRDM16多聚泛素化并促其降解;抑制该复合体可延长PRDM16半衰期并促进beige脂肪生成。这意味着PRDM16的“可操控节点”并不在转录层面,而在其上游的蛋白稳态调控模块,具备更强的可药靶点化前景。
然而,现阶段仍存在三个核心问题尚未解决:
-
病理相关性缺口:高血压/肥胖应激下,PVAT中APPBP2是否被异常激活?其与PRDM16蛋白水平、米色身份丢失是否呈因果关联?
-
机制闭环缺口:APPBP2-PRDM16稳态失衡如何改变PVAT分泌谱与免疫微环境,并驱动血管外膜纤维化与重构?
-
干预可行性缺口:PVAT局部靶向抑制APPBP2是否可恢复PRDM16稳态、重建米色身份并逆转高血压血管重构?
4. 本项目中心假说(可检验、可量化、可转化)
基于上述进展,本项目提出中心假说:在肥胖/高血压应激条件下,PVAT中APPBP2异常增强,触发PRDM16蛋白稳态崩解并造成米色身份丢失;该过程通过重塑PVAT旁分泌-免疫微环境,驱动血管外膜纤维化与血管重构,最终形成持续升高的“重构型高血压”表型;PVAT局部靶向抑制APPBP2可稳定PRDM16并实现血压与血管重构的同步改善。
该假说具备三大优势:
-
可检验:APPBP2/PRDM16蛋白稳态、泛素化水平可直接测定;血压与血管重构有标准终点。
-
可量化:PRDM16半衰期、UCP1表达、胶原沉积与血管张力可形成定量指标体系。
-
可转化:E3稳态模块具药靶潜力,PVAT局部递送策略降低系统性副作用风险。
(三)研究目标与拟解决的关键科学问题(What:Aim闭环)
总目标
阐明APPBP2-PRDM16蛋白稳态开关在PVAT米色身份维持、血管外膜重构及高血压发生发展中的决定性作用,并验证PVAT靶向抑制APPBP2的干预可行性。
拟解决的关键科学问题
-
高血压/肥胖应激下PVAT中APPBP2是否异常激活,并与PRDM16蛋白降低及米色身份丢失呈因果关系?
-
APPBP2-PRDM16稳态失衡如何驱动PVAT旁分泌谱与免疫微环境重塑,从而诱发血管外膜纤维化与结构重构?
-
PVAT局部靶向抑制APPBP2能否恢复米色身份并实现“血压下降+血管重构逆转”的双终点改善?
(四)研究内容与研究方案(How:3个Aim,青年C最优结构)
总体策略:采用“组学定位→机制拆解→干预验证”的三段式设计,确保每年都有清晰产出与里程碑。
Aim 1:解析高血压应激下PVAT中APPBP2-PRDM16稳态失衡的时空特征与临床关联
1.1 研究思路Science 2026证明PVAT米色身份丢失可致血管重构与高血压;Nature 2022证明APPBP2可决定PRDM16稳定性。本Aim回答“病理条件下APPBP2是否被激活、是否先于重构发生”,建立因果研究的入口。
1.2 研究设计
-
动物模型(至少两种,增强说服力)
-
HFD诱导肥胖(代谢型高血压风险背景)
-
AngII微泵输注诱导血管重构型高血压(结构重构强模型)
-
取材组织:主动脉PVAT(首选,结构清晰)、肾动脉PVAT(与血压调控强相关)
-
关键检测
-
APPBP2、PRDM16蛋白表达(WB/IHC/IF)
-
PRDM16泛素化水平(IP-Ub)
-
米色身份读数:UCP1、PGC1α、线粒体呼吸能力
-
血管重构:外膜胶原沉积(Masson/Sirius red)、中膜增厚、炎症浸润
-
血压:尾套+遥测(若平台允许优先遥测)
1.3 数据支撑与生信路线(加分点)
-
利用GEO公开PVAT相关转录组/单细胞数据(如PVAT祖细胞谱系资源)进行:
-
APPBP2在不同细胞群(脂肪细胞/祖细胞/免疫细胞)中的表达定位
-
与beige模块基因集(Ucp1/Ppargc1a等)相关性分析
-
细胞通讯推断(NicheNet/CellChat)锁定PVAT-血管重构相关旁分泌因子(此处不需要伪造倍数,强调“可获得数据与分析方法”即可)
1.4 预期结果
-
高血压应激下PVAT中APPBP2上调、PRDM16蛋白下降与泛素化增强同步出现
-
APPBP2变化先于或伴随PVAT米色身份丢失,并与外膜纤维化/血压升高显著相关
1.5 可能困难与替代
-
若整体PVAT信号弱:采用PVAT细胞分选(脂肪细胞vs基质血管组分SVF)增强检测灵敏度。
Aim 2:阐明APPBP2-PRDM16稳态失衡驱动PVAT旁分泌-免疫微环境重塑与血管外膜纤维化的机制链条
2.1 研究思路PVAT米色身份不仅影响产热,更可能决定“血管保护性分泌谱”。肥胖条件下PVAT分泌谱改变可损害血管功能;血管损伤诱导PVAT米色化具有保护效应。因此,本Aim的目标是把APPBP2-PRDM16稳态变化转化为“血管外膜重构的直接机制”。
2.2 研究设计:细胞—组织两级拆解(A)细胞水平:APPBP2操控与PRDM16救援
-
在原代PVAT脂肪细胞/诱导分化脂肪细胞中:
-
APPBP2过表达或敲低(shRNA/siRNA)
-
评估PRDM16半衰期(CHX追踪)、泛素化(IP-Ub)
-
救援实验:在APPBP2上调背景下外源PRDM16稳定化表达,观察beige程序能否恢复(关键因果证据)
(B)组织水平:PVAT-血管共培养验证旁分泌效应
-
PVAT条件培养基处理血管平滑肌细胞(VSMC)与外膜成纤维细胞:
-
纤维化读数:Col1a1、Acta2、Tgfb1等
-
迁移/增殖:EdU、Transwell
-
血管环离体实验:观察PVAT来源信号对血管舒缩反应的影响(Ach舒张、PE收缩)
2.3 免疫微环境解析(青年C的“高级感”来源)
-
流式/IHC定量PVAT免疫细胞:F4/80+巨噬细胞、Ly6C+单核细胞等
-
重点回答:APPBP2-PRDM16失衡是否导致PVAT从“低炎症保护态”转为“促纤维化炎症态”,并与血管外膜胶原沉积对应。
2.4 预期结果
-
APPBP2上调增强PRDM16泛素化降解,抑制beige程序并改变PVAT分泌谱
-
PRDM16救援可逆转旁分泌致纤维化效应,证明APPBP2作用依赖PRDM16
-
PVAT免疫浸润与外膜纤维化增强,为结构重构提供“微环境链条证据”
2.5 可能困难与替代
-
若旁分泌因子复杂难定位:采用蛋白质组/分泌组筛选“前10候选因子”,用中和抗体或受体拮抗剂进行功能验证。
Aim 3:验证PVAT局部靶向抑制APPBP2的治疗潜力:实现“血压降低+血管重构逆转”双终点改善
3.1 研究思路Nature 2022提示抑制CUL2–APPBP2可促进beige生成;Science 2026证明维持beige身份对血管与血压具有保护意义。本Aim将机制转化为可验证干预策略,是青年C“能打动评审”的核心Aim。
3.2 干预策略(强调“PVAT局部”以回应安全性质疑)
-
PVAT局部递送AAV-shAPPBP2(或脂质体/纳米颗粒递送siAPPBP2)
-
对照:AAV-shNC
-
机制对照:AAV-PRDM16(正对照)或“APPBP2抑制+PRDM16敲低”反救援
3.3 评价终点(双终点+机制终点)
-
主要终点1(生理):血压(遥测优先,至少尾套)
-
主要终点2(结构):血管重构/纤维化(外膜胶原、中膜厚度)
-
机制终点:PRDM16蛋白恢复、UCP1上调、免疫浸润下降、血管舒缩功能改善
3.4 预期结果
-
PVAT靶向APPBP2抑制可恢复PRDM16稳态与米色身份
-
血管外膜纤维化与重构显著减轻,血压降低并改善血管反应性
-
反救援实验确认疗效依赖PRDM16稳态通路
3.5 可能困难与替代
-
若局部递送效率不稳定:使用围血管凝胶缓释递送或多点注射提高PVAT覆盖;或采用外植体PVAT局部处理后回植策略。
(五)技术路线图(文字版,可直接转成图)
模型建立(HFD/AngII) → PVAT采集(主动脉/肾动脉) →Aim1:APPBP2/PRDM16蛋白稳态与泛素化 + 米色身份 + 血管重构 + 血压→ Aim2:细胞机制(APPBP2操控→PRDM16半衰期/泛素化→分泌谱) + 共培养验证外膜纤维化效应 + 免疫微环境定量→ Aim3:PVAT局部抑制APPBP2 → PRDM16稳定化 → 米色身份恢复 → 重构逆转 + 血压下降(双终点)
(六)本项目特色与创新点(评审可直接打“创新性强”)
1. 新靶标维度:从“转录因子不可药”转向“蛋白稳态可药靶点”
PRDM16本体难药靶化,而CUL2–APPBP2作为其降解开关具备可干预潜力。本项目以APPBP2为抓手,具备明确“新靶点价值”。
2. 新机制维度:提出“PVAT身份丢失被蛋白稳态锁定→外膜纤维化→僵硬型高血压”的病程模型
Science 2026给出beige丢失致高血压的因果证据;本项目进一步解释“为何会不可逆固化”,提出病程拐点机制。
3. 新视角/技术维度:局部PVAT靶向干预实现“血压+结构重构”双终点
相比传统全身代谢干预,本项目聚焦“血管外膜微环境重编程”,并用PVAT局部递送策略提升安全性与可转化性。
(七)可行性分析与研究基础(Can:证据链—平台—风险替代)
1. 证据链充分(外部强证据支撑)
-
PVAT米色身份丢失可导致血管重构与血压升高(Science 2026)
-
APPBP2决定PRDM16蛋白稳定性并调控beige生成(Nature 2022)
-
PVAT beiging可调控血管损伤炎症与重构(Nat Commun 2022)
-
肥胖状态PVAT分泌谱改变影响血管功能(Cell Reports Medicine 2025)
这些构成“从现象到机制到干预”的外部证据闭环,显著降低青年C立项风险。
2. 技术平台成熟
-
血压测定与AngII模型、组织学/免疫染色、蛋白稳态实验(IP-Ub、CHX追踪)均为常规可实现路线。
-
PVAT-血管共培养与血管环张力实验为血管生物学成熟范式。
3. 风险与替代方案(评审最关注的“Plan B”)
|
|
|
|
|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
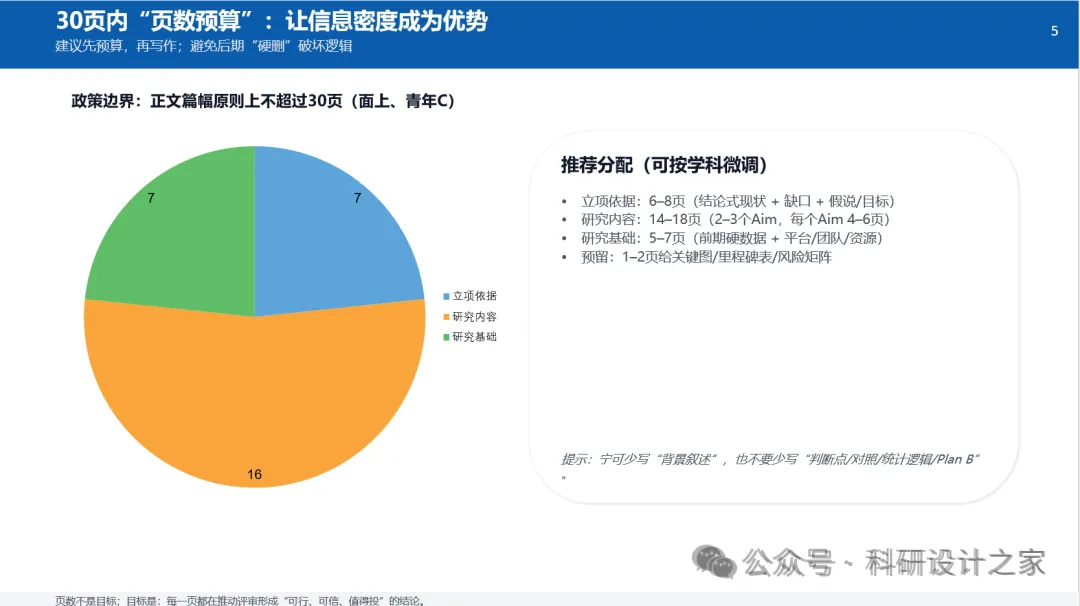
(八)年度研究计划与里程碑(3年青年C强节奏)
第1年:现象确证 + 稳态开关定位
-
建立HFD与AngII模型,完成血压与血管重构基线
-
完成PVAT中APPBP2/PRDM16稳态与泛素化时序图谱里程碑:锁定“APPBP2激活→PRDM16下降→beige丢失”的关键窗口
第2年:机制拆解 + 分泌/免疫微环境链条闭环
-
完成APPBP2操控与PRDM16救援的细胞机制
-
完成PVAT-血管共培养致纤维化效应验证里程碑:形成可发表的“稳态开关→外膜纤维化机制链”
第3年:PVAT局部靶向干预 + 双终点验证
-
完成PVAT靶向APPBP2抑制的干预实验
-
完成血压改善+血管重构逆转+机制反救援里程碑:形成青年C结题“机制+干预”高质量成果
(九)预期成果与学术贡献
-
发表高水平论文(目标1–2篇,至少1篇一区Top期刊)
-
形成PVAT-血压重构相关的蛋白稳态调控数据资源(可公开)
-
申请1项与“PVAT靶向APPBP2/PRDM16稳态干预”相关的发明专利
-
构建可转化策略雏形:PVAT局部递送的靶点验证体系,为后续面上/重点项目奠基
(十)关键参考文献(CNS为主,均可核验)
-
Koenen, M., et al. Ablation of Prdm16 and beige fat identity causes vascular remodeling and elevated blood pressure. Science, 2026. https://doi.org/10.1126/science.ady8644
-
Wang, Q., et al. Post-translational control of beige fat biogenesis by PRDM16 stabilization. Nature, 2022. https://doi.org/10.1038/s41586-022-05067-4
-
Zhu, Y., et al. Sympathetic neuropeptide Y protects from obesity by sustaining thermogenic fat. Nature, 2024. https://doi.org/10.1038/s41586-024-07863-6
-
Cox, N., et al. Diet-regulated production of PDGFcc by macrophages controls energy storage. Science, 2021. https://doi.org/10.1126/science.abe9383
-
Hepler, C., et al. Time-restricted feeding mitigates obesity through adipocyte thermogenesis. Science, 2022. https://doi.org/10.1126/science.abl8007
-
Adachi, Y., et al. Beiging of perivascular adipose tissue regulates its inflammation and vascular remodeling. Nature Communications, 2022. https://doi.org/10.1038/s41467-022-32658-6
-
Hof, A., et al. Myeloperoxidase impacts vascular function by altering perivascular adipocytes’ secretome in obesity. Cell Reports Medicine, 2025. (Article page)
-
Aguilar Castañeda, R.D. Comment on: renal denervation alleviates vascular remodeling… regulating PVAT. Hypertension Research, 2025. https://doi.org/10.1038/s41440-024-01889-z
最后一句(会评策略总结)
如果你要在青年C里最大化中标概率,这个方向最关键是把项目写成一句话的“硬闭环”:
“APPBP2这个可药化的蛋白稳态开关,决定PVAT米色身份是否崩解;其崩解将血管外膜推向纤维化重构并抬升血压;局部靶向抑制APPBP2可同时逆转血压与重构。”
以上是我们利用AI算法,对最新CNS文章做为选题拓展,设计的2026年的国自然三段式的标书方案,如您需要按照以上模板来优化升级您的标书方案,就可以扫码私信咨询如何优化!
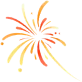






 夜雨聆风
夜雨聆风





