文档内容
重庆市 2025 年普通高等学校招生统一考试
化学试题注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂
黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将
答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:Se-79 Ag-108 Cl-35.5 I-127 O-16 Na-23
一、选择题:本大题共 14小题,每小题 3分,共 42分,每题给出的四个选项
中,只有一项符合题目要求。
1.抗日战争时期,我国军民同仇敌忾,利用简易装置制作了许多武器,下列制
造过程中涉及氧化还原反应的是
A.用研磨法代替粉碎机碾碎硝化棉 B.在陶缸中使用硫磺制作硫酸
C.用蒸馏法将白酒制取工业酒精 D.用水解法将植物油与熟石灰制备甘油
2.下列实验对应物质性质、现象都正确的是
选
性质 现象
项
A 焰色反应 Na、K 火焰都是紫色
B 漂白性 SO 、Cl 都可以使物质永久漂白
2 2
C 蛋白质变性 醋酸铅和甲醛都能让蛋白质变性
腐蚀印刷电 用氯化铁和浓硫酸在常温下都可以刻
D
路 画电路板
A.A B.B C.C D.D
3.下列有关离子反应错误的是
A.亚硫酸氢钠与石灰水反应:SO2Ca2 CaSO
3 3
试卷第1页,共10页B.Na O 与水反应:2Na O 2HO4Na4OHO
2 2 2 2 2 2
C.NO 与水反应:3NO H O2H 2NONO
2 2 2 3
D.Cl 与NaBr 溶液反应:Cl 2Br Br 2Cl
2 2 2
4.下列实验操作及装置正确的是
A.加热 B.定容 C.稀释 D.滴定
5.根据元素周期律,同时满足条件(ⅰ)和条件(ⅱ)的元素是
(ⅰ)电负性是同主族元素中最大;(ⅱ)第一电离能比同周期相邻主族元素大的。
A.Al B.Si C.B D.Be
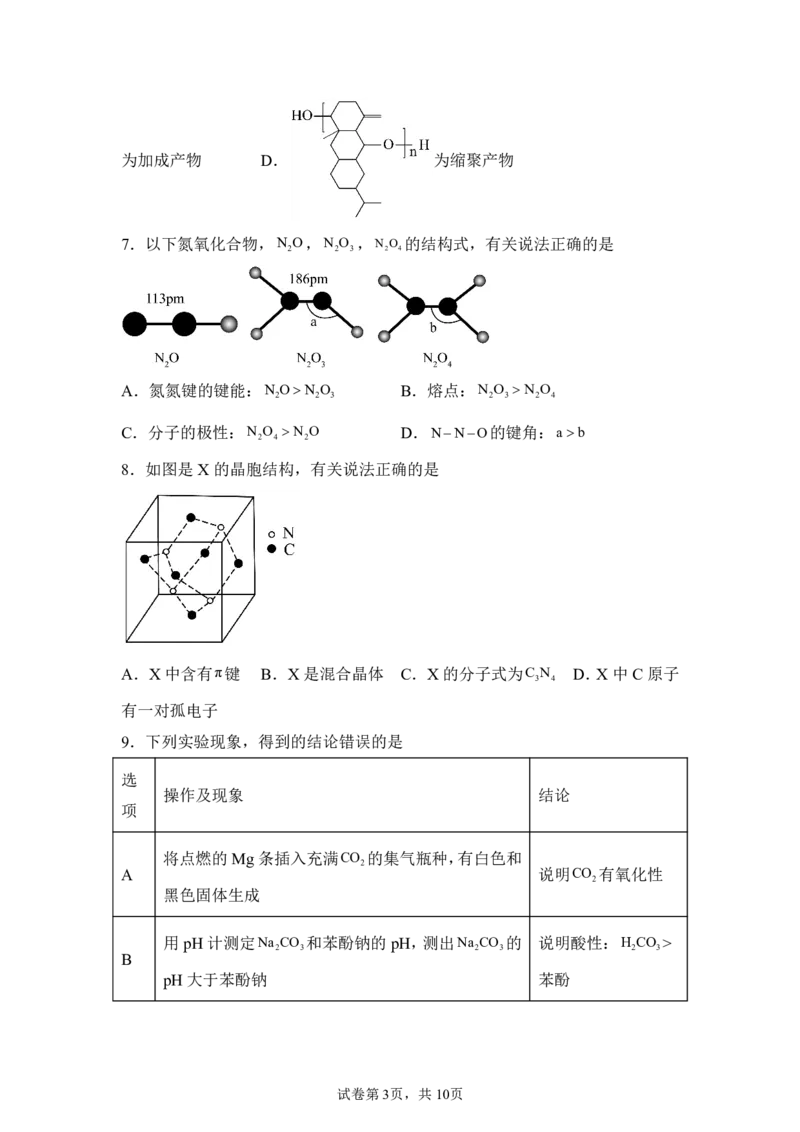
6.如图为有机物结构式,有关说法正确的是
A.分子式为C H O B.手性碳有3个 C.
15 24 2
试卷第2页,共10页为加成产物 D. 为缩聚产物
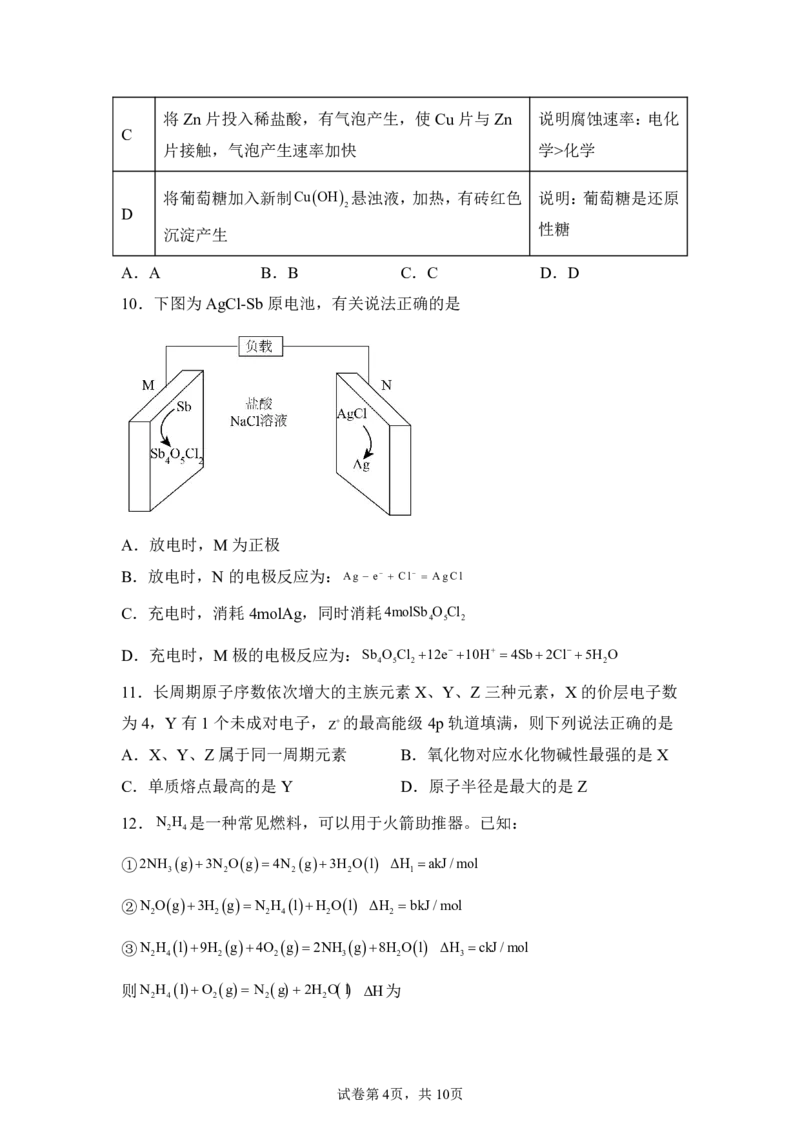
7.以下氮氧化合物,N O,N O ,N O 的结构式,有关说法正确的是
2 2 3 2 4
A.氮氮键的键能:N ON O B.熔点:N O N O
2 2 3 2 3 2 4
C.分子的极性:N O N O D.NNO的键角:ab
2 4 2
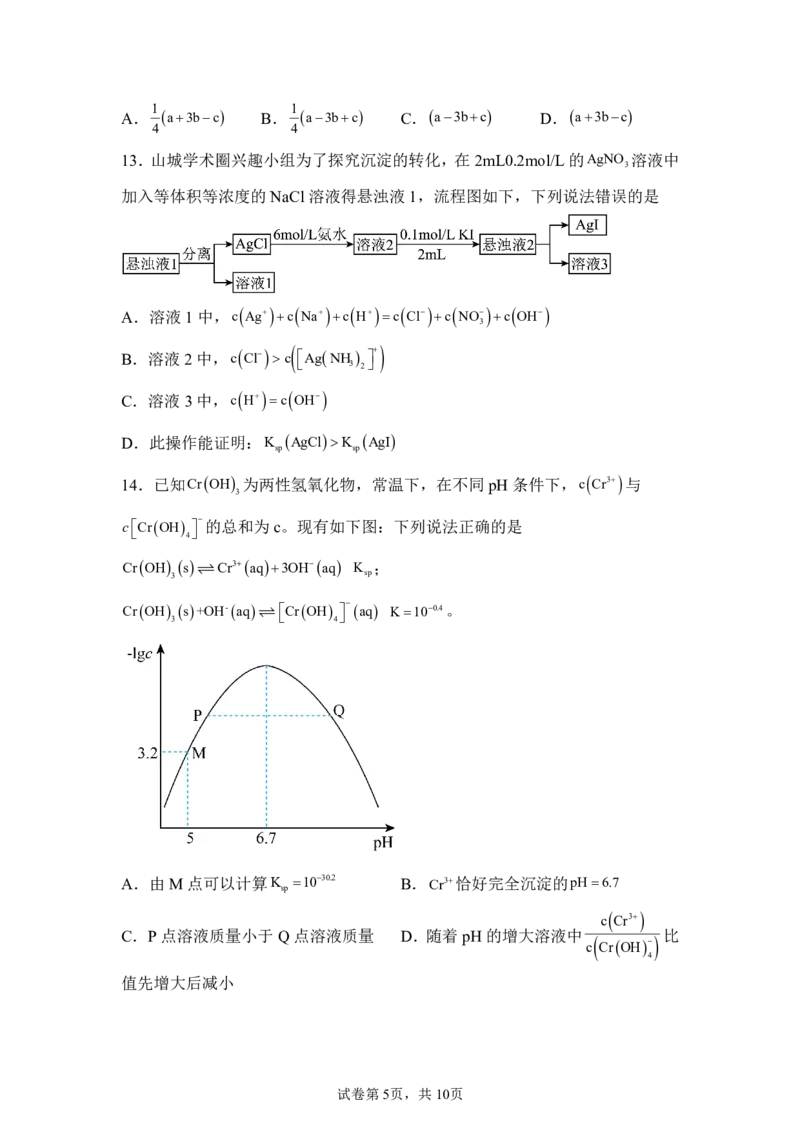
8.如图是X的晶胞结构,有关说法正确的是
A.X中含有π键 B.X 是混合晶体 C.X的分子式为C N D.X中C 原子
3 4
有一对孤电子
9.下列实验现象,得到的结论错误的是
选
操作及现象 结论
项
将点燃的Mg 条插入充满CO 的集气瓶种,有白色和
2
A 说明CO 有氧化性
2
黑色固体生成
用pH计测定Na CO 和苯酚钠的pH,测出Na CO 的 说明酸性:H CO >
2 3 2 3 2 3
B
pH大于苯酚钠 苯酚
试卷第3页,共10页将Zn 片投入稀盐酸,有气泡产生,使Cu 片与Zn 说明腐蚀速率:电化
C
片接触,气泡产生速率加快 学>化学
将葡萄糖加入新制CuOH 悬浊液,加热,有砖红色 说明:葡萄糖是还原
2
D
性糖
沉淀产生
A.A B.B C.C D.D
10.下图为AgCl-Sb原电池,有关说法正确的是
A.放电时,M 为正极
B.放电时,N的电极反应为:Ag e Cl AgCl
C.充电时,消耗4molAg,同时消耗4molSb O Cl
4 5 2
D.充电时,M 极的电极反应为:Sb O Cl 12e10H 4Sb2Cl5H O
4 5 2 2
11.长周期原子序数依次增大的主族元素X、Y、Z 三种元素,X的价层电子数
为4,Y有1个未成对电子, Z+的最高能级4p轨道填满,则下列说法正确的是
A.X、Y、Z 属于同一周期元素 B.氧化物对应水化物碱性最强的是X
C.单质熔点最高的是Y D.原子半径是最大的是Z
12.N H 是一种常见燃料,可以用于火箭助推器。已知:
2 4
①2NH g3N Og4N g3H Ol ΔH akJ/mol
3 2 2 2 1
②N Og3H gN H lH Ol ΔH bkJ/mol
2 2 2 4 2 2
③N H l9H g4O g2NH g8H Ol ΔH ckJ/mol
2 4 2 2 3 2 3
则N H lO g N g2H O l H为
2 4 2 2 2
试卷第4页,共10页1 1
A. a3bc B. a3bc C.a3bc D.a3bc
4 4
13.山城学术圈兴趣小组为了探究沉淀的转化,在2mL0.2mol/L 的AgNO 溶液中
3
加入等体积等浓度的NaCl 溶液得悬浊液1,流程图如下,下列说法错误的是
A.溶液1中,c Ag c Na c H c Cl c NO c OH
3
B.溶液2中,c Cl c
AgNH
3
2
C.溶液3中,c H c OH
D.此操作能证明:K AgClK AgI
sp sp
14.已知CrOH 为两性氢氧化物,常温下,在不同pH条件下,c Cr3与
3
cCrOH 的总和为c。现有如下图:下列说法正确的是
4
CrOH s Cr3aq3OHaq K ;
3 sp
CrOH s+OH-aq
CrOH
aq K100.4。
3 4
A.由M 点可以计算K 1030.2 B. Cr3恰好完全沉淀的pH6.7
sp
c
Cr3
C.P点溶液质量小于Q点溶液质量 D.随着pH 的增大溶液中
c
CrOH
比
4
值先增大后减小
试卷第5页,共10页二、非选择题:共 58分。
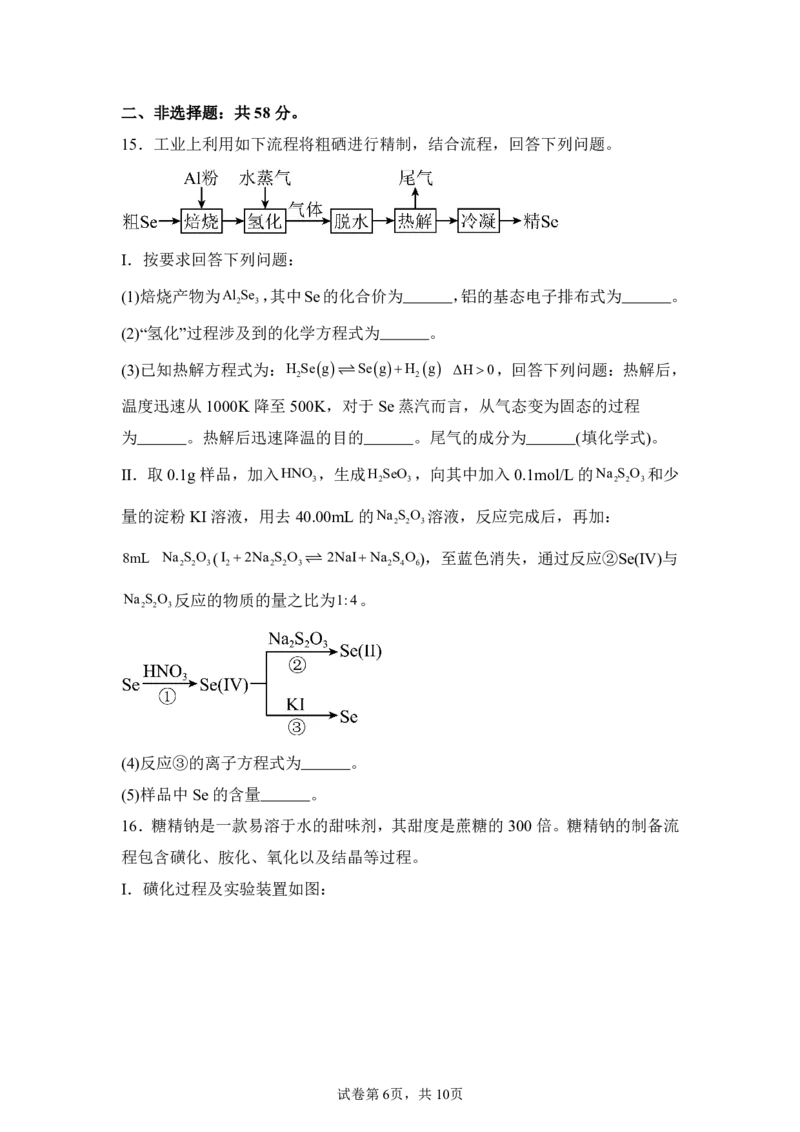
15.工业上利用如下流程将粗硒进行精制,结合流程,回答下列问题。
Ⅰ.按要求回答下列问题:
(1)焙烧产物为Al Se ,其中Se的化合价为 ,铝的基态电子排布式为 。
2 3
(2)“氢化”过程涉及到的化学方程式为 。
(3)已知热解方程式为:H Seg SegH g ΔH0,回答下列问题:热解后,
2 2
温度迅速从1000K降至500K,对于Se蒸汽而言,从气态变为固态的过程
为 。热解后迅速降温的目的 。尾气的成分为 (填化学式)。
Ⅱ.取0.1g样品,加入HNO ,生成H SeO ,向其中加入0.1mol/L的Na S O 和少
3 2 3 2 2 3
量的淀粉KI溶液,用去40.00mL 的Na S O 溶液,反应完成后,再加:
2 2 3
8mL Na S O (I 2Na S O 2NaINa S O),至蓝色消失,通过反应②Se(IV)与
2 2 3 2 2 2 3 2 4 6
Na S O 反应的物质的量之比为1:4。
2 2 3
(4)反应③的离子方程式为 。
(5)样品中Se的含量 。
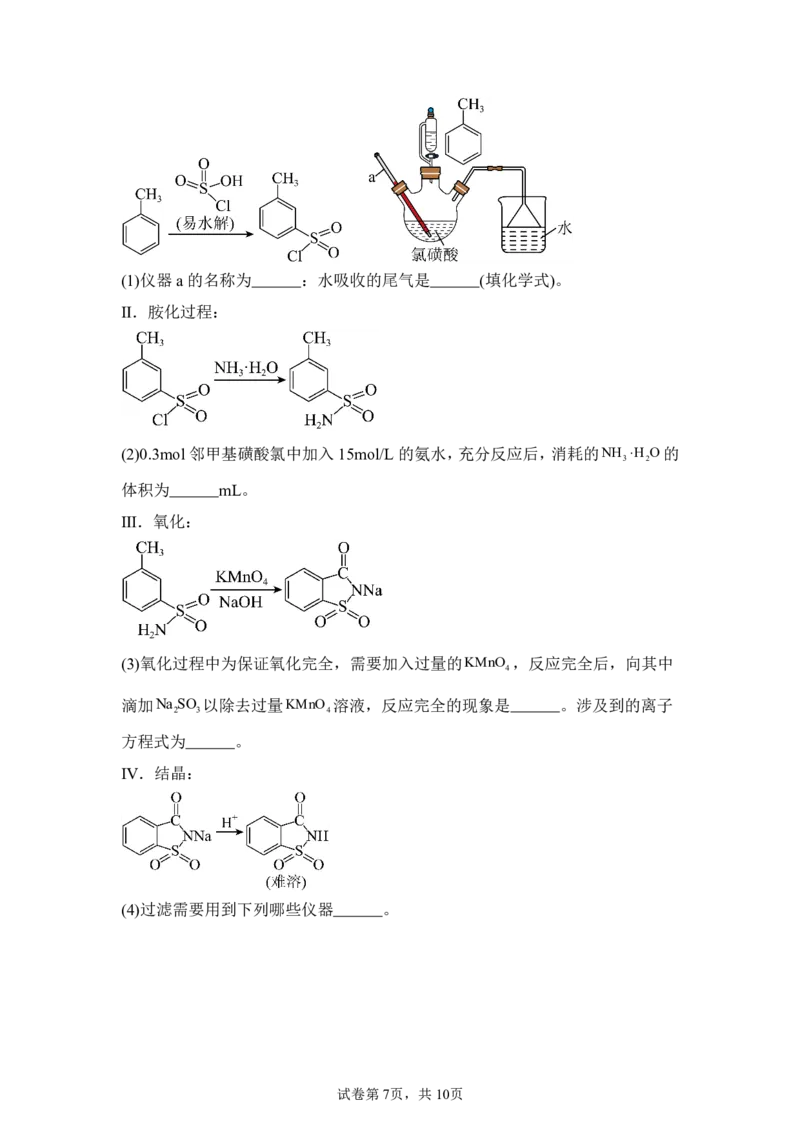
16.糖精钠是一款易溶于水的甜味剂,其甜度是蔗糖的300倍。糖精钠的制备流
程包含磺化、胺化、氧化以及结晶等过程。
Ⅰ.磺化过程及实验装置如图:
试卷第6页,共10页(1)仪器a 的名称为 :水吸收的尾气是 (填化学式)。
Ⅱ.胺化过程:
(2)0.3mol 邻甲基磺酸氯中加入15mol/L的氨水,充分反应后,消耗的NH H O的
3 2
体积为 mL。
Ⅲ.氧化:
(3)氧化过程中为保证氧化完全,需要加入过量的KMnO ,反应完全后,向其中
4
滴加Na SO 以除去过量KMnO 溶液,反应完全的现象是 。涉及到的离子
2 3 4
方程式为 。
Ⅳ.结晶:
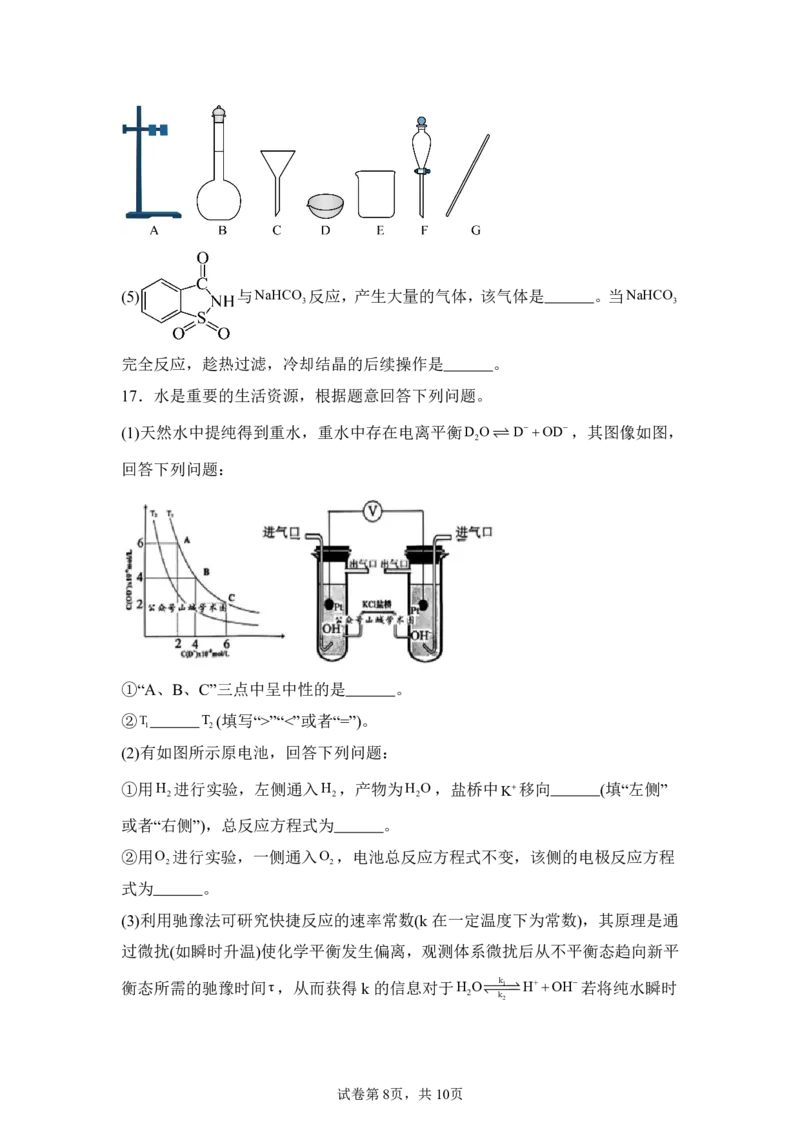
(4)过滤需要用到下列哪些仪器 。
试卷第7页,共10页(5) 与NaHCO 反应,产生大量的气体,该气体是 。当NaHCO
3 3
完全反应,趁热过滤,冷却结晶的后续操作是 。
17.水是重要的生活资源,根据题意回答下列问题。
(1)天然水中提纯得到重水,重水中存在电离平衡D ODOD,其图像如图,
2
回答下列问题:
①“A、B、C”三点中呈中性的是 。
②T T (填写“>”“<”或者“=”)。
1 2
(2)有如图所示原电池,回答下列问题:
①用H 进行实验,左侧通入H ,产物为H O,盐桥中 K移向 (填“左侧”
2 2 2
或者“右侧”),总反应方程式为 。
②用O 进行实验,一侧通入O ,电池总反应方程式不变,该侧的电极反应方程
2 2
式为 。
(3)利用驰豫法可研究快捷反应的速率常数(k 在一定温度下为常数),其原理是通
过微扰(如瞬时升温)使化学平衡发生偏离,观测体系微扰后从不平衡态趋向新平
衡态所需的驰豫时间τ,从而获得 k的信息对于H O k1HOH若将纯水瞬时
2 k2
试卷第8页,共10页升温到25℃,测得 τ4.0105s 。已知:25℃时,cH O55.6mol/L,v 正kcH O,
2 1 2
1
v 逆k c H c OH,τ (x 为 H的平衡浓度)。
2 k 2k x e
1 2 e
①25℃时,H OH OH,的平衡常数K mol/L(保留2位有效数字)。
2
②下列能正确表示瞬时升温后反应建立新平衡的过程示意图为 。
③25℃时,计算得k 为 L/mols。
2
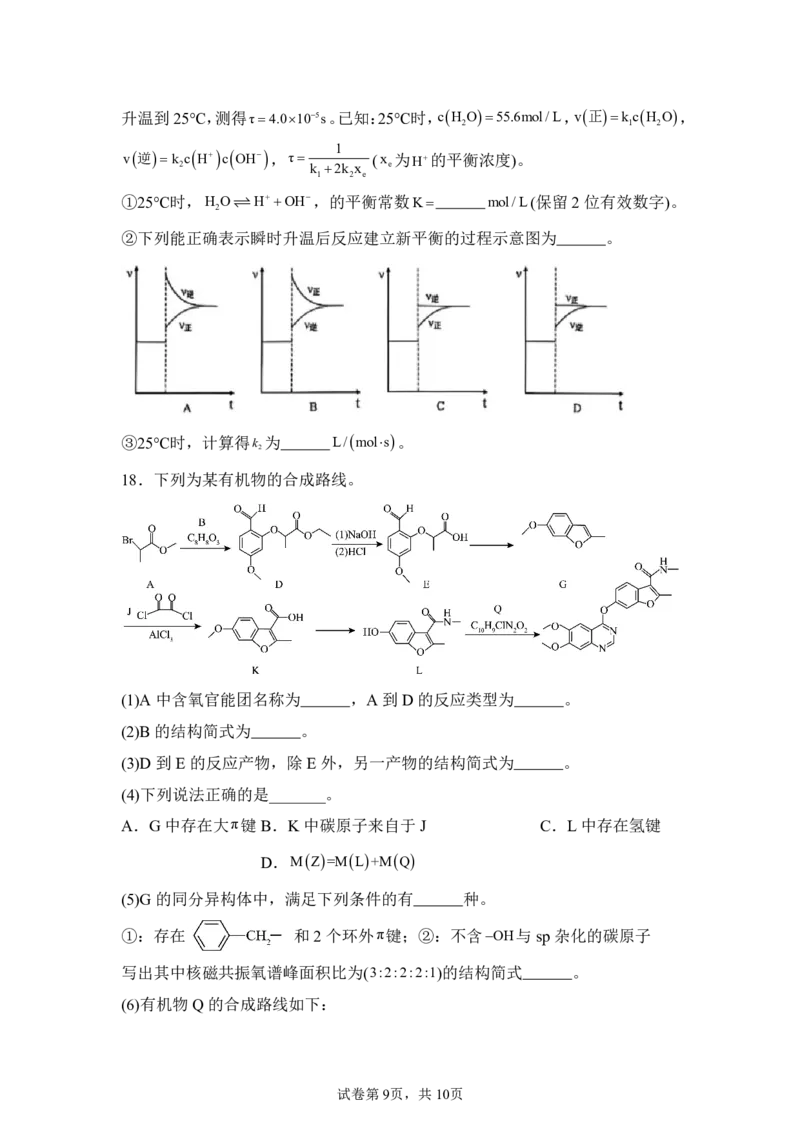
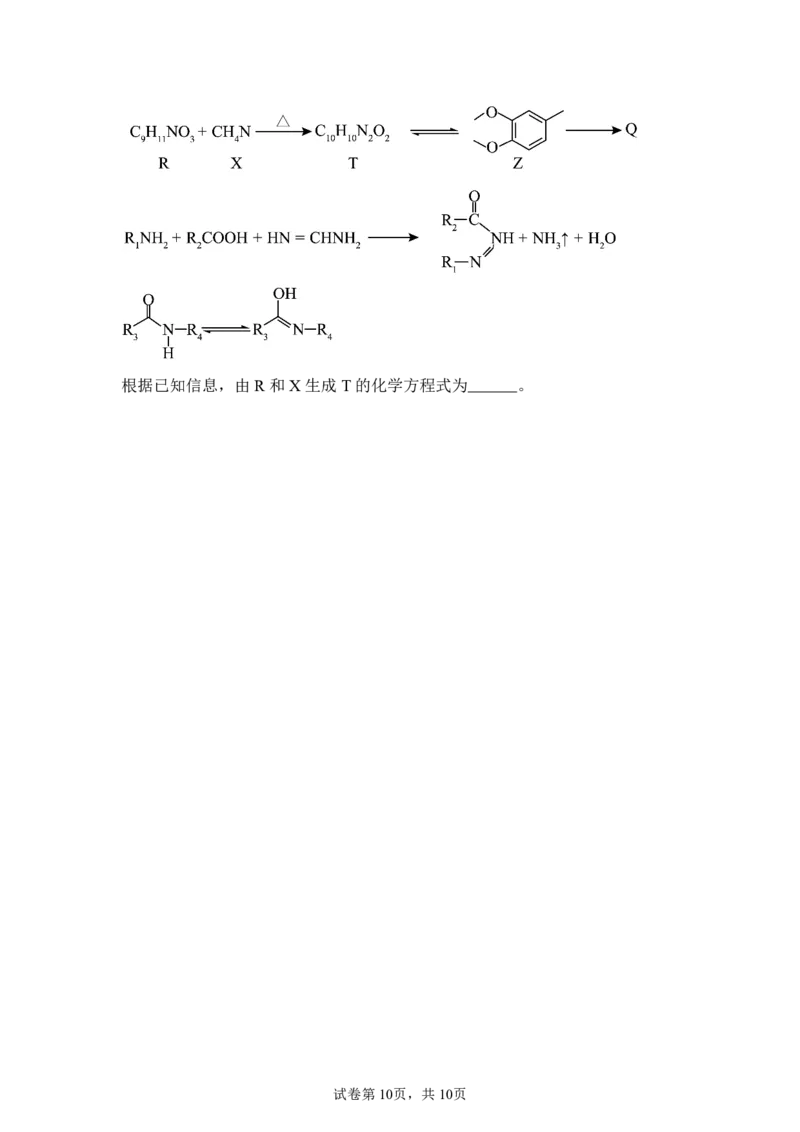
18.下列为某有机物的合成路线。
(1)A 中含氧官能团名称为 ,A到D的反应类型为 。
(2)B 的结构简式为 。
(3)D 到E的反应产物,除E外,另一产物的结构简式为 。
(4)下列说法正确的是_______。
A.G中存在大π键B.K 中碳原子来自于J C.L中存在氢键
D.MZ=ML+MQ
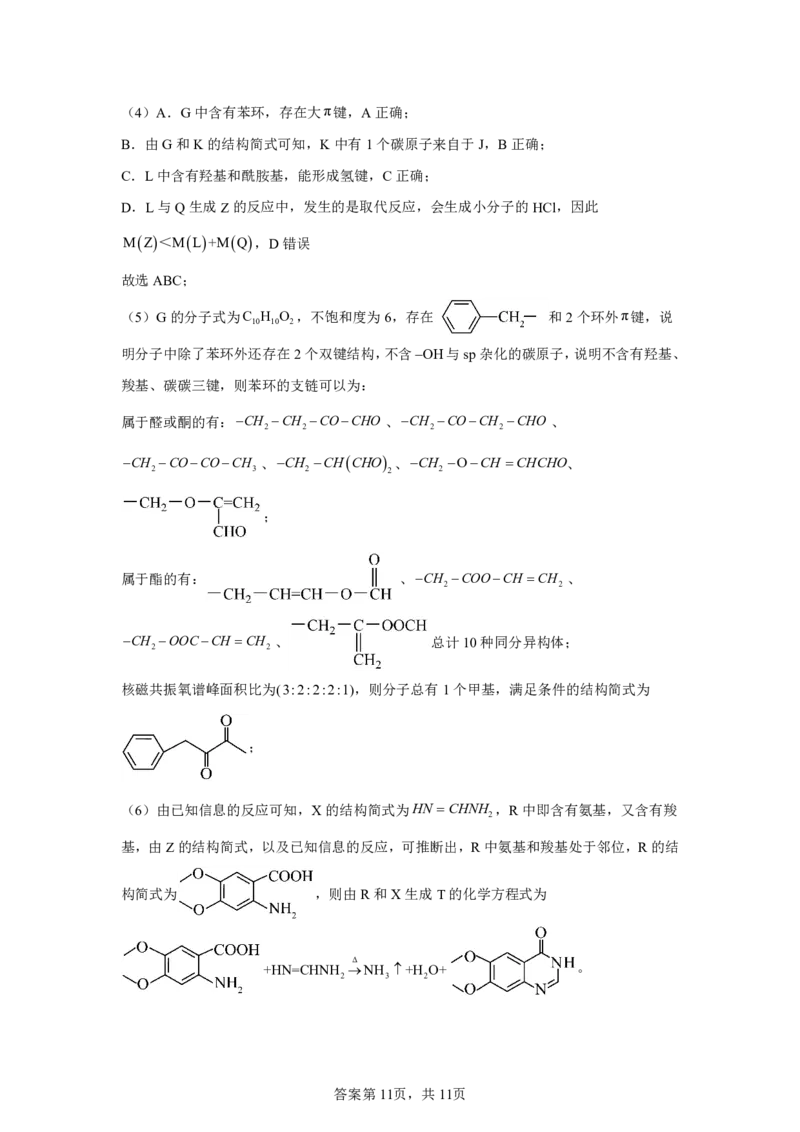
(5)G 的同分异构体中,满足下列条件的有 种。
①:存在 和2个环外π键;②:不含OH与sp 杂化的碳原子
写出其中核磁共振氧谱峰面积比为(3:2:2:2:1)的结构简式 。
(6)有机物Q 的合成路线如下:
试卷第9页,共10页根据已知信息,由R 和X生成T的化学方程式为 。
试卷第10页,共10页1.B
【详解】A.研磨硝化棉是物理粉碎过程,无化合价变化,不涉及氧化还原反应,A错误;
B.硫磺(S)转化为硫酸(H SO )时,硫的化合价从0升至+6,发生氧化反应,涉及氧化
2 4
还原反应,B正确;
C.蒸馏法分离酒精是物理过程,无新物质生成,不涉及氧化还原反应,C错误;
D.植物油水解生成甘油和脂肪酸盐,属于水解反应,无化合价变化,不涉及氧化还原反应,
D错误;
故选B。
2.C
【详解】A.钠的焰色反应为黄色,钾需透过蓝色钴玻璃观察呈紫色,现象描述错误,A错
误;
B.SO 的漂白是暂时性,Cl 需生成HClO才有漂白性且为永久性,但Cl 本身不直接漂白,
2 2 2
B错误;
C.醋酸铅(重金属盐)和甲醛均能使蛋白质不可逆变性,性质与现象正确,C正确;
D.铜在常温浓硫酸中表现出惰性,加热才能反应,故浓硫酸无法腐蚀铜电路板,而FeCl 溶
3
液可以,D错误;
故选C。
3.A
【详解】A.亚硫酸氢钠(NaHSO )与石灰水反应时,HSO不能拆开,先与OH-中和生成
3 3
SO2,再与Ca2+结合生成CaSO 沉淀,正确的方程式为:HSO-+OH-+Ca2+=CaSO +H O,
3 3 3 3 2
A方程式错误;
B.Na O 与水反应的离子方程式为2Na O +2H O=4Na++4OH-+O ↑,符合反应实际(生成
2 2 2 2 2 2
NaOH和O ),B离子方程式正确;
2
C.NO 与水反应的离子方程式为3NO +H O=2H++2NO -+NO,与化学方程式
2 2 2 3
3NO +H O=2HNO +NO一致,C方程式正确;
2 2 3
D.Cl 与NaBr溶液反应的离子方程式Cl +2Br-=Br +2Cl-,符合氧化还原反应规律(Cl 氧
2 2 2 2
化Br-为Br ),D方程式正确;
2
故选A。
答案第1页,共11页4.A
1
【详解】A.给试管中的物质加热时,液体体积不能超过试管容积的 ,且用酒精灯外焰加
3
热,操作合理,A正确;
B.定容时,视线应与刻度线保持水平,操作错误,B错误;
C.稀释浓硫酸应遵循“酸入水”的原则,操作错误,C错误;
D.氢氧化钠溶液呈碱性,应放在碱式滴定管中进行滴定,装置使用错误,D错误;
故选A。
5.D
【详解】A.Al是第ⅢA族元素,同主族中电负性最大的是B,因此Al不满足条件(i),A
错误;
B.Si是第ⅣA族元素,同主族中电负性最大的是C,因此Si不满足条件(i),B错误;
C.B是第ⅢA族元素,电负性在同主族中最大,满足条件(i)。B是ⅢA族元素,同周期
电离能从左往右逐渐增加,但Be是第ⅡA族元素,2p为全空,比较稳定,电离能大于B,
所以B的第一电离能比相邻的Be和C都小,不满足条件(ii),C错误;
D.Be是第ⅡA族元素,电负性在同主族中最大,满足条件(i);Be是第ⅡA族元素,2p为
全空,比较稳定,电离能大于B和Li,所以Be的第一电离能大于同周期相邻主族元素,满
足条件(ii),D正确;
故选D。
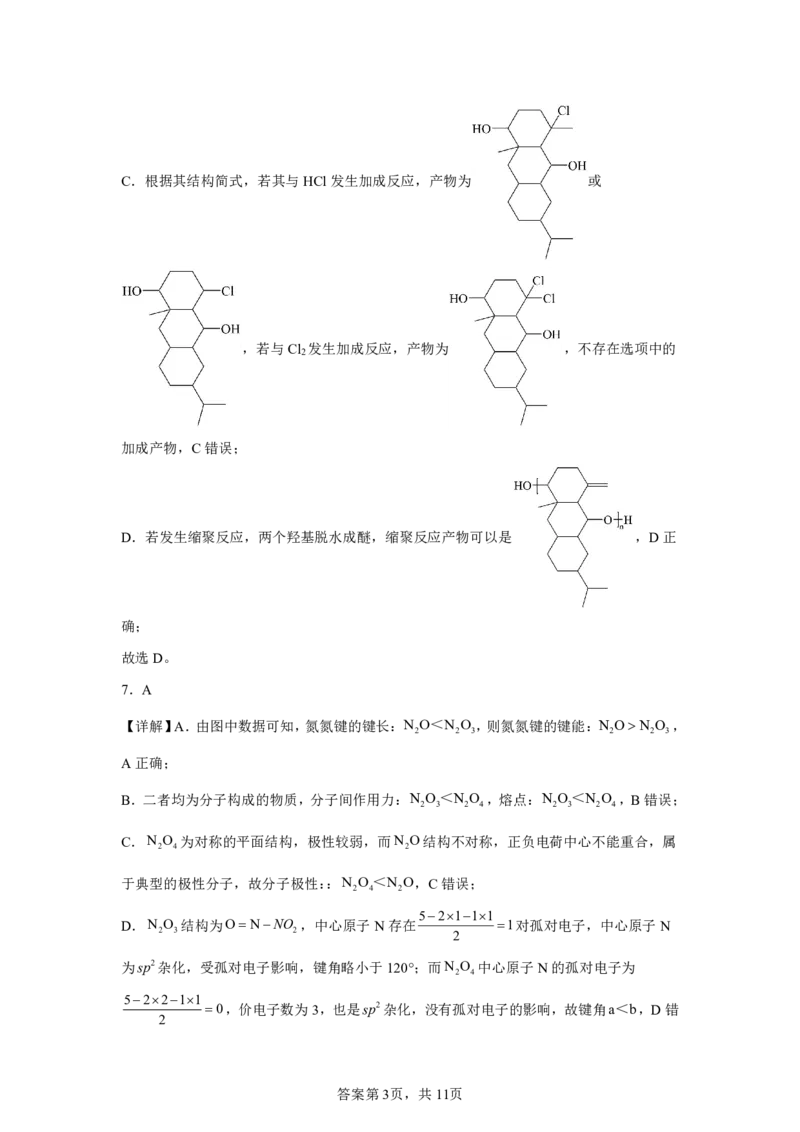
6.D
【详解】A.分子不饱和度为4,碳原子数为19,则氢原子个数为19222432,化
学式:C H O ,A错误;
19 32 2
B.连接四个互不相同的原子或原子团的碳原子是手性碳原子,根据该分子结构
,手性碳原子共有7个,B错误;
答案第2页,共11页C.根据其结构简式,若其与HCl发生加成反应,产物为 或
,若与Cl 发生加成反应,产物为 ,不存在选项中的
2
加成产物,C错误;
D.若发生缩聚反应,两个羟基脱水成醚,缩聚反应产物可以是 ,D正
确;
故选D。
7.A
【详解】A.由图中数据可知,氮氮键的键长:N O<N O ,则氮氮键的键能:N ON O ,
2 2 3 2 2 3
A正确;
B.二者均为分子构成的物质,分子间作用力:N O<N O ,熔点:N O<N O ,B错误;
2 3 2 4 2 3 2 4
C.N O 为对称的平面结构,极性较弱,而N O结构不对称,正负电荷中心不能重合,属
2 4 2
于典型的极性分子,故分子极性::N O<N O,C错误;
2 4 2
52111
D.N O 结构为ONNO ,中心原子N存在 1对孤对电子,中心原子N
2 3 2 2
为sp2杂化,受孤对电子影响,键角略小于120°;而N O 中心原子N的孤对电子为
2 4
52211
0,价电子数为3,也是sp2杂化,没有孤对电子的影响,故键角a<b,D错
2
答案第3页,共11页误;
故选A。
8.C
1
【分析】由图可知,晶胞中C原子的个数是6 3,N位于晶胞内部,个数为4,则晶胞
2
化学式为C N ;
3 4
【详解】A.C、N均以单键连接,晶胞中不含π键,A错误;
B.晶胞内只存在共价键,不是混合型晶体,B错误;
C.由分析可知,晶胞化学式为C N ,C正确;
3 4
D.位于面心的C原子,与周围4个氮原子(位于两个晶胞内)相连,其配位数为4,不存在
孤独电子,D错误;
故选C。
9.B
【详解】A.镁与CO 反应中,生成氧化镁和碳单质,CO 提供氧,而且化合价降低,所以
2 2
二氧化碳体现氧化性,A结论正确;
B.用pH计测定等浓度的Na CO 和苯酚钠的pH,根据水解原理,碳酸氢根的酸性比苯酚
2 3
弱,则碳酸根的水解程度较大,溶液的碱性较强,pH大,所以由现象可得出结论是酸性:HCO
3
<苯酚,不能直接比较碳酸和苯酚的酸性,而且选项中没有强调碳酸钠和苯酚钠的浓度是否
相等,B结论错误;
C.铜,锌和稀盐酸可形成原电池,加快了反应,所以电化学腐蚀速率更快,C结论正确;
D.葡萄糖与新制的氢氧化铜反应,生成的砖红色沉淀为Cu O,说明氢氧化铜做氧化剂,
2
葡萄糖作还原剂,证明葡萄糖具有还原性,D结论正确;
故选B。
10.D
【分析】由图可知,放电时,N电极上AgCl Ag发生得电子的还原反应,为正极,电极
反应为:AgCl+e=AgCl,M电极为负极,电极反应为
4Sb-12e2Cl5H O=Sb O Cl 10H,充电时,N为阳极,M为阴极,电极反应与原电
2 4 5 2
池相反,据此解答。
答案第4页,共11页【详解】A.由分析可知,放电时,M电极为负极,A错误;
B.由分析可知,放电时,N电极反应为:AgCl+e=AgCl,B错误;
C.由分析可知,建立电子转移关系式:Sb O Cl 12e12Ag,由此可知,消耗4molAg,
4 5 2
1
同时消耗 molSb O Cl ,C错误;
3 4 5 2
D.充电时,M极为阴极,电极反应与原电池相反:Sb O Cl 12e10H 4Sb2Cl5H O,
4 5 2 2
D正确;
故选D。
11.D
【分析】X、Y、Z的原子序数依次增大且均为长周期主族元素。X的价层电子数为4(ⅣA
族),Y有1个未成对电子(可能为IA族或ⅦA族), Z+的4p轨道填满,说明Z的原子序
数为37,即Rb,根据原子序数依次增大,可确定X为Ge,Y为Br,据此解答。
【详解】A.分析可知,X为Ge,Y为Br,Z为Rb,不属于同一周期,A错误;
B.X为Ge,Y为Br,Z为Rb,金属性最强的元素为Rb,所以最高价氧化物对应水化物碱
性最强的是Z,B错误;
C.X为Ge,单质为金属晶体;Y为Br,单质为分子晶体;Z为Rb,单质为金属晶体;Ge
原子半径较小,而且价电子数多,金属键较强,熔点较高,所以单质熔点最高的是X,C错
误;
D.电子层数越多的,原子半径越大,X,Y为第四周期,Z为第五周期,所Z的原子半径
最大,D正确;
故选D。
12.B
1
【分析】根据目标方程式与原方程式的特点可知,将原方程式进行 (①-3×②+③)变换,
4
1
可得目标方程式,所以,ΔH应为 a3bc,据此解答。
4
1 1
【详解】A.选项A的表达式为 a3bc,但根据推导结果,ΔH应为 a3bc,与
4 4
A不符,A错误;
B.推导过程中,通过组合反应①、③及反转的反应②×3,得到总ΔH为ac3b,再除以
1
4得 a3bc,与选项B一致,B正确;
4
答案第5页,共11页C.选项C未除以4,直接取a3bc,不符合目标反应的系数比例,C错误;
D.选项D的表达式为a3bc,符号和系数均与推导结果不符,D错误;
故选B。
13.C
【分析】在2mL0.2mol/L的AgNO 溶液中加入等体积等浓度的NaCl溶液得悬浊液1,经分
3
离后,向AgCl中滴加6mol/L的氨水,发生反应AgCl+2NH
3
·H
2
O=
AgNH
3
2
Cl+2H
2
O,
加入0.1mol/LKI溶液2mL,发生反应:
AgNH
3
2
ClKI AgI KCl2NH
3
,得到AgI
沉淀,由物质的量关系可知,
AgNH
3
2
Cl不能完全反应,溶液3中可能还存在剩余的氨
水以及AgNH Cl;
3 2
【详解】A.溶液1中主要溶质是NaNO ,同时由于存在溶解平衡:
3
AgCls
AgaqClaq,还存在极少量的Ag、Cl,选项中满足电荷守恒关系,A
正确;
B.根据元素守恒可知,若Ag不水解,则c Cl =c
AgNH
3
2
,但Ag会水解生成其
他含银的微粒,故c Cl c
AgNH
3
2
,B正确;
C.溶液3中可能存在氨水过量的情况,不能得出c
H
c
OH
的结论,C错误;
D.由实验操作可知,存在转化 AgCl
NH
3·H2O
AgNH Cl
KI
AgI ,由此说明AgI更难溶,
3 2
故可得出结论K AgClK AgI,D正确;
sp sp
故选C。
14.A
【分析】c Cr3 与CrOH 的总和为c,随着pH增大,发生反应:
4
Cr3aq3OHaq CrOH s,含铬微粒总浓度下降,随着pH继续增大,发生反应 :
3
CrOH s+OH-aq
CrOH
aq含铬微粒总浓度上升,据此解答。
3 4
【详解】A.M点时,c OH 1014 109mol/L ,K c CrOH 4 100.4,
105 c OH
答案第6页,共11页c
CrOH
109.4mol/L,几乎可以忽略不计,含Cr微粒主要为Cr3,
4
K c Cr3 ·c3 OH 103.2
1014
3
1030.2,A正确;
sp 105
B.Cr3恰好完全沉淀时,c
Cr3<105mol/L,由K
数据计算可知,
sp
c OH>3
1030.2
108.4,Cr3恰好完全沉淀pH最小值5.6,B错误;
105
C.P和Q点溶液中含Cr微粒总和相等,生成的CrOH s质量相等,则P点溶液质量等
3
于Q点溶液质量,C错误;
c
Cr3
D.随着pH的增大,c Cr3 减小,而c CrOH
4
增大,
c
CrOH 比值减小,D错误;
4
故选A。
15.(1) 2 1s22s22p63s23p1
(2)Al S +x+3H O=Al O xH O+3H Se
2 3 2 2 3 2 2
(3) 凝华 减少H Se生成,提高Se产率 H ,H Se
2 2 2
(4)4HH SeO 4I 2I Se3H O
2 3 2 2
(5)94.8%
【分析】粗Se加入铝粉焙烧得到Al Se ,通入水蒸气氢化得到H Se,脱水后热解发生反应:
2 3 2
H Seg SegH g,冷凝后得到精Se;
2 2
【详解】(1)Al是IIIA族元素,化合价为+3价,则Se化合价为-2价;铝的基态电子排布
式为1s22s22p63s23p1;
(2)“氢化”过程是Al Se 与水蒸气反应生成H Seg,化学方程式为
2 3 2
Al S +x+3H O=Al O ·xH O+3H Se;
2 3 2 2 3 2 2
(3)从气态变为固态的过程为凝华;已知热解正向是吸热反应,降温时,为避免平衡逆向
移动,需要迅速冷凝Se蒸汽,故目的是减少H Se生成,提高Se产率;尾气种含有H 以及
2 2
少量的H Se;
2
答案第7页,共11页(4)反应③是SeIV被KI还原为Se的过程,离子方程式为:
4HH SeO 4I 2I Se3H O;
2 3 2 2
(5)第一次加入40.00mL的Na S O 溶液和KI溶液,二者同时做还原剂,将H SeO 还原
2 2 3 2 3
为Se,第二次再加入同浓度的Na S O 滴定上一步生成的碘单质,整个过程相当于48mL
2 2 3
0.1mol/L的Na S O 溶液与H SeO 反应,根据已知条件Se(IV)与Na S O 反应的物质的量之
2 2 3 2 3 2 2 3
1
比为1:4,则n SeⅣ
481030.11.2103mol,样品中Se的含量:
4
1.2103mol79g/mol
100%94.8%。
0.1g
16.(1) 温度计 HCl
(2)40
(3) 溶液紫色褪去 2MnO-+3SO2-+H O=2MnO +3SO2+2OH-
4 3 2 2 4
(4)ACEG
(5) CO 过滤、洗涤、干燥
2
【详解】(1)由方程式可知,磺化过程中还生成了氯化氢,所以用水来吸收,由装置图可知,
a为温度计,故答案为:温度计;HCl;
(2)由方程式可知,邻甲基磺酸氯与氨水为1:1进行反应,0.3mol邻甲基磺酸氯中消耗的
氨水为0.3mol,加入15mol/L的氨水,充分反应后,消耗20毫升的氨水,同时产生0.3mol
的氯化氢,氯化氢与氨水中和反应,消耗的氨水为0.3mol,即20毫升,所以一共需要消耗
NH H O的体积为40mL,故答案为:40;
3 2
(3)氧化过程中为保证氧化完全,需要加入过量的KMnO ,反应完全后,向其中滴加Na SO
4 2 3
以除去过量KMnO 溶液,KMnO 溶液被消耗,则反应完全的现象是溶液紫色褪去,该溶液
4 4
为碱性,则KMnO 被还原成二氧化锰,根据氧化还原规律,得出离子方程式为:
4
2MnO-+3SO2-+H O=2MnO +3SO2+2OH-,故答案为:溶液紫色褪去;
4 3 2 2 4
2MnO-+3SO2-+H O=2MnO +3SO2+2OH-;
4 3 2 2 4
(4)过滤需要烧杯,漏斗,玻璃棒,铁架台等,故需要的仪器为:ACEG;
(5)
答案第8页,共11页能水解生成羧基,与NaHCO 反应,产生大量的二氧化碳气体,当NaHCO
3 3
完全反应,趁热过滤,冷却结晶的后续操作是过滤,洗涤,干燥,故答案为:CO ;过滤,
2
洗涤,干燥。
17.(1) B >
(2) 右侧 2H O 2H O O 4e2H O4OH-
2 2 2 2 2
(3) K1.81016 D k 1.251011
2
【详解】(1)①重水中存在电离平衡D ODOD,中性溶液中,c(D)c(OD),只
2
有B点符合,所以“A、B、C”三点中呈中性的是B点,故答案为:B;
②水的电离平衡为吸热过程,温度升高,电离程度增大,c(D),c(OD)均增大,Kw也增
大,由图可知,T 时离子浓度更高,Kw更大,所以T>T ,故答案为:>;
1 1 2
(2)①用H 进行实验,左侧通入H ,产物为H O,电极方程式为:H -2e-+2OH-=2H O,
2 2 2 2 2
左侧为负极,右侧为正极,电极方程式为O 4e2H O4OH-,在原电池中,正电荷向
2 2
正极移动,所以盐桥中K移向正极,即右侧,该电池为燃料电池,原料为氢气和氧气,总
反应方程式为2H O 2H O,故答案为:右侧;2H O 2H O;
2 2 2 2 2 2
②用O 进行实验,一侧通入O ,电池总反应方程式不变,则该电池为氢气和氧气组成的燃
2 2
料电池,该侧的电极反应方程式为O 4e2H O4OH-,故答案为:
2 2
O 4e2H O4OH-;
2 2
1
(3)①25℃时,由题意可知,4105 ,达到平衡时v 正 =v 逆 ,即
k 2k x
1 2 e
kcH O =k c H c OH , k 1
H
c
OH
,又因为cH O55.6mol/L,联立方程,
1 2 2 k cH O 2
2 2
得出H OH OH的平衡常数K1.81016 mol/L,故答案为:K1.81016;
2
②瞬时升温后,逆反应速率增大,但水的浓度是恒定的,正反应速率不变,所以建立新平衡
的过程示意图为D,
答案第9页,共11页③由①联立方程,得出k 1.251011 L/mols,故答案为:k 1.251011。
2 2
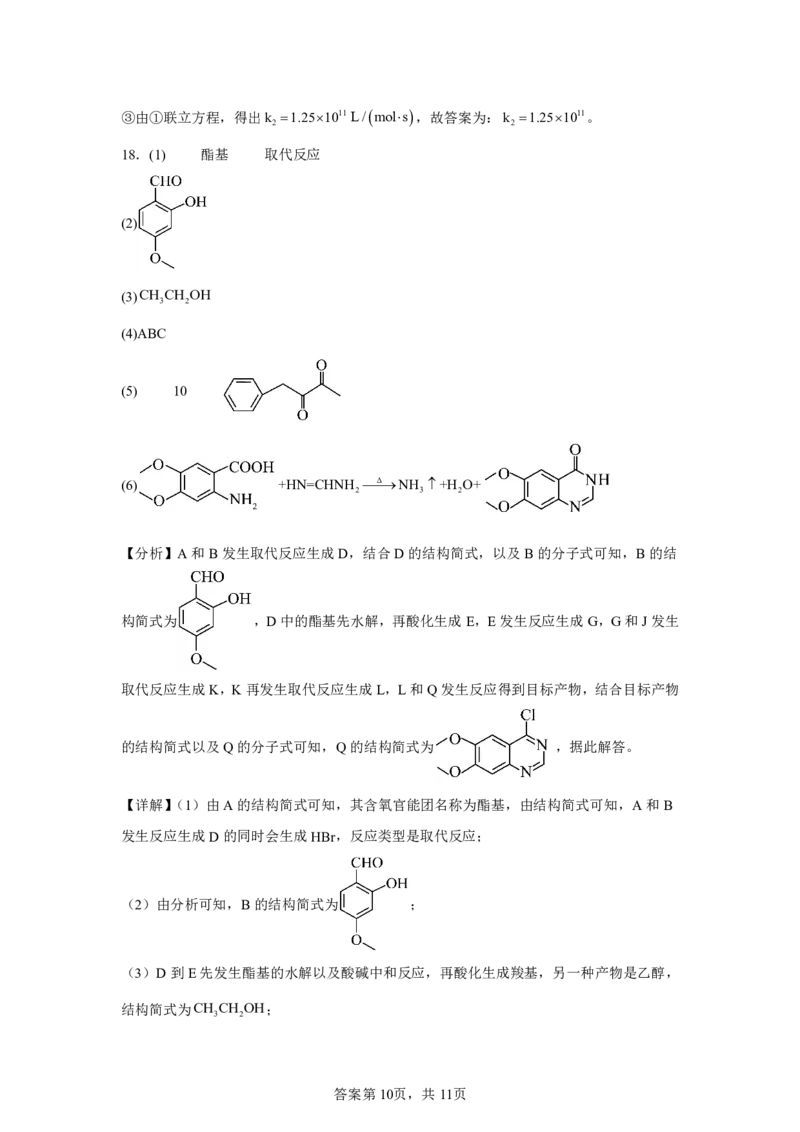
18.(1) 酯基 取代反应
(2)
(3)CH CH OH
3 2
(4)ABC
(5) 10
(6) +HN=CHNH ΔNH +H O+
2 3 2
【分析】A和B发生取代反应生成D,结合D的结构简式,以及B的分子式可知,B的结
构简式为 ,D中的酯基先水解,再酸化生成E,E发生反应生成G,G和J发生
取代反应生成K,K再发生取代反应生成L,L和Q发生反应得到目标产物,结合目标产物
的结构简式以及Q的分子式可知,Q的结构简式为 ,据此解答。
【详解】(1)由A的结构简式可知,其含氧官能团名称为酯基,由结构简式可知,A和B
发生反应生成D的同时会生成HBr,反应类型是取代反应;
(2)由分析可知,B的结构简式为 ;
(3)D到E先发生酯基的水解以及酸碱中和反应,再酸化生成羧基,另一种产物是乙醇,
结构简式为CH CH OH;
3 2
答案第10页,共11页(4)A.G中含有苯环,存在大π键,A正确;
B.由G和K的结构简式可知,K中有1个碳原子来自于J,B正确;
C.L中含有羟基和酰胺基,能形成氢键,C正确;
D.L与Q生成Z的反应中,发生的是取代反应,会生成小分子的HCl,因此
MZ<ML+MQ,D错误
故选ABC;
(5)G的分子式为C H O ,不饱和度为6,存在 和2个环外π键,说
10 10 2
明分子中除了苯环外还存在2个双键结构,不含OH与sp杂化的碳原子,说明不含有羟基、
羧基、碳碳三键,则苯环的支链可以为:
属于醛或酮的有:CH CH COCHO 、CH COCH CHO 、
2 2 2 2
CH COCOCH 、CH CHCHO 、CH OCH CHCHO、
2 3 2 2 2
;
属于酯的有: 、CH COOCH CH 、
2 2
CH OOCCH CH 、 总计10种同分异构体;
2 2
核磁共振氧谱峰面积比为(3:2:2:2:1),则分子总有1个甲基,满足条件的结构简式为
;
(6)由已知信息的反应可知,X的结构简式为HN CHNH ,R中即含有氨基,又含有羧
2
基,由Z的结构简式,以及已知信息的反应,可推断出,R中氨基和羧基处于邻位,R的结
构简式为 ,则由R和X生成T的化学方程式为
+HN=CHNH Δ NH +H O+ 。
2 3 2
答案第11页,共11页