文档内容
2020 年深圳中考化学试题
一、选择题(共10 小题,每小题1.5分,共15 分。在每小题给出的4 个选项中,只有一项符
合题意。)
1.下列描述正确的是( )
A. “滴水成冰”是化学变化
B. “花香四溢”表明分子在不断运动
的
C. “釜底抽薪”是为了降低可燃物 着火点
D. “百炼成钢”指生铁经多次煅炼转化为纯铁
【答案】B
【解析】
【详解】A、“滴水成冰”,是水的状态发生变化,没有生成新物质,属于物理变化,故A错误;
B、分子是不断运动的,所以我们能闻到各种气味,“花香四溢”表明分子在不断运动,故B正确。
C、着火点燃是物质的一种性质,一般不改变。“釜底抽薪”是清除可燃物,故C错误;
D、“百炼成钢”指生铁经多次煅炼碳含量降低成为钢,不是转化为纯铁,故D错误。
故选:B。
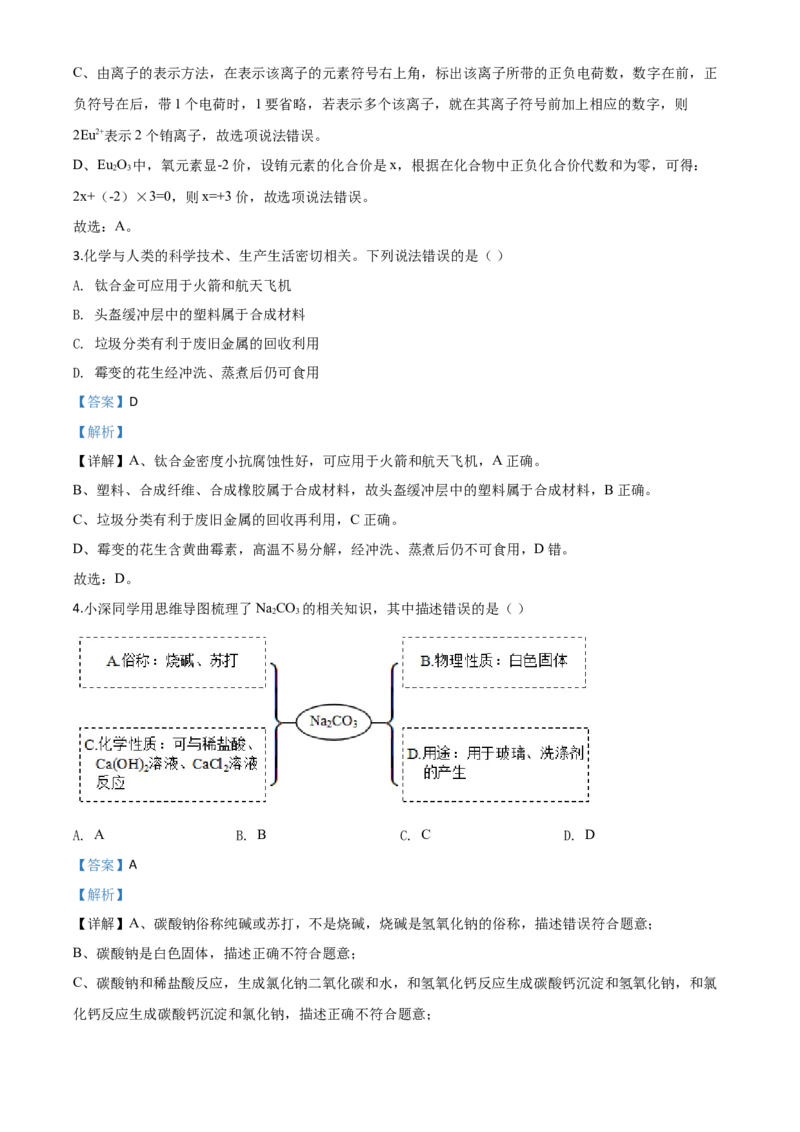
2.如图为铕在元素周期表中的相关信息,下列有关铕的说法正确的是( )
A. 铕原子中的质子数为63
B. 铕的相对原子质量是152.0g
C. 2Eu2+表示2 个铕原子
D. EuO 中铕元素的化合价为+6价
2 3
【答案】A
【解析】
【详解】A、根据元素周期表中的一格可知,左上角的数字为63,表示原子序数为63;根据原子中原子序
数=核电荷数=质子数=核外电子数,则铕原子中的质子数为63,故选项说法正确。
B、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为152.0,
相对原子质量单位是“1”,不是“克”,故选项说法错误。C、由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正
负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,则
2Eu2+表示2个铕离子,故选项说法错误。
D、EuO 中,氧元素显-2价,设铕元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:
2 3
2x+(-2)×3=0,则x=+3价,故选项说法错误。
故选:A。
3.化学与人类的科学技术、生产生活密切相关。下列说法错误的是( )
A. 钛合金可应用于火箭和航天飞机
B. 头盔缓冲层中的塑料属于合成材料
C. 垃圾分类有利于废旧金属的回收利用
D. 霉变的花生经冲洗、蒸煮后仍可食用
【答案】D
【解析】
【详解】A、钛合金密度小抗腐蚀性好,可应用于火箭和航天飞机,A正确。
B、塑料、合成纤维、合成橡胶属于合成材料,故头盔缓冲层中的塑料属于合成材料,B正确。
C、垃圾分类有利于废旧金属的回收再利用,C正确。
D、霉变的花生含黄曲霉素,高温不易分解,经冲洗、蒸煮后仍不可食用,D错。
故选:D。
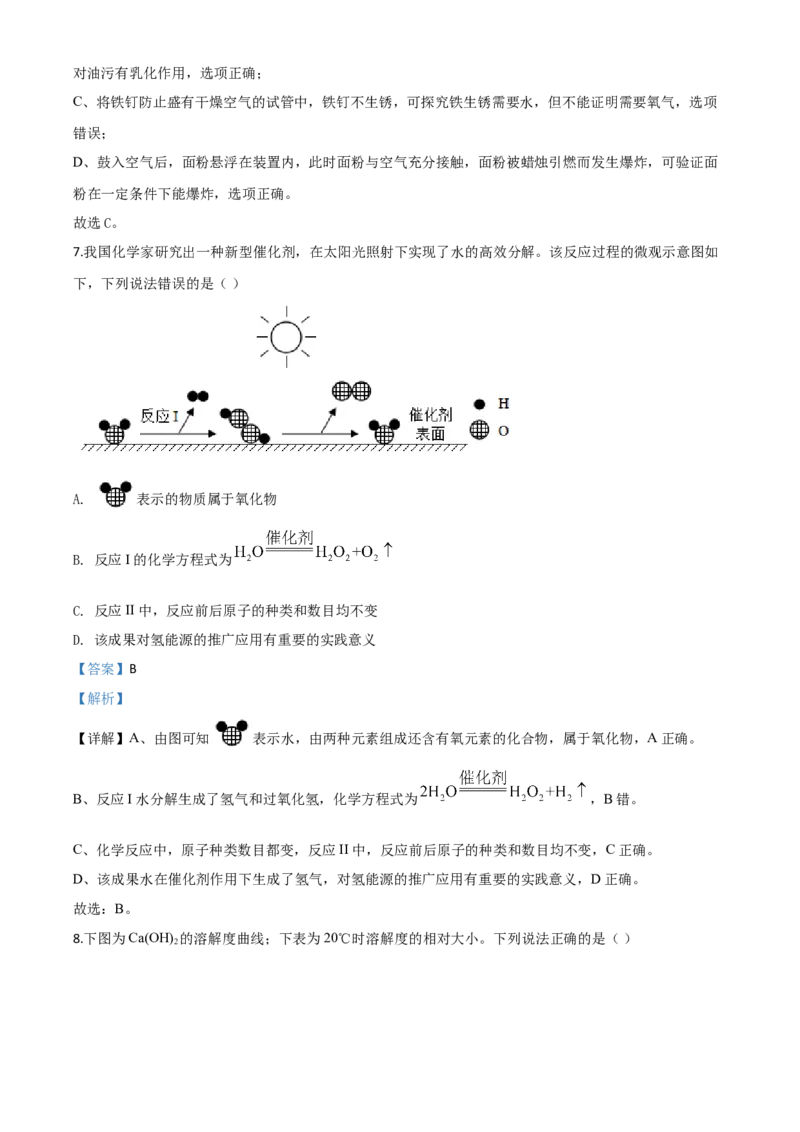
4.小深同学用思维导图梳理了NaCO 的相关知识,其中描述错误的是( )
2 3
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A、碳酸钠俗称纯碱或苏打,不是烧碱,烧碱是氢氧化钠的俗称,描述错误符合题意;
B、碳酸钠是白色固体,描述正确不符合题意;
C、碳酸钠和稀盐酸反应,生成氯化钠二氧化碳和水,和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,和氯
化钙反应生成碳酸钙沉淀和氯化钠,描述正确不符合题意;D、碳酸钠可用于玻璃、洗涤剂的生产,描述正确不符合题意。故选A。
5.“艾叶香,香满堂;粽子香,香厨房。”据研究,粽子的香味源于粽叶的主要成分——对乙烯基苯酚
(化学式为C HO)。下列说法正确的是 ( )
8 8
.
A 对乙烯基苯酚不属于有机物
B. 对乙烯基苯酚由3 种元素组成
C. 对乙烯基苯酚中C、H、O 三种元素的质量比为8﹕8﹕1
D. 对乙烯基苯酚由8 个C 原子、8 个H 原子、1 个O 原子构成
【答案】B
【解析】
【详解】A、含碳元素的化合物属于有机物,乙烯基苯酚(化学式为C HO)含碳元素,属于有机物,A
8 8
错。
B、对乙烯基苯酚由碳、氢、氧3 种元素组成,B正确。
C、对乙烯基苯酚中C、H、O 三种元素的质量比为(12×8):(1×8):(16×1)=12:1:2,C错。
D、一个对乙烯基苯酚分子由8 个C 原子、8 个H 原子、1 个O 原子构成,D错。
故选:B。
6.下列实验不能达到相应目的的是( )
A验证木炭具有吸附 D验证面粉在一定条件下能
B观察乳化现象 C探究铁生锈的条件
性 爆炸
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A、将集气瓶内放入一定量的木炭,震荡,气体的颜色变浅,甚至变成无色,证明木炭具有吸附
性,选项正确;
的
B、加入洗涤剂后,震荡,可观察到植物油“均匀”分散 倒水中,形成乳状液体(乳浊液),故洗涤剂对油污有乳化作用,选项正确;
C、将铁钉防止盛有干燥空气的试管中,铁钉不生锈,可探究铁生锈需要水,但不能证明需要氧气,选项
错误;
D、鼓入空气后,面粉悬浮在装置内,此时面粉与空气充分接触,面粉被蜡烛引燃而发生爆炸,可验证面
粉在一定条件下能爆炸,选项正确。
故选C。
7.我国化学家研究出一种新型催化剂,在太阳光照射下实现了水的高效分解。该反应过程的微观示意图如
下,下列说法错误的是( )
A. 表示的物质属于氧化物
B. 反应I 的化学方程式为
C. 反应II 中,反应前后原子的种类和数目均不变
D. 该成果对氢能源的推广应用有重要的实践意义
【答案】B
【解析】
【详解】A、由图可知 表示水,由两种元素组成还含有氧元素的化合物,属于氧化物,A正确。
B、反应I 水分解生成了氢气和过氧化氢,化学方程式为 ,B错。
C、化学反应中,原子种类数目都变,反应II 中,反应前后原子的种类和数目均不变,C正确。
D、该成果水在催化剂作用下生成了氢气,对氢能源的推广应用有重要的实践意义,D正确。
故选:B。
8.下图为Ca(OH) 的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
2溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A. Ca(OH) 属于易溶物质
2
B. Ca(OH) 的溶解度随温度的升高而增大
2
C. 30℃时,Ca(OH) 的饱和溶液中溶质与溶剂的质量比为3﹕20
2
D. 70℃时Ca(OH) 的饱和溶液,降温到50℃时没有析出固体
2
【答案】D
【解析】
【详解】A、20℃时,氢氧化钙的溶解度为0.16g,对照表格可知,其属于微溶物质,说法错误;
B、Ca(OH) 的溶解度曲线可知,氢氧化钙的溶解度随温度的升高而减小,说法错误;
2
C、30℃时,氢氧化钙的溶解度为0.15g,其饱和溶液中溶质与溶剂的质量比为0.15g:100g=3﹕2000,说
法错误;
D、氢氧化钙的溶解度随温度的降低而增大,70℃时氢氧化钙的饱和溶液,降温到50℃时没有析出固体,
说法正确。
故选:D。
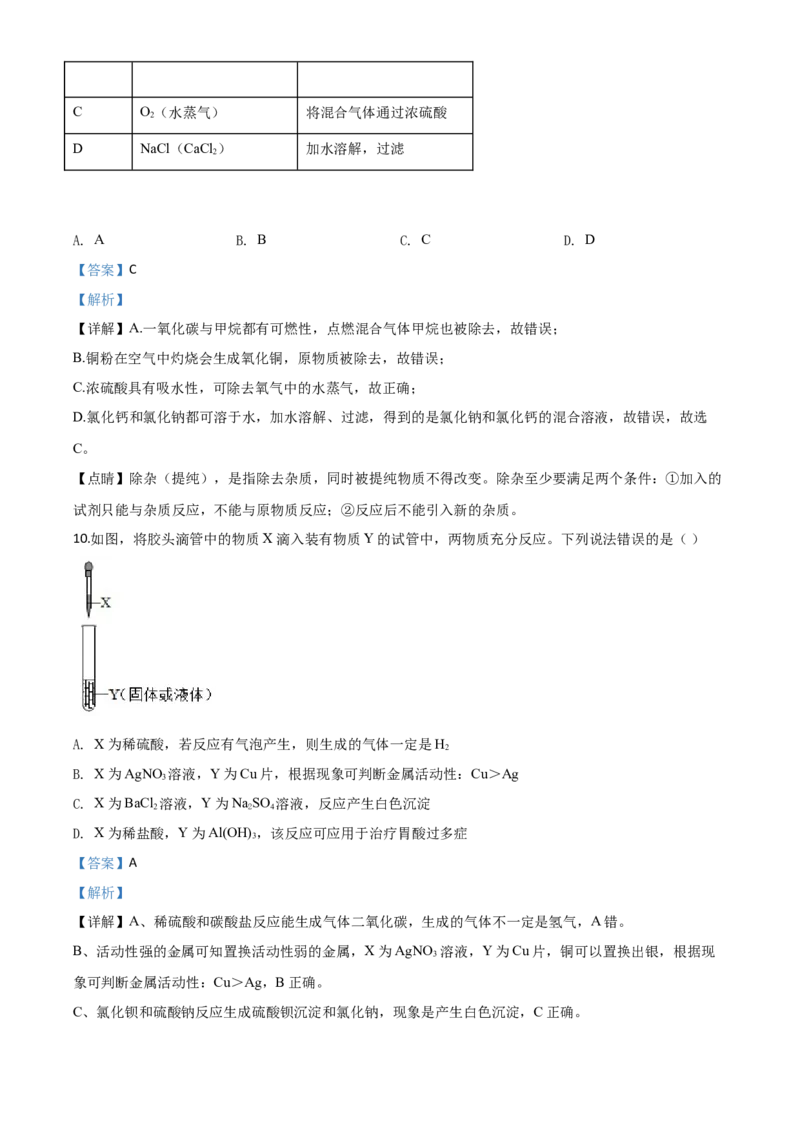
9.下列方法能达到除杂目的的是( )
选项 物质(括号内为杂质) 方法
A CH(CO) 点燃混合气体
4
B 铜粉(碳粉) 在空气中灼烧固体混合物C O(水蒸气) 将混合气体通过浓硫酸
2
D NaCl(CaCl ) 加水溶解,过滤
2
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.一氧化碳与甲烷都有可燃性,点燃混合气体甲烷也被除去,故错误;
B.铜粉在空气中灼烧会生成氧化铜,原物质被除去,故错误;
C.浓硫酸具有吸水性,可除去氧气中的水蒸气,故正确;
D.氯化钙和氯化钠都可溶于水,加水溶解、过滤,得到的是氯化钠和氯化钙的混合溶液,故错误,故选
C。
【点睛】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂至少要满足两个条件:①加入的
试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
10.如图,将胶头滴管中的物质X 滴入装有物质Y 的试管中,两物质充分反应。下列说法错误的是( )
A. X 为稀硫酸,若反应有气泡产生,则生成的气体一定是H
2
B. X 为AgNO 溶液,Y 为Cu片,根据现象可判断金属活动性:Cu>Ag
3
C. X 为BaCl 溶液,Y 为NaSO 溶液,反应产生白色沉淀
2 2 4
D. X 为稀盐酸,Y 为Al(OH) ,该反应可应用于治疗胃酸过多症
3
【答案】A
【解析】
【详解】A、稀硫酸和碳酸盐反应能生成气体二氧化碳,生成的气体不一定是氢气,A错。
B、活动性强的金属可知置换活动性弱的金属,X 为AgNO 溶液,Y 为Cu片,铜可以置换出银,根据现
3
象可判断金属活动性:Cu>Ag,B正确。
C、氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,现象是产生白色沉淀,C正确。D、氢氧化铝和稀盐酸反应生成氯化铝和水,该反应是氢氧化铝治疗胃酸的反应,D正确。
故选:A。
二、非选择题(共3 题,共25 分)
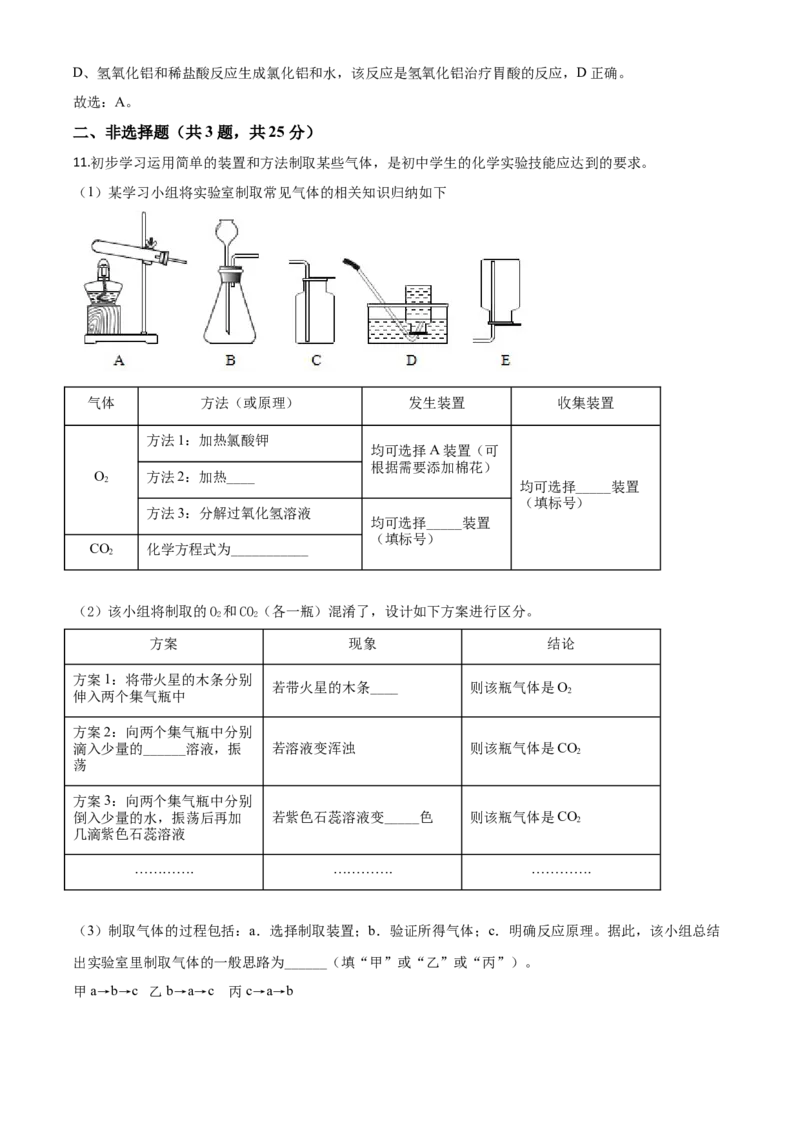
11.初步学习运用简单的装置和方法制取某些气体,是初中学生的化学实验技能应达到的要求。
(1)某学习小组将实验室制取常见气体的相关知识归纳如下
气体 方法(或原理) 发生装置 收集装置
方法1:加热氯酸钾
均可选择A装置(可
根据需要添加棉花)
O 方法2:加热____
2 均可选择_____装置
(填标号)
方法3:分解过氧化氢溶液
均可选择_____装置
(填标号)
CO 化学方程式为___________
2
(2)该小组将制取的O 和CO(各一瓶)混淆了,设计如下方案进行区分。
2 2
方案 现象 结论
方案1:将带火星的木条分别
若带火星的木条____ 则该瓶气体是O
伸入两个集气瓶中 2
方案2:向两个集气瓶中分别
滴入少量的______溶液,振 若溶液变浑浊 则该瓶气体是CO
2
荡
方案3:向两个集气瓶中分别
倒入少量的水,振荡后再加 若紫色石蕊溶液变_____色 则该瓶气体是CO
2
几滴紫色石蕊溶液
…………. …………. ………….
(3)制取气体的过程包括:a.选择制取装置;b.验证所得气体;c.明确反应原理。据此,该小组总结
出实验室里制取气体的一般思路为______(填“甲”或“乙”或“丙”)。
甲 a→b→c 乙 b→a→c 丙 c→a→b【答案】 (1). C (2). 高锰酸钾(或KMnO ) (3). B (4). (5). 复
4
燃 (6). 氢氧化钙(或Ca(OH) ) (7). 红 (8). 丙
2
【解析】
【详解】(1)制取二氧化碳使用碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,属于固液混合不需加
热型,发生装置可与过氧化氢制取氧气的装置相同,均可用B装置;制取氧气还可以加热氯酸钾或高锰酸
钾,属于固体加热型,发生装置均可用A;二氧化碳、氧气密度均比空气大,但二氧化碳能溶于水、氧气
不易溶于水,均可用C装置收集;故有:
气体 方法(或原理) 发生装置 收集装置
方法1:加热氯酸钾 均可选择A装置
(可根据需要添加
O 方法2:加热 高锰酸钾 ( 或 KMnO ) 棉花)
2 4
均可选择C 装置
方法3:分解过氧化氢溶液
均可选择B 装置
化学方程式为
CO
2
(2)氧气具有助燃性,可以使带火星的木条复燃;二氧化碳能使澄清石灰水变浑浊,二氧化碳溶于水并
与水反应生成碳酸,碳酸可使紫色石蕊溶液变红;故有:
方案 现象 结论
方案1:将带火星的木条分别
若带火星的木条复燃 则该瓶气体是O
伸入两个集气瓶中 2
方案2:向两个集气瓶中分别
滴入少量的氢氧化钙(或 若溶液变浑浊 则该瓶气体是CO
2
Ca(OH) )溶液,振荡
2
方案3:向两个集气瓶中分别
倒入少量的水,振荡后再加 若紫色石蕊溶液变红色 则该瓶气体是CO
2
几滴紫色石蕊溶液
(3)实验室里制取气体的一般思路为明确反应原理、选择制取装置、验证所得气体;故填:丙。
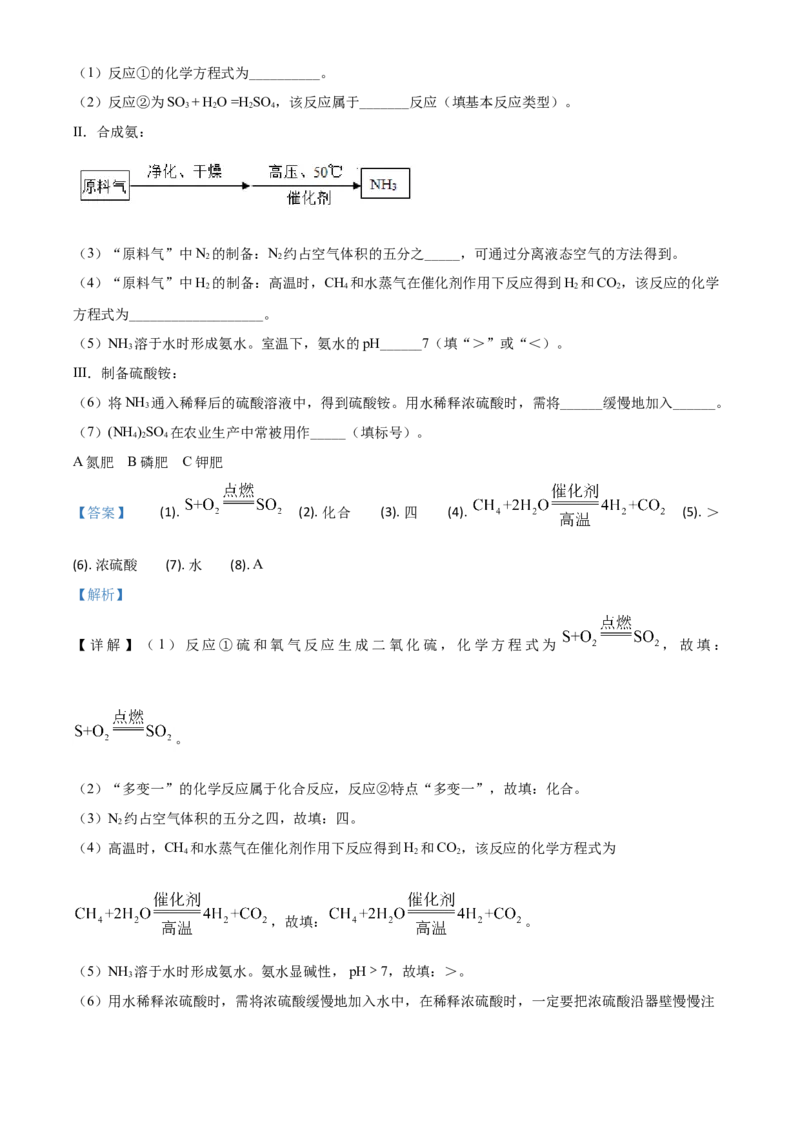
12.下列流程可用于制备硫酸铵。
I.制硫酸:(1)反应①的化学方程式为__________。
(2)反应②为SO + H O =H SO ,该反应属于_______反应(填基本反应类型)。
3 2 2 4
II.合成氨:
(3)“原料气”中N 的制备:N 约占空气体积的五分之_____,可通过分离液态空气的方法得到。
2 2
(4)“原料气”中H 的制备:高温时,CH 和水蒸气在催化剂作用下反应得到H 和CO,该反应的化学
2 4 2 2
方程式为___________________。
(5)NH 溶于水时形成氨水。室温下,氨水的pH______7(填“>”或“<)。
3
III.制备硫酸铵:
(6)将NH 通入稀释后的硫酸溶液中,得到硫酸铵。用水稀释浓硫酸时,需将______缓慢地加入______。
3
(7)(NH )SO 在农业生产中常被用作_____(填标号)。
4 2 4
A氮肥 B磷肥 C钾肥
【答案】 (1). (2). 化合 (3). 四 (4). (5). >
(6). 浓硫酸 (7). 水 (8). A
【解析】
【详解】(1)反应①硫和氧气反应生成二氧化硫,化学方程式为 ,故填:
。
(2)“多变一”的化学反应属于化合反应,反应②特点“多变一”,故填:化合。
(3)N 约占空气体积的五分之四,故填:四。
2
(4)高温时,CH 和水蒸气在催化剂作用下反应得到H 和CO,该反应的化学方程式为
4 2 2
,故填: 。
(5)NH 溶于水时形成氨水。氨水显碱性, pH>7,故填:>。
3
(6)用水稀释浓硫酸时,需将浓硫酸缓慢地加入水中,在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌,切不可将水倒进浓硫酸中。如果水倒进浓硫酸中,由于水的密度小,浮在硫酸的上
面,硫酸溶解时放出的热量不易散失,使水暴沸,带着酸向四处飞溅,有可能发生意外。故填:浓硫酸;
水。
(7)(NH )SO 含氮元素,在农业生产中常被用作氮肥,故选:A。
4 2 4
13.氧气是人类生产活动的重要资源。
(1)下列属于O 的化学性质的是_____(填标号)。
2
A O 能支持燃烧
2
B O 的密度比空气的密度略大
2
C O 在低温、高压时能变为液体或固体
2
的
(2)小圳同学进行实验室制备O 相关探究。
2
【查阅】他得知在KClO 分解制O 的反应中,Fe O 可作催化剂。
3 2 2 3
【实验】他用电子秤称取0.49gFe O 和一定量的KClO,充分混合后加热至KClO 完全分解,冷却至室温,
2 3 3 3
称得剩余固体的质量为1.98g。
【计算】①剩余固体中KCl 的质量。
②该反应生成O 的质量(根据化学方程式写出完整的计算步骤)。
2
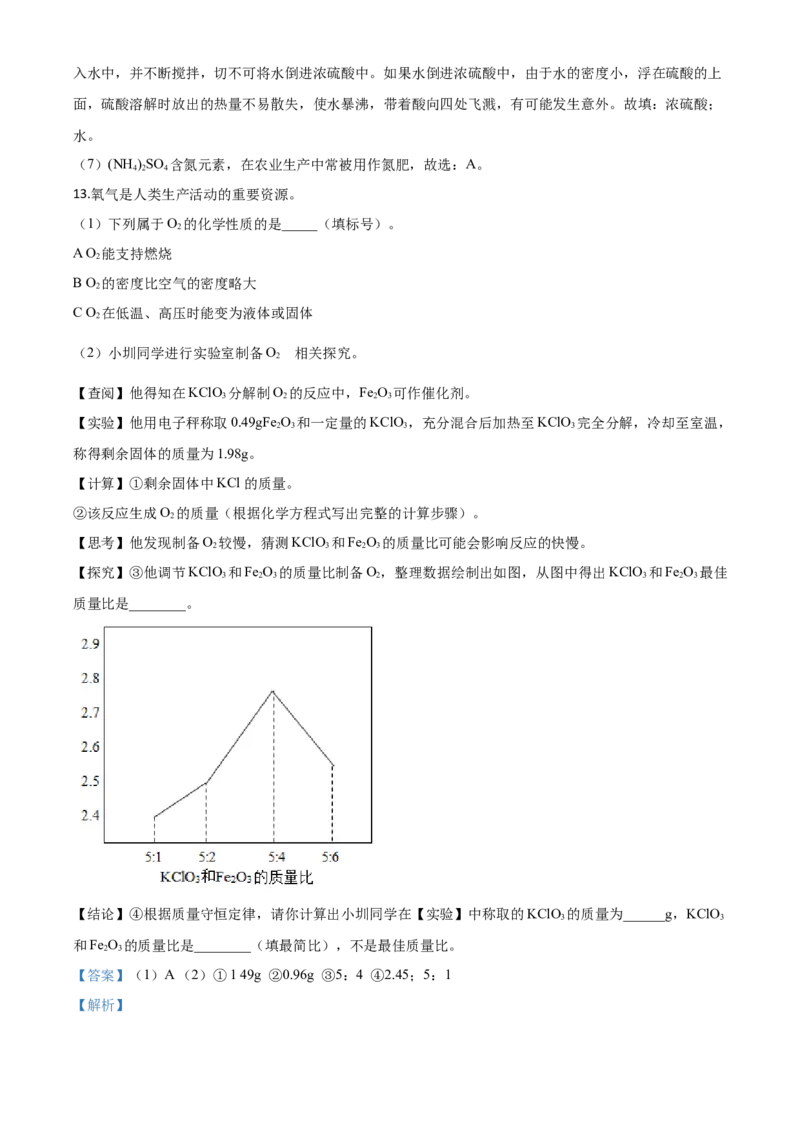
【思考】他发现制备O 较慢,猜测KClO 和Fe O 的质量比可能会影响反应的快慢。
2 3 2 3
【探究】③他调节KClO 和Fe O 的质量比制备O,整理数据绘制出如图,从图中得出KClO 和Fe O 最佳
3 2 3 2 3 2 3
质量比是________。
【结论】④根据质量守恒定律,请你计算出小圳同学在【实验】中称取的KClO 的质量为______g,KClO
3 3
和Fe O 的质量比是________(填最简比),不是最佳质量比。
2 3
.
【答案】(1)A (2)①149g ②0.96g ③5:4 ④2.45;5:1
【解析】【详解】(1)通过化学变化体现的性质属于化学性质,O 能支持燃烧属于化学性质,密度和状态的改变
2
属于物理性质,故选:A。
(2)剩余氯化钾质量1.98g-0.49g=1.49g,设生成氧气质量为x,则
故填:1.49g;0.96g。
(3)由图可知KClO 和Fe O 最佳质量比是5:4,反应速率最快,故选:5:4。
3 2 3
(4)设氯酸钾质量为y,则
KClO 和Fe O 的质量比是2.45g:0.49g=5:1,故填:2.45;5:1。
3 2 3本试卷的题干、答案和解析均由组卷网(http://zujuan.xkw.com)专业教师团队编校出品。
登录组卷网可对本试卷进行单题组卷、细目表分析、布置作业、举一反三等操作。
试卷地址:在组卷网浏览本卷
组卷网是学科网旗下的在线题库平台,覆盖小初高全学段全学科、超过900万精品解析试题。
关注组卷网服务号,可使用移动教学助手功能(布置作业、线上考试、加入错题本、错题训练)。
学科网长期征集全国最新统考试卷、名校试卷、原创题,赢取丰厚稿酬,欢迎合作。
钱老师 QQ:537008204 曹老师 QQ:713000635