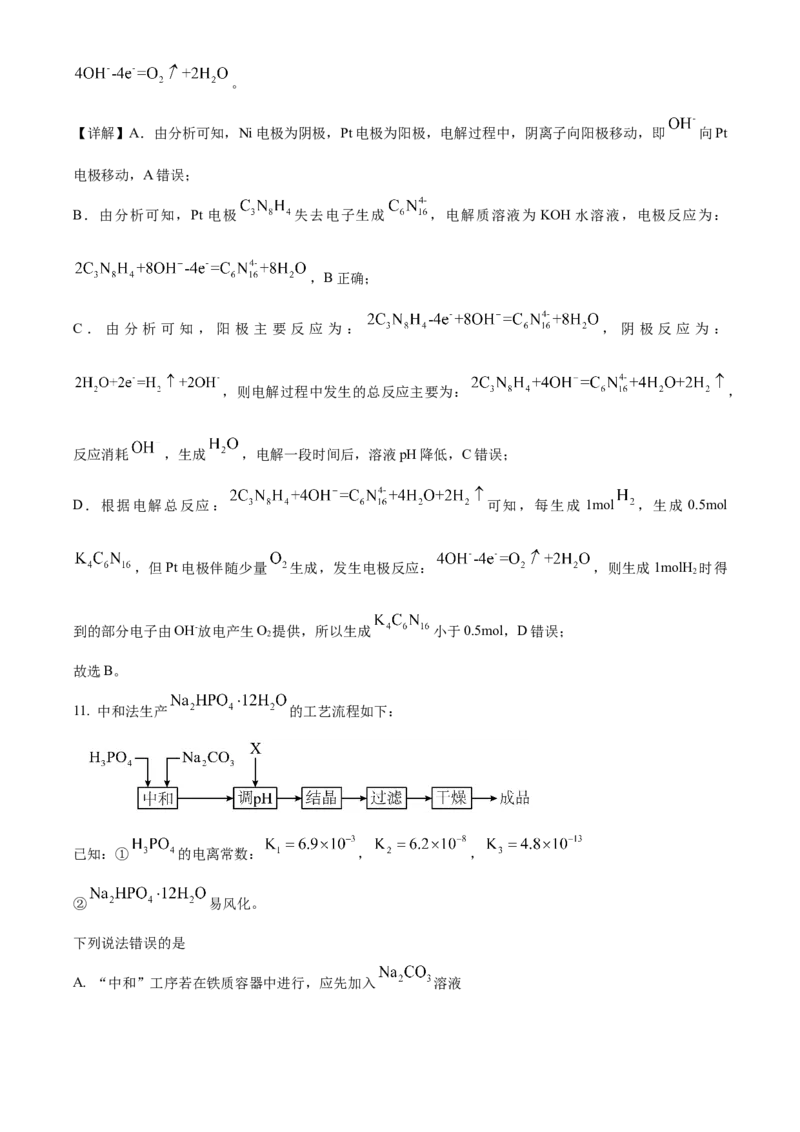
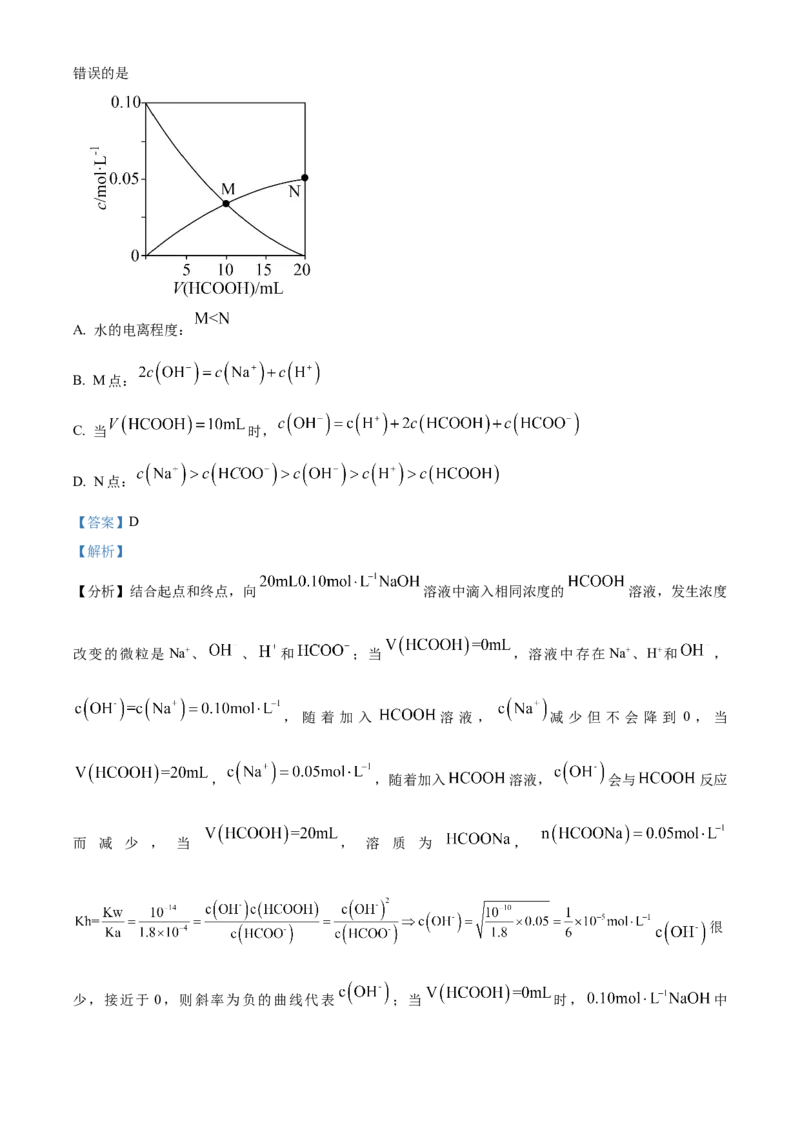
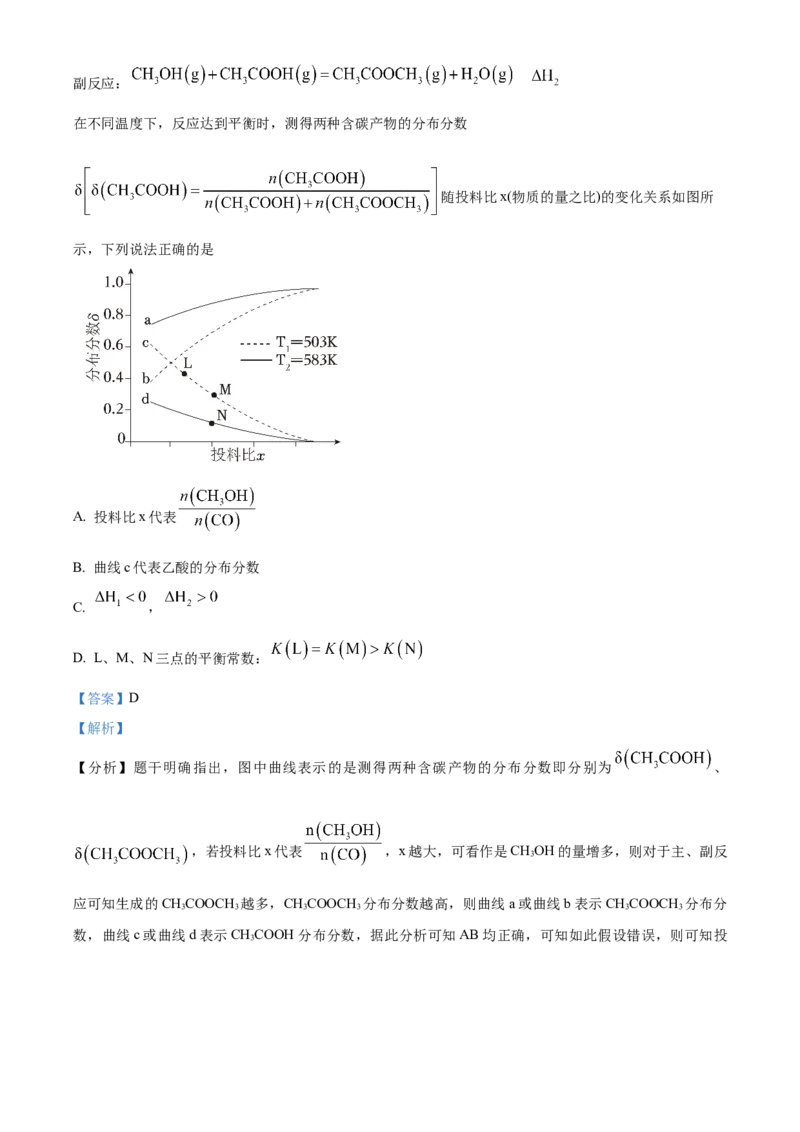
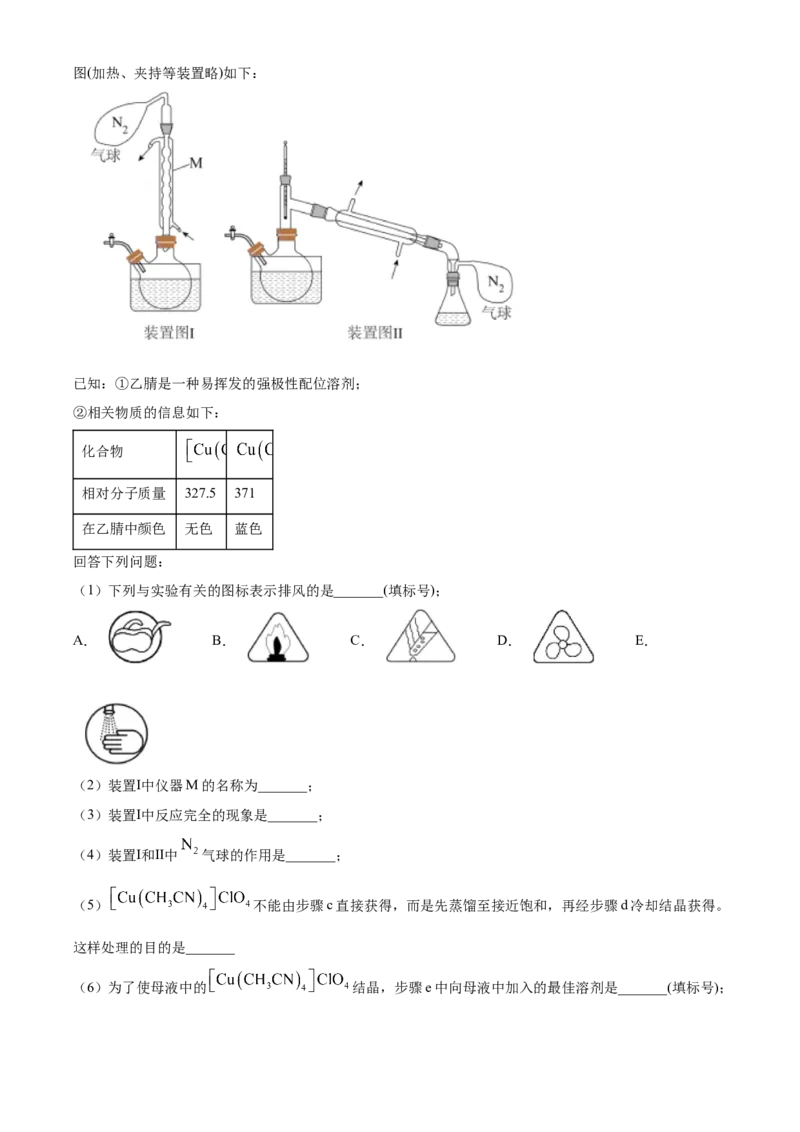
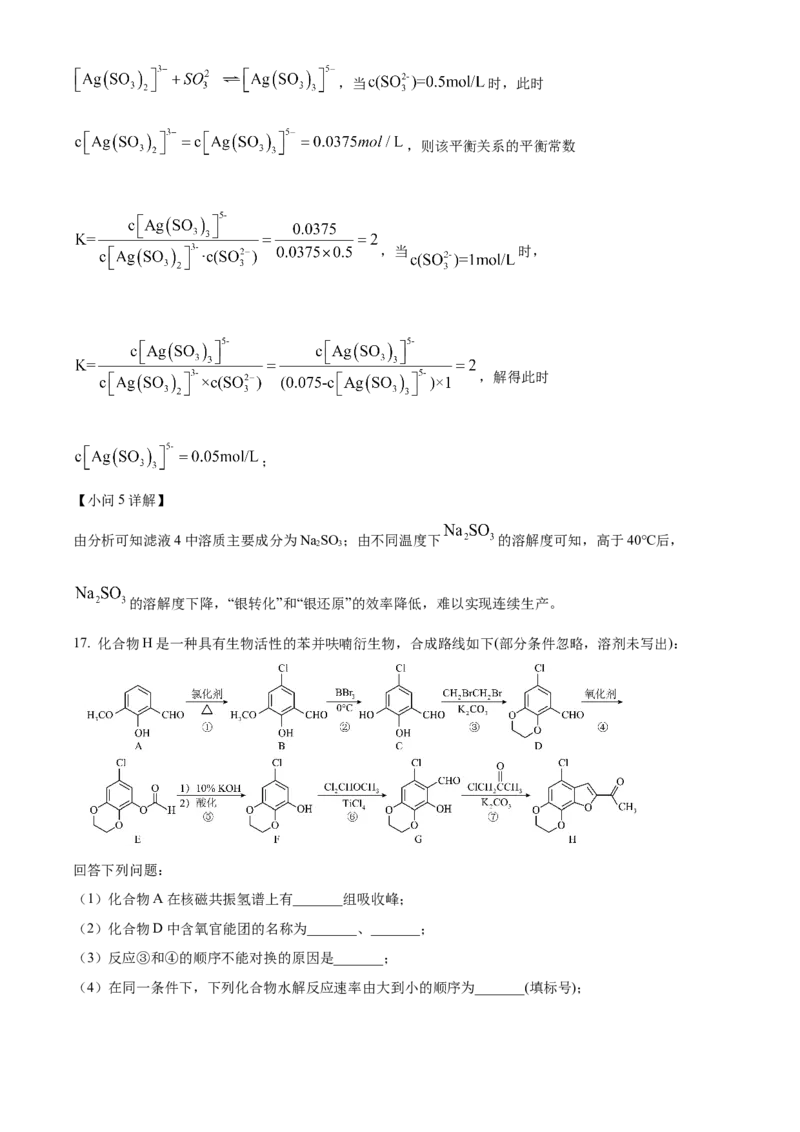
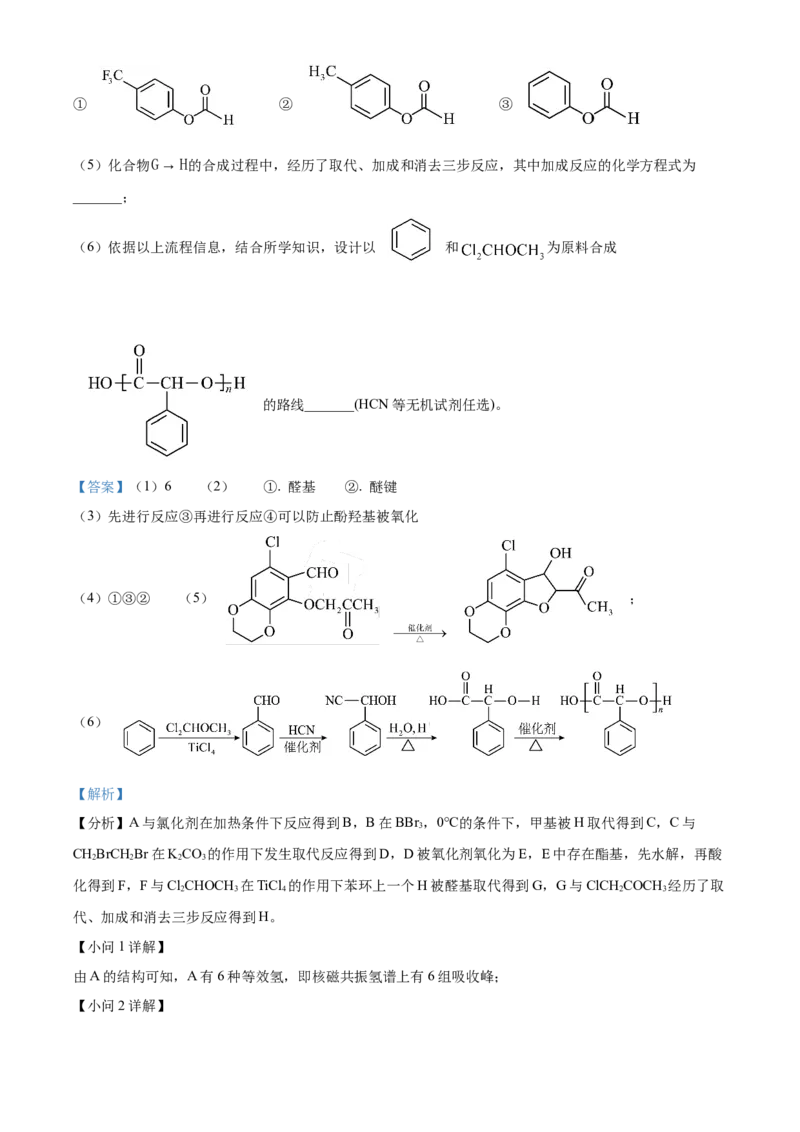
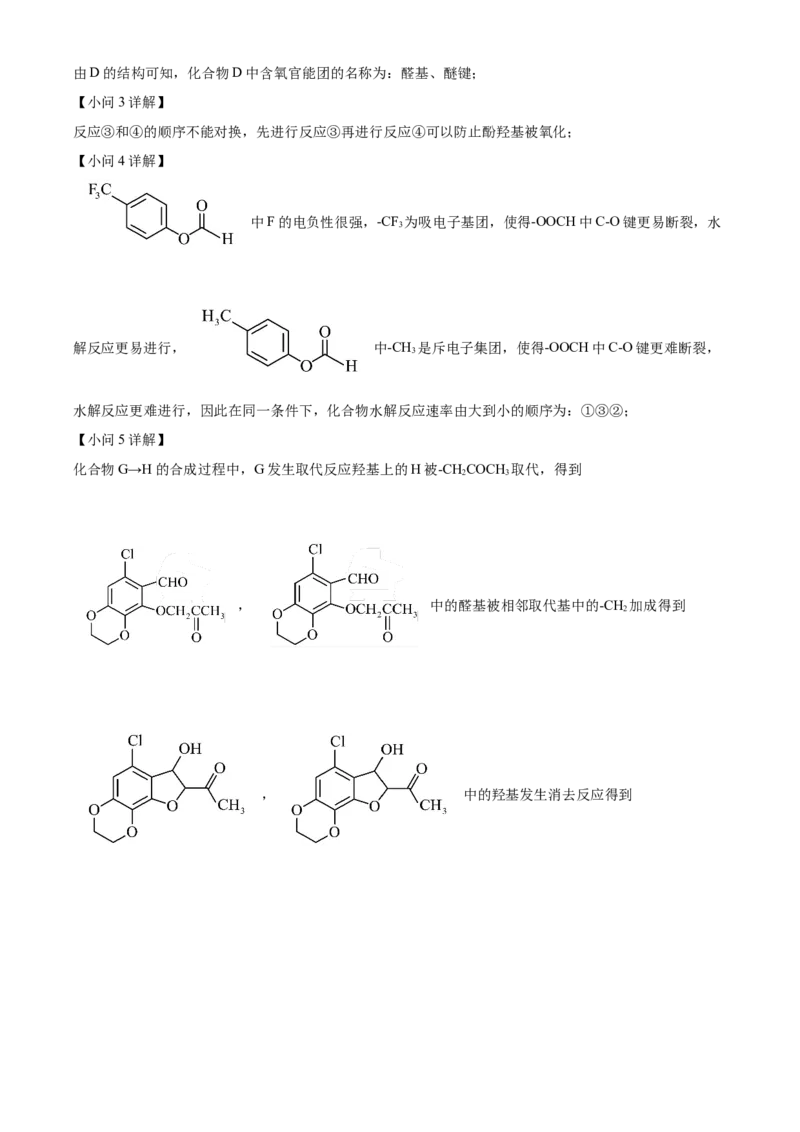
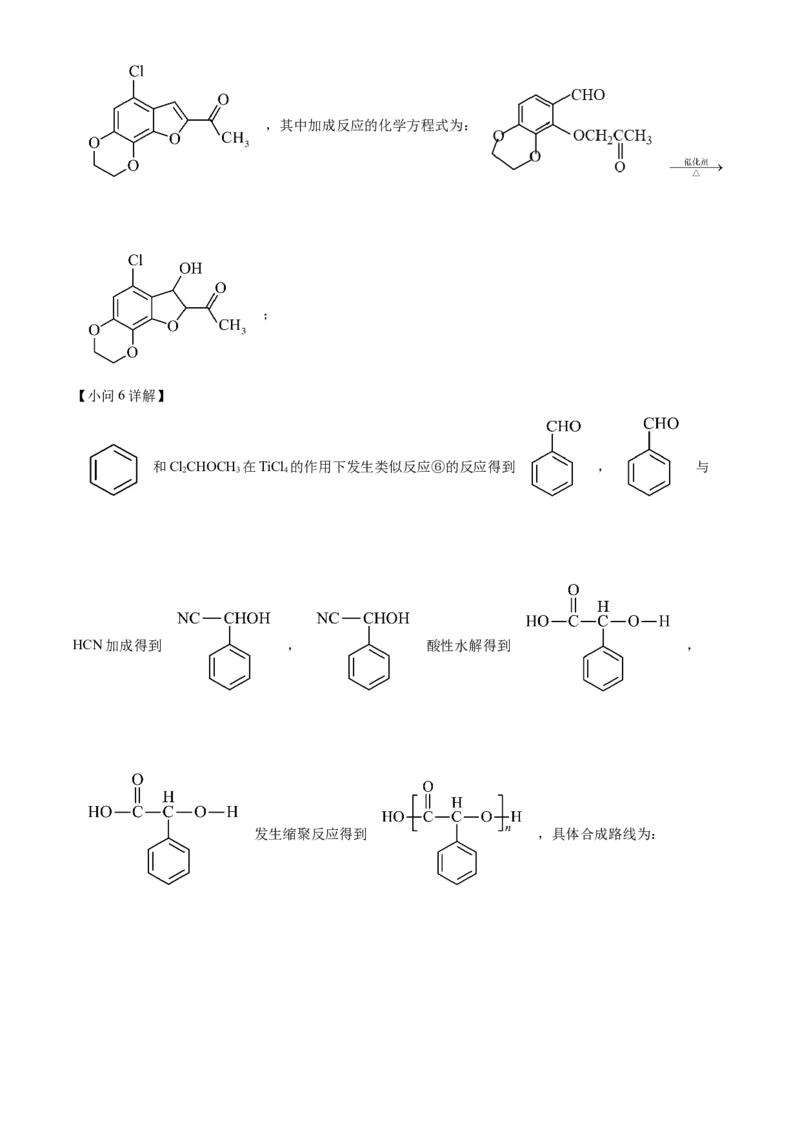
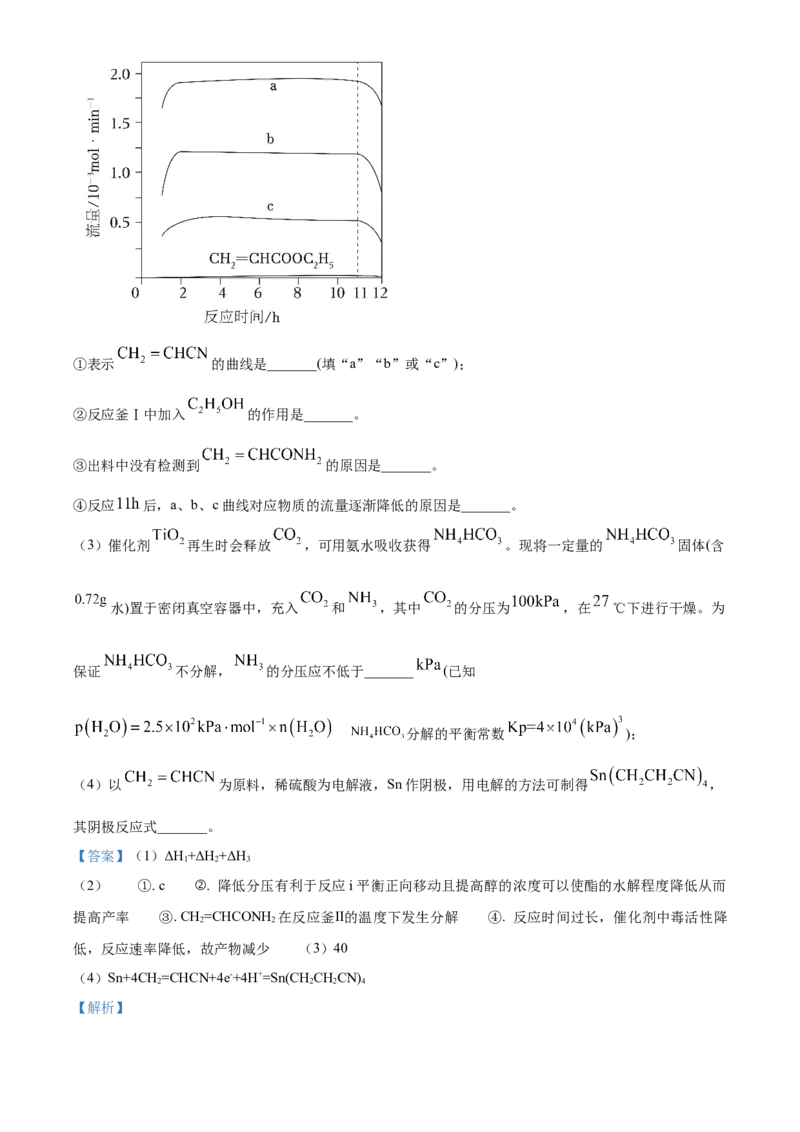
文档内容
化学试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Cu 64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1. 近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是
A. 理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B. 氢氧燃料电池具有能量转化率高、清洁等优点
C. 锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D. 太阳能电池是一种将化学能转化为电能的装置
【答案】D
【解析】
【详解】A.理想的新能源应具有可再生、无污染等特点,故A正确;
B.氢氧燃料电池利用原电池将化学能转化为电能,对氢气与氧气反应的能量进行利用,减小了直接燃烧
的热量散失,产物无污染,故具有能量转化率高、清洁等优点,B正确;
C.脱嵌是锂从电极材料中出来的过程,放电时,负极材料产生锂离子,则锂离子在负极脱嵌,则充电时,
锂离子在阳极脱嵌,C正确;
D.太阳能电池是一种将太阳能能转化为电能的装置,D错误;
本题选D。
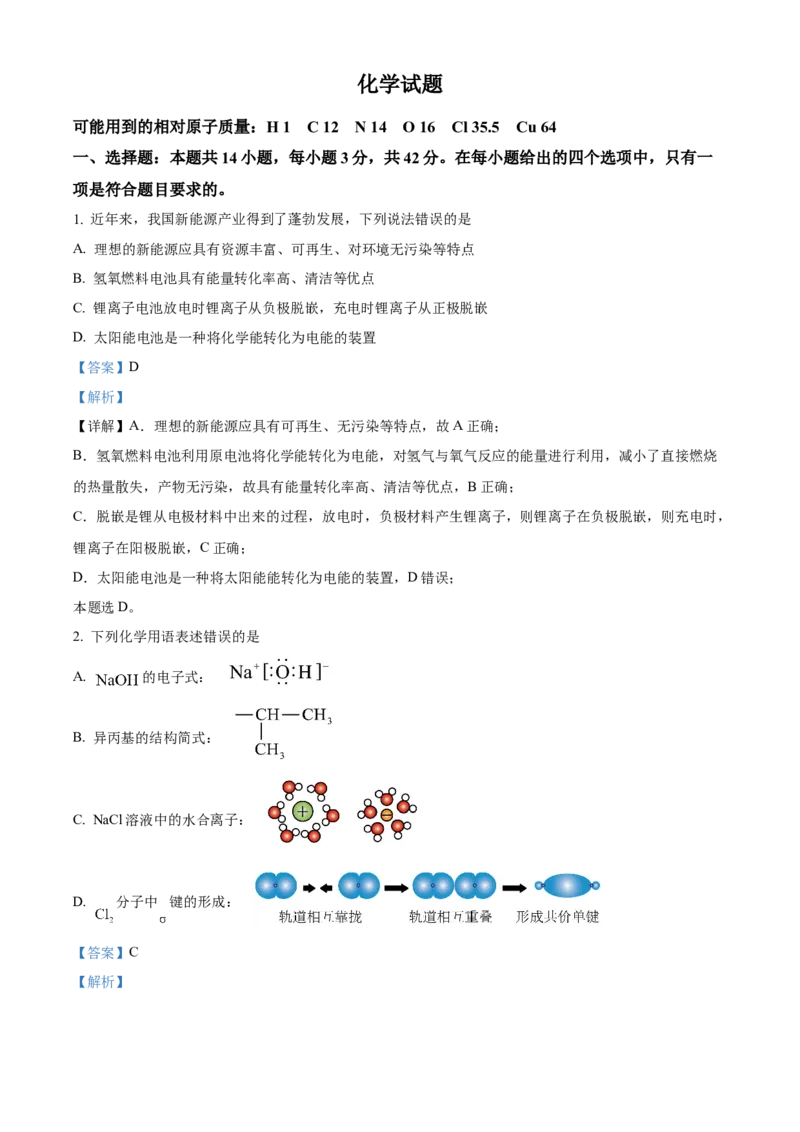
2. 下列化学用语表述错误的是
A. 的电子式:
B. 异丙基的结构简式:
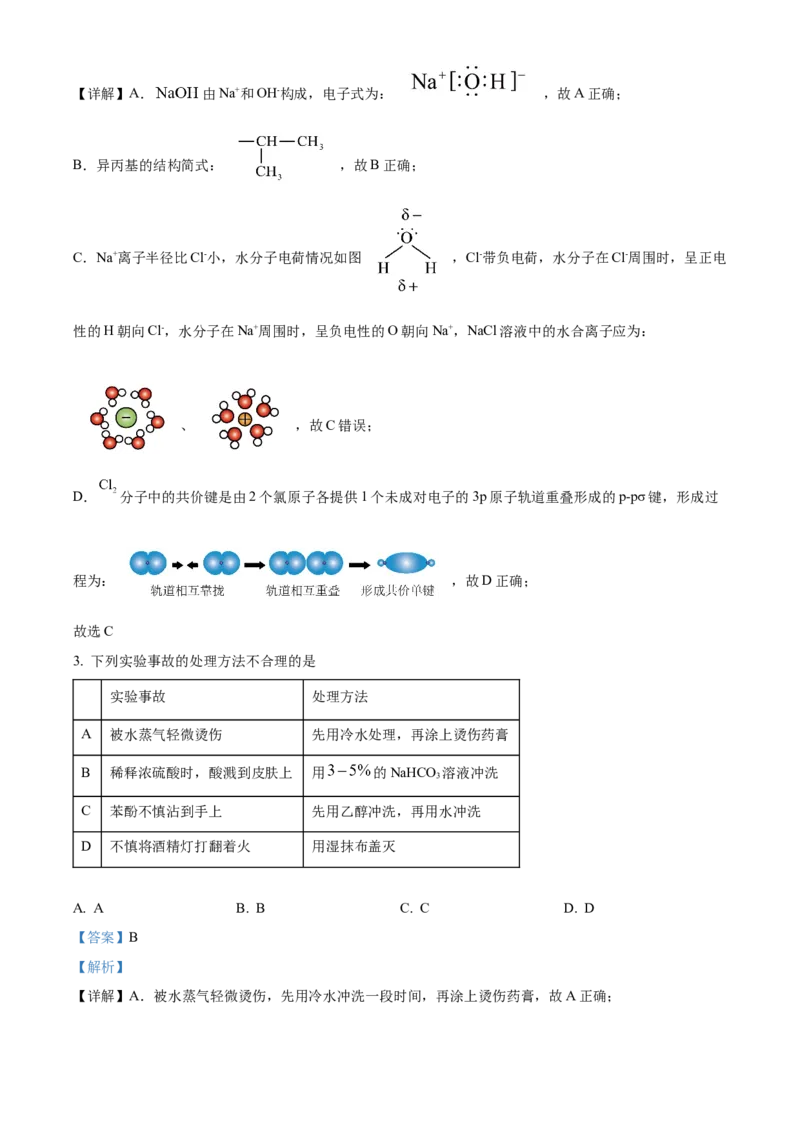
C. NaCl溶液中的水合离子:
D. 分子中 键的形成:
【答案】C
【解析】【详解】A. 由Na+和OH-构成,电子式为: ,故A正确;
B.异丙基的结构简式: ,故B正确;
C.Na+离子半径比Cl-小,水分子电荷情况如图 ,Cl-带负电荷,水分子在Cl-周围时,呈正电
性的H朝向Cl-,水分子在Na+周围时,呈负电性的O朝向Na+,NaCl溶液中的水合离子应为:
、 ,故C错误;
D. 分子中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的p-pσ键,形成过
程为: ,故D正确;
故选C 。
3. 下列实验事故的处理方法不合理的是
实验事故 处理方法
A 被水蒸气轻微烫伤 先用冷水处理,再涂上烫伤药膏
B 稀释浓硫酸时,酸溅到皮肤上 用 的NaHCO 溶液冲洗
3
C 苯酚不慎沾到手上 先用乙醇冲洗,再用水冲洗
D 不慎将酒精灯打翻着火 用湿抹布盖灭
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.被水蒸气轻微烫伤,先用冷水冲洗一段时间,再涂上烫伤药膏,故A正确;B.稀释浓硫酸时,酸溅到皮肤上,先用大量的水冲洗,再涂上 的NaHCO 溶液,故B错误;
3
C.苯酚有毒,对皮肤有腐蚀性,常温下苯酚在水中溶解性不大,但易溶于乙醇,苯酚不慎沾到手上,先
用乙醇冲洗,再用水冲洗,故C正确;
D.酒精灯打翻着火时,用湿抹布盖灭,湿抹布可以隔绝氧气,也可以降温,故D正确;
故选B 。
4. 下列有关化学概念或性质的判断错误的是
A. 分子是正四面体结构,则 没有同分异构体
B. 环己烷与苯分子中 键的键能相等
C. 甲苯的质谱图中,质荷比为92的峰归属于
D. 由 与 组成的离子液体常温下呈液态,与其离子的体积较大有关
【答案】B
【解析】
【详解】A. 为四面体结构,其中任何两个顶点都是相邻关系,因此 没有同分异构体,故
A项说法正确;
B.环己烷中碳原子采用sp3杂化,苯分子中碳原子采用sp2杂化,由于同能层中s轨道更接近原子核,因
此杂化轨道的s成分越多,其杂化轨道更接近原子核,由此可知sp2杂化轨道参与组成的C-H共价键的电子
云更偏向碳原子核,即苯分子中的C-H键长小于环己烷,键能更高,故B项说法错误;
C. 带1个单位电荷,其相对分子质量为92,因此其质荷比为92,故C项说法正
确;
D.当阴阳离子体积较大时,其电荷较为分散,导致它们之间的作用力较低,以至于熔点接近室温,故D
项说法正确;
综上所述,错误的是B项。
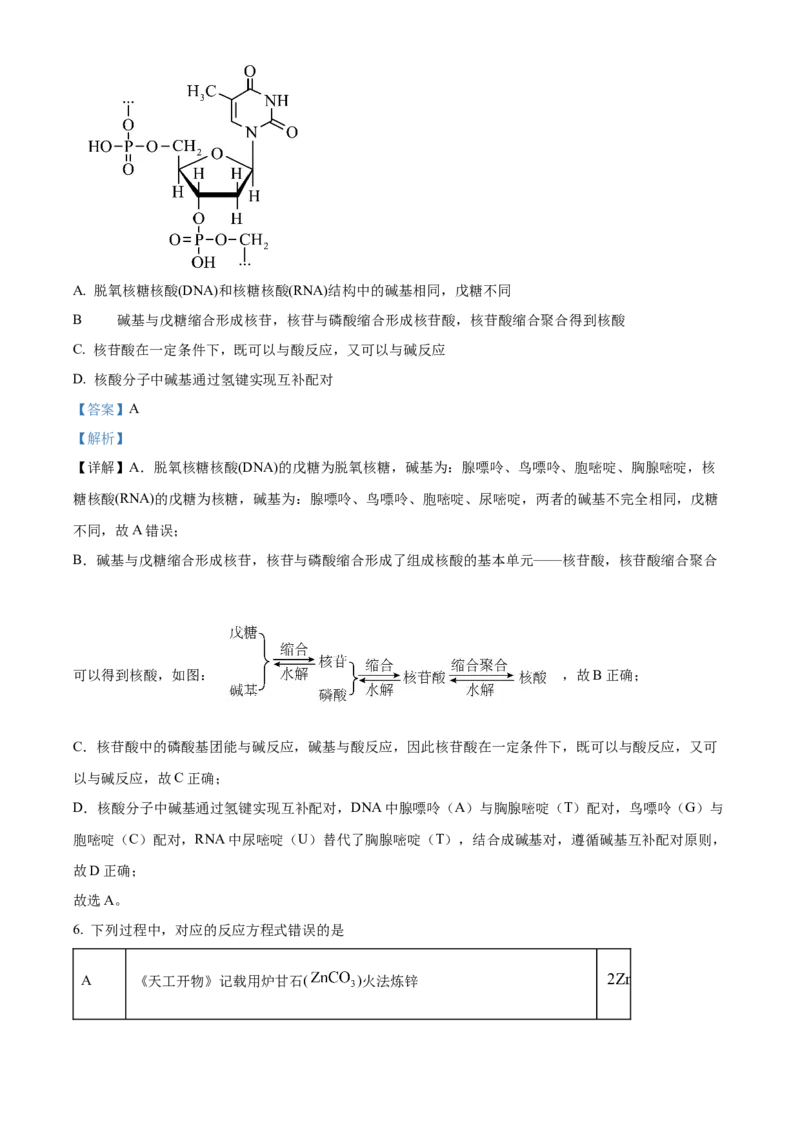
5. 组成核酸的基本单元是核苷酸,下图是核酸的某一结构片段,下列说法错误的是A. 脱氧核糖核酸(DNA)和核糖核酸(RNA)结构中的碱基相同,戊糖不同
.
B 碱基与戊糖缩合形成核苷,核苷与磷酸缩合形成核苷酸,核苷酸缩合聚合得到核酸
C. 核苷酸在一定条件下,既可以与酸反应,又可以与碱反应
D. 核酸分子中碱基通过氢键实现互补配对
【答案】A
【解析】
【详解】A.脱氧核糖核酸(DNA)的戊糖为脱氧核糖,碱基为:腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶,核
糖核酸(RNA)的戊糖为核糖,碱基为:腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶,两者的碱基不完全相同,戊糖
不同,故A错误;
B.碱基与戊糖缩合形成核苷,核苷与磷酸缩合形成了组成核酸的基本单元——核苷酸,核苷酸缩合聚合
可以得到核酸,如图: ,故B正确;
C.核苷酸中的磷酸基团能与碱反应,碱基与酸反应,因此核苷酸在一定条件下,既可以与酸反应,又可
以与碱反应,故C正确;
D.核酸分子中碱基通过氢键实现互补配对,DNA中腺嘌呤(A)与胸腺嘧啶(T)配对,鸟嘌呤(G)与
胞嘧啶(C)配对,RNA中尿嘧啶(U)替代了胸腺嘧啶(T),结合成碱基对,遵循碱基互补配对原则,
故D正确;
故选A。
6. 下列过程中,对应的反应方程式错误的是
A 《天工开物》记载用炉甘石( )火法炼锌B 用作野外生氢剂
C 饱和 溶液浸泡锅炉水垢
D 绿矾( )处理酸性工业废水中的
A. A B. B C. C D. D
【答案】A
【解析】
为
【详解】A.火法炼锌过程中C作还原剂,ZnCO 和C在高温条件下生成ZnO、CO,因此总反应
3
,故A项错误;
B. 为活泼金属氢化物,因此能与HO发生归中反应生成碱和氢气,反应方程式为
2
,故B项正确;
C.锅炉水垢中主要成分为CaSO、MgCO 等,由于溶解性:CaSO>CaCO ,因此向锅炉水垢中加入饱和
4 3 4 3
溶液,根据难溶物转化原则可知CaSO 转化为CaCO ,反应方程式为
4 3
,故C项正确;
D. 具有强氧化性,加入具有还原性的Fe2+,二者发生氧化还原反应生成Fe3+、Cr3+,Cr元素化合
价由+6降低至+3,Fe元素化合价由+2升高至+3,根据守恒规则可知反应离子方程式为
,故D项正确;
综上所述,错误的是A项。
7. 某学生按图示方法进行实验,观察到以下实验现象:①铜丝表面缓慢放出气泡,锥形瓶内气体呈红棕色;
②铜丝表面气泡释放速度逐渐加快,气体颜色逐渐变深;
③一段时间后气体颜色逐渐变浅,至几乎无色;
④锥形瓶中液面下降,长颈漏斗中液面上升,最终铜丝与液面脱离接触,反应停止。
下列说法正确的是
A. 开始阶段铜丝表面气泡释放速度缓慢,原因是铜丝在稀HNO 中表面钝化
3
B. 锥形瓶内出现了红棕色气体,表明铜和稀HNO 反应生成了NO
3 2
C. 红棕色逐渐变浅的主要原因是
D. 铜丝与液面脱离接触,反应停止,原因是硝酸消耗完全
【答案】C
【解析】
【详解】A.金属铜与稀硝酸不会产生钝化。开始反应速率较慢,可能的原因是铜表面有氧化铜,故A项
说法错误;
B.由于装置内有空气,铜和稀HNO 反应生成的NO迅速被氧气氧化为红棕色的NO ,产生的NO 浓度逐
3 2 2
渐增加,气体颜色逐渐变深,故B项说法错误;
C.装置内氧气逐渐被消耗,生成的NO 量逐渐达到最大值,同时装置内的NO 能与溶液中的HO反应
2 2 2
3NO +H O=2HNO +NO,气体颜色变浅,故C项说法正确;
2 2 3
D.由于该装置为密闭体系,生成的NO无法排出,逐渐将锥形瓶内液体压入长颈漏斗,铜丝与液面脱离
接触,反应停止,故D项说法错误;
答案选C。
8. 为达到下列实验目的,操作方法合理的是
实验目的 操作方法
A 从含有 的NaCl固体中提取 用CCl 溶解、萃取、分液
4
依次用 溶液洗涤、水洗、分
B 提纯实验室制备的乙酸乙酯
液、干燥
C 用 标准溶液滴定未知浓度 用甲基橙作指示剂进行滴定的 溶液
D 从明矾过饱和溶液中快速析出晶体 用玻璃棒摩擦烧杯内壁
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.从含有I 的NaCl固体中提取I,用CCl 溶解、萃取、分液后,I 仍然溶在四氯化碳中,没有
2 2 4 2
提取出来,A错误;
B.乙酸乙酯在氢氧化钠碱性条件下可以发生水解反应,故提纯乙酸乙酯不能用氢氧化钠溶液洗涤,B错
误;
C.用NaOH标准溶液滴定未知浓度的CHCOOH溶液,反应到达终点时生成CHCOONa,是碱性,而甲
3 3
基橙变色范围pH值较小,故不能用甲基橙作指示剂进行滴定,否则误差较大,应用酚酞作指示剂,C错
误;
D.从明矾过饱和溶液中快速析出晶体,可以用玻璃棒摩擦烧杯内壁,在烧杯内壁产生微小的玻璃微晶来
充当晶核,D正确;
本题选D。
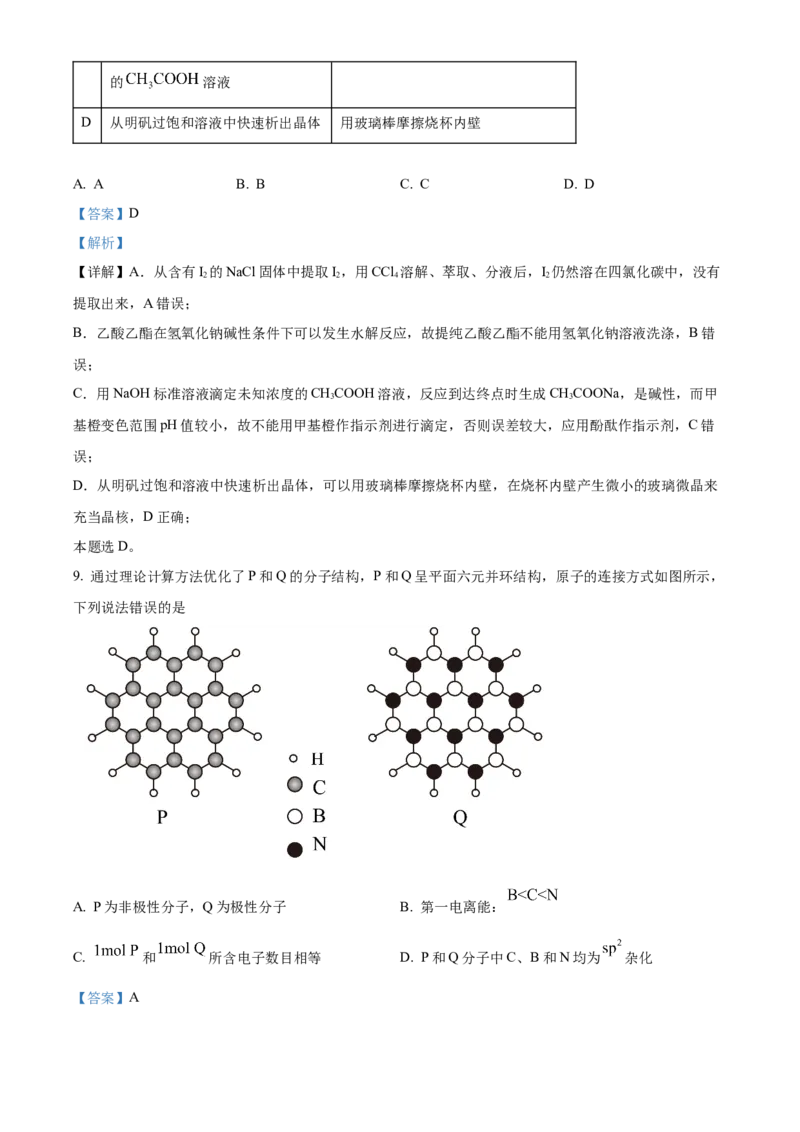
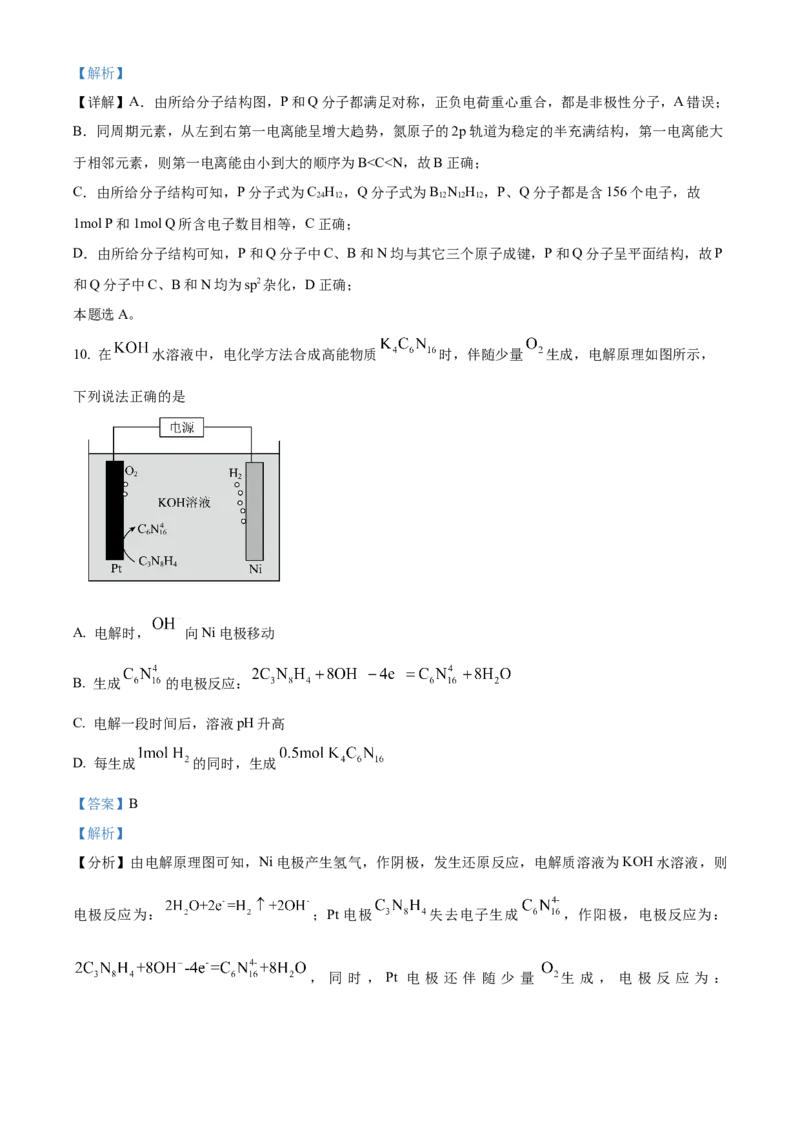
9. 通过理论计算方法优化了P和Q的分子结构,P和Q呈平面六元并环结构,原子的连接方式如图所示,
下列说法错误的是
A. P为非极性分子,Q为极性分子 B. 第一电离能:
C. 和 所含电子数目相等 D. P和Q分子中C、B和N均为 杂化
【答案】A【解析】
【详解】A.由所给分子结构图,P和Q分子都满足对称,正负电荷重心重合,都是非极性分子,A错误;
B.同周期元素,从左到右第一电离能呈增大趋势,氮原子的2p轨道为稳定的半充满结构,第一电离能大
于相邻元素,则第一电离能由小到大的顺序为B