文档内容
试卷类型:A
惠州市 2026 届高三第二次调研考试
化 学
本试卷共8页,20道小题 考试时间:75分钟 满分:100分
可能用到的相对原子质量:H1 C12 O16
一、选择题:本题共16小题,共44分。第1~10题,每小题2分;第11~16题,每小
题4分。在每小题给出的四个选项中,只有一个选项符合题意。
1.活字印刷术促进了世界文化的交流,推动了人类文明的进步。下列“活字”字坯的主
要成分为有机高分子材料的是
A.铜活字 B.木活字 C.泥活字 D.铅活字
2.抗坏血酸葡萄糖苷(下图)具有抗氧化功能。下列关于抗坏血酸葡萄糖苷说法正确的是
A.共有8个羟基
B.能与乙酸发生酯化反应
C.两个环上的C原子均共平面
D.不能使酸性KMnO 溶液褪色
4
3.现代科技,增强国力,增进民生福祉。下列说法不正确的是
A.“梦想”号钻探船钻头使用镍合金,镍合金硬度比金属镍大
B.“嫦娥六号”利用太阳能电池供电,该电池将太阳能转化为电能
C.我国科学家成功将CO 转化为淀粉,CO 的电子式为
2 2
D.电动汽车广泛使用磷酸铁锂电池,LiFePO 中Fe的化合价为+3价
4
4.劳动创造美好生活。下列劳动项目与所述化学知识表述不正确的是
选项 劳动项目 化学知识
A 用热的纯碱溶液去除油污 CO
3
2− +2H
2
O⇌H
2
CO
3
+2OH--
B 用FeCl₃溶液腐蚀铜电路板 2Fe3++Cu=2Fe2++Cu2+
C 用含过氧碳酸钠的洗衣粉漂白衣物 过氧碳酸钠会释放活性氧,氧化色素
D 用活性炭包去除冰箱异味 活性炭具有吸附性
{#{QQABBQAl4wC40JQACT7aQ0EgCQuYsJKTJAguBRCQqAZKARNABCA=}#}5.视觉材料在显示与成像技术中应用广泛。下列说法不正确的是
A.树脂镜片的主要成分是聚碳酸酯,可通过缩聚反应合成
B.数码相机感光元件CMOS芯片的单晶硅,属于分子晶体
C.普通光学玻璃的主要成分是硅酸盐,属于传统无机非金属材料
D.变色眼镜在光照下变暗是卤化银分解所致,此过程为化学变化
6.为验证淀粉的水解产物能发生银镜反应,并清洗反应后的试管。下列操作不能达到实
验目的的是
氨水 淀粉
稀H 2 SO 4 水解液 稀HNO 3
AgNO 溶液
淀粉溶液 3 银氨溶液 银镜
A.淀粉水解 B.制备银氨溶液 C.进行银镜反应 D.清洗银镜
7.下列常见物质间的直接转化关系中,推理不成立的是
A.X可为Na,Z是NaOH
B.X可为C,盐的水溶液呈碱性
C.X可为S,Y可使品红溶液褪色
D.X可为Fe,盐的水溶液遇KSCN溶液变红
8.下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 氯水需保存在棕色试剂瓶中并避光放置 HClO具有强氧化性
B 浓硫酸可用于干燥NH 浓硫酸具有吸水性
3
C 向氯水中通入SO ,氯水褪色 Cl +SO +2H O==H SO +2HCl
2 2 2 2 2 4
D 用Na SO 与稀HNO 反应制备SO 强酸可制弱酸
2 3 3 2
9.元素a~h为短周期元素,其电负性的相对大小、最高正价或最低负价与原子序数的关
系如图。下列说法不正确的是
A.a与e同主族
B.原子半径:b<c
C.最简单氢化物沸点:g<d
D.金属性:f<e
10.设N 为阿伏加德罗常数的值,下列说法正确的是
A
A.1molCH ==CH 含有的σ键数为4N
2 2 A
B.0.1molCl 与足量NaOH溶液反应,转移的电子数为0.1N
2 A
C.11.2LN 和CO混合气体中含有的原子数为N
2 A
D.1L0.1mol·L-1FeCl 溶液中,Fe(OH) 胶粒的数目为0.1N
3 3 A
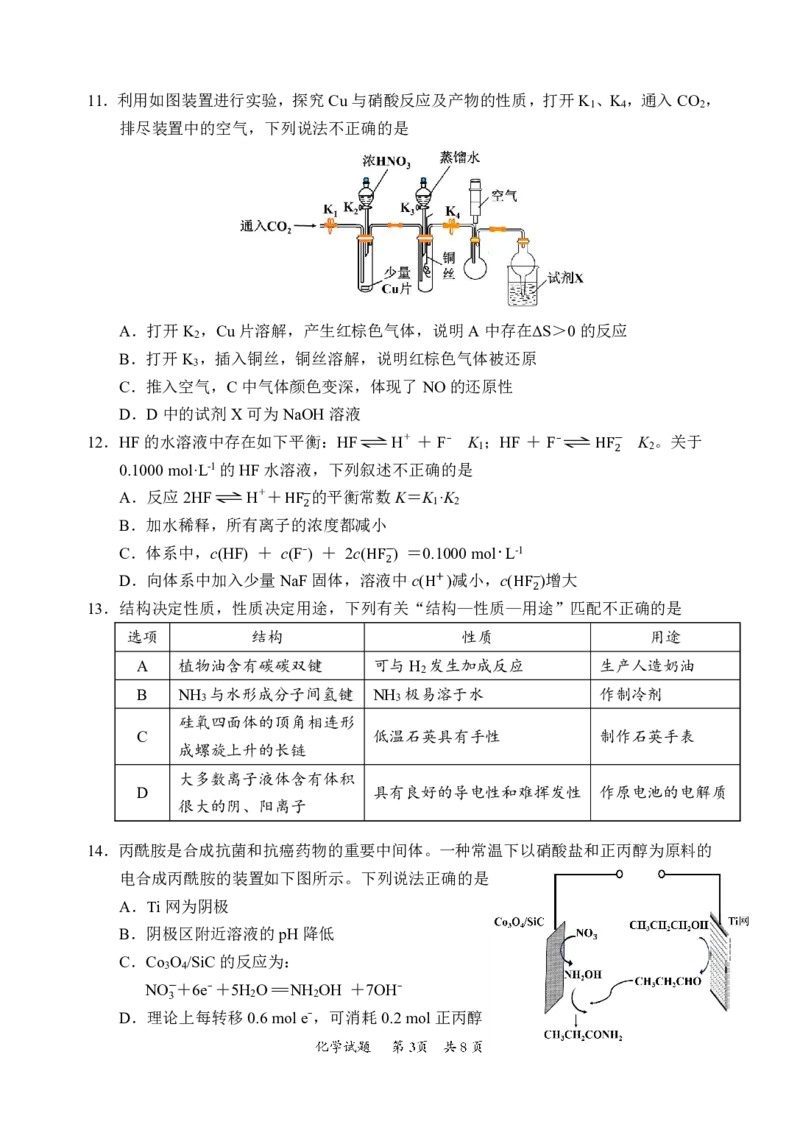
{#{QQABBQAl4wC40JQACT7aQ0EgCQuYsJKTJAguBRCQqAZKARNABCA=}#}11.利用如图装置进行实验,探究Cu与硝酸反应及产物的性质,打开K 、K ,通入CO ,
1 4 2
排尽装置中的空气,下列说法不正确的是
A.打开K ,Cu片溶解,产生红棕色气体,说明A中存在ΔS>0的反应
2
B.打开K ,插入铜丝,铜丝溶解,说明红棕色气体被还原
3
C.推入空气,C中气体颜色变深,体现了NO的还原性
D.D中的试剂X可为NaOH溶液
12.HF的水溶液中存在如下平衡:HF⇌H+ + F- K 1 ;HF + F- ⇌ K 2 。关于
0.1000mol·L-1的HF水溶液,下列叙述不正确的是
HF2
−
A.反应2HF⇌H++ 的平衡常数K=K
1
·K
2
B.加水稀释,所有离子
H
的
F2
−浓度都减小
C.体系中,c(HF) + c(F-) + 2c( ) =0.1000mol L-1
D.向体系中加入少量NaF固体,溶
H
液
F2
−中c( )减小,c( )增大
13.结构决定性质,性质决定用途,下列有关“
H
结+构—性质—
H
用
F2
−途”匹配不正确的是
选项 结构 性质 用途
A 植物油含有碳碳双键 可与H 发生加成反应 生产人造奶油
2
B NH 与水形成分子间氢键 NH 极易溶于水 作制冷剂
3 3
硅氧四面体的顶角相连形
C 低温石英具有手性 制作石英手表
成螺旋上升的长链
大多数离子液体含有体积
D 具有良好的导电性和难挥发性 作原电池的电解质
很大的阴、阳离子
14.丙酰胺是合成抗菌和抗癌药物的重要中间体。一种常温下以硝酸盐和正丙醇为原料的
电合成丙酰胺的装置如下图所示。下列说法正确的是
A.Ti网为阴极
B.阴极区附近溶液的pH降低
C.Co O /SiC的反应为:
3 4
NO +6e-+5H O==NH OH +7OH-
3 2 2
D.理论−上每转移0.6mole-,可消耗0.2mol正丙醇
{#{QQABBQAl4wC40JQACT7aQ0EgCQuYsJKTJAguBRCQqAZKARNABCA=}#}15.学习小组对乙醇催化氧化实验进行改进,装置如下图所示(已知氯化钙吸收乙醇后形
成配合物CaCl ·4C H OH,常温下稳定,受热会分解)。反应过程中下列说法不正确
2 2 5
的是
A.配合物CaCl ·4C H OH发生分解反应,释放出乙醇
2 2 5
B.打开止水夹,挤压洗耳球的目的是鼓入空气
C.可观察到粗铜丝先变黑后变红
D.将银氨溶液换成酸性高锰酸钾溶液,溶液褪色,证明有乙醛生成
16.科研人员利用CO 与NO 通过电催化反应生成CO(NH ) ,可能的反应机理如图所示
2 3 2 2
(图中吸附在催化剂表面−的物种用“*”标注)。下列说法不正确的是
A.过程Ⅱ中*CO 和*NO 都发生还原反应
2 3
B.总反应方程式: −
通电
CO +2NO +18H++16e-- CO(NH ) +7H O
2 3 2 2 2
催化剂
−
C.反应过程中C原子和N原子的杂化方式都发生了改变
D.常温常压、无催化剂条件下,CO 气体通入氨水也可
2
得到CO(NH )
2 2
二、非选择题:本题共4小题,共56分。
17.(14分)化学学习小组对苯酚( )的性质进行探究。
I.探究苯酚的酸性
(1)往苯酚钠溶液中通入CO ,溶液变浑浊,用化学方程式解释其原因 ,
2
该反应可以证明苯酚的酸性 碳酸(填“大于”“等于”或“小于”)。
(2)测定苯酚的电离常数K 。实验如下:往锥形瓶中加入20.00mL0.1mol·L-1苯酚溶液,
a
加入适当过量NaOH溶液,用盐酸标准溶液滴定。
①下列关于滴定实验的操作,正确的是 (填字母)。
A.排气 B.控速 C.滴定 D.读数
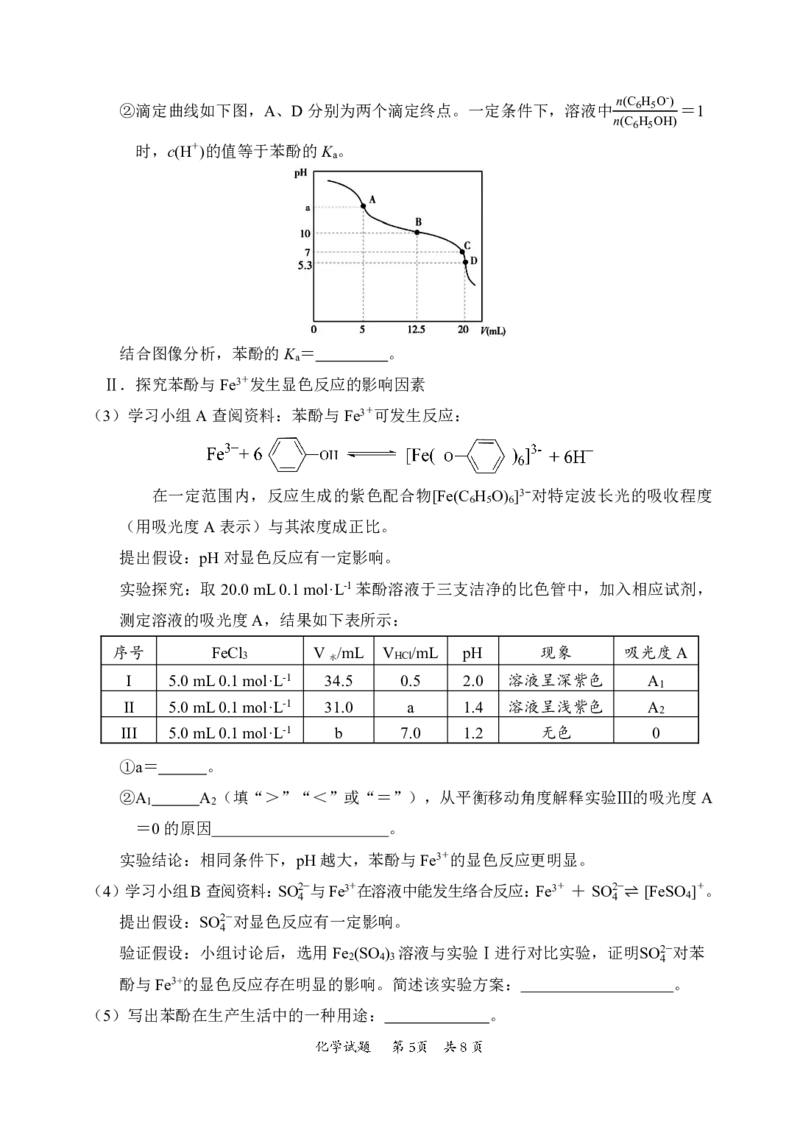
{#{QQABBQAl4wC40JQACT7aQ0EgCQuYsJKTJAguBRCQqAZKARNABCA=}#}②滴定曲线如下图,A、D分别为两个滴定终点。一定条件下,溶液中
n(C6H5O-)
=1
n(C6H5OH)
时,c(H+)的值等于苯酚的K 。
a
结合图像分析,苯酚的K = 。
a
Ⅱ.探究苯酚与Fe3+发生显色反应的影响因素
(3)学习小组A查阅资料:苯酚与Fe3+可发生反应:
在一定范围内,反应生成的紫色配合物[Fe(C H O) ]3−对特定波长光的吸收程度
6 5 6
(用吸光度A表示)与其浓度成正比。
提出假设:pH对显色反应有一定影响。
实验探究:取20.0mL0.1mol·L-1苯酚溶液于三支洁净的比色管中,加入相应试剂,
测定溶液的吸光度A,结果如下表所示:
序号 FeCl V /mL V /mL pH 现象 吸光度A
3 水 HCl
I 5.0mL0.1mol·L-1 34.5 0.5 2.0 溶液呈深紫色 A
1
II 5.0mL0.1mol·L-1 31.0 a 1.4 溶液呈浅紫色 A
2
III 5.0mL0.1mol·L-1 b 7.0 1.2 无色 0
①a= 。
②A A (填“>”“<”或“=”),从平衡移动角度解释实验Ⅲ的吸光度A
1 2
=0的原因 。
实验结论:相同条件下,pH越大,苯酚与Fe3+的显色反应更明显。
(4)学习小组B查阅资料:SO 4 2−与Fe3+在溶液中能发生络合反应:Fe3+ + SO 4 2− ⇌ [FeSO 4 ]+。
提出假设:SO2−对显色反应有一定影响。
4
验证假设:小组讨论后,选用Fe (SO ) 溶液与实验Ⅰ进行对比实验,证明SO2−对苯
2 4 3 4
酚与Fe3+的显色反应存在明显的影响。简述该实验方案: 。
(5)写出苯酚在生产生活中的一种用途: 。
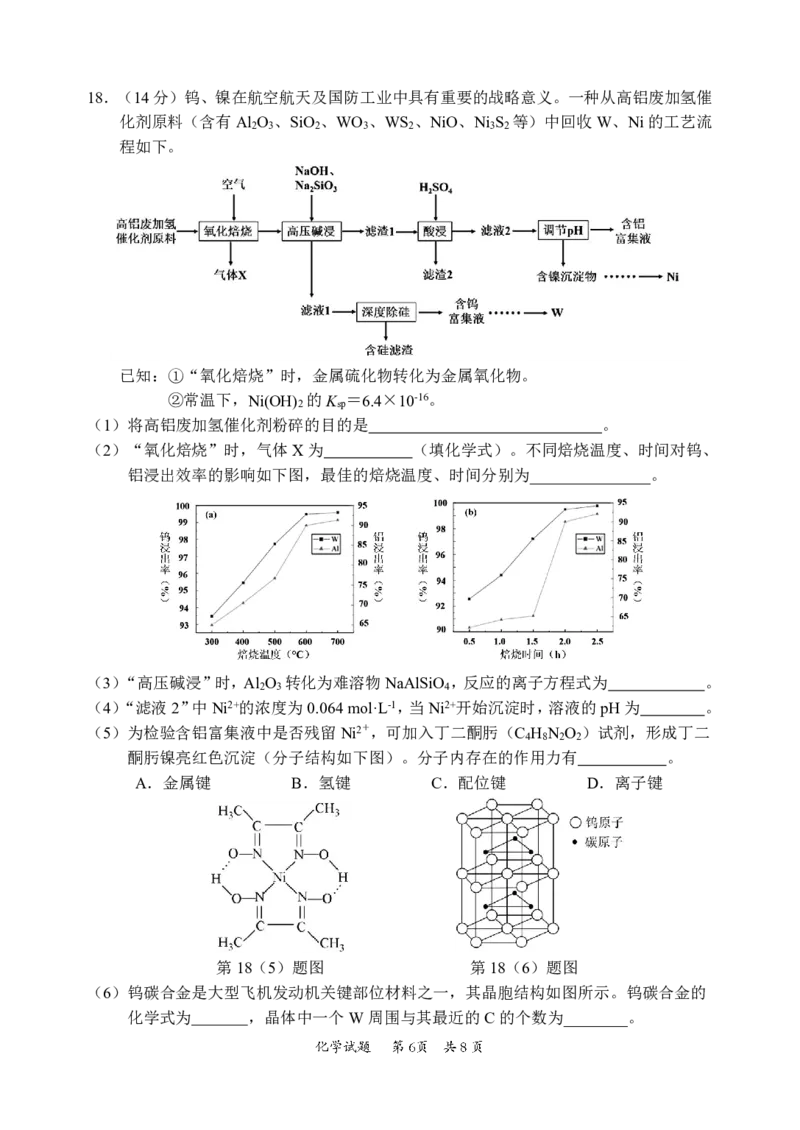
{#{QQABBQAl4wC40JQACT7aQ0EgCQuYsJKTJAguBRCQqAZKARNABCA=}#}18.(14分)钨、镍在航空航天及国防工业中具有重要的战略意义。一种从高铝废加氢催
化剂原料(含有Al O 、SiO 、WO 、WS 、NiO、Ni S 等)中回收W、Ni的工艺流
2 3 2 3 2 3 2
程如下。
已知:①“氧化焙烧”时,金属硫化物转化为金属氧化物。
②常温下,Ni(OH) 的K =6.4×10-16。
2 sp
(1)将高铝废加氢催化剂粉碎的目的是 。
(2)“氧化焙烧”时,气体X为 (填化学式)。不同焙烧温度、时间对钨、
铝浸出效率的影响如下图,最佳的焙烧温度、时间分别为_______________。
(3)“高压碱浸”时,Al O 转化为难溶物NaAlSiO ,反应的离子方程式为 。
2 3 4
(4)“滤液2”中Ni2+的浓度为0.064mol·L-1,当Ni2+开始沉淀时,溶液的pH为 。
(5)为检验含铝富集液中是否残留Ni2+,可加入丁二酮肟(C H N O )试剂,形成丁二
4 8 2 2
酮肟镍亮红色沉淀(分子结构如下图)。分子内存在的作用力有 。
A.金属键 B.氢键 C.配位键 D.离子键
第18(5)题图 第18(6)题图
(6)钨碳合金是大型飞机发动机关键部位材料之一,其晶胞结构如图所示。钨碳合金的
化学式为 ,晶体中一个W周围与其最近的C的个数为________。
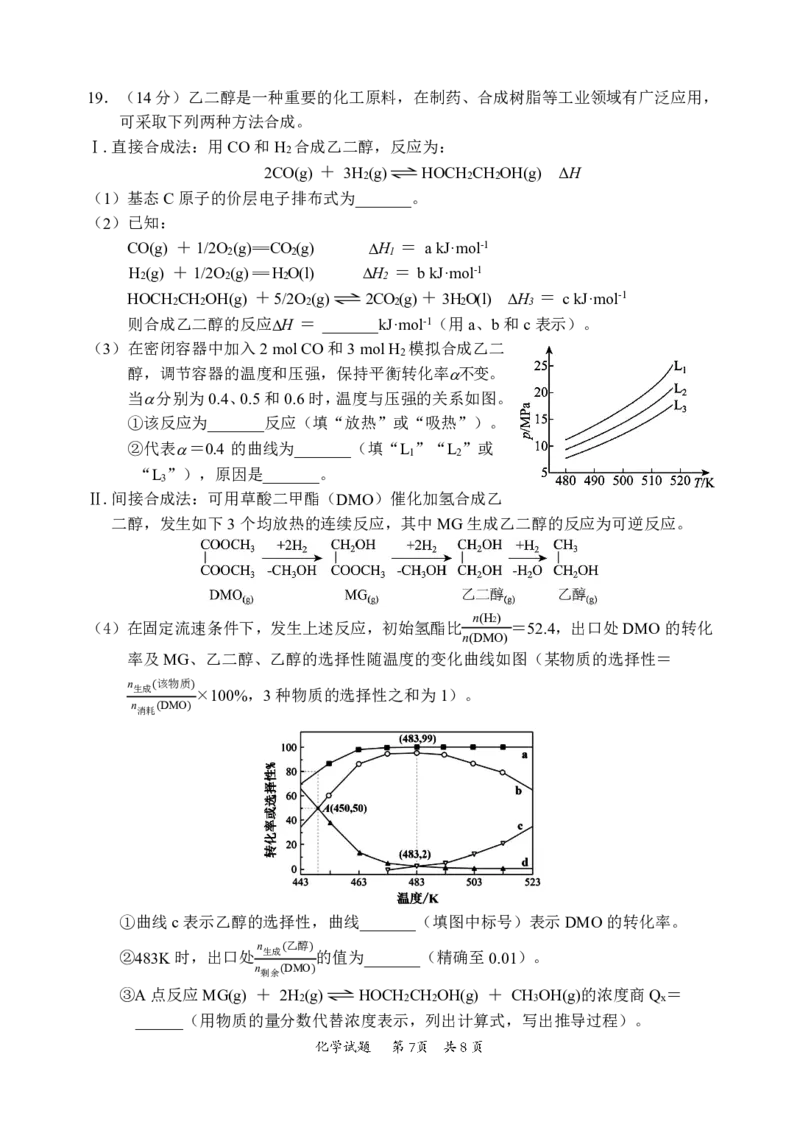
{#{QQABBQAl4wC40JQACT7aQ0EgCQuYsJKTJAguBRCQqAZKARNABCA=}#}19.(14分)乙二醇是一种重要的化工原料,在制药、合成树脂等工业领域有广泛应用,
可采取下列两种方法合成。
Ⅰ.直接合成法:用CO和H 合成乙二醇,反应为:
2
2CO(g) + 3H
2
(g)⇌HOCH
2
CH
2
OH(g) ΔH
(1)基态C原子的价层电子排布式为_______。
(2)已知:
CO(g) +1/2O (g)=CO(g) H = akJ·mol-1
2 2 1
H (g) +1/2O (g)=HO(l) H = bkJ·mol-1
2 2 2 2
HOCH
2
CH
2
OH(g) +5/2O
2
(g)⇌2CO
2
(g)+ 3H
2
O(l) H
3
= ckJ·mol-1
则合成乙二醇的反应H = _______kJ·mol-1(用a、b和c表示)。
(3)在密闭容器中加入2molCO和3molH 模拟合成乙二
2
醇,调节容器的温度和压强,保持平衡转化率不变。
当分别为0.4、0.5和0.6时,温度与压强的关系如图。
①该反应为_______反应(填“放热”或“吸热”)。
②代表=0.4 的曲线为_______(填“L ”“L ”或
1 2
“L ”),原因是_______。
3
Ⅱ.间接合成法:可用草酸二甲酯(DMO)催化加氢合成乙
二醇,发生如下3个均放热的连续反应,其中MG生成乙二醇的反应为可逆反应。
(4)在固定流速条件下,发生上述反应,初始氢酯比
n(H2)
=52.4,出口处DMO的转化
n(DMO)
率及MG、乙二醇、乙醇的选择性随温度的变化曲线如图(某物质的选择性=
n 该物质
生成 ×100%,3种物质的选择性之和为1)。
n 消耗(DMO)
( )
①曲线c表示乙醇的选择性,曲线_______(填图中标号)表示DMO的转化率。
n 乙醇
②483K时,出口处 生成 的值为_______(精确至0.01)。
n 剩余(DMO)
③A点反应MG(g) + (2H
2
(g))⇌HOCH
2
CH
2
OH(g) + CH
3
OH(g)的浓度商Q
x
=
______(用物质的量分数代替浓度表示,列出计算式,写出推导过程)。
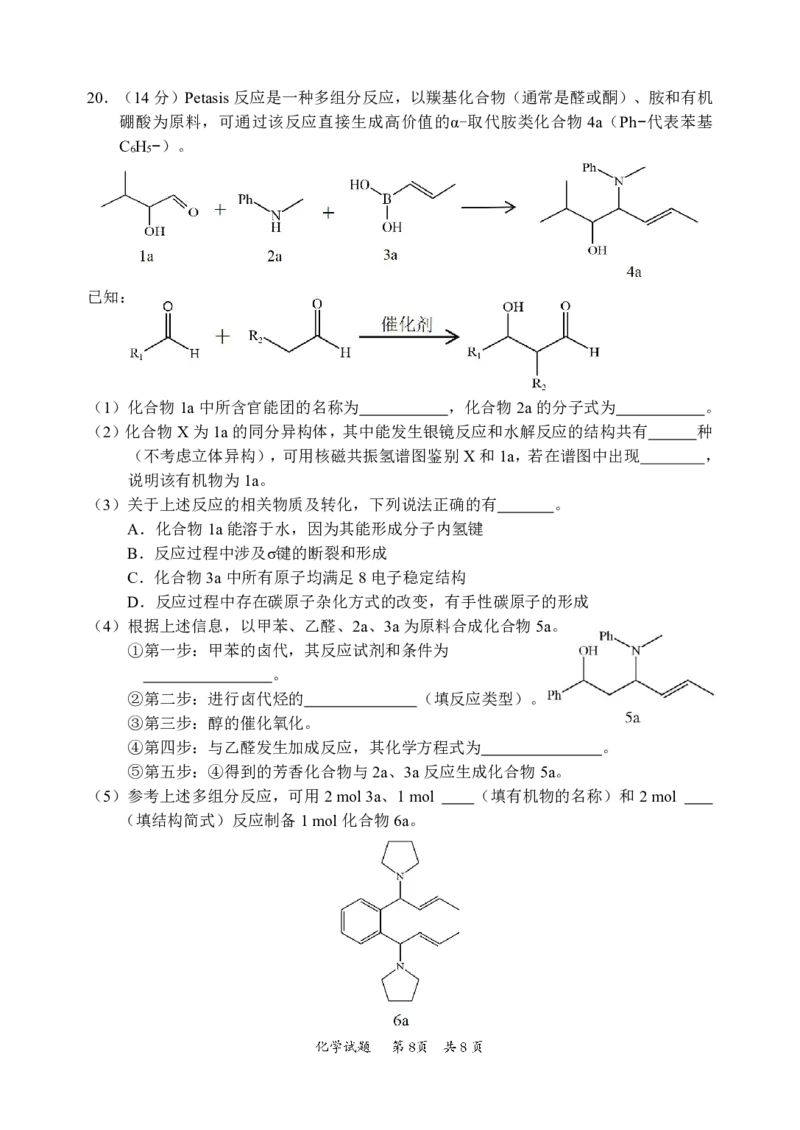
{#{QQABBQAl4wC40JQACT7aQ0EgCQuYsJKTJAguBRCQqAZKARNABCA=}#}20.(14分)Petasis反应是一种多组分反应,以羰基化合物(通常是醛或酮)、胺和有机
硼酸为原料,可通过该反应直接生成高价值的α-取代胺类化合物4a(Ph−代表苯基
C H −)。
6 5
已知:
(1)化合物1a中所含官能团的名称为 ,化合物2a的分子式为 。
(2)化合物X为1a的同分异构体,其中能发生银镜反应和水解反应的结构共有 种
(不考虑立体异构),可用核磁共振氢谱图鉴别X和1a,若在谱图中出现 ,
说明该有机物为1a。
(3)关于上述反应的相关物质及转化,下列说法正确的有 。
A.化合物1a能溶于水,因为其能形成分子内氢键
B.反应过程中涉及σ键的断裂和形成
C.化合物3a中所有原子均满足8电子稳定结构
D.反应过程中存在碳原子杂化方式的改变,有手性碳原子的形成
(4)根据上述信息,以甲苯、乙醛、2a、3a为原料合成化合物5a。
①第一步:甲苯的卤代,其反应试剂和条件为
。
②第二步:进行卤代烃的 (填反应类型)。
③第三步:醇的催化氧化。
④第四步:与乙醛发生加成反应,其化学方程式为 。
⑤第五步:④得到的芳香化合物与2a、3a反应生成化合物5a。
(5)参考上述多组分反应,可用2mol3a、1mol (填有机物的名称)和2mol
(填结构简式)反应制备1mol化合物6a。
{#{QQABBQAl4wC40JQACT7aQ0EgCQuYsJKTJAguBRCQqAZKARNABCA=}#}