文档内容
2024 届云南三校高考备考实用性联考卷(一)
化学参考答案
一、选择题:本题共20小题,第1~10题,每小题2分;第11~20题,每小题3分,共50
分。在每小题给出的四个选项中,只有一项是符合题目要求的。
题号 1 2 3 4 5 6 7 8 9 10
答案 B C C B D D A B D B
题号 11 12 13 14 15 16 17 18 19 20
答案 A C D B C C B A C C
【解析】
1.丝绸的主要成分是蛋白质,A 说法正确。包装食品的塑料袋为聚乙烯,B 说法错误。氮
化硼陶瓷属于无机非金属材料,C 说法正确。“空气捕捉”法能实现从空气中捕获二氧
化碳,减少二氧化碳排放,有利于“碳达峰、碳中和”,D说法正确。答案为B。
2.
学科网(北京)股份有限公司
1 88 O 2 是8号元素,质子数为8,核外电子数为10,其结构示意图为 ,A错误。基
态Fe原子的核外电子排布式为[Ar]3d64s2,Fe2+的价层电子排布式为3d6,则Fe2+的价层
电子排布图为 ,B 错误。银氨络离子中中心离子为银离子,氨
分子为配体,用箭头表示银氨络离子的配位键为[H N→Ag←NH ]+,C 正确。
3 3
S O
3
无孤
电子对,价层电子对数为3,VSEPR模型是平面三角形,与图不相符,D错误。答案选
C。
3.氨气与水发生可逆反应生成 NH ·H O,且NH ·H O为弱电解质,部分电离,则在标
3 2 3 2
准状况下,2.24L NH 通入水中制成氨水,溶液中NH 数目小于0.1N ,A正确。分子
3 4 A
式为 C H O 的稳定化合物的结构简式为 CH CHO,分子中含有 4 个碳氢键,则 44g
2 4 3
44g
CH CHO分子中含有碳氢键的数目为 ×4×N mol−1=4N ,B正确。每个环氧乙烷
3 A A
44g/mol
分子含有 7 个共价键,所以 0.1mol 环氧乙烷( )共有 0.7N 个共价键,C 错误。氢
A22.4L
氧燃料电池O 在正极得电子,n(O ) 1mol,1molO 得4N 个电子。
2 2 22.4L/mol 2 A
4.Al3+与HCO能发生双水解反应,二者不能共存,A不符合题意。pH12的溶液显碱性,
3
c(H)
碱性条件下,该组离子均能共存,B 符合题意。 1012的溶液呈酸性,酸性条件
c(OH)
下, MnO 能氧化Cl ,二者不能共存,C 不符合题意。常温下,水电离出的
4
c(H)1.01012mol L1的溶液既可以为酸性溶液又可以为碱性溶液。酸性溶液中,S2−
不能大量存在,碱性溶液中,
学科网(北京)股份有限公司
N H +4 不能大量存在,D不符合题意。故选B。
5.向含Mn2+的溶液中加入NH HCO ,Mn2+结合HCO
4 3
3 电离出的碳酸根生成碳酸锰沉淀,
同时促进HCO 3 的电离,产生氢离子,氢离子和 HCO 3 反应生成水和二氧化碳,所以离
子方程式为 Mn2++2HCO 3 =MnCO ↓+CO ↑+H O,A 正确。过量的铁粉与稀硝酸反
3 2 2
应,应该生成 Fe2+,B 正确。苯酚钠溶液中通入二氧化碳利用强酸制取弱酸生成苯酚和
碳酸氢钠,C正确。明矾溶液中加入少量 Ba(OH) 溶液,参与反应的Ba2+与 OH−物质的
2
量之比为1∶2,生成的Al(OH) 与BaSO 沉淀物质的量之比为2∶3,反应的离子方程式
3 4
为2Al3++3 S O 24 +3Ba2++6OH−=2Al(OH) ↓+3BaSO ↓,D错误。故选D。
3 4
6.铝和氧气生成氧化铝,氧化铝不溶于水不能一步转化为氢氧化铝,氢氧化铝和盐酸生成
氯化铝,不是均能一步转化,A 不符合题意。硫燃烧生成二氧化硫而不是三氧化硫,三
氧化硫和水生成硫酸,硫酸和氯化钡生成硫酸钡沉淀,不是均能一步转化,B 不符合题
意。钠燃烧生成氯化钠,氯化钠不能一步转化为氧化钠,氧化钠和氧气生成过氧化钠,
不是均能一步转化,C 不符合题意。氯气和氢氧化钠生成次氯酸钠,次氯酸钠和二氧化
碳生成次氯酸,次氯酸分解生成盐酸,均能一步转化,D符合题意。故选D。
7.Be与Al处于对角线,两者性质具有相似性,Be(OH) 能与NaOH溶液反应生成Na [Be(OH) ],
2 2 4
A正确。氯气的氧化性大于碘单质,Fe与Cl 反应生成FeCl ,则Fe与I 反应生成FeI ,
2 3 2 2
B 错误。组成与结构相似的共价分子:相对分子质量越大,分子间作用力越大,熔沸点
越高,则 SiH 的沸点比 CH 高,但氨气形成分子间氢键会增大熔沸点,则 PH 的沸点
4 4 3比 NH 低,C 错误。Na O 与 CO 反应生成 Na CO 和 O ,Na O 具有强氧化性、SO
3 2 2 2 2 3 2 2 2 2
有强还原性,Na O 与SO 反应生成Na SO ,D错误。答案选A。
2 2 2 2 4
8.乙醇可与浓硫酸发生氧化还原反应,生成可与酸性高锰酸钾溶液发生反应的二氧化硫气
体,A 错误。实验室制备氨气利用熟石灰与氯化铵混合加热,采用向上排空气法收集,
B 正确。实验室制取氯气应该用浓盐酸与二氧化锰反应,用稀盐酸不行,C 错误。电石
与水剧烈反应,所以需要使用饱和食盐水与电石反应制取乙炔,D错误。故选B。
9.将红热的木炭加入浓硝酸中,产生红棕色气体,可能是浓硝酸在受热的条件下分解得到
二氧化氮,不一定是碳与浓硝酸反应生成了
学科网(北京)股份有限公司
N O
2
,A不符合题意。CH COONH 中
3 4
N H +4 水
解, N H +4 + H
2
O N H
3
H
2
O + H ,会消耗 CH COO−水解生成的 OH−,测定相同浓度
3
的 CH COONH 和 NaHCO 溶 液 的 pH , 后 者 大 于 前 者 , 不 能 说 明
3 4 3
K (CH COO−)Y,B正确。X、Z两点温度相同,但压强不同, N O
2
为红棕色
气体,增大压强,平衡右移,但是气体的体积变小,浓度增大的影响较大,气体的颜色
加深,则 X、Z 两点气体的颜色:X 浅,Z 深,C 正确。X、Z 两点都在等温线上,X
的压强小,增大压强,化学平衡正向移动,Z点时气体的物质的量小,则平均相对分子
质量变大,即平均相对分子质量:Xa,D错误。
15.因为反应物气体分子数大于生成物气体分子数,所以适当增大压强可使平衡正向移动,
从而增大甲醇的平衡转化率,A 合理。c 点时,CO 的转化率小于该温度下的平衡转化
率,则平衡正向移动,反应速率v v ,B合理。因为 e点时温度高于 b点时温度,
正 逆
所以e点反应速率比b点快,即反应速率v v ,但正反应为放热反应,温度越高,平
b e衡常数越小,所以平衡常数K >K ,C不合理。80~85℃时,CO 的转化率已经达
75℃ 90℃
到95.5%以上,且反应速率较快,所以生产时反应温度宜控制在80~85℃,D合理。故
选C。
16.纵坐标越大,银离子浓度越小,横坐标越大,阴离子浓度越小,故阴影区域 AgCl 和
学科网(北京)股份有限公司
A g
2
C r O
4
都不沉淀,A错误。2pAg+pCrO =11.72,pCrO =4.45时,pAg=(11.72−4.45)/2=
4 4
3.635,B错误。由图可知,当K CrO 浓度在0.01mol L1左右时(pCrO =2)形成
2 4 4
A g
2
C r O
4
所需要的银离子浓度约为 10−5mol/L,根据氯化银的溶度积可知此时氯离子浓度约为
1.6×10−5mol/L,氯离子接近完全沉淀,滴定误差较小,C正确。当溶液中有1.0 m o l L 1 KCl
时,则此时氯离子的浓度为1.0 m o l L 1 ,pCl=0,由图可知,此时无法形成 A g
2
C r O
4
,
D错误。故选C。
17.键能:C—H>Si—H,则破坏C—H键所需的能量比Si—H大,因此 C H
4
比 S iH
4
稳定,
A 正确。经计算,I 3 和 H O 的孤电子对数都为 2,B错误。NH 和 PH 分子中,N、P
2 3 3
原子的最外层都只有 1 个孤电子对,键角: N H
3
P H
3
,原因是 NH 的成键电子对间
3
的排斥力更大,C 正确。极性:F—C>Cl—C,使 CF COOH 分子中羧基的极性强于
3
CCl COOH分子中羧基的极性,因此酸性
3
C F
3
C O O H C C l
3
C O O H ,D正确。故选B。
18.X、Y、Z、Q、W分别为 H、C、N、Cl、Zn 元素。Q单质(Cl )与Z的简单气态氢化物
2
(NH )反应为 8NH +3Cl =6NH Cl+N ,则 Cl 可置换出 NH 中的 N,A 正确。同
3 3 2 4 2 2 3
周期,从左到右,元素的第一电离能呈增大趋势,N>C,即 Z>Y,B 不正确。Q 与 Y
原子形成的分子可以为 CCl ,也可以是 C Cl ,CCl 是正四面体结构,而 C Cl 不是四
4 2 6 4 2 6
面体形结构,C不正确。[W(ZX ) ]2+为[Zn(NH ) ]2+,每个NH 中含有3 个 σ 键,另外
3 4 3 4 3
还形成4个配位键,配位键也属于σ键,则σ键数为3×4+4=16,D不正确。故选A。
19.钛元素的原子序数为22,价电子排布式为3d24s2,是位于元素周期表d区的过渡元素,
A正确。由晶胞结构可知,钛原子位于氮原子构成的八面体空隙中,B正确。由晶胞结
1
构可知,晶胞中位于棱上和体心的Ti原子个数为12× +1=4,位于顶点和面心的N原
41 1 2.481023
子个数为8× +6× =4,C错误。该晶胞密度为 ,D正确。答案选C。
8 2 N a3
A
20.由二者所含官能团判断,酚羟基、羧基可与 NaOH 溶液反应,A 正确。阿魏酸中存在
碳碳双键的顺反异构,与氢气完全加成后的产物为 ,其
中含带*的碳原子连接四个互不相同原子或原子团,即含手性碳原子,B 正确。阿魏酸
中碳碳双键发生加聚反应,产物 ,其中酚羟基的邻位碳原子上有氢
可与溴发生取代反应,故能使溴水褪色,C错误。能发生银镜反应的酚类化合物,其中
含有醛基或甲酸基和酚羟基,从香兰素的结构简式确定其分子式为 C H O ,不饱和度
8 8 3
为 5,又分子中有 5 种不同化学环境的氢,故符合条件的结构有: 、
、 、 ,共4种,D正
确。故选C。
二、非选择题:本题共4小题,共50分。
21.(除特殊标注外,每空2分,共12分)
(1)3d74s2
(2)适当升高反应温度(或增大NaOH溶液浓度、粉碎材料等)(1分)
(3)石墨(或碳、C)(1分)
(4)2LiCoO +H O +6H+=2Co2++O ↑+2Li++4H O
2 2 2 2 2
(5)当温度高于80℃,H O 分解导致浸出反应速率下降
2 2
(6)2.1
高温
(7)4CoC O +2Li CO +3O =====4LiCoO +10CO
2 4 2 3 2 2 2
学科网(北京)股份有限公司【解析】废旧正极材料加 NaOH溶液,铝箔和NaOH 溶液反应生成 NaAlO 进入滤液,
2
滤渣1的主要成分为石墨和钴酸锂,滤渣1中加入硫酸和 H O 酸浸,石墨不反应,成
2 2
为滤渣2,滤液2中含有硫酸钴和硫酸锂,除杂后加入草酸,硫酸钴和草酸反应生成草
酸钴沉淀,滤液中含 Li+,净化后加入碳酸钠溶液,得到碳酸锂沉淀,碳酸锂和草酸钴
高温下反应得到钴酸锂。
(1)Co的原子序数为27,价电子排布式为3d74s2。
(2)为提高“碱浸”效率可采取的措施有适当升高反应温度(或增大NaOH溶液浓度、
粉碎材料等)。
(3)由以上分析可知,“滤渣2”的主要成分为石墨(或碳、C)。
(4)“酸浸”中钴酸锂和H O 在酸性溶液中发生氧化还原反应,钴酸锂中的+3价钴被
2 2
H O 还 原 为 +2 价 , H O 被 氧 化 为 氧 气 , 反 应 的 离 子 方 程 式 为
2 2 2 2
2LiCoO +H O +6H+=2Co2++O ↑+2Li++4H O。
2 2 2 2 2
(5)“酸浸”时用到 H O ,H O 不稳定,受热易分解,当温度高于 80℃,H O 分解
2 2 2 2 2 2
导致浸出率下降。
( 6 ) 该 反 应 的 平 衡 常 数
K=
学科网(北京)股份有限公司
c ( C o 2
c
+
2 (
) c
H
( H
)
C
2 2
O
4
)
c ( C o 2
c
+
2 (
) c
H
( C
) c
O
2
(
24
C
O
2)
c (
24H )
C
2 2
O
4
)
K
sp
K
( C
K
a1o
C
a 2O
2 4
)
5 .6 1 0
4
.0
2
1 .5
1 0
6
1 0 4
=2.1。
(7)在空气中,CoC O 与 Li CO 高温下生成 LiCoO ,钴的化合价从+2 价升高到+3
2 4 2 3 2
价,需要空气中的氧气参与,草酸钴中碳也被氧化,生成二氧化碳,反应的化学方程式
高温
为4CoC O +2Li CO +3O =====4LiCoO +10CO 。
2 4 2 3 2 2 2
22.(除特殊标注外,每空2分,共10分)
(1)球形冷凝管(1分) B(1分)
(2)防止硝基取代两个酚羟基对位上的氢原子
(3)在烧杯中加入适量的浓硝酸,沿杯壁缓慢加入一定量的浓硫酸,边加边搅拌,冷却
(1分)(4)B(1分)
(5)BC
(6)20.0%
【解析】(1)根据仪器的外观可知图甲中仪器b的名称是球形冷凝管,由题中信息可知,
在磺化步骤中要控制温度低于 65℃。若温度过低,磺化反应的速率过慢。间苯二酚具
有较强的还原性,而浓硫酸具有强氧化性,若温度过高,苯二酚易被浓硫酸氧化,并且
酚羟基的所有邻位均可被磺化,这将影响下一步硝化反应的进行,因此,在磺化步骤中
控制温度最合适的范围为60℃~65℃。
(2)已知:酚羟基邻、对位的氢原子比较活泼,均易被取代,故第一步磺化引入磺酸基
基团(—
学科网(北京)股份有限公司
S O
3
H )的作用是防止硝基取代两个酚羟基对位上的氢原子。
(3)类比浓硫酸的稀释方法,为了防止液体飞溅和硝酸温度过高发生分解和挥发过多,
要将浓硫酸慢慢加入浓硝酸中,因此,硝化步骤中制取“混酸”的具体操作是:在烧杯
中加入适量的浓硝酸,沿杯壁缓慢加入一定量的浓硫酸,边加边搅拌,冷却。
(4)由题中信息可知,水蒸气蒸馏是分离和提纯有机物的方法之一,在低于100℃的情
况下,有机物可以随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。因此,被提纯
物质必须具备的条件是:其在一定的温度范围内有一定的挥发性,可以随水蒸气一起被
蒸馏出来。不溶或难溶于水,便于最后分离。在沸腾条件下不与水发生化学反应。故选
B。
(5)反应一段时间后,停止蒸馏,应先打开旋塞,再熄灭酒精灯,A 错误。由于 2-硝
基-1,3-苯二酚的熔点是87.8℃,且其难溶于水,因此,冷凝管C中有2-硝基-1,3-
苯二酚析出,可能看到的现象是冷凝管内壁有桔红色晶体析出,B正确。图乙中烧瓶A
中长玻璃管起稳压作用,能使装置中的气体压强维持在一定的安全范围,能防止装置中
压强过大引起事故,C正确。球形冷凝管用于冷凝分离时,会有物质存留在球形凹槽内,
使分离物质的量减少,故不能替换,D错误。故选BC。
(6)11.0g 间苯二酚的物质的量为 0.1mol,理论上可以制备出 2−硝基−1,3−苯二酚
0.1mol,其质量为 15.5g。本实验最终获得 3.1g 桔红色晶体,则 2−硝基−1,3−苯二酚的产率约为20.0%。
23.(除特殊标注外,每空2分,共15分)
(1)−90.17kJ/mol(1分) 低温自发(1分) >(1分)
(2)①温度低于T 时,甲醇选择性随温度升高而增大,高于T 时,甲醇的选择性随温
1 1
度的升高而减小,则说明温度 T 时反应达到平衡,升高温度甲醇选择性降低,说明反
1
应①逆向移动,正反应放热
在实际工业生产中压强过高,成本太高,但反应①为气体体积减小的反应,所以压强不
能过低,否则影响甲醇的选择性
②0.04
学科网(北京)股份有限公司
1
1
7
(3)B CH OH−6e−+8OH−=CO
3
23 +6H O
2
【解析】(1)由盖斯定律可得,反应③可由反应①减去反应②得到,即 Δ H =
3
Δ H −
1
Δ H =
2
−90.17kJ/mol。反应③焓变 Δ H<0且熵减,即 Δ S < 0 , 又 Δ G Δ H T Δ S < 0 ,所以低温自
发。由于该反应是放热反应,所以正反应活化能小于逆反应活化能,即 E
a
( 正 ) < E
a
( 逆 ) 。
(2)①温度低于T 时,甲醇选择性随温度升高而增大,高于T 时,甲醇的选择性随温
1 1
度的升高而减小,则说明温度 T 时反应达到平衡,升高温度甲醇选择性降低,说明反
1
应①逆向移动,正反应放热。由于生成甲醇的反应是气体体积减小的反应,所以压强过
低不利于生成甲醇且反应速率慢,虽压强过高有利于生成甲醇,但对设备抗压能力要求
高,即在实际工业生产中压强过高,成本太高,但反应①为气体体积减小的反应,所以
压强不能过低,否则影响甲醇的选择性。
②设起始加入二氧化碳和氢气的物质的量分别为1mol和3mol,又a点达到平衡且二氧
化碳转化率为 50%、甲醇的选择性 80%,所以消耗的二氧化碳物质的量为 0.5mol,即
生成的甲醇和一氧化碳的物质的量之和为 0.5mol,结合甲醇的选择性计算公式可算出
生成的甲醇物质的量为 0.50.8mol=0.4mol,则生成一氧化碳物质的量为 0.1mol,即平
衡时甲醇物质的量为 0.4mol,水的物质的量为 0.5mol,一氧化碳物质的量为 0.1mol,
氢气物质的量为 1.7mol,二氧化碳物质的量为 0.5mol,所以甲醇的分压为0.4mol 0.4MPa
3.2MPa0.4MPa ,则速率为 0.04MPa/min 。一氧化碳分压为
3.2mol 10min
0.1mol 0.5mol
3.2MPa0.1MPa ,水的分压为 3.2MPa0.5MPa ,二氧化碳分压为
3.2mol 3.2mol
0.5mol 1.7mol
3.2MPa0.5MPa,氢气分压为 3.2MPa1.7MPa,所以反应②的平衡
3.2mol 3.2mol
0.50.1 1
常数为K 。
p 0.51.7 17
(3)电子由 a 流向b,说明a 为负极,b为正极,CH OH与 O 的反应可将化学能转化
3 2
为电能,甲醇失电子发生氧化反应,所以 CH OH 从 A 通入,B通入O 。由 a 极发生
3 2
的电极反应CH OH−6e−+8OH−=CO
3
学科网(北京)股份有限公司
23 +6H O。
2
24.(除特殊标注外,每空2分,共13分)
(1)8(1分)
(2)还原反应(1分)
(3)硝基、羧基
(4)
(5)4(1分) 7(1分)
(6)8
(7) (3分)
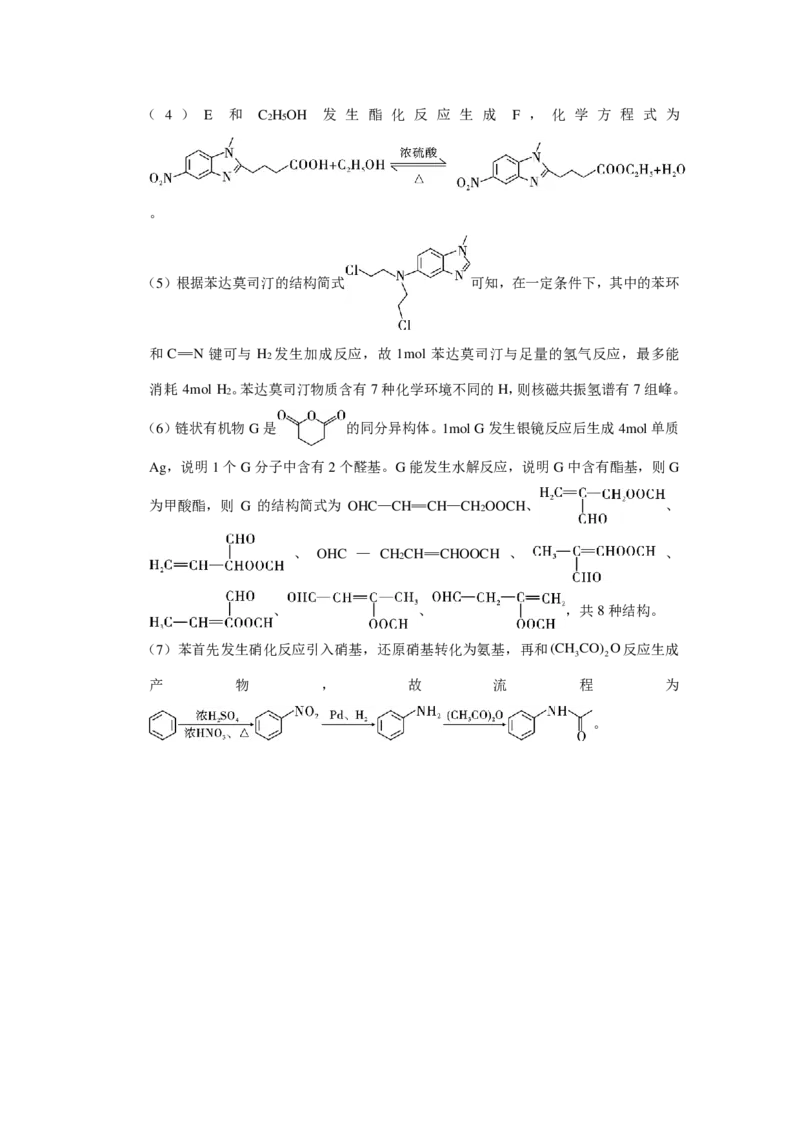
【解析】A和CH NH 发生取代反应生成 B。B和 H 发生还原反应,硝基转化为氨基生
3 2 2
成C。C和 反应生成D。D在催化剂的作用下转化为E,E和C H OH发生
2 5
酯化反应生成F,则E为 。F再经过系列反应转化为苯达
莫司汀。
(1)A分子中苯环上的碳原子和氮原子均为sp2杂化,故为8个。
(3)E为 ,其中含氧官能团为硝基、羧基。( 4 ) E 和 C H OH 发 生 酯 化 反 应 生 成 F , 化 学 方 程 式 为
2 5
。
(5)根据苯达莫司汀的结构简式 可知,在一定条件下,其中的苯环
和C=N 键可与 H 发生加成反应,故 1mol 苯达莫司汀与足量的氢气反应,最多能
2
消耗 4mol H 。苯达莫司汀物质含有7种化学环境不同的H,则核磁共振氢谱有7组峰。
2
(6)链状有机物G是 的同分异构体。1mol G发生银镜反应后生成4mol单质
Ag,说明1个G分子中含有2个醛基。G能发生水解反应,说明G中含有酯基,则G
为甲酸酯,则 G 的结构简式为 OHC—CH=CH—CH OOCH、 、
2
、 OHC — CH CH=CHOOCH 、 、
2
、 、 ,共8种结构。
(7)苯首先发生硝化反应引入硝基,还原硝基转化为氨基,再和
学科网(北京)股份有限公司
( C H
3
C O )
2
O 反应生成
产 物 , 故 流 程 为
。学科网(北京)股份有限公司