文档内容
2024 年普通高中学业水平选择性考试(河北卷)
化学
本试卷满分100分,考试时间75分钟。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每)小题给出的四个选项中,只有一
项是符合题目要求的。
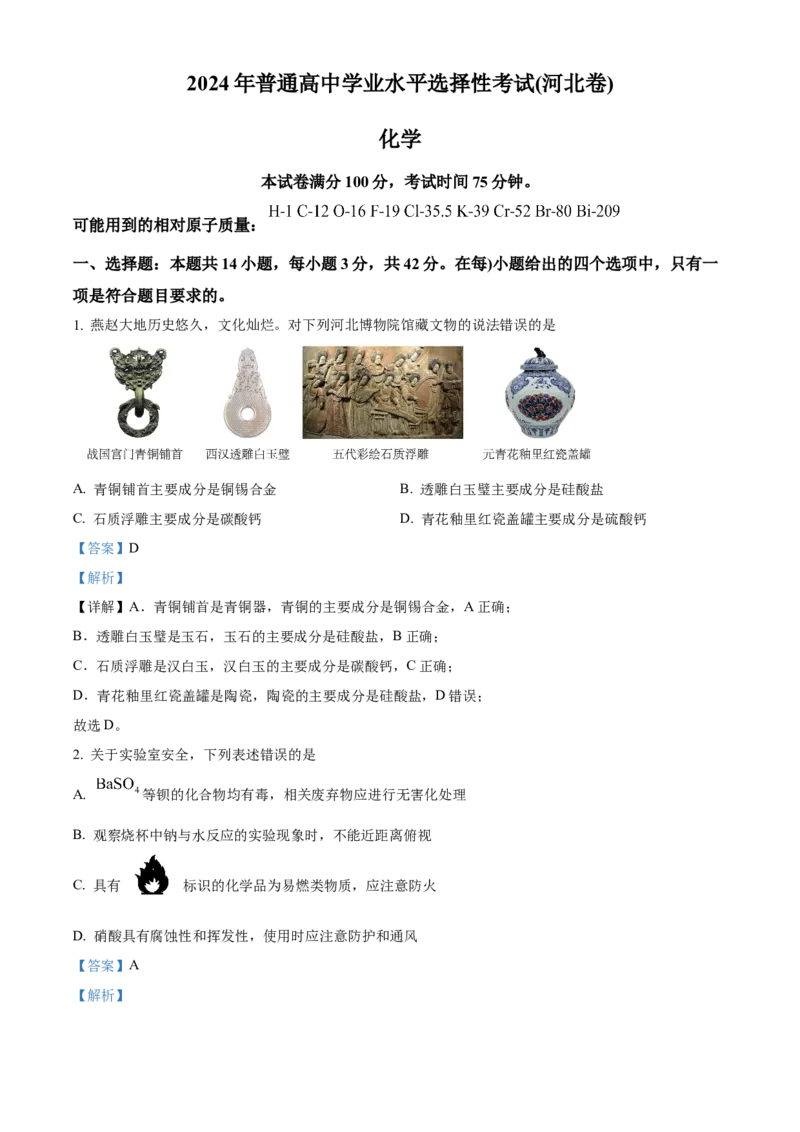
1. 燕赵大地历史悠久,文化灿烂。对下列河北博物院馆藏文物的说法错误的是
A. 青铜铺首主要成分是铜锡合金 B. 透雕白玉璧主要成分是硅酸盐
C. 石质浮雕主要成分是碳酸钙 D. 青花釉里红瓷盖罐主要成分是硫酸钙
【答案】D
【解析】
【详解】A.青铜铺首是青铜器,青铜的主要成分是铜锡合金,A正确;
B.透雕白玉璧是玉石,玉石的主要成分是硅酸盐,B正确;
C.石质浮雕是汉白玉,汉白玉的主要成分是碳酸钙,C正确;
D.青花釉里红瓷盖罐是陶瓷,陶瓷的主要成分是硅酸盐,D错误;
故选D。
2. 关于实验室安全,下列表述错误的是
A. 等钡的化合物均有毒,相关废弃物应进行无害化处理
B. 观察烧杯中钠与水反应的实验现象时,不能近距离俯视
C. 具有 标识的化学品为易燃类物质,应注意防火
D. 硝酸具有腐蚀性和挥发性,使用时应注意防护和通风
【答案】A
【解析】【详解】A. 性质稳定,不溶于水和酸,可用作“钡餐”说明对人体无害,无毒性,A错误;
B.钠与水反应剧烈且放热,观察烧杯中钠与水反应的实验现象时,不能近距离俯视,B正确;
C. 为易燃类物质的标识,使用该类化学品时应注意防火,以免发生火灾,C正确;
D.硝酸具有腐蚀性和挥发性,使用时应注意防护和通风,D正确;
故选A 。
3. 高分子材料在生产、生活中得到广泛应用。下列说法错误的是
A. 线型聚乙烯塑料为长链高分子,受热易软化
B. 聚四氟乙烯由四氟乙烯加聚合成,受热易分解
C. 尼龙66由己二酸和己二胺缩聚合成,强度高、韧性好
D. 聚甲基丙烯酸酯(有机玻璃)由甲基丙烯酸酯加聚合成,透明度高
【答案】B
【解析】
【详解】A.线型聚乙烯塑料具有热塑性,受热易软化,A正确;
B.聚四氟乙烯由四氟乙烯加聚合成,具有一定的热稳定性,受热不易分解,B错误;
C.尼龙66即聚己二酰己二胺,由己二酸和己二胺缩聚合成,强度高、韧性好,C正确;
D.聚甲基丙烯酸酯由甲基丙烯酸酯加聚合成,又名有机玻璃,说明其透明度高,D正确;
故选B。
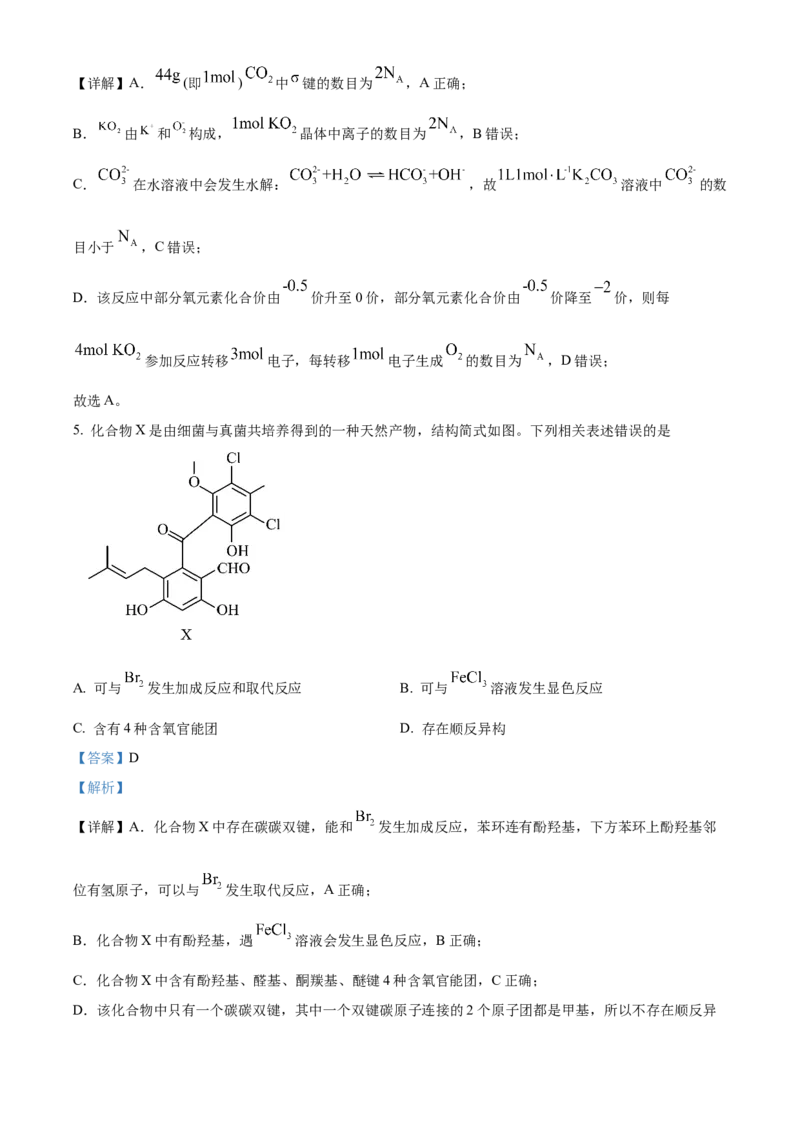
4. 超氧化钾 可用作潜水或宇航装置的 吸收剂和供氧剂,反应为 ,
为阿伏加德罗常数的值。下列说法正确的是
A. 中 键的数目为
B. 晶体中离子的数目为
C. 溶液中 的数目为
D. 该反应中每转移 电子生成 的数目为
【答案】A
【解析】【详解】A. (即 ) 中 键的数目为 ,A正确;
B. 由 和 构成, 晶体中离子的数目为 ,B错误;
C. 在水溶液中会发生水解: ,故 溶液中 的数
目小于 ,C错误;
D.该反应中部分氧元素化合价由 价升至0价,部分氧元素化合价由 价降至 价,则每
参加反应转移 电子,每转移 电子生成 的数目为 ,D错误;
故选A。
5. 化合物X是由细菌与真菌共培养得到的一种天然产物,结构简式如图。下列相关表述错误的是
A. 可与 发生加成反应和取代反应 B. 可与 溶液发生显色反应
C. 含有4种含氧官能团 D. 存在顺反异构
【答案】D
【解析】
【详解】A.化合物X中存在碳碳双键,能和 发生加成反应,苯环连有酚羟基,下方苯环上酚羟基邻
位有氢原子,可以与 发生取代反应,A正确;
B.化合物X中有酚羟基,遇 溶液会发生显色反应,B正确;
C.化合物X中含有酚羟基、醛基、酮羰基、醚键4种含氧官能团,C正确;
D.该化合物中只有一个碳碳双键,其中一个双键碳原子连接的2个原子团都是甲基,所以不存在顺反异构,D错误;
故选D。
6. 下列实验操作及现象能得出相应结论的是
选
实验操作及现象 结论
项
还原铁粉与水蒸气反应生成的气体点燃后
A 具有还原性
有爆鸣声
B 待测液中滴加 溶液,生成白色沉淀 待测液含有
和 中均分别加入
C 溶液和盐酸, 只溶于盐 比 碱性强
酸, 都能溶
溶液中滴加 溶液,溶液由 增大生成物的浓度,平衡向逆反应
D
橙色变为黄色 方向移动
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.铁与水蒸气反应生成的气体是 ,该反应中H由 价变成0价,被还原,体现了 的氧
化性,A错误;
B.如果待测液中含有 , 与 反应也能产生白色沉淀,或者 、 也会与Ba2+产生白色
沉淀,所以通过该实验不能得出待测液中含有 的结论,B错误;
C. 溶液能与盐酸反应,不能与 溶液反应, 与 溶液和盐酸都能反应,
说明 的碱性比 的强,C正确;
D. 溶液中存在平衡 (橙色) (黄色) ,加入 溶液后, 与
反应,生成物浓度减小,使平衡正向移动,导致溶液由橙色变为黄色,题给结论错误,D错误;
故选C。7. 侯氏制碱法工艺流程中的主反应为 ,其中W、X、Y、Z、
Q、R分别代表相关化学元素。下列说法正确的是
A. 原子半径: B. 第一电离能:
C. 单质沸点: D. 电负性:
【答案】C
【解析】
【分析】侯氏制碱法主反应的化学方程式为 ,则可推出
W、X、Y、Z、Q、R分别为H元素、C元素、N元素、O元素、 元素、 元素。
【详解】A.一般原子的电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,则原子半
径: ,故A错误;
B.同周期从左到右元素第一电离能呈增大趋势,ⅡA族、ⅤA族原子的第一电离能大于同周期相邻元素,
则第一电离能: ,故B错误;
C. 、 为分子晶体,相对分子质量越大,沸点越高,二者在常温下均为气体, 在常温下为固体,
则沸点: ,故C正确;
D.同周期元素,从左往右电负性逐渐增大,同族元素,从上到下电负性逐渐减小,电负性: ,
故D错误;
故选C。
8. 从微观视角探析物质结构及性质是学习化学的有效方法。下列实例与解释不符的是
选项 实例 解释
A 原子光谱是不连续的线状谱线 原子的能级是量子化的
键角依次减
B 孤电子对与成键电子对的斥力大于成键电子对之间的斥力
小晶体中 与8个 配位,
C 比 的半径大
而 晶体中 与6个 配位
逐个断开 中的 键,每步
D 各步中的 键所处化学环境不同
所需能量不同
.
A A B. B C. C D. D
【答案】B
【解析】
【详解】A.原子光谱是不连续的线状谱线,说明原子的能级是不连续的,即原子能级是量子化的,故A
正确;
B. 中中心C原子为 杂化,键角为 , 中中心C原子为 杂化,键角大约为 ,
中中心C原子为 杂化,键角为 ,三种物质中心C原子都没有孤电子对,三者键角大小与
孤电子对无关,故B错误;
C.离子晶体的配位数取决于阴、阳离子半径的相对大小,离子半径比越大,配位数越大, 周围最多
能排布8个 , 周围最多能排布6个 ,说明 比 半径大,故C正确;
D.断开第一个键时,碳原子周围的共用电子对多,原子核对共用电子对的吸引力较弱,需要能量较小,
断开 键越多,碳原子周围共用电子对越少,原子核对共用电子对的吸引力越大,需要的能量变大,
所以各步中的 键所处化学环境不同,每步所需能量不同,故D正确;
故选B。
9. 是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:
。下列有关化学用语或表述正确的是
A. 的形成过程可表示为
B. 中的阴、阳离子有相同的VSEPR模型和空间结构C. 在 、石墨、金刚石中,碳原子有 和 三种杂化方式
D. 和 都能作制冷剂是因为它们有相同类型的分子间作用力
【答案】B
【解析】
【详解】A. 是共价化合物,其电子式为 , 的形成过程可表示为
,故A错误;
B. 中 的中心N原子孤电子对数为 ,价层电子对数为4, 的中心 原
子孤电子对数为 ,价层电子对数为4,则二者的 模型和空间结构均为正四面体
形,故B正确;
C. 、石墨、金刚石中碳原子的杂化方式分别为 、 、 ,共有2种杂化方式,故C错误;
D. 易液化,其汽化时吸收热量,可作制冷剂,干冰易升华,升华时吸收热量,也可作制冷剂,
分子间作用力为氢键和范德华力, 分子间仅存在范德华力,故D错误;
故选B。
10. 图示装置不能完成相应气体的发生和收集实验的是(加热、除杂和尾气处理装置任选)
选项 气体 试剂
A 饱和 溶液+浓硫酸
B 浓盐酸
C 固体 熟石灰
D 石灰石+稀盐酸
A. A B. B C. C D. D
【答案】C
【解析】
【分析】如图所示的气体发生装置可以为固液加热型反应,也可以是固液不加热型;右侧气体收集装置,
长进短出为向上排空气法,短进长出为向下排空气法,装满水后短进长出为排水法;
【详解】A.饱和 溶液和浓硫酸反应可以制 ,使用固液不加热制气装置, 密度比空气大,
用向上排空气法收集,可以完成相应气体的发生和收集实验,A不符合题意;
B. 和浓盐酸加热反应可以制 ,使用固液加热制气装置, 密度比空气大,用向上排空气法收
集,可以完成相应气体的发生和收集实验,B不符合题意;
C.固体 与熟石灰加热可以制 需要使用固固加热制气装置,图中装置不合理,不能完成相应
气体的发生和收集实验,C符合题意;
D.石灰石(主要成分为 )和稀盐酸反应可以制 ,使用固液不加热制气装置, 密度比空气
大,用向上排空气法收集,可以完成相应气体的发生和收集实验,D不符合题意;
本题选C。
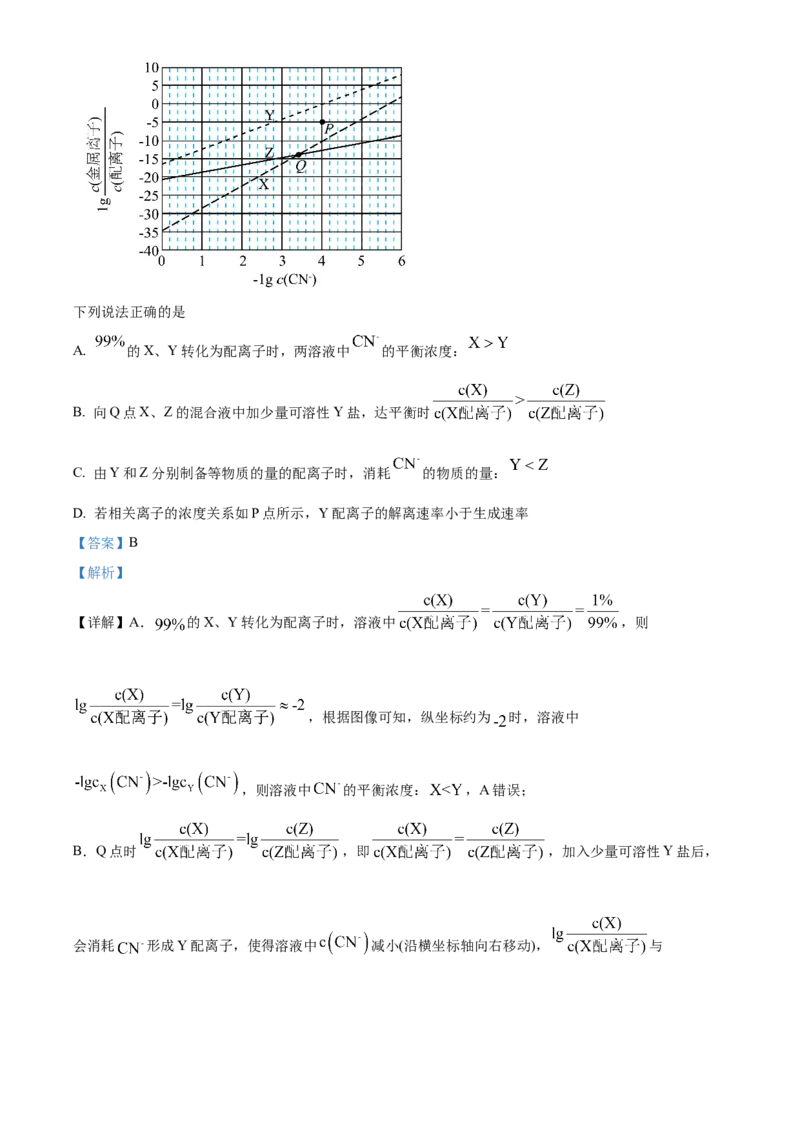
11. 在水溶液中, 可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与 形成配离子达平
衡时, 与 的关系如图。下列说法正确的是
A. 的X、Y转化为配离子时,两溶液中 的平衡浓度:
B. 向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时
C. 由Y和Z分别制备等物质的量的配离子时,消耗 的物质的量:
D. 若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
【答案】B
【解析】
【详解】A. 的X、Y转化为配离子时,溶液中 ,则
,根据图像可知,纵坐标约为 时,溶液中
,则溶液中 的平衡浓度: ,A错误;
B.Q点时 ,即 ,加入少量可溶性Y盐后,
会消耗 形成Y配离子,使得溶液中 减小(沿横坐标轴向右移动), 与曲线在Q点相交后,随着 继续增大,X对应曲线位于Z对应曲线上方,即
,则 ,B正确;
C.设金属离子形成配离子的离子方程式为金属离子 配离子,则平衡常数
, ,即
,故X、Y、Z三种金属离子形成配离子时结合的 越多,对应
曲线斜率越大,由题图知,曲线斜率: ,则由Y、Z制备等物质的量
的配离子时,消耗 的物质的量: ,C错误;
D.由P点状态移动到形成Y配离子的反应的平衡状态时, 不变, 增大,即
增大、c(Y配离子)减小,则P点状态Y配离子的解离速率>生成速率,D错误;
本题选B。
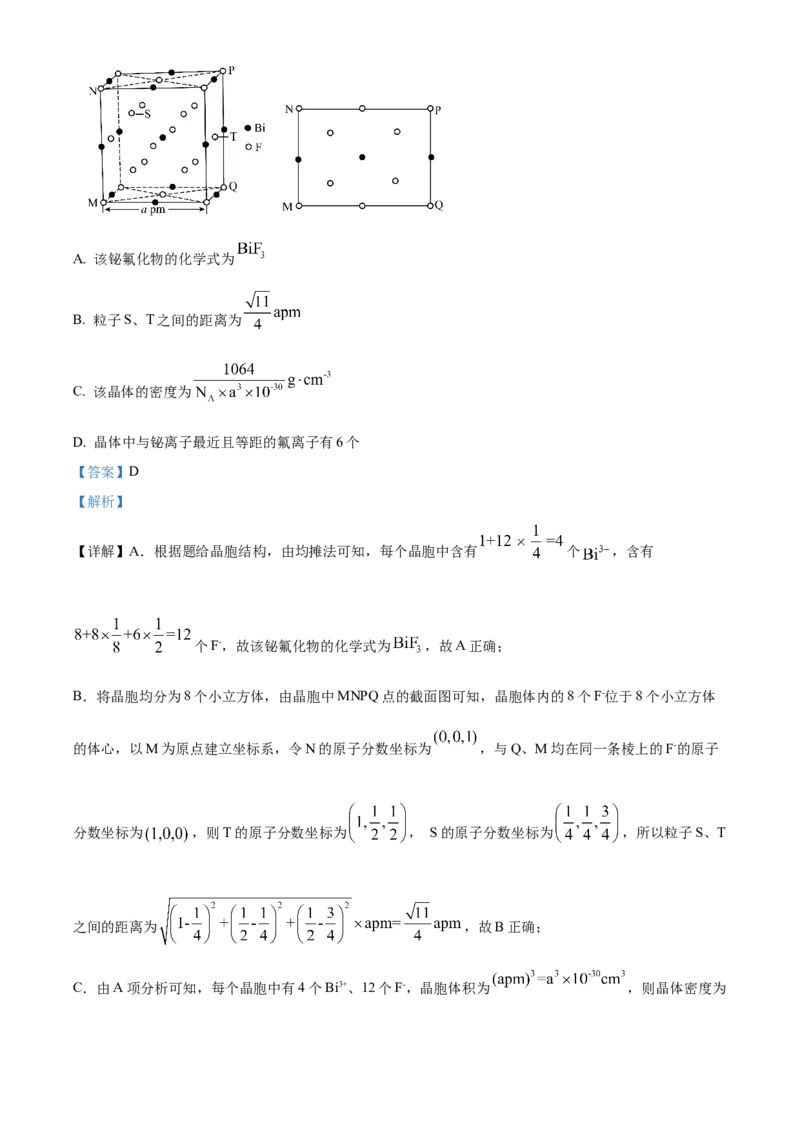
12. 金属铋及其化合物广泛应用于电子设备、医药等领域。如图是铋的一种氟化物的立方晶胞及晶胞中
MNPQ点的截面图,晶胞的边长为 为阿伏加德罗常数的值。下列说法错误的是A. 该铋氟化物的化学式为
B. 粒子S、T之间的距离为
C. 该晶体的密度为
D. 晶体中与铋离子最近且等距的氟离子有6个
【答案】D
【解析】
【详解】A.根据题给晶胞结构,由均摊法可知,每个晶胞中含有 个 ,含有
个F-,故该铋氟化物的化学式为 ,故A正确;
B.将晶胞均分为8个小立方体,由晶胞中MNPQ点的截面图可知,晶胞体内的8个F-位于8个小立方体
的体心,以M为原点建立坐标系,令N的原子分数坐标为 ,与Q、M均在同一条棱上的F-的原子
分数坐标为 ,则T的原子分数坐标为 , S的原子分数坐标为 ,所以粒子S、T
之间的距离为 ,故B正确;
C.由A项分析可知,每个晶胞中有4个Bi3+、12个F-,晶胞体积为 ,则晶体密度为= ,故C正确;
D.以晶胞体心处铋离子为分析对象,距离其最近且等距的氟离子位于晶胞体内,为将晶胞均分为8个小
立方体后,每个小立方体的体心的F-,即有8个,故D错误;
故答案为:D。
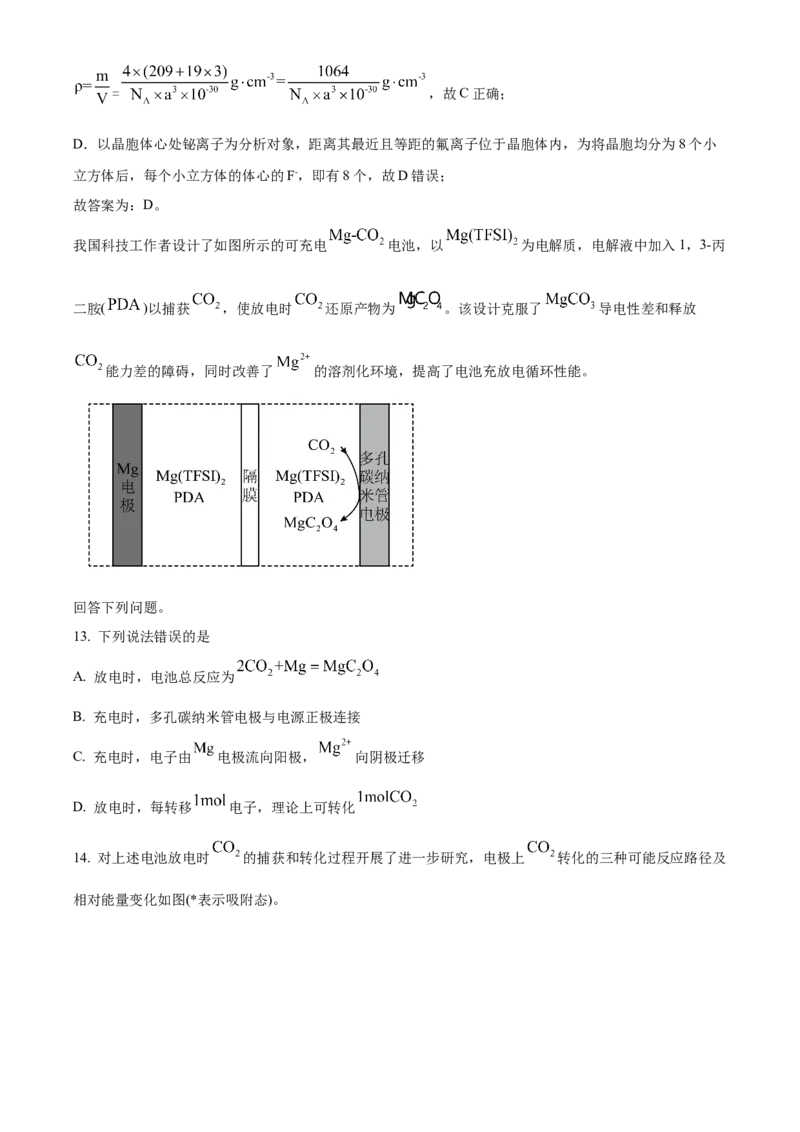
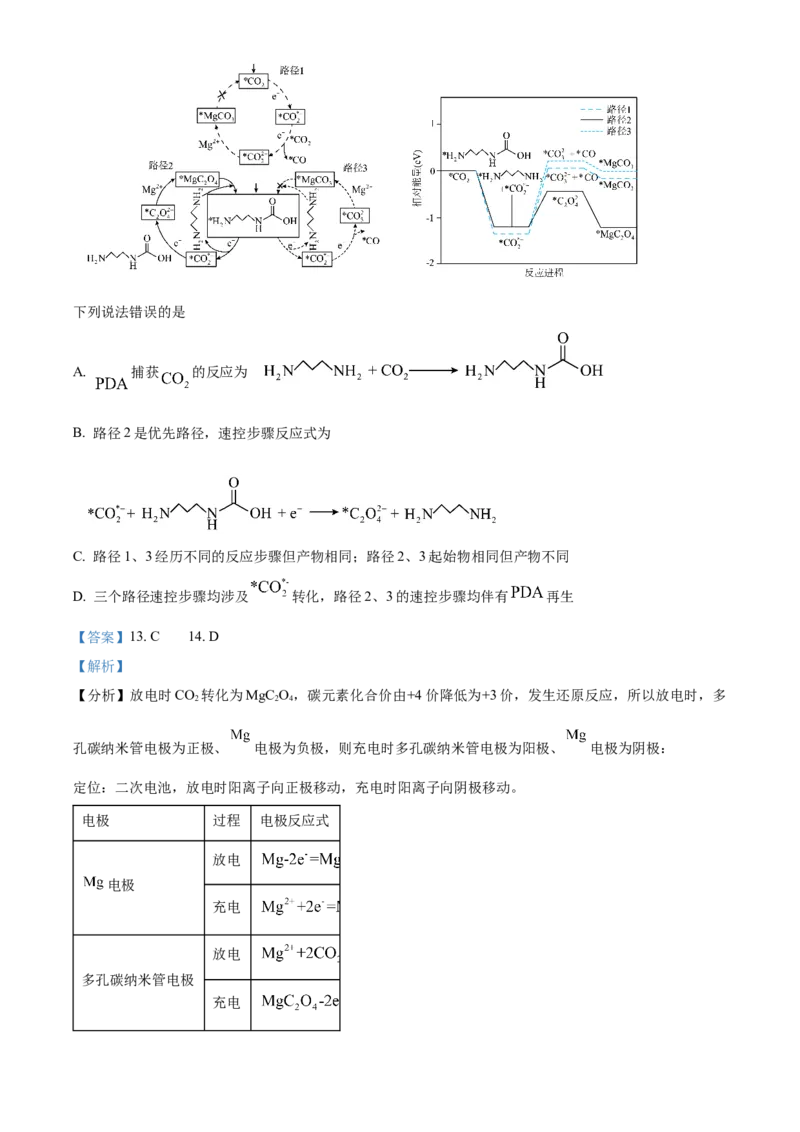
我国科技工作者设计了如图所示的可充电 电池,以 为电解质,电解液中加入1,3-丙
二胺( )以捕获 ,使放电时 还原产物为 。该设计克服了 导电性差和释放
能力差的障碍,同时改善了 的溶剂化环境,提高了电池充放电循环性能。
回答下列问题。
13. 下列说法错误的是
A. 放电时,电池总反应为
B. 充电时,多孔碳纳米管电极与电源正极连接
C. 充电时,电子由 电极流向阳极, 向阴极迁移
D. 放电时,每转移 电子,理论上可转化
14. 对上述电池放电时 的捕获和转化过程开展了进一步研究,电极上 转化的三种可能反应路径及
相对能量变化如图(*表示吸附态)。下列说法错误的是
A. 捕获 的反应为
B. 路径2是优先路径,速控步骤反应式为
C. 路径1、3经历不同的反应步骤但产物相同;路径2、3起始物相同但产物不同
D. 三个路径速控步骤均涉及 转化,路径2、3的速控步骤均伴有 再生
【答案】13. C 14. D
【解析】
【分析】放电时CO 转化为MgC O ,碳元素化合价由+4价降低为+3价,发生还原反应,所以放电时,多
2 2 4
孔碳纳米管电极为正极、 电极为负极,则充电时多孔碳纳米管电极为阳极、 电极为阴极:
定位:二次电池,放电时阳离子向正极移动,充电时阳离子向阴极移动。
电极 过程 电极反应式
放电
电极
充电
放电
多孔碳纳米管电极
充电【13题详解】A.根据以上分析,放电时正极反应式为 、负极反应式为
,将放电时正、负电极反应式相加,可得放电时电池总反应: ,A
正确;
B.充电时,多孔碳纳米管电极上发生失电子的氧化反应,则多孔碳纳米管在充电时是阳极,与电源正极
连接,B正确;
C.充电时, 电极为阴极,电子从电源负极经外电路流向 电极,同时 向阴极迁移,C错误;
D.根据放电时的电极反应式 可知,每转移 电子,有 参与反
应,因此每转移 电子,理论上可转化 ,D正确;
故选C。
【14题详解】
A.根据题给反应路径图可知, (1,3-丙二胺)捕获 的产物为 ,因
此 捕获 的反应为 ,A正确;
B.由反应进程-相对能量图可知,路径2的最大能垒最小,因此与路径1和路径3相比,路径2是优先路
径,且路径2的最大能垒为 的步骤,据反应路径2的图示可知,该步骤有
参与反应,因此速控步骤反应式为,B正确;
C.根据反应路径图可知,路径1、3的中间产物不同,即经历了不同的反应步骤,但产物均为 ,
而路径2、3的起始物均为 ,产物分别为 和 ,C正确;
D.根据反应路径与相对能量的图像可知,三个路径的速控步骤中 都参与了反应,且由B项分析可
知,路径2的速控步骤伴有 再生,但路径3的速控步骤为 得电子转化为 和 ,没有
的生成,D错误;
故选D。
二、非选择题:共58分。
15. 市售的溴(纯度 )中含有少量的 和 ,某化学兴趣小组利用氧化还原反应原理,设计实验制备
高纯度的溴。回答下列问题:
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓 溶液的B中,水浴加热至不再有红棕色液体
馏出。仪器C的名称为_______; 溶液的作用为_______;D中发生的主要反应的化学方程式为
_______。
(2)将D中溶液转移至_______(填仪器名称)中,边加热边向其中滴加酸化的 溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成 的离子方程式为_______。
(3)利用图示相同装置,将R和 固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴
加适量浓 ,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水
的作用为_______和_______。
(4)为保证溴的纯度,步骤(3)中 固体的用量按理论所需量的 计算,若固体R质量为m克(以
计),则需称取_______ (用含m的代数式表示)。
(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内
壁,转移溶液时用_______,滤液沿烧杯壁流下。
【 答 案 】 ( 1 ) ① . 直 形 冷 凝 管 ② . 除 去 市 售 的 溴 中 少 量 的 ③ .
(2) ①. 蒸发皿 ②.
(3) ①. 液封 ②. 降低温度
(4)
(5)玻璃棒引流,玻璃棒下端靠在三层滤纸处
【解析】
【分析】市售的溴(纯度99%)中含有少量的Cl 和I ,实验利用氧化还原反应原理制备高纯度的溴,市售的
2 2
溴滴入盛有浓CaBr 溶液中,Cl 可与CaBr 发生氧化还原反应而除去,I 与Br 一起蒸馏入草酸钾溶液中,
2 2 2 2 2
并被草酸钾还原为I-、Br-,并向溶液中滴加高锰酸钾溶液氧化 I-,加热蒸干得KBr固体,将KBr固体和
KCr O 固体混合均匀加入冷的蒸馏水,同时滴加适量浓HSO ,水浴加热蒸馏,得到的液体分液、干燥、
2 2 7 2 4
蒸馏,可得高纯度的溴。
【小问1详解】
仪器C为直形冷凝管,用于冷凝蒸气;市售的溴中含有少量的 , 可与 发生氧化还原反应而除去;水浴加热时, 、 蒸发进入装置D中,分别与 发生氧化还原反应,
、 ,由于Br 为进入D的主要物质,故主要
2
反应的化学方程式为 ;
【小问2详解】
将D中溶液转移至蒸发皿中,边加热边向其中滴加酸化的 溶液至出现红棕色气体( ),即说明
已将 全部氧化,发生反应的离子方程式为 ;
几乎未被氧化,继续加热将溶液蒸干所得固体R的主要成分为 ;
【小问3详解】
密度 ,D中冷的蒸馏水起到液封的作用,同时冷的蒸馏水温度较低,均可减少溴的挥发;
【小问4详解】
m克KBr固体的物质的量为 ,根据转移电子相等可得关系式 ,则理论上需
要 的物质的量为 ,实际所需称取 的质量为
;
【小问5详解】
趁热过滤的具体操作:漏斗下端管口紧靠烧杯内壁,转移溶液时用玻璃棒引流,玻璃棒下端靠在三层滤纸
处,滤液沿烧杯壁流下。
16. 是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
已知:i石煤是一种含 的矿物,杂质为大量 和少量 等;苛化泥的主要成分为
等。
ⅱ高温下,苛化泥的主要成分可与 反应生成偏铝酸盐;室温下,偏钒酸钙 和偏铝酸钙
均难溶于水。回答下列问题:
(1)钒原子的价层电子排布式为_______;焙烧生成的偏钒酸盐中钒的化合价为_______,产生的气体①
为_______(填化学式)。
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为_______(填化
学式)。
(3)在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为_______; 加压导入盐浸
工序可提高浸出率的原因为_______;浸取后低浓度的滤液①进入_______(填工序名称),可实现钒元素的
充分利用。
(4)洗脱工序中洗脱液的主要成分为_______(填化学式)。
(5)下列不利于沉钒过程的两种操作为_______(填序号)。
a.延长沉钒时间 b.将溶液调至碱性 c.搅拌 d.降低 溶液的浓度
【答案】(1) ①. ②. ③.(2)
(3) ①. ②. 提高溶液中 浓度,
促使偏钒酸钙转化为碳酸钙,释放 ③. 离子交换
(4)
(5)bd
【解析】
【分析】石煤和苛化泥通入空气进行焙烧,反应生成 、 、 、 、
和 等,水浸可分离焙烧后的可溶性物质(如 )和不溶性物质[ 、
等],过滤后滤液进行离子交换、洗脱,用于富集和提纯 ,加入氯化铵溶液沉钒,生成 ,经
一系列处理后得到VO;滤渣①在 , 的条件下加入3%NH HCO 溶液进行盐浸,滤渣①
2 3 4 3
中含有钒元素,通过盐浸,使滤渣①中的钒元素进入滤液①中,再将滤液①回流到离子交换工序,进行
的富集。
【小问1详解】
钒是23号元素,其价层电子排布式为 ;焙烧过程中,氧气被还原, 被氧化生成 ,偏钒
酸盐中钒的化合价为 价; 在 以上开始分解,生成的气体①为 。
【小问2详解】
由已知信息可知,高温下,苛化泥的主要成分与 反应生成偏铝酸钠和偏铝酸钙,偏铝酸钠溶于水,
偏铝酸钙难溶于水,所以滤液中杂质的主要成分是 。
【小问3详解】在弱碱性环境下, 与 和 反应生成 、 和 ,离子方程式为:
; CO 加压导入盐浸工序可提高浸出率,因为C
2
可提高溶液中 浓度,促使偏钒酸钙转化为碳酸钙,释放 ;滤液①中含有 、 等,且浓
度较低,若要利用其中的钒元素,需要通过离子交换进行分离、富集,故滤液①应进入离子交换工序。
【小问4详解】
的
由离子交换工序中树脂 组成可知,洗脱液中应含有 ,考虑到水浸所得溶液中含有 ,为避免
引人其他杂质离子,且 廉价易得,故洗脱液的主要成分应为 。
【小问5详解】
a.延长沉钒时间,能使反应更加完全,有利于沉钒,a不符合题意;
b. 呈弱酸性,如果将溶液调至碱性, 与 反应,不利于生成 ,b符合题意;
c.搅拌能使反应物更好的接触,提高反应速率,使反应更加充分,有利于沉钒,c不符合题意;
d.降低 溶液的浓度,不利于生成 ,d符合题意;
故选bd。
17. 氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。硫酰氯及1,4-二(氯甲基)苯等可
通过氯化反应制备。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:
。
①若正反应的活化能为 ,则逆反应的活化能 _______ (用含 正的代数式表
示)。
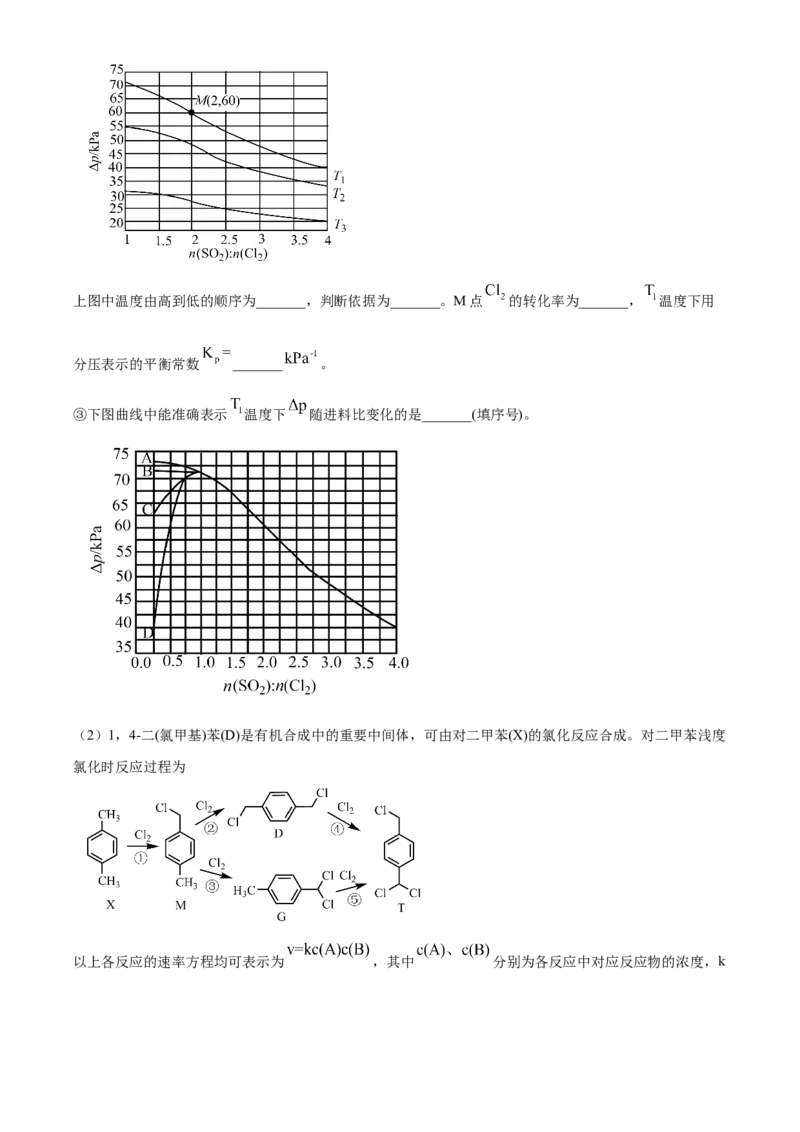
②恒容密闭容器中按不同进料比充入 和其 ,测定 温度下体系达平衡时的 (
为体系初始压强, ,P为体系平衡压强),结果如图。上图中温度由高到低的顺序为_______,判断依据为_______。M点 的转化率为_______, 温度下用
分压表示的平衡常数 _______ 。
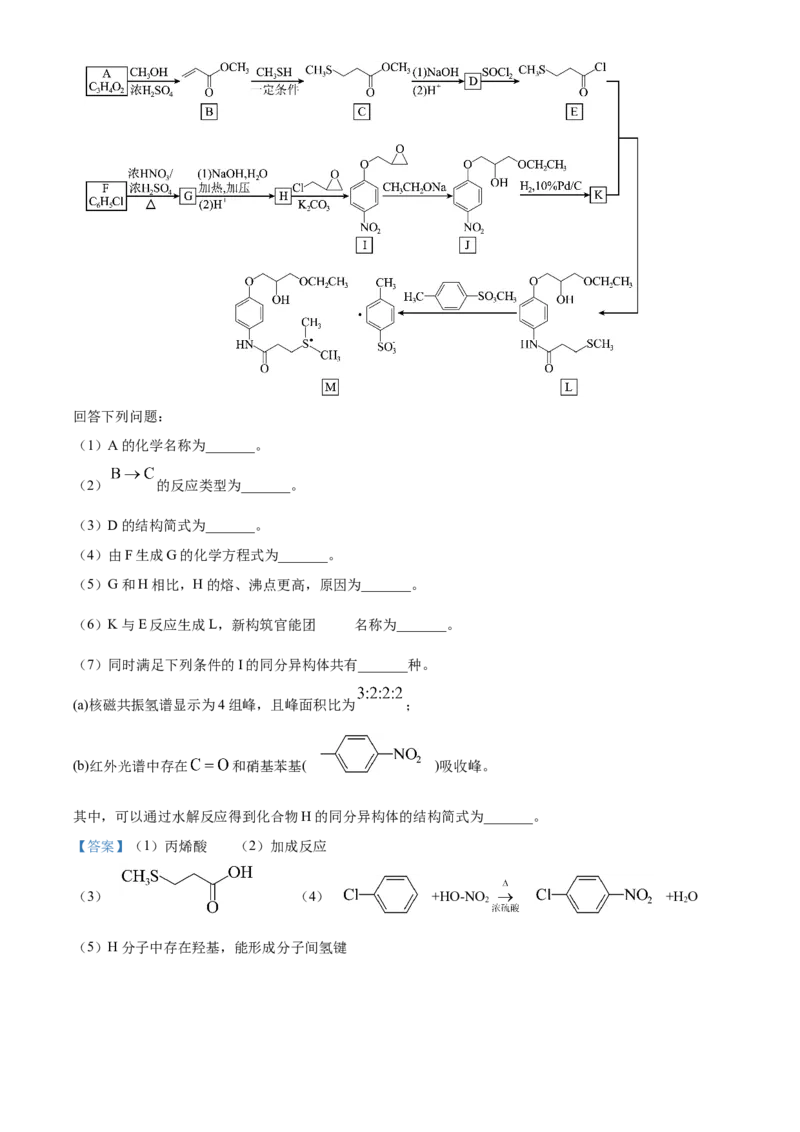
③下图曲线中能准确表示 温度下 随进料比变化的是_______(填序号)。
(2)1,4-二(氯甲基)苯(D)是有机合成中的重要中间体,可由对二甲苯(X)的氯化反应合成。对二甲苯浅度
氯化时反应过程为
以上各反应的速率方程均可表示为 ,其中 分别为各反应中对应反应物的浓度,k为速率常数( 分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定
(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,
。
① 时, ,且 内 ,反应进行到 时,
_______ 。
② 时, ,若 产物T的含量可忽略不计,则此时 _______
后,随T的含量增加, _______(填“增大”“减小”或“不变”)。
【答案】(1) ①. ②. ③. 该反应正反应放热,且气体分子数减小,反
应正向进行时,容器内压强减小,从 到 平衡时 增大,说明反应正向进行程度逐渐增大,对应温度
逐渐降低 ④. ⑤. 0.03 ⑥. D
(2) ①. 5.54 ②. 0.033 ③. 增大
【解析】
【小问1详解】
①根据反应热 与活化能E 和E 关系为 正反应活化能-逆反应活化能可知,该反应的
正 逆
。
②该反应的正反应为气体体积减小的反应,因此反应正向进行程度越大,平衡时容器内压强越小, 即
越大。从 到 , 增大,说明反应正向进行程度逐渐增大,已知正反应为放热反应,则温度由 到
逐渐降低,即 。由题图甲中M点可知,进料比为 ,平衡时 ,已
知恒温恒容情况下,容器内气体物质的量之比等于压强之比,可据此列出“三段式”。可计算得 , 。
③由题图甲中M点可知,进料比为2时, ,结合“三段式”,以及 时化学平衡常数可知,
进料比为0.5时, 也为 ,曲线D上存在(0.5,60)。本题也可以快解:根据“等效平衡”原理,
该反应中 和 的化学计量数之比为 ,则 和 的进料比互为倒数(如2与0.5)时, 相等。
【小问2详解】
①根据化学反应速率的计算公式时, , 时,
。
②已知 ,又由题给反应速率方程推知, ,则
,即 后 。 后,D和G转化为T的速
率比为 ,G消耗得更快,则 增大。
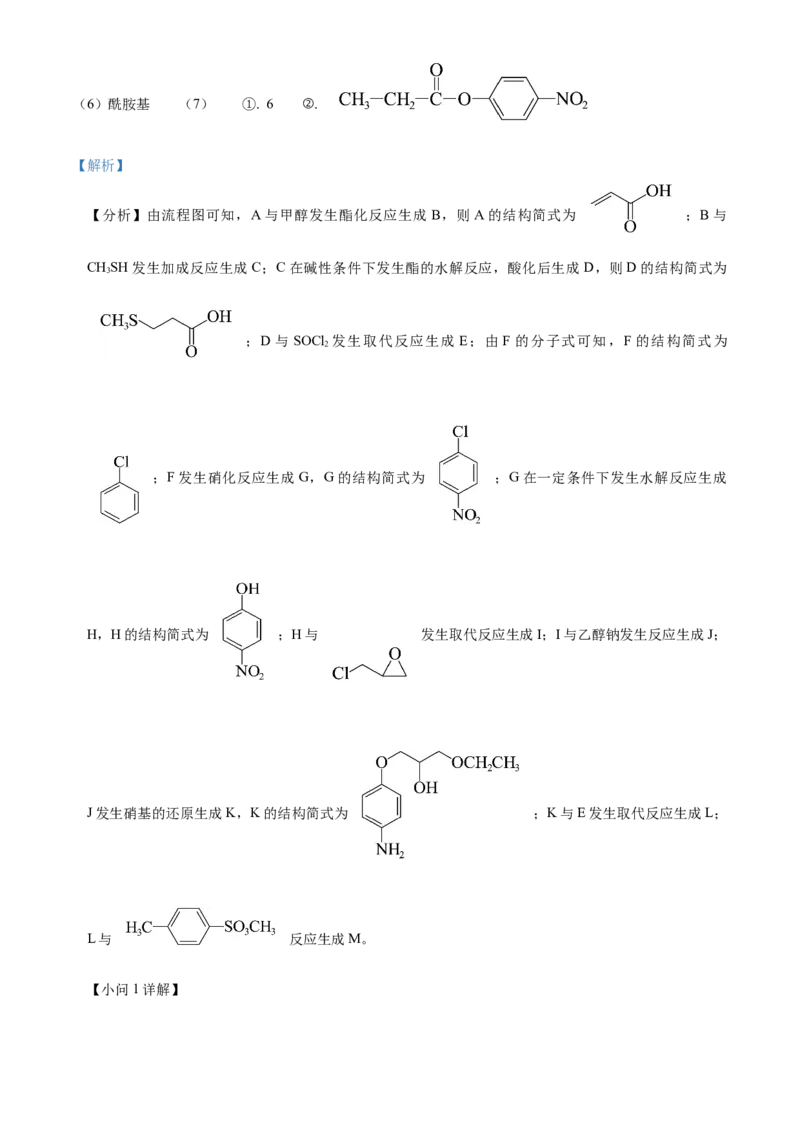
18. 甲磺司特(M)是一种在临床上治疗支气管哮喘、特应性皮炎和过敏性鼻炎等疾病的药物。M的一种合成
路线如下(部分试剂和条件省略)。回答下列问题:
(1)A的化学名称为_______。
(2) 的反应类型为_______。
(3)D的结构简式为_______。
(4)由F生成G的化学方程式为_______。
(5)G和H相比,H的熔、沸点更高,原因为_______。
的
(6)K与E反应生成L,新构筑官能团 名称为_______。
(7)同时满足下列条件的I的同分异构体共有_______种。
(a)核磁共振氢谱显示为4组峰,且峰面积比为 ;
(b)红外光谱中存在 和硝基苯基( )吸收峰。
其中,可以通过水解反应得到化合物H的同分异构体的结构简式为_______。
【答案】(1)丙烯酸 (2)加成反应
(3) (4) +HO-NO +H O
2 2
(5)H分子中存在羟基,能形成分子间氢键(6)酰胺基 (7) ①. 6 ②.
【解析】
【分析】由流程图可知,A与甲醇发生酯化反应生成 B,则A的结构简式为 ;B与
CHSH发生加成反应生成C;C在碱性条件下发生酯的水解反应,酸化后生成 D,则D的结构简式为
3
;D 与 SOCl 发生取代反应生成 E;由 F 的分子式可知,F 的结构简式为
2
;F发生硝化反应生成G,G的结构简式为 ;G在一定条件下发生水解反应生成
H,H的结构简式为 ;H与 发生取代反应生成I;I与乙醇钠发生反应生成J;
J发生硝基的还原生成K,K的结构简式为 ;K与E发生取代反应生成L;
L与 反应生成M。
【小问1详解】由A→B的反应条件和B的结构简式可知该步骤为酯化反应,因此A为 ,其名称为丙烯酸。
【小问2详解】
B与 发生加成反应, 和 分别加到双键碳原子上生成C。
【
小问3详解】
结合C和E的结构简式以及C→D和D→E的反应条件,可知C→D为C先在碱性条件下发生水解反应后
酸化,D为 ,D与亚硫酰氯发生取代反应生成E。
【小问4详解】
F→G的反应中,结合I的结构可知,苯环上碳氯键的对位引入硝基,浓硫酸作催化剂和吸水剂,吸收反应
产物中的水,硝化反应的条件为加热,反应的化学方程式是: +HO-NO
2
+H O。
2
【小问5详解】
由分析可知,G的结构简式为 ,H的结构简式为 ,H分子中存在羟基,能形成分子
间氢键,G分子不能形成分子间氢键,分子间氢键会使物质的熔、沸点显著升高。
【小问6详解】
根据分析可知,K与E反应生成L为取代反应,反应中新构筑的官能团为酰胺基。
【小问7详解】
I的分子式为 ,其不饱和度为6,其中苯环占4个不饱和度, 和硝基各占1个不饱和度,
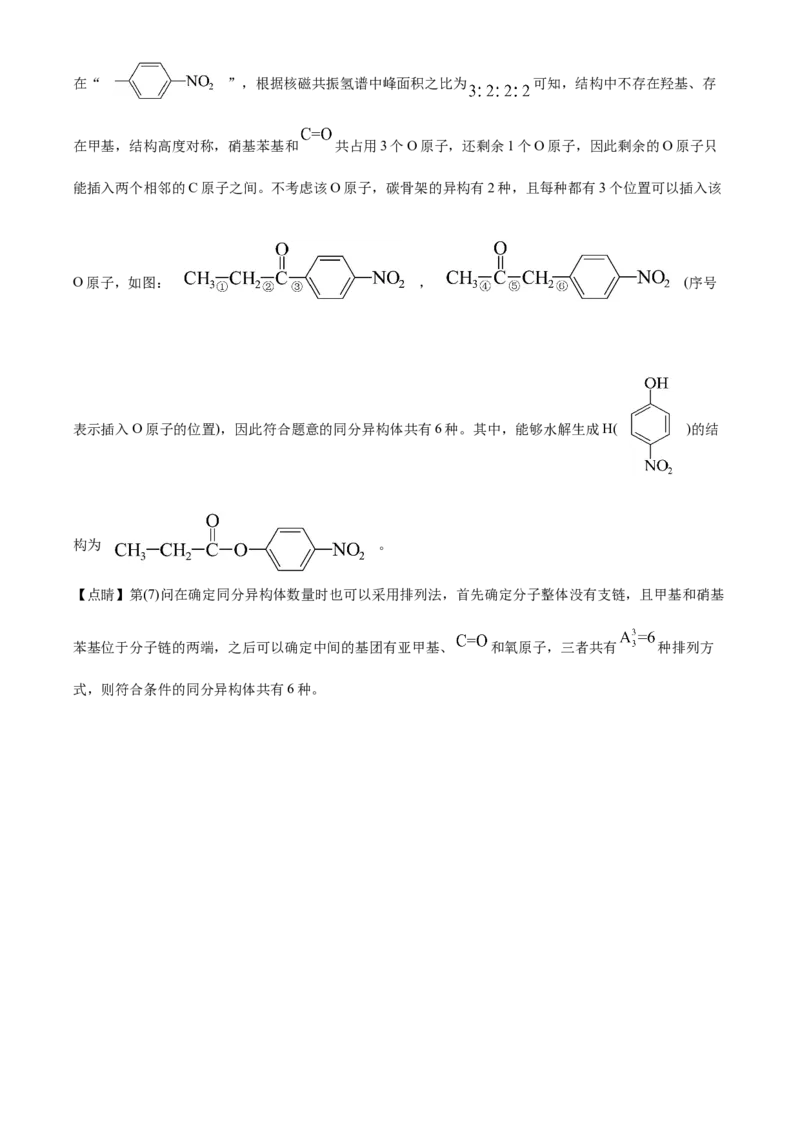
因此满足条件的同分异构体中除了苯环、 和硝基之外没有其他不饱和结构。由题给信息,结构中存在“ ”,根据核磁共振氢谱中峰面积之比为 可知,结构中不存在羟基、存
在甲基,结构高度对称,硝基苯基和 共占用3个O原子,还剩余1个O原子,因此剩余的O原子只
能插入两个相邻的C原子之间。不考虑该O原子,碳骨架的异构有2种,且每种都有3个位置可以插入该
O原子,如图: , (序号
表示插入O原子的位置),因此符合题意的同分异构体共有6种。其中,能够水解生成H( )的结
构为 。
【点睛】第(7)问在确定同分异构体数量时也可以采用排列法,首先确定分子整体没有支链,且甲基和硝基
苯基位于分子链的两端,之后可以确定中间的基团有亚甲基、 和氧原子,三者共有 种排列方
式,则符合条件的同分异构体共有6种。