文档内容
专题12 离子反应与离子检验
1.【2022年重庆卷】下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、NO 等离子大量共存的是
A.加入ZnSO B.加入Fe粉 C.通入NH D.通入CO
4 3 2
【答案】D
【解析】A.向溶液中加入硫酸锌溶液,硫酸根离子会与溶液中的钡离子反应,会影响溶液中离子的大量
共存,故A不符合题意;B.向溶液中加入铁粉,铁离子会与铁反应生成亚铁离子,会影响溶液中离
子的大量共存,故B不符合题意;C.向溶液中通入氨气,铝离子、铁离子会与氨水反应生成氢氧化
铝、氢氧化铁沉淀,会影响溶液中离子的大量共存,故C不符合题意;D.向溶液中通入二氧化碳,
二氧化碳与溶液中离子不发生任何反应,不会影响溶液中离子的大量共存,故D符合题意;故选D。
2.(2021·北京真题)使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→
暗(或灭)→亮”现象的是
选项 A B C D
试剂a CuSO NH HCO HSO CHCOOH
4 4 3 2 4 3
试剂b Ba(OH) Ca(OH) Ba(OH) NH ·H O
2 2 2 3 2
【答案】D
【解析】A.Ba(OH) 与CuSO 发生离子反应:Ba2++2OH-+Cu2++ =BaSO ↓+Cu(OH) ↓,随着反应的进行,
2 4 4 2
溶液中自由移动的离子浓度减小,灯泡变暗,当二者恰好反应时,溶液中几乎不存在自由移动的微粒,
灯泡完全熄灭。当CuSO 溶液过量时,其电离产生的Cu2+、 导电,使灯泡逐渐又变亮,A不符合
4
题意;B.Ca(OH) 与NH HCO 发生离子反应:Ca2++2OH-+ + =CaCO ↓+H O+NH ·H O,随
2 4 3 3 2 3 2着反应的进行,溶液中自由移动离子浓度减小,灯泡逐渐变暗,当二者恰好反应时,溶液中自由移动
的微粒浓度很小,灯泡很暗。当 NH HCO 溶液过量时,其电离产生的 、 导电,使灯泡逐
4 3
渐又变亮,B不符合题意;C.Ba(OH) 与HSO 发生离子反应:Ba2++2OH-+2H++
2 2 4
=BaSO ↓+2H O,随着反应的进行,溶液中自由移动的离子浓度减小,灯泡变暗,当二者恰好反应时,
4 2
溶液中几乎不存在自由移动的微粒,灯泡完全熄灭。当HSO 溶液过量时,其电离产生的H+、 导
2 4
电,使灯泡逐渐又变亮,C不符合题意;D.CHCOOH与氨水发生离子反应:
3
CHCOOH+NH ·H O=CHCOO-+ +H O,反应后自由移动的离子浓度增大,溶液导电能力增强,
3 3 2 3 2
灯泡更明亮,不出现亮—灭(或暗)—亮的变化,D符合题意;故合理选项是D。
3.(2021·湖南真题)对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
粒子组 判断和分析
不能大量共存,因发生反应:
A 、 、 、
不能大量共存,因发生反应:
B 、 、 、
C 、 、 、 能大量共存,粒子间不反应
D 、 、 、 能大量共存,粒子间不反应
【答案】B
【解析】A.Al3+和NH HO生成Al(OH) 沉淀而不是生成Al ,故A错误;B.S 和H+反应生成单
3 2 3 2
质硫、二氧化硫和水,离子方程式为:2H++ S =S↓+SO↑+H O,故B正确;C.Fe3+可以将HO 氧
2 2 2 2 2
化得Fe2+和O,不能大量共存,故C错误;D.在酸性条件下Mn 能将Cl-氧化为Cl,不能大量共
2 2
存,故D错误;答案选B。
4.(2021.6·浙江真题)下列物质属于弱电解质的是
A.CO B.HO C.HNO D.NaOH
2 2 3
【答案】B
【解析】在水溶液中或熔融状态下不能够完全电离的电解质叫做若电解质。A.CO 在水溶液中或熔融状
2
态下不能够电离,为非电解质,A不符合题意;B.HO在水溶液中或熔融状态下能够部分电离,为
2
弱电解质,B符合题意;C.HNO 为一种强酸,在水溶液中或熔融状态下能够完全电离,为强电解质,
3
C不符合题意;D.NaOH为一种强碱,在水溶液中或熔融状态下能够完全电离,为强电解质,D不符
合题意;故答案选B。
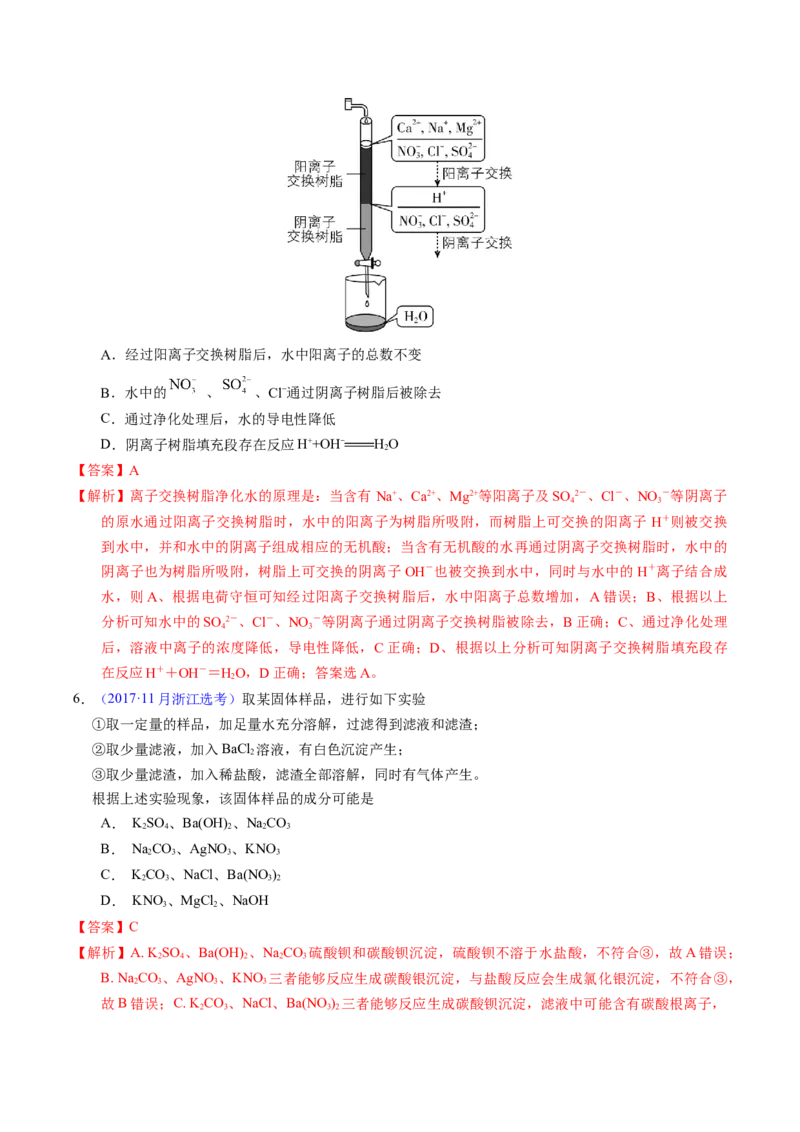
5.(2019新课标Ⅲ)离子交换法净化水过程如图所示。下列说法中错误的是A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的 、 、Cl−通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH− HO
2
【答案】A
【解析】离子交换树脂净化水的原理是:当含有 Na+、Ca2+、Mg2+等阳离子及SO 2-、Cl-、NO -等阴离子
4 3
的原水通过阳离子交换树脂时,水中的阳离子为树脂所吸附,而树脂上可交换的阳离子 H+则被交换
到水中,并和水中的阴离子组成相应的无机酸;当含有无机酸的水再通过阴离子交换树脂时,水中的
阴离子也为树脂所吸附,树脂上可交换的阴离子OH-也被交换到水中,同时与水中的H+离子结合成
水,则A、根据电荷守恒可知经过阳离子交换树脂后,水中阳离子总数增加,A错误;B、根据以上
分析可知水中的SO 2-、Cl-、NO -等阴离子通过阴离子交换树脂被除去,B正确;C、通过净化处理
4 3
后,溶液中离子的浓度降低,导电性降低,C正确;D、根据以上分析可知阴离子交换树脂填充段存
在反应H++OH-=HO,D正确;答案选A。
2
6.(2017·11月浙江选考)取某固体样品,进行如下实验
①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl 溶液,有白色沉淀产生;
2
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是
A. KSO 、Ba(OH) 、NaCO
2 4 2 2 3
B. NaCO、AgNO、KNO
2 3 3 3
C. KCO、NaCl、Ba(NO )
2 3 3 2
D. KNO、MgCl 、NaOH
3 2
【答案】C
【解析】A. K SO 、Ba(OH) 、NaCO 硫酸钡和碳酸钡沉淀,硫酸钡不溶于水盐酸,不符合③,故A错误;
2 4 2 2 3
B. Na CO 、AgNO 、KNO 三者能够反应生成碳酸银沉淀,与盐酸反应会生成氯化银沉淀,不符合③,
2 3 3 3
故B错误;C. K CO 、NaCl、Ba(NO ) 三者能够反应生成碳酸钡沉淀,滤液中可能含有碳酸根离子,
2 3 3 2加入氯化钡溶液生成白色沉淀,滤渣碳酸钡能够与盐酸反应放出二氧化碳而溶解,符合上述实验过程,
故C正确;D. KNO 、MgCl 、NaOH三者能够反应生成氢氧化镁沉淀,氢氧化镁与盐酸反应没有气体
3 2
放出,不符合③,故D错误;故选C。
7.(2017·4月浙江选考)某固体混合物中可能含有:K+、Na+、Cl-、CO、SO等离子,将该固体溶解所
得到的溶液进行如下实验:
下列说法正确的是
A.该混合物一定是KCO 和NaCl
2 3
B.该混合物可能是NaCO 和KCl
2 3
C.该混合物可能是NaSO 和NaCO
2 4 2 3
D.该混合物一定是NaCO 和NaCl
2 3
【答案】B
【解析】过量硝酸钡之后产生的白色沉淀溶于过量盐酸,说明有 CO、无SO,溶液加入AgNO/HNO 产生
3 3
白色沉淀说明有Cl-,颜色反应显黄色说明有Na+,但不能确定是否含有K+。
8.【2011年全国卷】将足量CO 通入下列各溶液中,所含离子还能大量共存的是( )
2
A.K+、SiO2-、Cl-、NO - B.H+、NH +、Al3+、SO 2-
3 3 4 4
C.Na+、S2-、OH-、SO 2- D.Na+、C HO-、CHCOO-、HCO -
4 6 5 3 3
【答案】B
【解析】A.因碳酸酸性强于硅酸,将足量二氧化碳通入该溶液中可得硅酸沉淀,则SiO2-不能大量共存,
3
错误;B.将足量二氧化碳通入该溶液中,四种离子均不发生反应,可以大量共存,正确;C.将足量
二氧化碳通入该溶液中,OH-不能大量共存,错误;D.碳酸酸性强于苯酚,将足量二氧化碳通入该
溶液中,C HO-不能大量共存,错误。
6 5
9.【2015上海化学】某无色溶液含有下列离子中的若干种:H+、NH +、Fe3+、Ba2+、Al3+、CO2–、Cl–、
4 3
OH–、NO –。向该溶液中加入铝粉,只放出H,则溶液中能大量存在的离子最多有( )
3 2
A.3种 B.4种
C.5种
D.6种
【答案】C
【解析】含有Fe3+的溶液显黄色,在无色溶液中不能大量存在;H+与CO2–、OH–会发生反应,不能大量共
3
存;OH–与NH +、Al3+会发生反应,不能大量共存;Ba2+、Al3+、CO2–会发生反应,不能大量共存。向
4 3
该溶液中加入铝粉,只放出H,若溶液为碱性,则含有大量的OH–。还可能含有大量的Ba2+、CO2–、
2 3
Cl–、NO –。离子最多4种;若溶液为酸性,由于H+、NO –起硝酸的作用,加入Al不能产生氢气,所
3 3
以含有的离子可能是:H+、NH +、Ba2+、Al3+、Cl–,最多是5种离子。故选项是C。
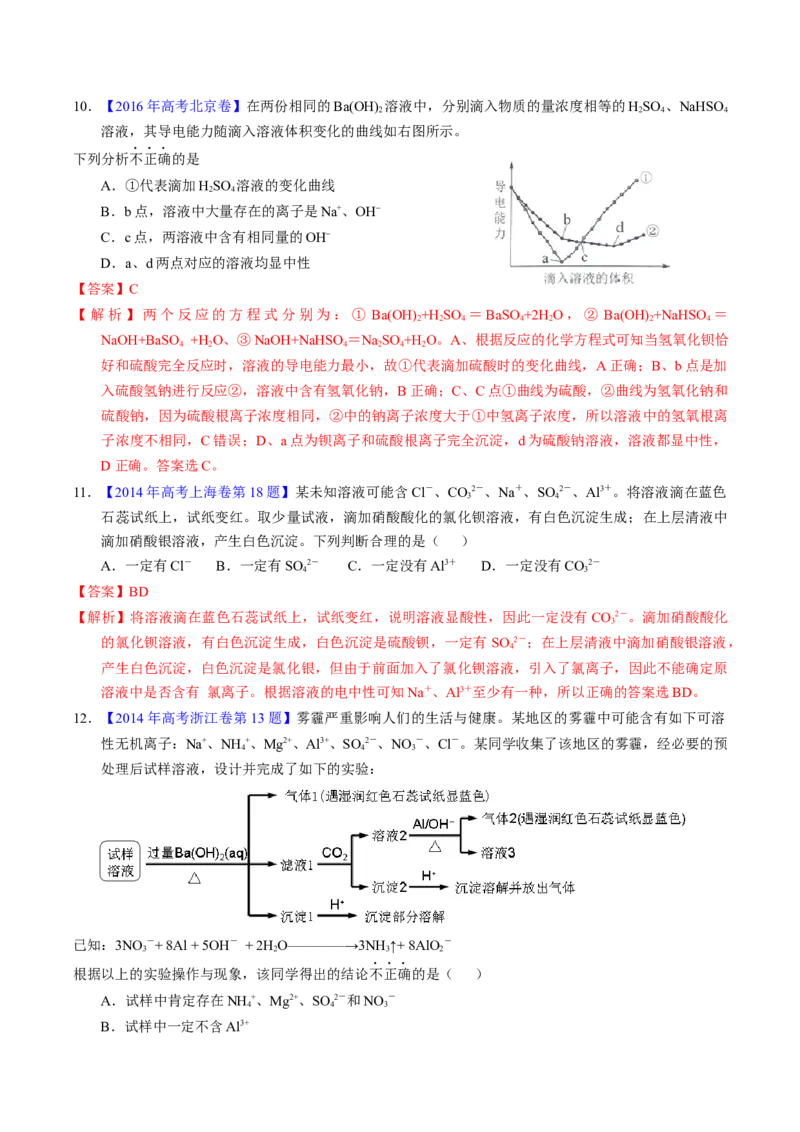
410.【2016年高考北京卷】在两份相同的Ba(OH) 溶液中,分别滴入物质的量浓度相等的HSO 、NaHSO
2 2 4 4
溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确的是
A.①代表滴加HSO 溶液的变化曲线
2 4
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
【答案】C
【解析】两个反应的方程式分别为:① Ba(OH) +H SO =BaSO+2H O,② Ba(OH) +NaHSO =
2 2 4 4 2 2 4
NaOH+BaSO +H O、③NaOH+NaHSO =NaSO +H O。A、根据反应的化学方程式可知当氢氧化钡恰
4 2 4 2 4 2
好和硫酸完全反应时,溶液的导电能力最小,故①代表滴加硫酸时的变化曲线,A正确;B、b点是加
入硫酸氢钠进行反应②,溶液中含有氢氧化钠,B正确;C、C点①曲线为硫酸,②曲线为氢氧化钠和
硫酸钠,因为硫酸根离子浓度相同,②中的钠离子浓度大于①中氢离子浓度,所以溶液中的氢氧根离
子浓度不相同,C错误;D、a点为钡离子和硫酸根离子完全沉淀,d为硫酸钠溶液,溶液都显中性,
D正确。答案选C。
11.【2014年高考上海卷第18题】某未知溶液可能含Cl-、CO2-、Na+、SO 2-、Al3+。将溶液滴在蓝色
3 4
石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中
滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( )
A.一定有Cl- B.一定有SO 2- C.一定没有Al3+ D.一定没有CO2-
4 3
【答案】BD
【解析】将溶液滴在蓝色石蕊试纸上,试纸变红,说明溶液显酸性,因此一定没有CO2-。滴加硝酸酸化
3
的氯化钡溶液,有白色沉淀生成,白色沉淀是硫酸钡,一定有 SO 2-;在上层清液中滴加硝酸银溶液,
4
产生白色沉淀,白色沉淀是氯化银,但由于前面加入了氯化钡溶液,引入了氯离子,因此不能确定原
溶液中是否含有 氯离子。根据溶液的电中性可知Na+、Al3+至少有一种,所以正确的答案选BD。
12.【2014年高考浙江卷第13题】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶
性无机离子:Na+、NH +、Mg2+、Al3+、SO 2-、NO -、Cl-。某同学收集了该地区的雾霾,经必要的预
4 4 3
处理后试样溶液,设计并完成了如下的实验:
已知:3NO -+ 8Al + 5OH- + 2H O————→3NH ↑+ 8AlO -
3 2 3 2
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定存在NH +、Mg2+、SO 2-和NO -
4 4 3
B.试样中一定不含Al3+C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO 、NH Cl和MgSO
3 4 4
【答案】B
【解析】试样溶液中加入过量Ba(OH) 并加热,生成的气体1能使湿润的红色石蕊试纸变蓝色,说明气
2
体1是NH ,则试样中含有NH +;向滤液中通入CO ,得到溶液2、沉淀2,溶液2中加入Al,生成
3 4 2
气体2,该气体能使湿润红色石蕊试纸变蓝色,说明含有气体 2是NH ,根据已知条件知,溶液2中
3
含有NO -,根据元素守恒知,原溶液中含有NO -;滤液1中通入CO ,得到沉淀2,向沉淀2中加入
3 3 2
酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐;沉淀1加入酸后,沉淀部分溶解,
硫酸钡不溶于酸,说明原来溶液中含有SO 2-,能和过量Ba(OH) 反应生成能溶于酸的沉淀,根据离
4 2
子知,该沉淀为Mg(OH) ,所以溶液中含有Mg 2+,则A、通过以上分析知,试样中肯定存在
2
NH +、Mg2+、SO 2-和NO -,故A正确;B、通过以上分析知,试样中不能确定是否含有Al3+,故B错
4 4 3
误;C、通过以上分析知,试样中可能存在Na+、Cl-,要检验是否含有钠离子或氯离子,可以采用焰
色反应鉴定钠离子,用硝酸酸化的硝酸银检验氯离子,故C正确;D、根据以上分析知,试样中肯定
存在 NH +、Mg2+、SO 2-和 NO -,可能存在 Na+、Cl-,所以该雾霾中可能存在 NaNO 、NH Cl 和
4 4 3 3 4
MgSO ,故D正确,答案选B。
4
13.【2013年高考上海卷第17题】某溶液可能含有Cl-、SO 2-、CO2-、NH +、Fe3+、Al3+和K+。取该溶液
4 3 4
100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,
得到1.6g固体;向上述滤液中加足量BaCl 溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液
2
中( )
A.至少存在5种离子
B.Cl-一定存在,且c(Cl-)≥0.4mol/L
C.SO 2-、NH +、一定存在,Cl-可能不存在
4 4
D.CO2-、Al3+一定不存在,K+可能存在
3
【答案】B
【解析】根据加入过量NaOH溶液,加热,得到0.02mol气体,说明有NH +,而且为0.02mol,同时产
4
生红褐色沉淀,说明有Fe3+,而且为0.02mol,则没有CO2-,根据不溶于盐酸的4.66g沉淀,说明
3
有SO 2-,且为0.02mol,再根据电荷守恒可知一定有Cl-,至少有0.06mol(0.02×3+0.02×2-0.
4
02×2),B正确。
14.【2011四川卷】甲、乙、丙、丁四种易溶于水的物质,分别由NH +、Ba2+、Mg2+、H+、OH-、Cl
4
-、HCO -、SO 2-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液
3 4
混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO 溶液有
3
不溶于稀HNO 的白色沉淀生成。下列结论不正确的是( )
3
A.甲溶液含有Ba2+ B.乙溶液含有SO 2-
4
C.丙溶液含有Cl- D.丁溶液含有Mg2+
【答案】D【解析】由②知乙溶液一定为强酸溶液,且0.1 mol·L-1乙溶液电离出的c(H+)>0.1 mol·L-1,可得乙为
HSO ;由③知丙溶液中一定存在Cl-,则丁溶液中的阴离子为HCO ,因为甲能与乙、丙、丁均生成
2 4
沉淀,则甲为Ba(OH) ,丙为MgCl ,丁为NH HCO ,可得A、B、C正确,D错误。
2 2 4 3
15.【2011年上海卷2】某溶液中可能含有Na+、NH +、Ba2+、SO 2-、I-、S2-。分别取样:①用pH计测
4 4
试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )
A.Na+ B.SO 2- C.Ba2+ D.NH +
4 4
【答案】A
【解析】用pH试纸测试溶液呈弱酸性,可排除S2-,加氯水和淀粉无明显现象,说明不存在I-,故溶液中
的阴离子只能为SO 2-,可排除Ba2+;因溶液呈弱酸性,故一定含NH +,有没有钠离子还不能确定,
4 4
还需检验,答案为A项。
16.【2013年高考浙江卷第13题】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某
同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
已知:控制溶液pH=4时,Fe(OH) 沉淀完全,Ca2+、Mg2+不沉淀。
3
该同学得出的结论正确的是( )
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
【答案】C
【解析】A.因加入了NaOH (aq)和NaCO(aq),在滤液中引入了Na+,不能根据滤液焰色反应的黄色火焰
2 3
判断试液是否含Na+。B.试液是葡萄糖酸盐溶液,其中一定含葡萄糖酸根,葡萄糖能发生银镜反应,
葡萄糖酸根不能发生银镜反应。C.根据“控制溶液pH=4时,Fe(OH) 沉淀完全,Ca2+、Mg2+不沉
3
淀”信息,在过滤除去Fe(OH) 的滤液中分别加入NH ·H O(aq)和NaCO(aq),加入NH ·H O(aq)不产
3 3 2 2 3 3 2
生沉淀说明滤液中不含Mg2+,加入NaCO (aq)产生白色沉淀,说明滤液中含Ca2+。D.溶液加入HO
2 3 2 2
后再滴加KSCN(aq)显血红色,不能证明葡萄糖酸盐试液中是否含Fe2+。正确的方法是:在溶液中滴加
KSCN(aq)不显血红色,再滴入滴加HO 显血红色,证明溶液中只含Fe2+。
2 2
17.【2012年高考浙江卷】水溶液X中只可能溶有K+、Mg2+、Al3+、 、 、 、 中的
若干种离子。某同学对该溶有进行了如下实验:下列判断正确的是( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、 和 一定存在于溶液X中
D. 和 一定不存在于溶液X中
【答案】C
【解析】溶液中加入过量盐酸后有沉淀和气体生成,说明原溶液中至少含有CO2-、SO 2-中的一种,一定
3 3
含有SiO2-,一定不存在Al3+和Mg2+,一定存在K+,可能存在AlO2-、SO 2-,当所得溶液继续加氨
3 4
水时产生沉淀,说明有Al3+存在,而该Al3+是由AlO2-与过量盐酸反应而转变所得,所以,C项正确,
D项错误。若CO2-、SO 2-同时存在,则气体是一种混合物,A项错误;溶液中一定不含有Mg2+,B
3 3
项错误;
18.【2016年高考上海卷】已知:SO 2-+I +H O→SO 2-+2I-+2H+。某溶液中可能含有 Na+、NH +、Fe2+、
3 2 2 4 4
K+、I-、SO 2- 、SO 2-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。
3 4
下列关于该溶液的判断正确的是
A.肯定不含I- B.肯定不含SO 2-
4
C.肯定含有SO 2- D.肯定含有NH +
3 4
【答案】BC
【解析】溶液本身无色,说明没有Fe2+。加入溴水仍然无色,说明溴水发生了反应,且产物无色,I-和
SO 2-均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I 生成,则原溶液中一定有SO 2
3 2 3
-。由于SO 2-的还原性比I-强,故I-是否存在无法判断。因所有离子浓度相等,则根据电荷守恒可判
3
断SO 2-肯定没有。故选BC。
4