文档内容
SS202601 A
高三化学
注意事项:
1.答题前,务必将自己的个人信息填写在答题卡上,并将条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干
净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。
可能用到的相对原子质量:H1C12N14016Na23Cl35.5 Cu64
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.中国传统节日是传承中华文化的重要载体,传统节日多通过具体的物质形式进行展现。下列有关中国传
统节日使用物质的说法错误的是
A.春节——鞭炮中的火药爆炸时,木炭为还原剂,硫黄、硝酸钾为氧化剂
B.端午节——粽子由糯米等制成,糯米中的淀粉可发生水解反应
C.中秋节——月饼的原料淀粉、糖、油脂均为有机高分子
D.重阳节——菊花酒中的乙醇具有挥发性
2.下列化学用语或图示表示正确的是
A.基态P原子的价电子轨道表示式:
B.用电子式表示HCl的形成过程:
C.乙烯的空间填充模型:
D.反-2-戊烯的结构简式:
3.实验安全是实验顺利开展的基础和保障,下列操作或做法不符合实验安全规范的是
A.少量钠着火时,迅速用湿抹布盖灭
B.浓硫酸与蔗糖反应的“黑面包”实验须开启通风设备
C.氯水要密封于棕色细口玻璃瓶中,且放置在阴凉处
D.粗铜电解精炼实验中,杜绝湿手操作
4.加热条件下甲烷可还原 CuO:CH +CuO→CO +H O+Cu(未配平)设 N 表示阿伏加德罗常数的值,下列有
4 2 2 A
关说法正确的是
A.11.2LCH 中含有的共用电子对数为2N
4 A
B.8.0gCuO中含有的阳离子数为0.2N
A
学科网(北京)股份有限公司C.3.6gH O中含有的σ键数为0.4N
2 A
D.生成1molCu转移的电子数为8N
A
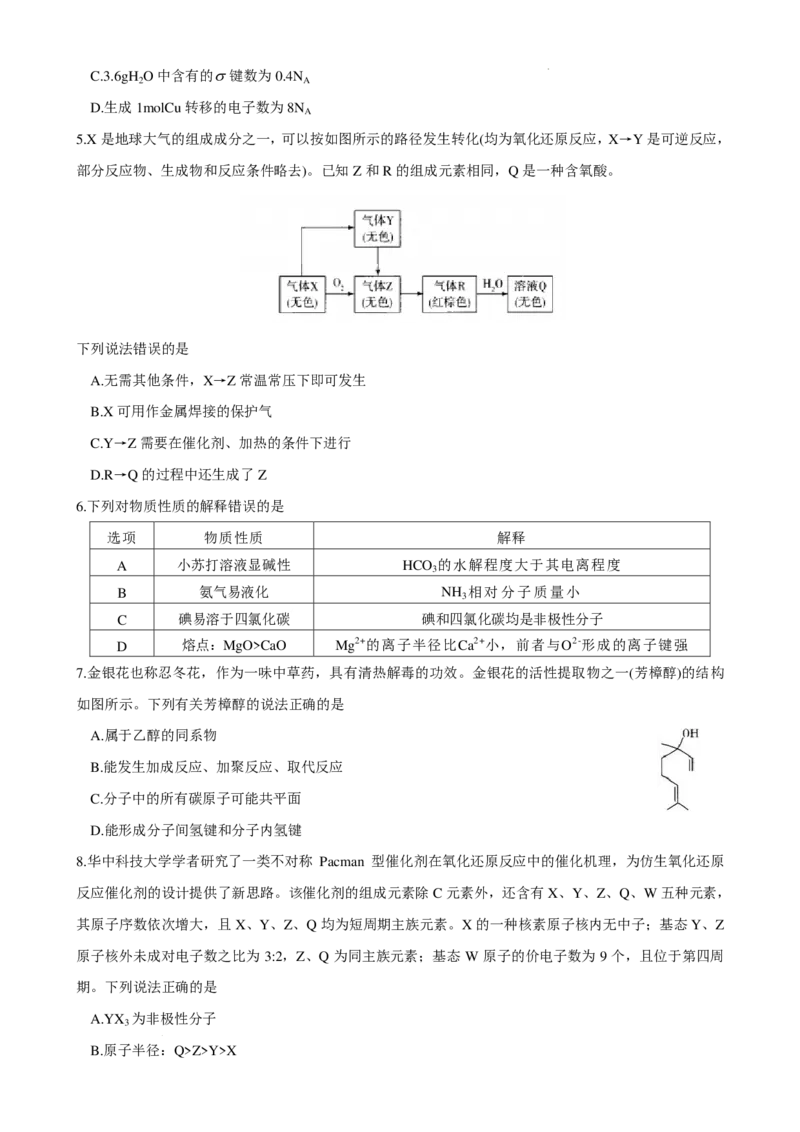
5.X是地球大气的组成成分之一,可以按如图所示的路径发生转化(均为氧化还原反应,X→Y是可逆反应,
部分反应物、生成物和反应条件略去)。已知Z和R的组成元素相同,Q是一种含氧酸。
下列说法错误的是
A.无需其他条件,X→Z常温常压下即可发生
B.X可用作金属焊接的保护气
C.Y→Z需要在催化剂、加热的条件下进行
D.R→Q的过程中还生成了Z
6.下列对物质性质的解释错误的是
选项 物质性质 解释
A 小苏打溶液显碱性 HCO 的水解程度大于其电离程度
3
B 氨气易液化 NH 相对分子质量小
3
C 碘易溶于四氯化碳 碘和四氯化碳均是非极性分子
D 熔点:MgO>CaO Mg2+的离子半径比Ca2+小,前者与O2-形成的离子键强
7.金银花也称忍冬花,作为一味中草药,具有清热解毒的功效。金银花的活性提取物之一(芳樟醇)的结构
如图所示。下列有关芳樟醇的说法正确的是
A.属于乙醇的同系物
B.能发生加成反应、加聚反应、取代反应
C.分子中的所有碳原子可能共平面
D.能形成分子间氢键和分子内氢键
8.华中科技大学学者研究了一类不对称 Pacman 型催化剂在氧化还原反应中的催化机理,为仿生氧化还原
反应催化剂的设计提供了新思路。该催化剂的组成元素除C元素外,还含有X、Y、Z、Q、W五种元素,
其原子序数依次增大,且X、Y、Z、Q均为短周期主族元素。X的一种核素原子核内无中子;基态Y、Z
原子核外未成对电子数之比为 3:2,Z、Q 为同主族元素;基态 W 原子的价电子数为 9 个,且位于第四周
期。下列说法正确的是
A.YX 为非极性分子
3
B.原子半径:Q>Z>Y>X
学科网(北京)股份有限公司C.
[
W
(
X Z
) ]2+中含共价健、自配位键、氢键等化学键
2 4
D.第一电离能:1>Z>Q
9.某同学学过“糖类”知识后,在老师的指导下设计如图所示实验,探究葡萄糖的性质。红色石蕊试纸
下列说法错误的是
A.①~③过程中Ag+最终转化为[Ag(NH ) ]+
3 2
B.⑥中产生的气体可使红色石蕊试纸变蓝
C.葡萄糖中的还原性官能团醛基、羟基都能还原[Ag(NH ) ]+
3 2
D.在上述转化中N元素的化合价未发生变化
10.中国科学院上海光学精密机械研究所在稀土磷酸盐玻璃局域结构方面取得进展,研究进一步通过多维固
态核磁共振技术,解析Sc O −xKPO 玻璃中31P、45Sc与39K 的局域结构,该玻璃中相关原子(离子)相
2 3 3
互之间的连接及空间分布关系如图所示。下列说法正确的是
A.KPO 焰色为紫色,产生的原因与原子核外电子跃迁吸收能量有关
3
B.Sc O −xKPO 玻璃中Sc3+的配位数为6
2 3 3
C.31P、45Sc的中子数相同
D.基态氧原子核外电子有8种空间运动状态
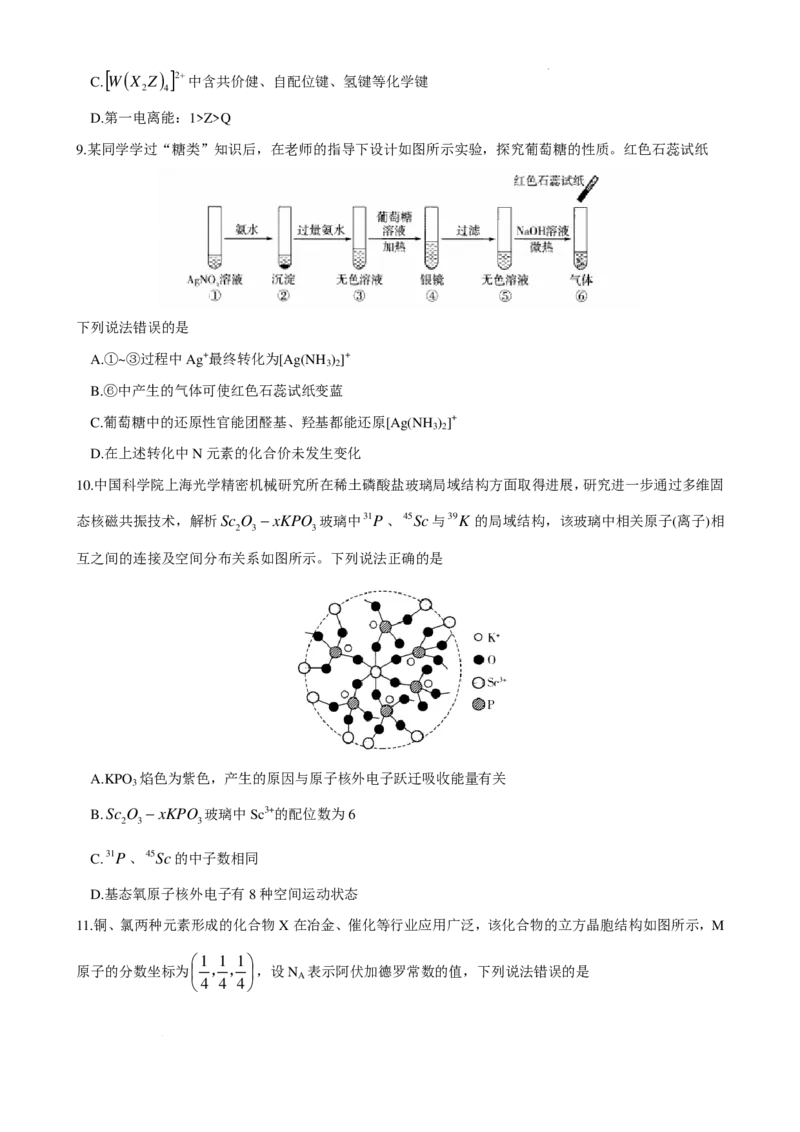
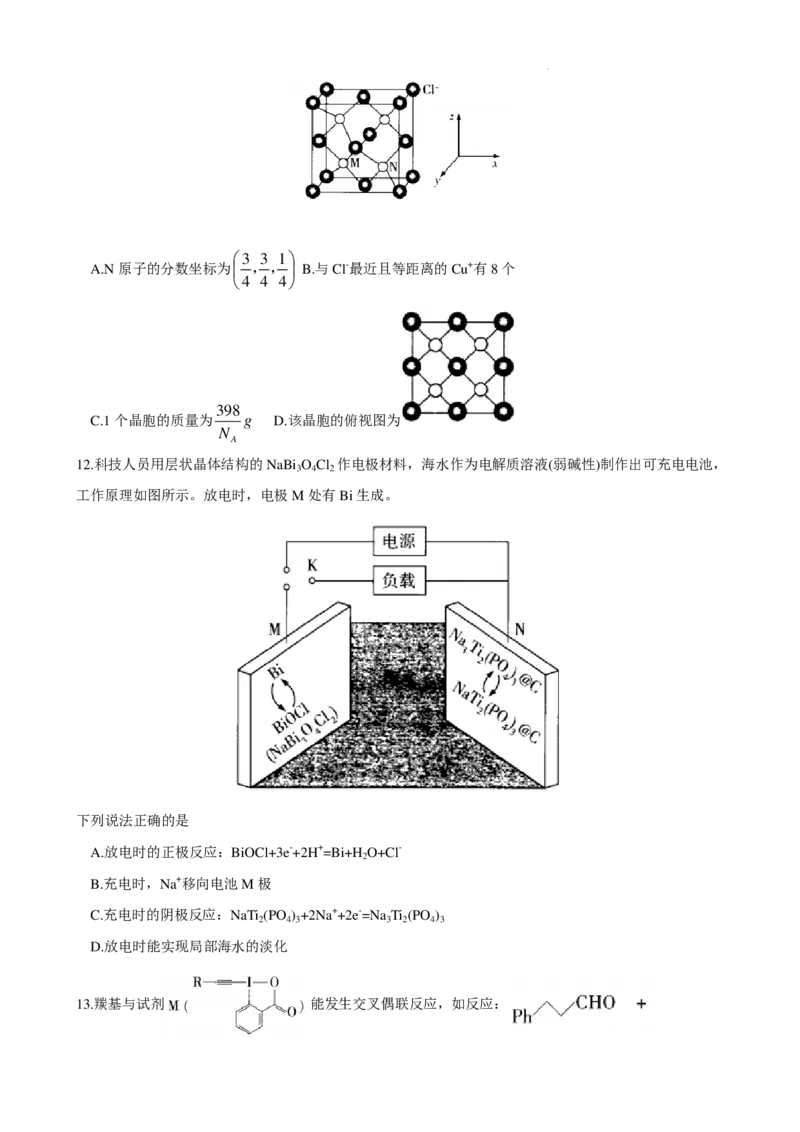
11.铜、氯两种元素形成的化合物X在冶金、催化等行业应用广泛,该化合物的立方晶胞结构如图所示,M
1 1 1
原子的分数坐标为 ,,,设N 表示阿伏加德罗常数的值,下列说法错误的是
A
4 4 4
学科网(北京)股份有限公司3 3 1
A.N原子的分数坐标为 ,, B.与Cl-最近且等距离的Cu+有8个
4 4 4
398
C.1个晶胞的质量为 g D.该晶胞的俯视图为
N
A
12.科技人员用层状晶体结构的NaBi O Cl 作电极材料,海水作为电解质溶液(弱碱性)制作出可充电电池,
3 4 2
工作原理如图所示。放电时,电极M处有Bi生成。
下列说法正确的是
A.放电时的正极反应:BiOCl+3e-+2H+=Bi+H O+Cl-
2
B.充电时,Na+移向电池M极
C.充电时的阴极反应:NaTi (PO ) +2Na++2e-=Na Ti (PO )
2 4 3 3 2 4 3
D.放电时能实现局部海水的淡化
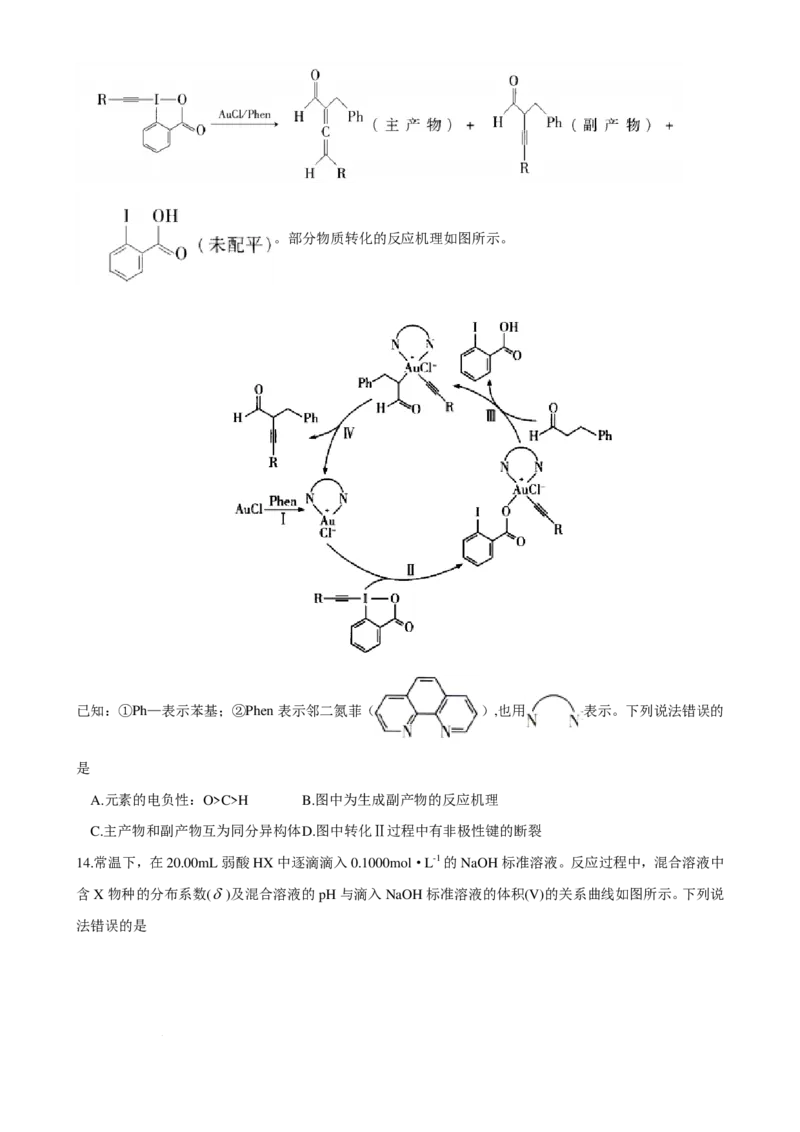
13.羰基与试剂 能发生交叉偶联反应,如反应:
学科网(北京)股份有限公司。部分物质转化的反应机理如图所示。
已知:①Ph—表示苯基;②Phen表示邻二氮菲( ),也用 表示。下列说法错误的
是
A.元素的电负性:O>C>H B.图中为生成副产物的反应机理
C.主产物和副产物互为同分异构体 D.图中转化Ⅱ过程中有非极性键的断裂
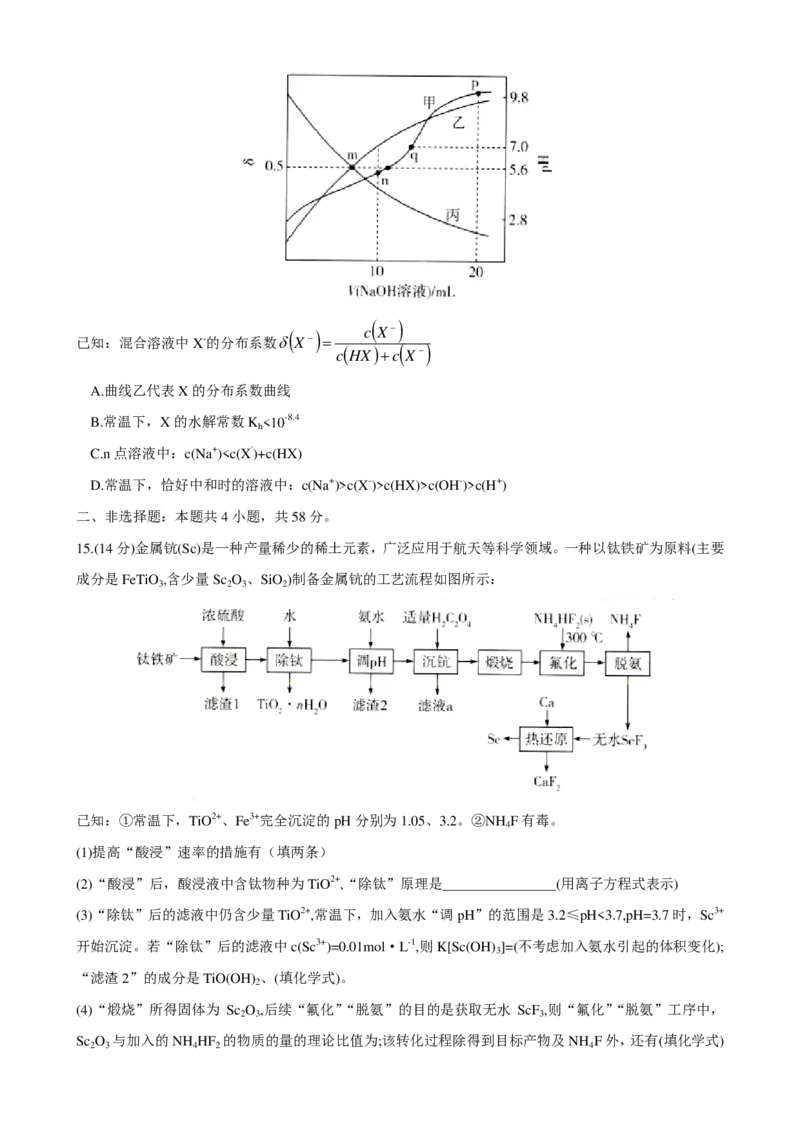
14.常温下,在20.00mL弱酸HX中逐滴滴入0.1000mol·L-1的NaOH标准溶液。反应过程中,混合溶液中
含X物种的分布系数(δ)及混合溶液的pH与滴入NaOH标准溶液的体积(V)的关系曲线如图所示。下列说
法错误的是
学科网(北京)股份有限公司( )
( ) c X−
已知:混合溶液中X-的分布系数δX− =
c ( HX ) +c ( X− )
A.曲线乙代表X的分布系数曲线
B.常温下,X的水解常数K <10-8.4
h
C.n点溶液中:c(Na+)c(X-)>c(HX)>c(OH-)>c(H+)
二、非选择题:本题共4小题,共58分。
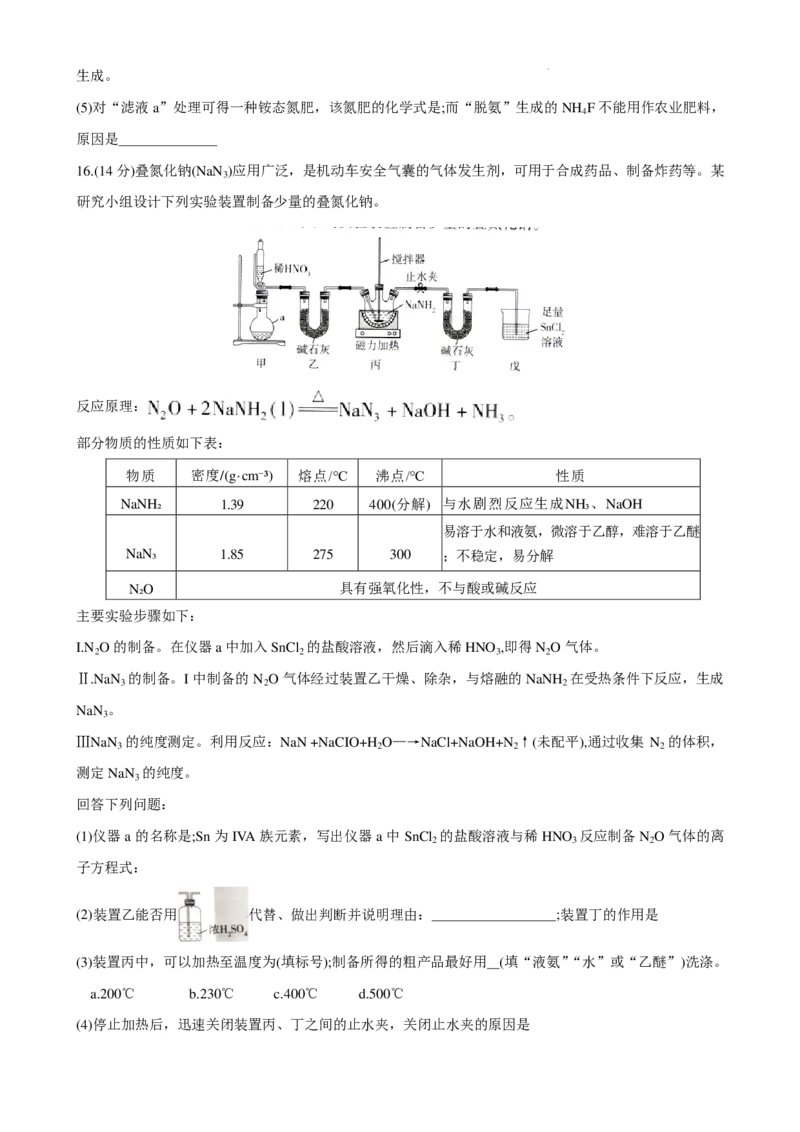
15.(14分)金属钪(Sc)是一种产量稀少的稀土元素,广泛应用于航天等科学领域。一种以钛铁矿为原料(主要
成分是FeTiO ,含少量Sc O 、SiO )制备金属钪的工艺流程如图所示:
3 2 3 2
已知:①常温下,TiO2+、Fe3+完全沉淀的pH分别为1.05、3.2。②NH F有毒。
4
(1)提高“酸浸”速率的措施有(填两条)
(2)“酸浸”后,酸浸液中含钛物种为TiO2+,“除钛”原理是 (用离子方程式表示)
(3)“除钛”后的滤液中仍含少量TiO2+,常温下,加入氨水“调pH”的范围是3.2≤pH<3.7,pH=3.7时,Sc3+
开始沉淀。若“除钛”后的滤液中c(Sc3+)=0.01mol·L-1,则K[Sc(OH) ]=(不考虑加入氨水引起的体积变化);
3
“滤渣2”的成分是TiO(OH) 、(填化学式)。
2
(4)“煅烧”所得固体为 Sc O ,后续“氟化”“脱氨”的目的是获取无水 ScF ,则“氟化”“脱氨”工序中,
2 3 3
Sc O 与加入的NH HF 的物质的量的理论比值为;该转化过程除得到目标产物及NH F外,还有(填化学式)
2 3 4 2 4
学科网(北京)股份有限公司生成。
(5)对“滤液a”处理可得一种铵态氮肥,该氮肥的化学式是;而“脱氨”生成的NH F不能用作农业肥料,
4
原因是
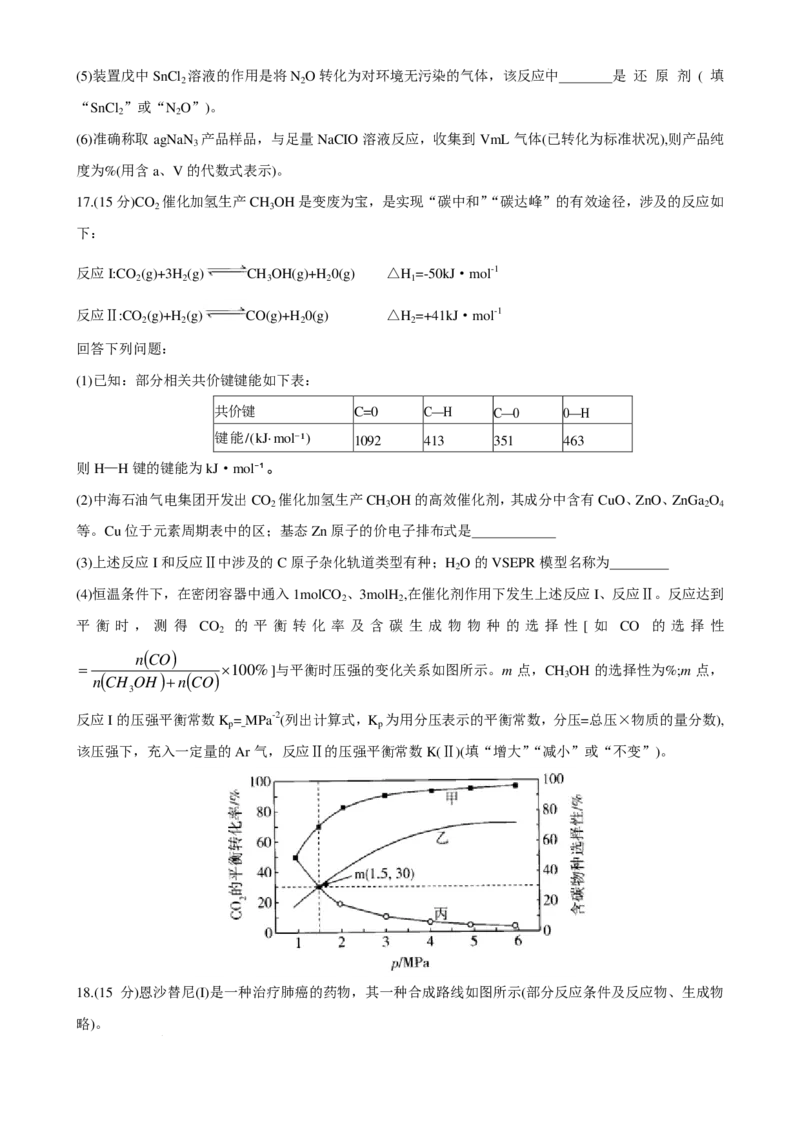
16.(14分)叠氮化钠(NaN )应用广泛,是机动车安全气囊的气体发生剂,可用于合成药品、制备炸药等。某
3
研究小组设计下列实验装置制备少量的叠氮化钠。
反应原理:
部分物质的性质如下表:
物质 密度/(g·cm⁻³) 熔点/℃ 沸点/℃ 性质
NaNH₂ 1.39 220 400(分解) 与水剧烈反应生成NH₃、NaOH
易溶于水和液氨,微溶于乙醇,难溶于乙醚
NaN₃ 1.85 275 300 ;不稳定,易分解
N₂O 具有强氧化性,不与酸或碱反应
主要实验步骤如下:
I.N O的制备。在仪器a中加入SnCl 的盐酸溶液,然后滴入稀HNO ,即得N O气体。
2 2 3 2
Ⅱ.NaN 的制备。I中制备的 N O气体经过装置乙干燥、除杂,与熔融的NaNH 在受热条件下反应,生成
3 2 2
NaN 。
3
ⅢNaN 的纯度测定。利用反应:NaN₃+NaCIO+H O—→NaCl+NaOH+N ↑(未配平),通过收集 N 的体积,
3 2 2 2
测定NaN 的纯度。
3
回答下列问题:
(1)仪器a的名称是;Sn为IVA族元素,写出仪器a中SnCl 的盐酸溶液与稀HNO 反应制备N O气体的离
2 3 2
子方程式:
(2)装置乙能否用 代替、做出判断并说明理由: ;装置丁的作用是
(3)装置丙中,可以加热至温度为(填标号);制备所得的粗产品最好用 (填“液氨”“水”或“乙醚”)洗涤。
a.200℃ b.230℃ c.400℃ d.500℃
(4)停止加热后,迅速关闭装置丙、丁之间的止水夹,关闭止水夹的原因是
学科网(北京)股份有限公司(5)装置戊中SnCl 溶液的作用是将N O转化为对环境无污染的气体,该反应中 是 还 原 剂( 填
2 2
“SnCl ”或“N O”)。
2 2
(6)准确称取 agNaN 产品样品,与足量 NaCIO 溶液反应,收集到 VmL 气体(已转化为标准状况),则产品纯
3
度为%(用含a、V的代数式表示)。
17.(15分)CO 催化加氢生产CH OH是变废为宝,是实现“碳中和”“碳达峰”的有效途径,涉及的反应如
2 3
下:
反应I:CO (g)+3H (g) CH OH(g)+H 0(g) △H =-50kJ·mol-1
2 2 3 2 1
反应Ⅱ:CO (g)+H (g) CO(g)+H 0(g) △H =+41kJ·mol-1
2 2 2 2
回答下列问题:
(1)已知:部分相关共价键键能如下表:
共价键 C=0 C—H C—0 0—H
键能/(kJ·mol⁻¹)
1092 413 351 463
则H—H键的键能为kJ·mol⁻¹。
(2)中海石油气电集团开发出CO 催化加氢生产CH OH的高效催化剂,其成分中含有CuO、ZnO、ZnGa O
2 3 2 4
等。Cu位于元素周期表中的区;基态Zn原子的价电子排布式是
(3)上述反应I和反应Ⅱ中涉及的C原子杂化轨道类型有种;H O的VSEPR模型名称为
2
(4)恒温条件下,在密闭容器中通入1molCO 、3molH ,在催化剂作用下发生上述反应I、反应Ⅱ。反应达到
2 2
平 衡 时 , 测 得 CO 的 平 衡 转 化 率 及 含 碳 生 成 物 物 种 的 选 择 性 [ 如 CO 的 选 择 性
2
( )
n CO
= ×100%]与平衡时压强的变化关系如图所示。m 点,CH OH 的选择性为%;m 点,
( ) ( ) 3
n CH OH +n CO
3
反应I的压强平衡常数K = MPa-2(列出计算式,K 为用分压表示的平衡常数,分压=总压×物质的量分数),
p p
该压强下,充入一定量的Ar气,反应Ⅱ的压强平衡常数K(Ⅱ)(填“增大”“减小”或“不变”)。
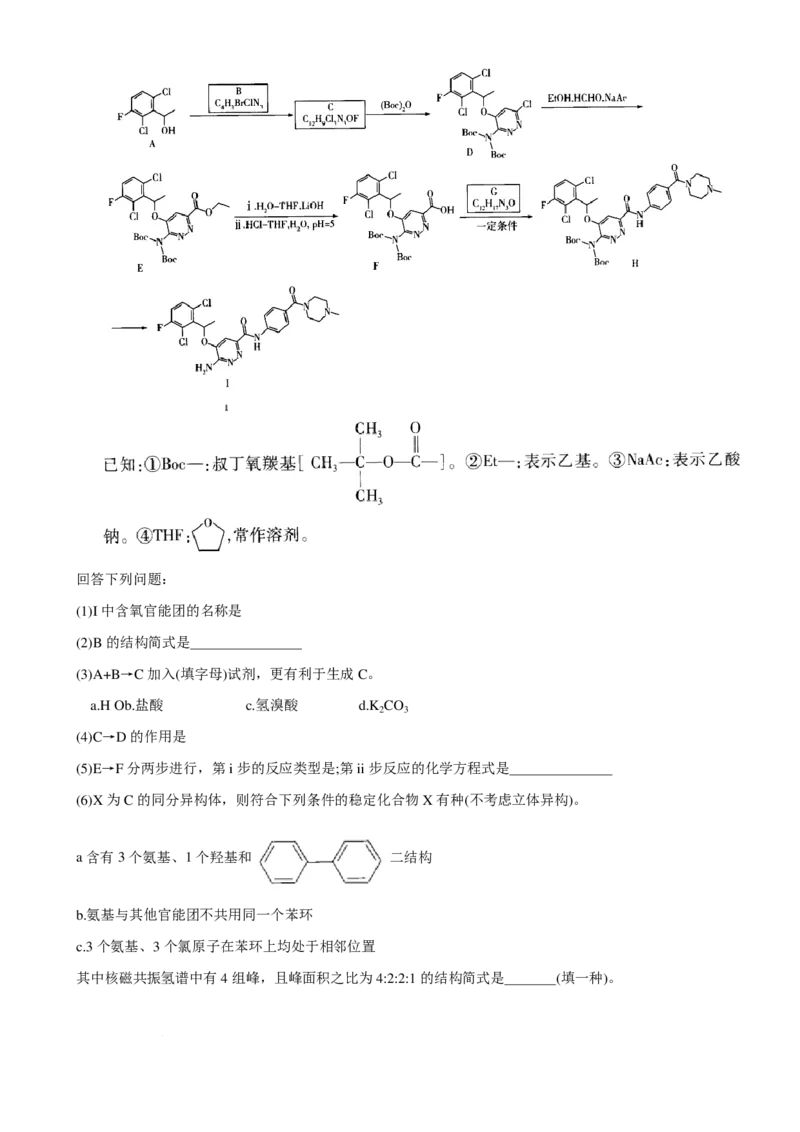
18.(15 分)恩沙替尼(I)是一种治疗肺癌的药物,其一种合成路线如图所示(部分反应条件及反应物、生成物
略)。
学科网(北京)股份有限公司回答下列问题:
(1)I中含氧官能团的名称是
(2)B的结构简式是
(3)A+B→C加入(填字母)试剂,更有利于生成C。
a.H₃Ob.盐酸 c.氢溴酸 d.K CO
2 3
(4)C→D的作用是
(5)E→F分两步进行,第i步的反应类型是;第ii步反应的化学方程式是
(6)X为C的同分异构体,则符合下列条件的稳定化合物X有种(不考虑立体异构)。
a含有3个氨基、1个羟基和 二结构
b.氨基与其他官能团不共用同一个苯环
c.3个氨基、3个氯原子在苯环上均处于相邻位置
其中核磁共振氢谱中有4组峰,且峰面积之比为4:2:2:1的结构简式是 (填一种)。
学科网(北京)股份有限公司