文档内容
专题 15 物质结构与性质综合题
考点 命题趋势
在当前的旧高考中,"物质结构与性质"属于选择性考试内容,以综合性客观题形式出
现,随着新课程的落实,"物质结构与性质"已成为选择性必修课程,将成为新高考的
必考内容,在新高考中,部分卷区不再设置"物质结构与性质"综合题,而是将其考查
分散到选择题和其他综合题当中。纵观近年来高考真题,物质结构与性质综合题基本
考点1 物质结构 上考的都是最基本、最典型、最主干的知识点。以下是高考时时常考的知识点:原子
与性质综合题 结构与元素的性质方面,如原子电子排布式,元素原子的性质;化学键与物质的性质
方面,如杂化轨道类型,分子(离子)空间构型;分子间作用力与物质的性质方面;如
晶胞判断与计算。试题均建构在以教材为主的中学化学基础知识之上,没有偏离教材
体系和考试说明的要求, 试题基本保持稳定。试卷并不能把所有的知识面全部覆盖,
也不能保证重要知识点可能反复出现。
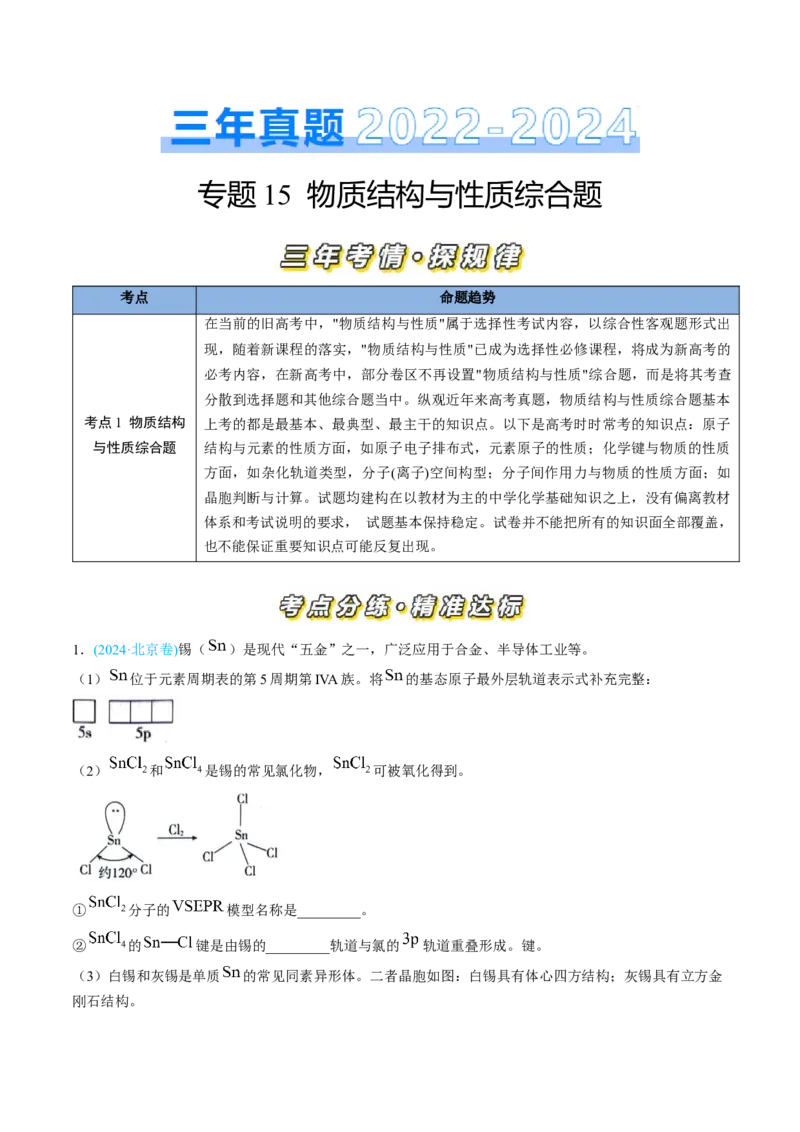
1.(2024·北京卷)锡( )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1) 位于元素周期表的第5周期第IVA族。将 的基态原子最外层轨道表示式补充完整:
(2) 和 是锡的常见氯化物, 可被氧化得到。
① 分子的 模型名称是_________。
② 的 键是由锡的_________轨道与氯的 轨道重叠形成。键。
(3)白锡和灰锡是单质 的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金
刚石结构。①灰锡中每个 原子周围与它最近且距离相等的 原子有_________个。
②若白锡和灰锡的晶胞体积分别为 和 ,则白锡和灰锡晶体的密度之比是_________。
(4)单质 的制备:将 与焦炭充分混合后,于惰性气氛中加热至 ,由于固体之间反应慢,
未明显发生反应。若通入空气在 下, 能迅速被还原为单质 ,通入空气的作用是
_________________________________________________________________________________。
2. (2024·浙江卷6月)氧是构建化合物的重要元素。请回答:
(1)某化合物的晶胞如图1, 的配位数(紧邻的阳离子数)为_______;写出该化合物的化学式_______,
写出该化合物与足量 溶液反应的化学方程式_______。
(2)下列有关单核微粒的描述正确的是_______。
A. 的基态原子电子排布方式只有一种
B. 的第二电离能 的第一电离能
C. 的基态原子简化电子排布式为
D. 原子变成 ,优先失去 轨道上 的电子
(3)化合物 和 的结构如图2。
① 和 中羟基与水均可形成氢键( ),按照氢键由强到弱对三种酸排序_______,
请说明理由_______。
②已知 、 钠盐的碱性 ,请从结构角度说明理由_______。
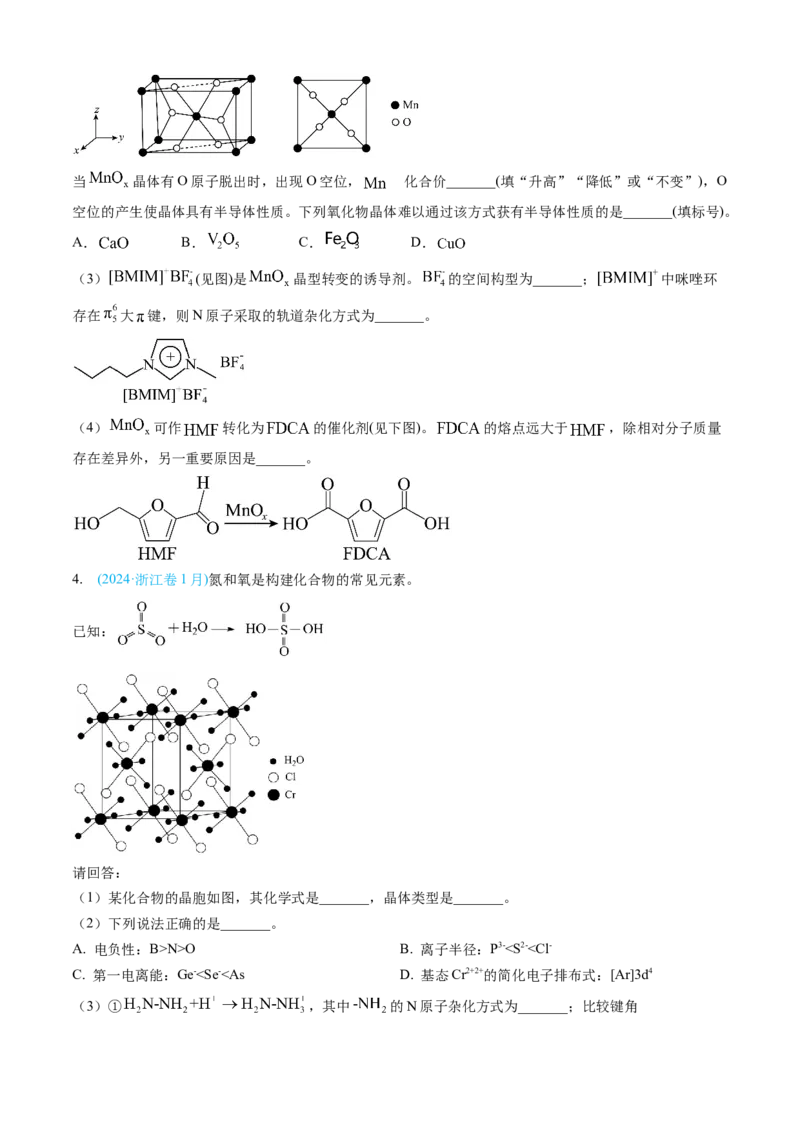
3. (2024·山东卷)锰氧化物具有较大应用价值,回答下列问题:
(1) 在元素周期表中位于第_______周期_______族;同周期中,基态原子未成对电子数比 多的
元素是_______(填元素符号)。
(2) 如某种氧化物 的四方晶胞及其在xy平面的投影如图所示,该氧化物化学式为_______。当 晶体有O原子脱出时,出现O空位, 的化合价_______(填“升高”“降低”或“不变”),O
空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是_______(填标号)。
A. B. C. D.
(3) (见图)是 晶型转变的诱导剂。 的空间构型为_______; 中咪唑环
存在 大 键,则N原子采取的轨道杂化方式为_______。
(4) 可作 转化为 的催化剂(见下图)。 的熔点远大于 ,除相对分子质量
存在差异外,另一重要原因是_______。
4. (2024·浙江卷1月)氮和氧是构建化合物的常见元素。
已知:
请回答:
(1)某化合物的晶胞如图,其化学式是_______,晶体类型是_______。
(2)下列说法正确的是_______。
A. 电负性:B>N>O B. 离子半径:P3-”、“<”或“=”),请说明理由_______。
②将 与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。
比较氧化性强弱: _______ (填“>”、“<”或“=”);写出A中阴离子的结构式_______。
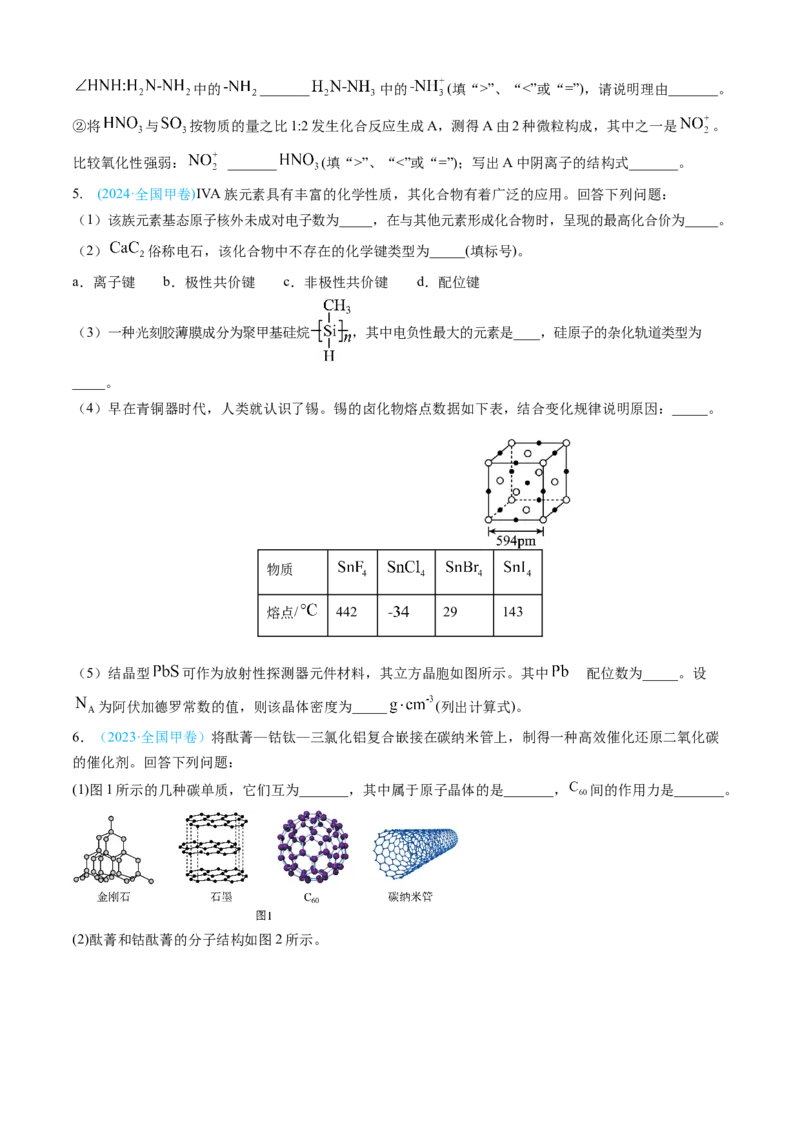
5. (2024·全国甲卷)ⅣA族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为_____,在与其他元素形成化合物时,呈现的最高化合价为_____。
(2) 俗称电石,该化合物中不存在的化学键类型为_____(填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷 ,其中电负性最大的元素是____,硅原子的杂化轨道类型为
_____。
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:_____。
物质
熔点/ 442 29 143
(5)结晶型 可作为放射性探测器元件材料,其立方晶胞如图所示。其中 配的位数为_____。设
为阿伏加德罗常数的值,则该晶体密度为_____ (列出计算式)。
6.(2023·全国甲卷)将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳
的催化剂。回答下列问题:
(1)图1所示的几种碳单质,它们互为_______,其中属于原子晶体的是_______, 间的作用力是_______。
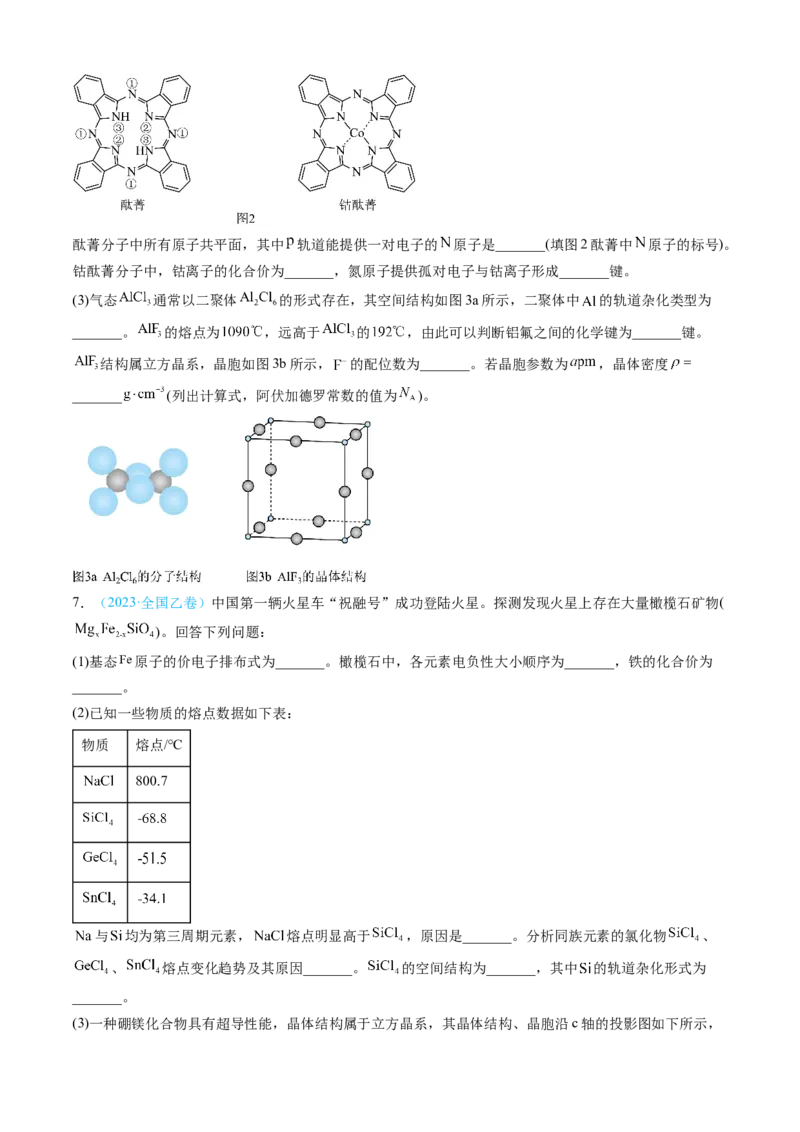
(2)酞菁和钴酞菁的分子结构如图2所示。酞菁分子中所有原子共平面,其中 轨道能提供一对电子的 原子是_______(填图2酞菁中 原子的标号)。
钴酞菁分子中,钴离子的化合价为_______,氮原子提供孤对电子与钴离子形成_______键。
(3)气态 通常以二聚体 的形式存在,其空间结构如图3a所示,二聚体中 的轨道杂化类型为
_______。 的熔点为 ,远高于 的 ,由此可以判断铝氟之间的化学键为_______键。
结构属立方晶系,晶胞如图3b所示, 的配位数为_______。若晶胞参数为 ,晶体密度
_______ (列出计算式,阿伏加德罗常数的值为 )。
7.(2023·全国乙卷)中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(
)。回答下列问题:
(1)基态 原子的价电子排布式为_______。橄榄石中,各元素电负性大小顺序为_______,铁的化合价为
_______。
(2)已知一些物质的熔点数据如下表:
物质 熔点/℃
800.7
与 均为第三周期元素, 熔点明显高于 ,原因是_______。分析同族元素的氯化物 、
、 熔点变化趋势及其原因_______。 的空间结构为_______,其中 的轨道杂化形式为
_______。
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有_______个 。该物质化学式为_______,B-B最近距离为_______。
8.(2023·山东卷)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1) 时, 与冰反应生成 利 。常温常压下, 为无色气休,固态 的晶体类型为
_____, 水解反应的产物为_____(填化学式)。
(2) 中心原子为 , 中心原子为 ,二者均为 形结构,但 中存在大 键 。 中
原子的轨道杂化方式_____;为 键角_____ 键角(填“>”“ <”或“=”)。比较 与
中 键的键长并说明原因_____。
(3)一定条件下, 和 反应生成 和化合物 。已知 属于四方晶系,晶胞结构如图所示(晶胞
参数 ),其中 化合价为 。上述反应的化学方程式为_____。若阿伏加德罗常数
的值为 ,化合物 的密度 _____ (用含 的代数式表示)。
9.(2023·北京卷)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根 可看作是 中的
一个 原子被 原子取代的产物。
(1)基态 原子价层电子排布式是__________。
(2)比较 原子和 原子的第一电离能大小,从原子结构的角度说明理由:____________________。
(3) 的空间结构是__________。
(4)同位素示踪实验可证实 中两个 原子的化学环境不同,实验过程为
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
和 ,过程ⅱ含硫产物是__________。
(5) 的晶胞形状为长方体,边长分别为 、 ,结构如图所示。晶胞中的 个数为__________。已知 的摩尔质量是 ,阿伏加德罗常数
为 ,该晶体的密度为__________ 。
(6)浸金时, 作为配体可提供孤电子对与 形成 。分别判断 中的中心 原子和
端基 原子能否做配位原子并说明理由:____________________。
10.(2023年6月·浙江卷)氮的化合物种类繁多,应用广泛。
请回答:
(1)基态N原子的价层电子排布式是 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①下列说法不正确的是 。
A.能量最低的激发态N原子的电子排布式:
B.化学键中离子键成分的百分数:
C.最简单的氮烯分子式:
D.氮烷中N原子的杂化方式都是
②氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为 。
③给出 的能力: (填“>”或“<”),理由是 。
(3)某含氮化合物晶胞如图,其化学式为 ,每个阴离子团的配位数(紧邻的阳离子数)为
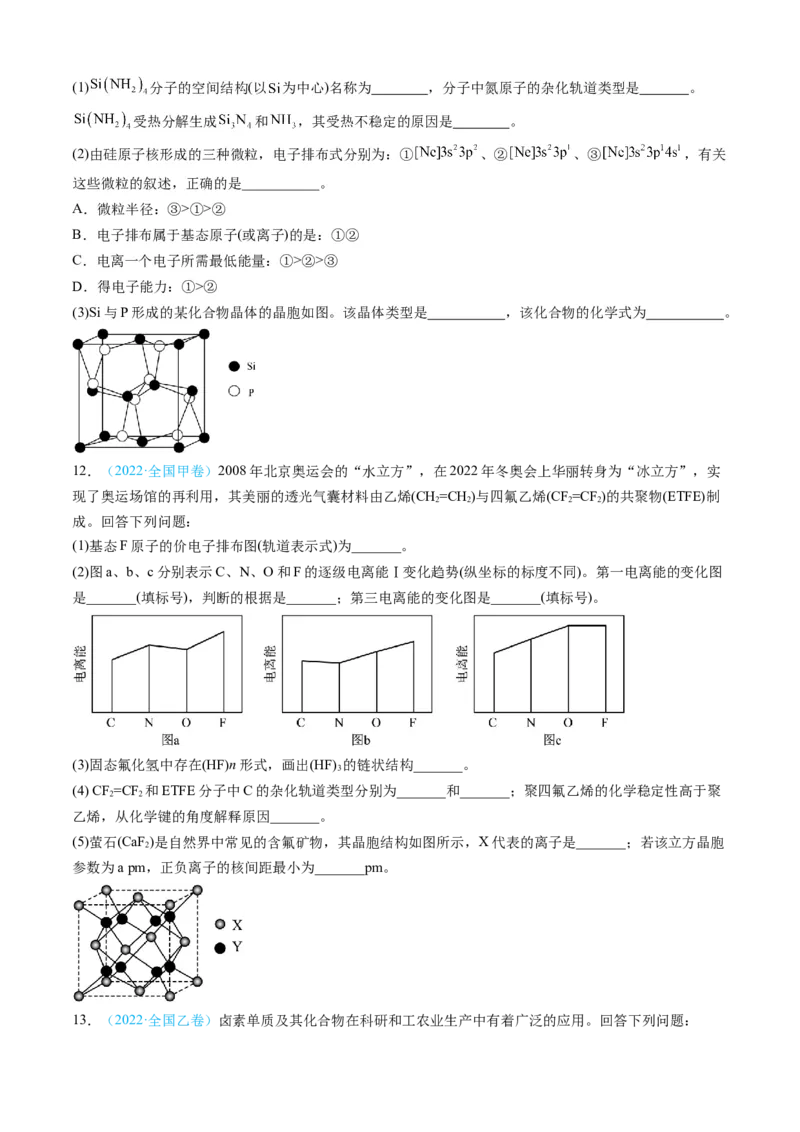
。
11.(2023年1月·浙江卷)硅材料在生活中占有重要地位。请回答:(1) 分子的空间结构(以 为中心)名称为 ,分子中氮原子的杂化轨道类型是 。
受热分解生成 和 ,其受热不稳定的原因是 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:① 、② 、③ ,有关
这些微粒的叙述,正确的是___________。
A.微粒半径:③>①>②
B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。
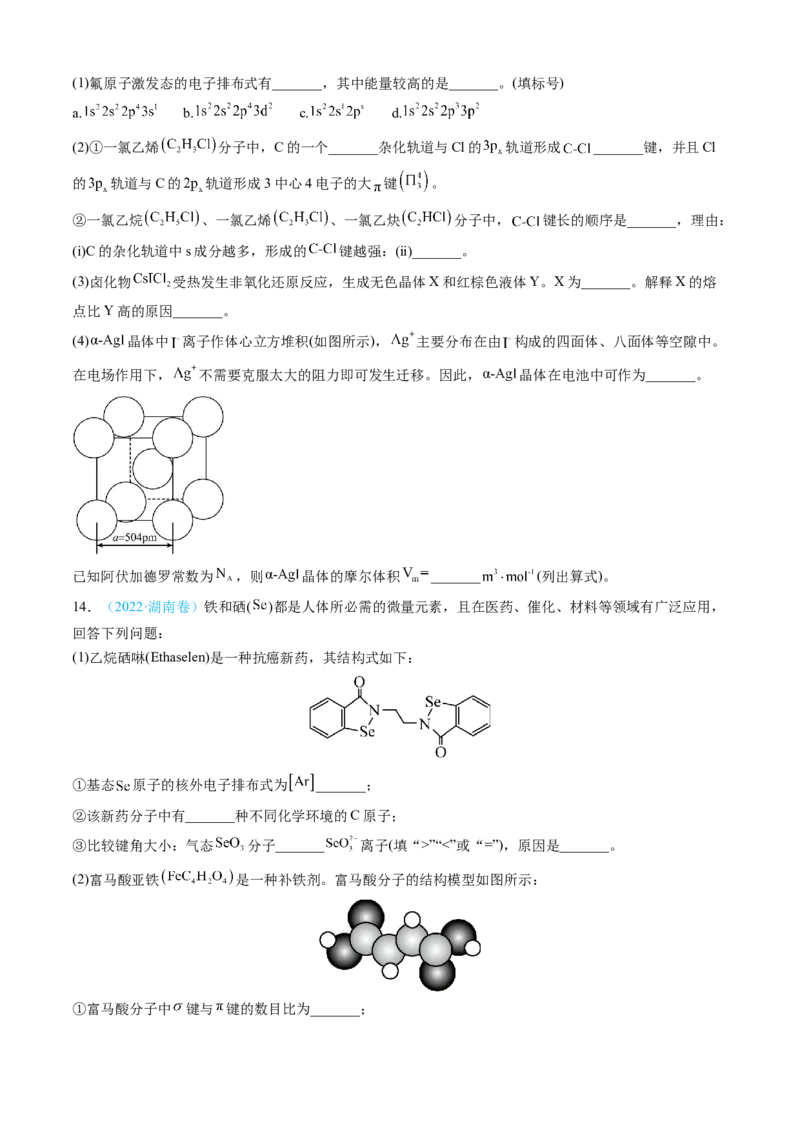
12.(2022·全国甲卷)2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实
现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH=CH )与四氟乙烯(CF=CF )的共聚物(ETFE)制
2 2 2 2
成。回答下列问题:
(1)基态F原子的价电子排布图(轨道表示式)为_______。
(2)图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图
是_______(填标号),判断的根据是_______;第三电离能的变化图是_______(填标号)。
(3)固态氟化氢中存在(HF)n形式,画出(HF) 的链状结构_______。
3
(4) CF =CF 和ETFE分子中C的杂化轨道类型分别为_______和_______;聚四氟乙烯的化学稳定性高于聚
2 2
乙烯,从化学键的角度解释原因_______。
(5)萤石(CaF )是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______;若该立方晶胞
2
参数为a pm,正负离子的核间距最小为_______pm。
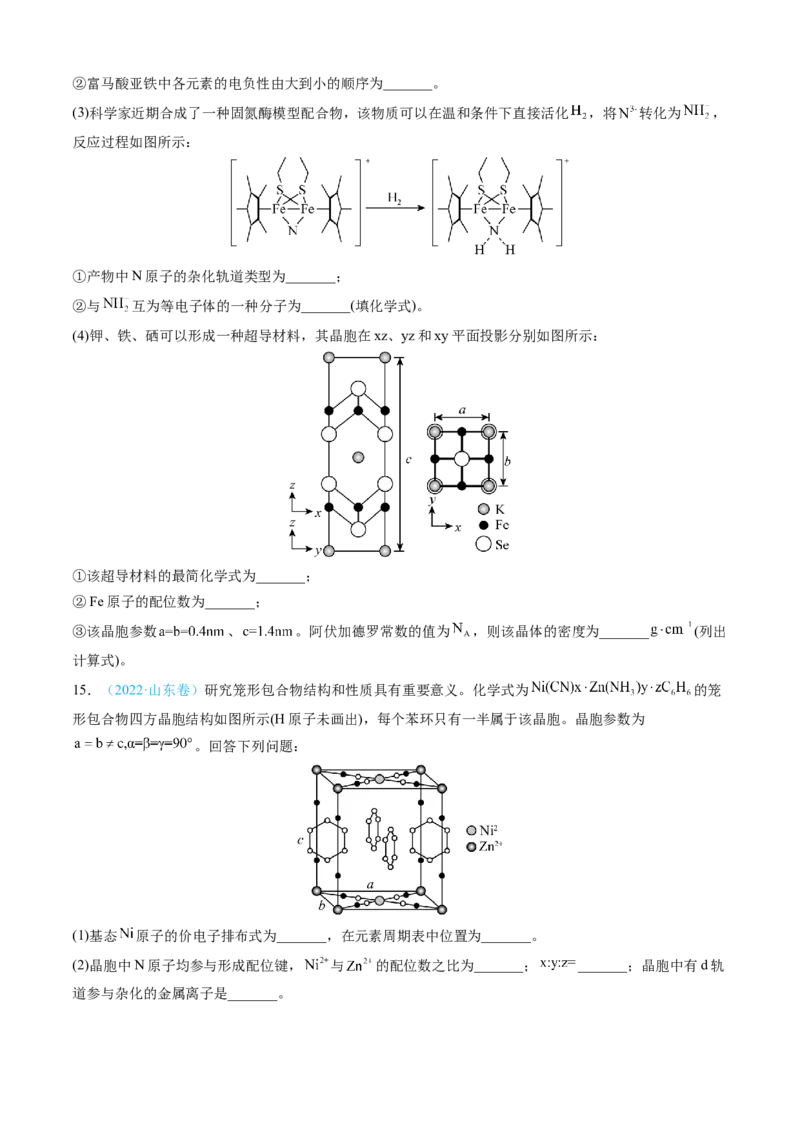
13.(2022·全国乙卷)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:(1)氟原子激发态的电子排布式有_______,其中能量较高的是_______。(填标号)
a. b. c. d.
(2)①一氯乙烯 分子中,C的一个_______杂化轨道与Cl的 轨道形成 _______键,并且Cl
的 轨道与C的 轨道形成3中心4电子的大 键 。
②一氯乙烷 、一氯乙烯 、一氯乙炔 分子中, 键长的顺序是_______,理由:
(ⅰ)C的杂化轨道中s成分越多,形成的 键越强:(ⅱ)_______。
(3)卤化物 受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为_______。解释X的熔
点比Y高的原因_______。
(4) 晶体中 离子作体心立方堆积(如图所示), 主要分布在由 构成的四面体、八面体等空隙中。
在电场作用下, 不需要克服太大的阻力即可发生迁移。因此, 晶体在电池中可作为_______。
已知阿伏加德罗常数为 ,则 晶体的摩尔体积 _______ (列出算式)。
14.(2022·湖南卷)铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,
回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 原子的核外电子排布式为 _______;
②该新药分子中有_______种不同化学环境的C原子;
③比较键角大小:气态 分子_______ 离子(填“>”“<”或“=”),原因是_______。
(2)富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中 键与 键的数目比为_______;②富马酸亚铁中各元素的电负性由大到小的顺序为_______。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将 转化为 ,
反应过程如图所示:
①产物中N原子的杂化轨道类型为_______;
②与 互为等电子体的一种分子为_______(填化学式)。
(4)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为_______;
②Fe原子的配位数为_______;
③该晶胞参数 、 。阿伏加德罗常数的值为 ,则该晶体的密度为_______ (列出
计算式)。
15.(2022·山东卷)研究笼形包合物结构和性质具有重要意义。化学式为 的笼
形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为
。回答下列问题:
(1)基态 原子的价电子排布式为_______,在元素周期表中位置为_______。
(2)晶胞中N原子均参与形成配位键, 与 的配位数之比为_______; _______;晶胞中有d轨
道参与杂化的金属离子是_______。(3)吡啶( )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的 大 键、则吡啶中N原
子的价层孤电子对占据_______(填标号)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
(4)在水中的溶解度,吡啶远大于苯,主要原因是①_______,②_______。
(5) 、 、 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是
_______。
16.(2022·北京卷) 失水后可转为 ,与 可联合制备铁粉精 和 。
I. 结构如图所示。
(1) 价层电子排布式为___________。
(2)比较 和 分子中的键角大小并给出相应解释:___________。
(3) 与 和 的作用分别为___________。
II. 晶胞为立方体,边长为 ,如图所示。
(4)①与 紧邻的阴离子个数为___________。
②晶胞的密度为 ___________ 。
(5)以 为燃料,配合 可以制备铁粉精 和 。结合图示解释可充分实现能源和
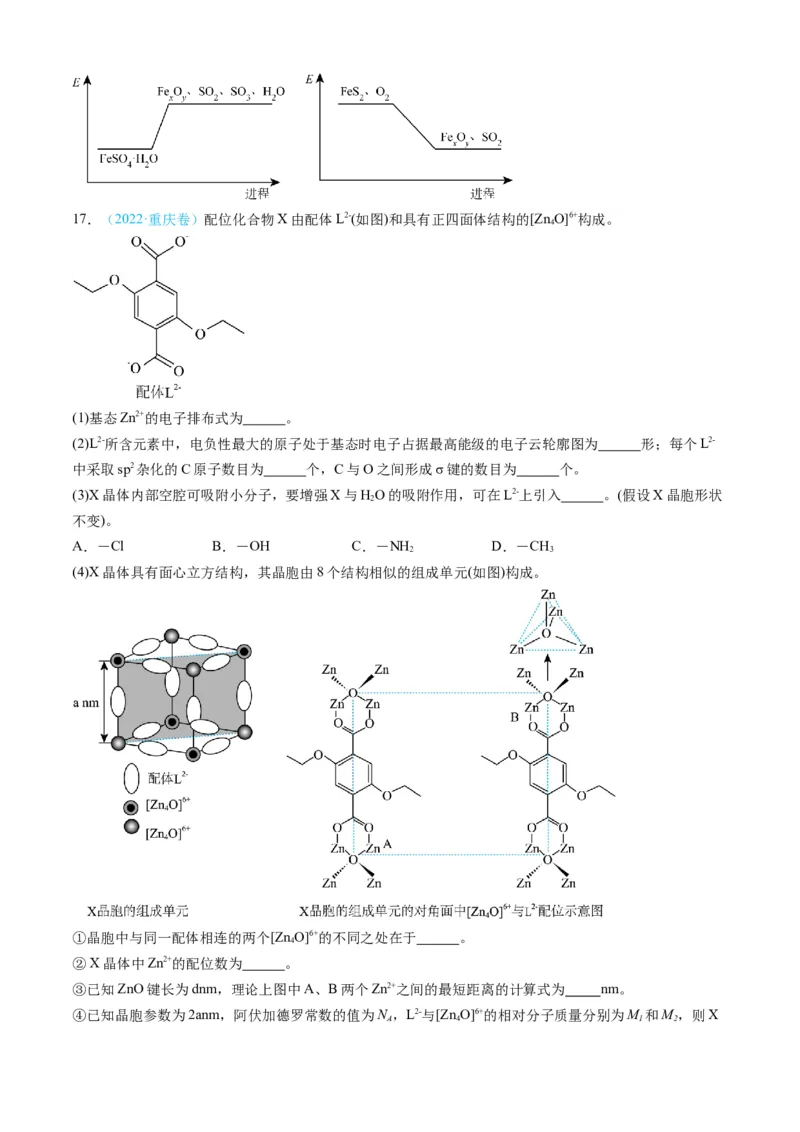
资源有效利用的原因为___________。17.(2022·重庆卷)配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn O]6+构成。
4
(1)基态Zn2+的电子排布式为 。
(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为 形;每个L2-
中采取sp2杂化的C原子数目为 个,C与O之间形成σ键的数目为 个。
(3)X晶体内部空腔可吸附小分子,要增强X与HO的吸附作用,可在L2-上引入 。(假设X晶胞形状
2
不变)。
A.-Cl B.-OH C.-NH D.-CH
2 3
(4)X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
①晶胞中与同一配体相连的两个[Zn O]6+的不同之处在于 。
4
②X晶体中Zn2+的配位数为 。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为 nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为N ,L2-与[Zn O]6+的相对分子质量分别为M 和M,则X
A 4 1 2的晶体密度为 g•cm-3(列出化简的计算式)。
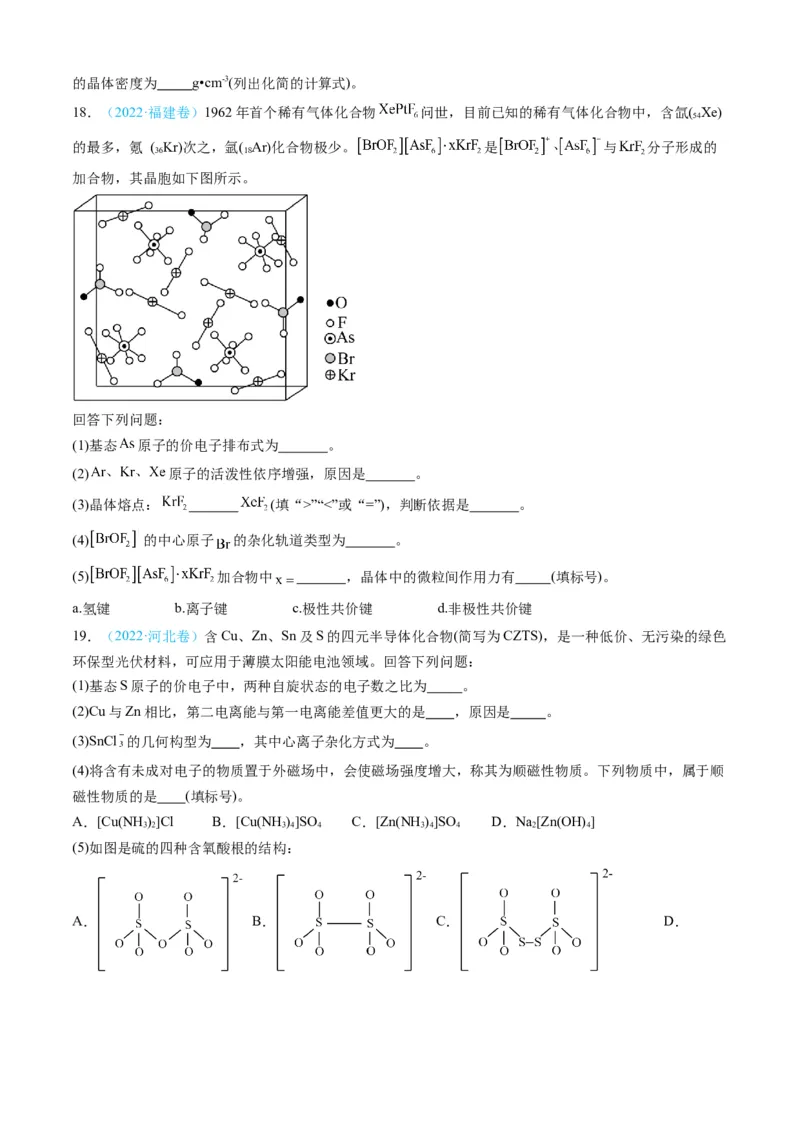
18.(2022·福建卷)1962年首个稀有气体化合物 问世,目前已知的稀有气体化合物中,含氙( Xe)
54
的最多,氪 ( Kr)次之,氩( Ar)化合物极少。 是 与 分子形成的
36 18
加合物,其晶胞如下图所示。
回答下列问题:
(1)基态 原子的价电子排布式为 。
(2) 原子的活泼性依序增强,原因是 。
(3)晶体熔点: (填“>”“<”或“=”),判断依据是 。
(4) 的中心原子 的杂化轨道类型为 。
(5) 加合物中 ,晶体中的微粒间作用力有 (填标号)。
a.氢键 b.离子键 c.极性共价键 d.非极性共价键
19.(2022·河北卷)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色
环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是 ,原因是 。
(3)SnCl 的几何构型为 ,其中心离子杂化方式为 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺
磁性物质的是 (填标号)。
A.[Cu(NH )]Cl B.[Cu(NH )]SO C.[Zn(NH )]SO D.Na[Zn(OH) ]
3 2 3 4 4 3 4 4 2 4
(5)如图是硫的四种含氧酸根的结构:
A. B. C. D.根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO 的是 (填标号),理由是 。
(6)如图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原
子的坐标为( , , ),则B原子的坐标为 。
20.(2022·海南卷)以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答
问题:
(1)基态O原子的电子排布式 ,其中未成对电子有 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是 。
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共
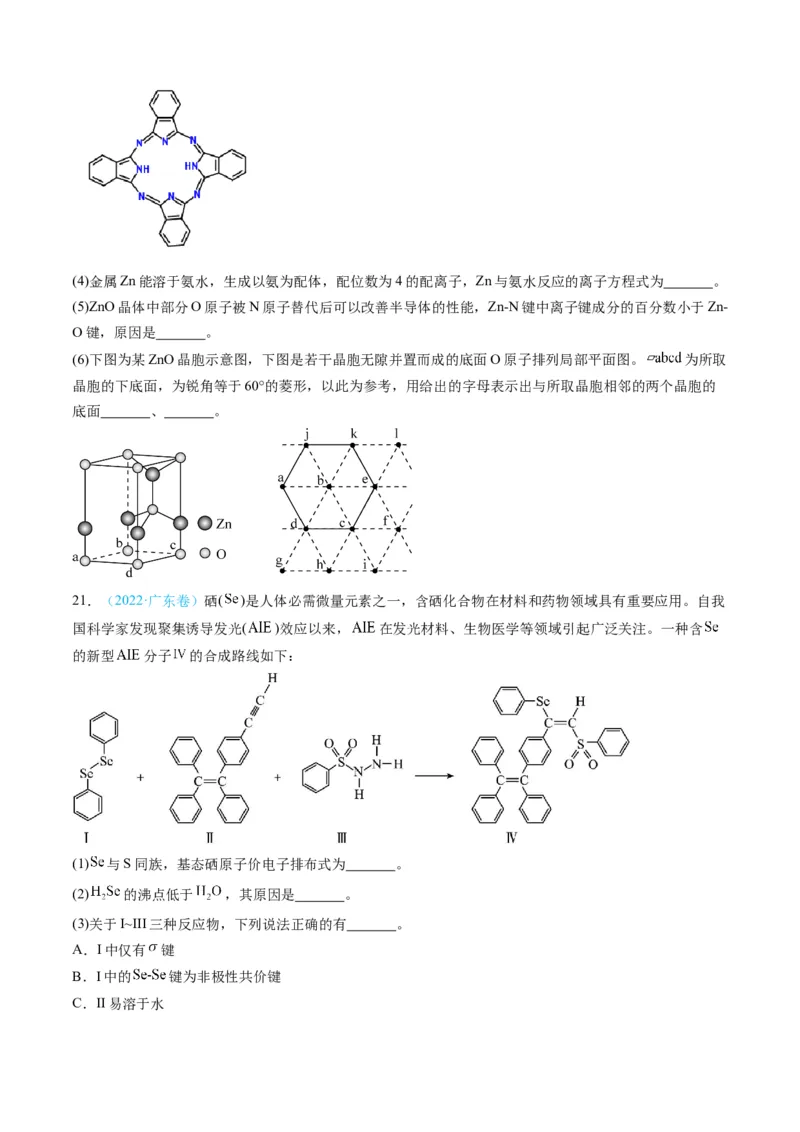
平面,所有N原子的杂化轨道类型相同,均采取 杂化。邻苯二甲酸酐( )和邻苯二甲酰
亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是 。(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-
O键,原因是 。
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取
晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的
底面 、 。
21.(2022·广东卷)硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我
国科学家发现聚集诱导发光( )效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
的新型 分子 的合成路线如下:
(1) 与S同族,基态硒原子价电子排布式为 。
(2) 的沸点低于 ,其原因是 。
(3)关于I~III三种反应物,下列说法正确的有 。
A.I中仅有 键
B.I中的 键为非极性共价键
C.II易溶于水D.II中原子的杂化轨道类型只有 与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有 。
(5)硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸
钠( )可减轻重金属铊引起的中毒。 的立体构型为 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速
新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿
x、y、z轴方向的投影均为图2。
①X的化学式为 。
②设X的最简式的式量为 ,晶体密度为 ,则X中相邻K之间的最短距离为 (列出计
算式, 为阿伏加德罗常数的值)。