文档内容
哈尔滨市第九中学 2024- -2025 学年度高三上学期期中考试
化学学科试卷
(考试时间: 90分钟满分100分) .
I卷选择题
可能用到的相对原子质量: H-1、 O-16、CI-35.5、 NI-59、 Mn-55、 Zn-65、
Ga-70、Ti-48
一、 单项选择题(本题包括20小题)
1.化学在科技和生活中扮演着重要的角色,下列说法错误的是
A.哈九中成人礼开幕式现场燃放的烟花,利用了金属单质的性质
B.9月25日我国发射的洲际导弹的外壳由多种材料组成,其中玻璃钢属于复合
材料
C.蛋白质是生命的基石,2024年诺贝尔化学奖表彰三位科学家关于“蛋白质结构
预测”和“计算蛋白质设计”的贡献
D.巴黎奥运会比赛中的杠铃,采用的弹簧钢材料“60Si2Mn"属于合金
2.下列化学用语正确的是
A Cl 原子的核外电子排布式: 1s22s22p5
B. Na O 的电子式:
2 2
C. Fe2+的价层电子轨道表示式:
D. Cu 的原子结构示意图:
3.下列关于物质的用途说法正确的是
A.碳酸纳能中和胃里过多的胃酸,缓解胃部不适
D. FeCl 溶液作“腐蚀液”将覆铜板上不需要的铜腐蚀
2
C漂白液可用作棉、 麻、纸张的漂白剂,也可用作泳池消毒剂
D铝制餐具日常生活中随处可见,通常用来蒸煮或存放所有食物
4.下列离子方程式书写错误的是
A.将Fe O 溶于氢碘酸中:
2 3
B. 泡沫灭火器原理:
C.用石灰乳制漂白粉:
D.工业冶炼镁的离子方程式:
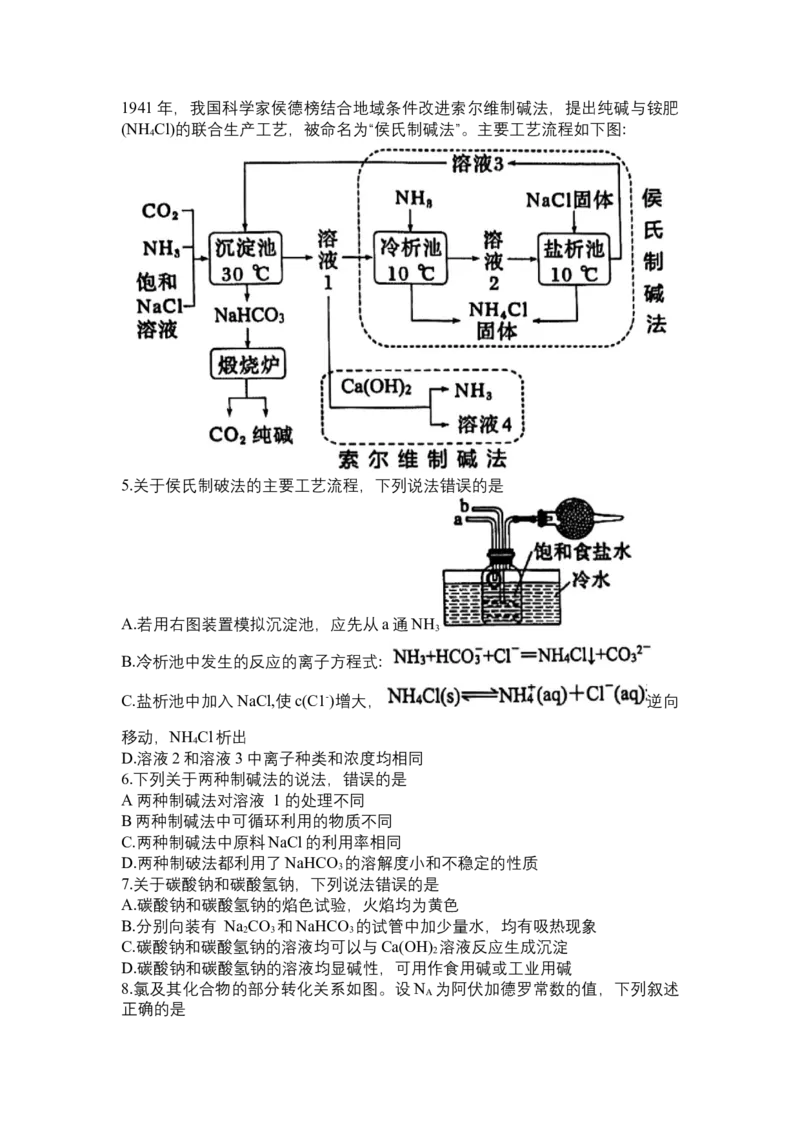
根据以下信息回答5-7题:1941年,我国科学家侯德榜结合地域条件改进索尔维制碱法,提出纯碱与铵肥
(NH Cl)的联合生产工艺,被命名为“侯氏制碱法”。主要工艺流程如下图:
4
5.关于侯氏制破法的主要工艺流程,下列说法错误的是
A.若用右图装置模拟沉淀池,应先从a通NH
3
B.冷析池中发生的反应的离子方程式:
C.盐析池中加入NaCl,使c(C1-)增大, 逆向
移动,NH Cl析出
4
D.溶液2和溶液3中离子种类和浓度均相同
6.下列关于两种制碱法的说法,错误的是
A两种制碱法对溶液 1的处理不同
B两种制碱法中可循环利用的物质不同
C.两种制碱法中原料NaCl的利用率相同
D.两种制破法都利用了NaHCO 的溶解度小和不稳定的性质
3
7.关于碳酸钠和碳酸氢钠,下列说法错误的是
A.碳酸钠和碳酸氢钠的焰色试验,火焰均为黄色
B.分别向装有 Na CO 和NaHCO 的试管中加少量水,均有吸热现象
2 3 3
C.碳酸钠和碳酸氢钠的溶液均可以与Ca(OH) 溶液反应生成沉淀
2
D.碳酸钠和碳酸氢钠的溶液均显碱性,可用作食用碱或工业用碱
8.氯及其化合物的部分转化关系如图。设N 为阿伏加德罗常数的值,下列叙述
A
正确的是A.1 mol KOH固体中阴离子的电子数为9N
A
B.100 mL 0.1 mo/L KClO溶液中,ClO- 数目小于0.01N
A
C.当反应①中消耗1molKClO 时,生成还原产物的分子数为2.5N
3 A
D.标准状况下,22.4L Cl 发生反应②,转移电子数为2N
2 A
9.含铝微粒所带的电荷与其中铝元素化合价的关系如图所示。下列推断正确的
是
A.若R为氧化物,可用作熔融烧碱的坩埚材料
B. Q中加入过量的氨水可转化为M
C将小苏打与M的钠盐混合,可以产生白色沉淀和无色气体
D.若R为碱,可通过含M与含Q的溶液混合制得
10.2025年2月我国将大范围禁用脱氢乙酸钠(结构如下图)。它是低毒高效的广
谱性防腐剂,能较好地抑制细菌、霉菌和酵母菌,避免霉变。但脱氢乙酸及其
钠盐能被人体完全吸收,并能抑制人体内多种氧化酶,长期过量摄入会危害人
体健康。
下列说法错误的是
A.脱氢乙酸的化学式为C H O
8 8 4
R.脱氢乙酸能使酸性高锰酸钾和溴水褪色
C.脱氢乙酸钠中的碳原子均为sp2杂化
D.脱氢乙酸钠易溶于水,其水溶液呈碱性
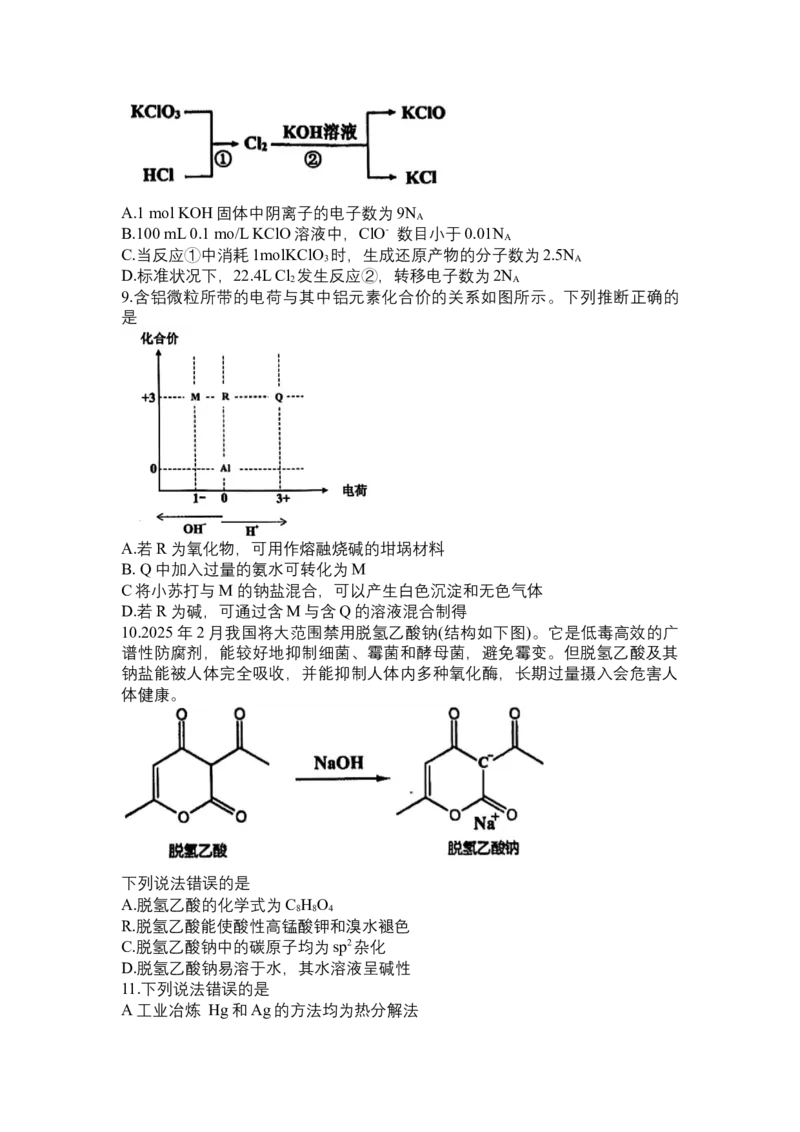
11.下列说法错误的是
A工业冶炼 Hg和Ag的方法均为热分解法A. Rb的半径和还原性都小于Cs
C AgCl 和AgBr均为具有感光性且难溶与水的物质
D. HF的稳定性和酸性都大于HI
12.下列除杂试剂和操作有错误的是
13.如图装置(部分夹持装置省略)所示的实验方案正确的是
14.二氧化锰氧化还原吸附剂调制的3,其库仑效率(衡量电池充放电过程中电荷转
移效率的一个重要指标)优于传统的锌氯电池。其工作原理如图所示,下列说法
错误的是
A.放电时,碳毡的电势高于锌箔B.放电时,负极的电极反应式:
C.充时,Cl-向锌箔移动
D.充电时,阴极增重6.5g时,阳极转移0.2N 个电子
A
15.类推类比迁移的思维方法可以预测许多物质的性质,但类比是相对的,不能
违背客观事实。下列类比分析结果正确的是
A. Na O 与CO 反应生成Na CO 和O ,推测Na O 与SO 反应生成Na SO 和O
2 2 2 2 3 2 2 2 2 2 3 2
B. MgI稀盐酸,Al构成的原电池负极为Mg,推测MgI稀NaOH, Al构成的原电
池负极为Mg
C.Cu与S反应生成Cu S,推测Cu与I 反应生成CuI
2 2
D. Cl 使紫色石蕊溶液先变红后褪色,推测SO 使紫色石蕊溶液先变红后褪色
2 2
16.下列各物质在一定条件下均与水反应,验证反应产物的操作或现象错误的是
17.常温下,CdCO 和Cd(OH) 的沉淀溶解平衡曲线如图所示。下列说法正确的
3 2
是
A.曲线I代表的是Cd(OH) 的沉淀溶解平衡曲线
2
B.若要除去废液中的Cd2+,加入NaOH比加入Na CO 的效果更好
2 3
C.常温下,c(Cd2+)=1.0×10-4 mol/L的Cd(OH) 饱和溶液的pH=5
2
D. X点对应的CdCO 溶液是不饱和溶液
318.常遇下,用0.100 mol●L-1NH SCN溶液滴定25.00 mL未知浓度的AgNO 溶液
4 3
以NH Fe(SO ) 为指示剂,测得溶液中pSCN、pAg随加入NH SCN溶液体积的
4 4 2 4
变化关系如图所示。已知:①lg3=0.5,② pX=lgc(X 或 X-),③ Ag++SCN-
=AgSCN↓。下 列说法错误的是
A.该温度下AgSCN溶度积常数Ksp=l.0×10-12
B.为防止指示剂失效,滴定过程中应保持溶液空呈酸性
C.加入V(NH SCN)=20mL时, pAg=2
4
D.相同条件下,若改为0.05mol·L-1的NH SCN溶液, 滴定终点将向左半移
4
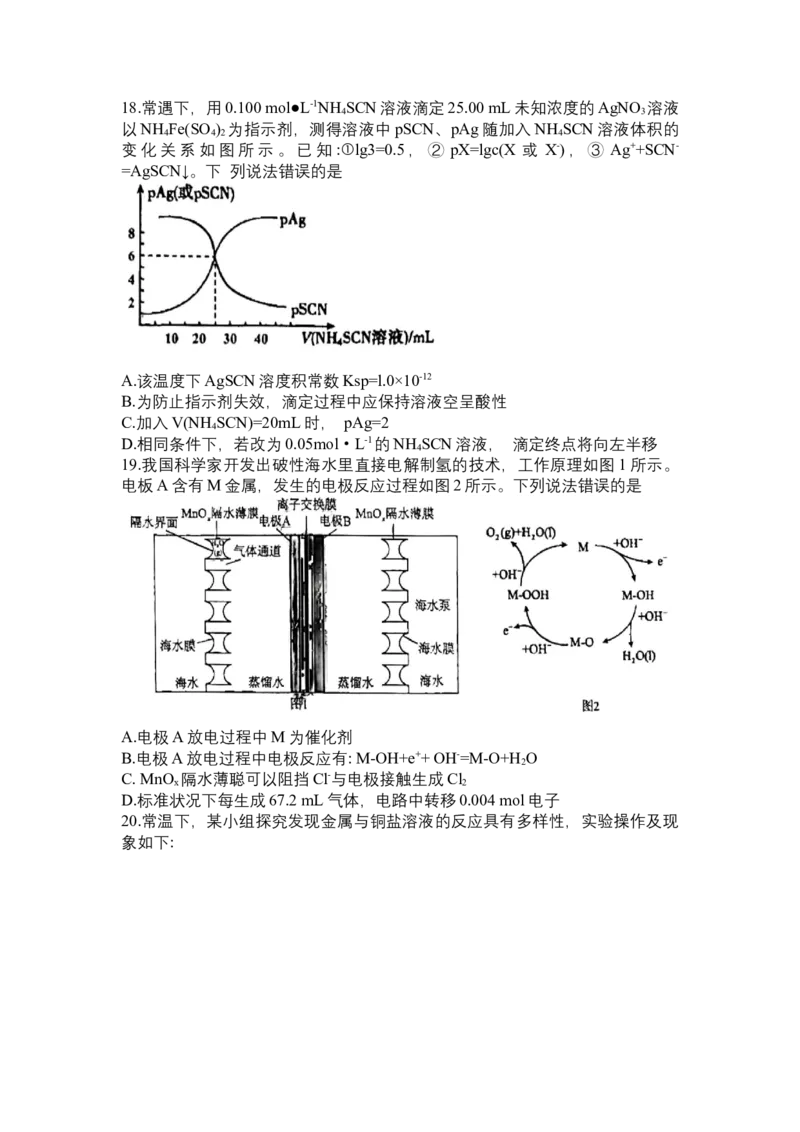
19.我国科学家开发出破性海水里直接电解制氢的技术,工作原理如图1所示。
电板A含有M金属,发生的电极反应过程如图2所示。下列说法错误的是
A.电极A放电过程中M为催化剂
B.电极A放电过程中电极反应有: M-OH+e++ OH-=M-O+H O
2
C. MnO 隔水薄聪可以阻挡Cl-与电极接触生成Cl
x 2
D.标准状况下每生成67.2 mL气体,电路中转移0.004 mol电子
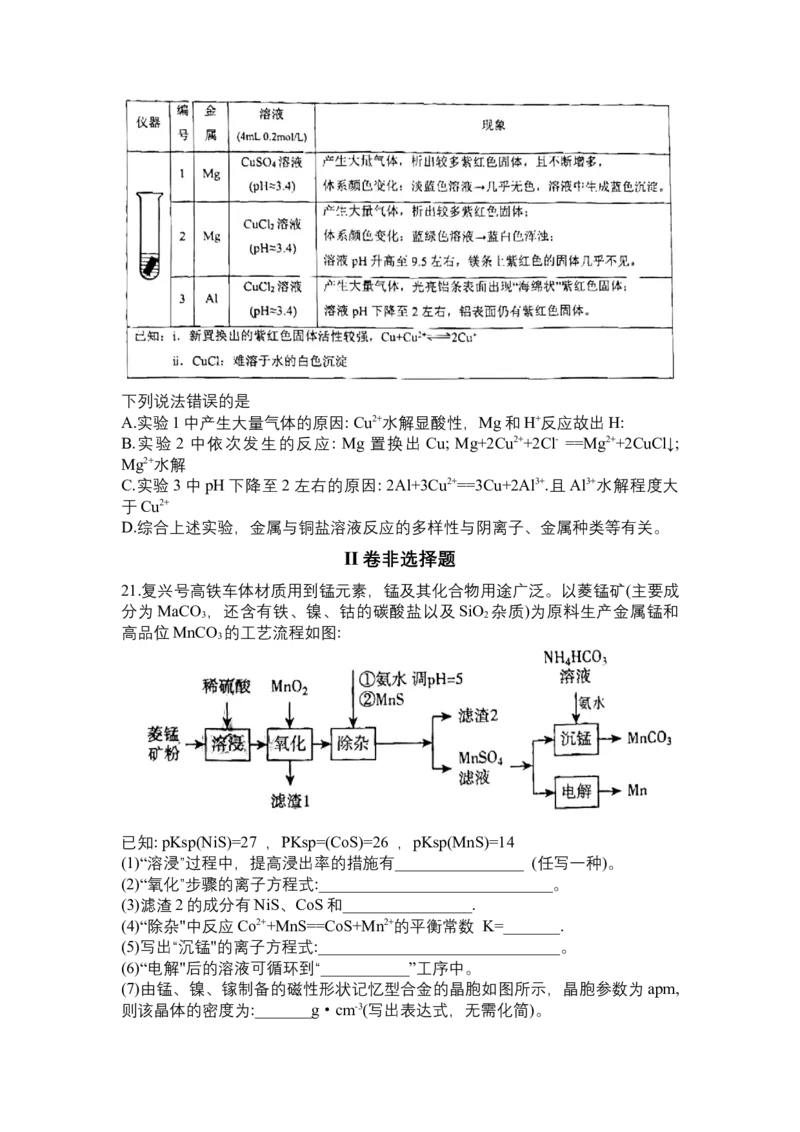
20.常温下,某小组探究发现金属与铜盐溶液的反应具有多样性,实验操作及现
象如下:下列说法错误的是
A.实验1中产生大量气体的原因: Cu2+水解显酸性,Mg和H+反应故出H:
B.实验 2 中依次发生的反应: Mg 置换出 Cu; Mg+2Cu2++2Cl- ==Mg2++2CuCl↓;
Mg2+水解
C.实验3中pH下降至2左右的原因: 2Al+3Cu2+==3Cu+2Al3+.且Al3+水解程度大
于Cu2+
D.综合上述实验,金属与铜盐溶液反应的多样性与阴离子、金属种类等有关。
II卷非选择题
21.复兴号高铁车体材质用到锰元素,锰及其化合物用途广泛。以菱锰矿(主要成
分为MaCO ,还含有铁、镍、钴的碳酸盐以及SiO 杂质)为原料生产金属锰和
3 2
高品位MnCO 的工艺流程如图:
3
已知: pKsp(NiS)=27 ,PKsp=(CoS)=26 ,pKsp(MnS)=14
(1)“溶浸”过程中,提高浸出率的措施有________________ (任写一种)。
(2)“氧化”步骤的离子方程式:_____________________________。
(3)滤渣2的成分有NiS、CoS和________________.
(4)“除杂"中反应Co2++MnS==CoS+Mn2+的平衡常数 K=_______.
(5)写出“沉锰"的离子方程式:______________________________。
(6)“电解"后的溶液可循环到“___________”工序中。
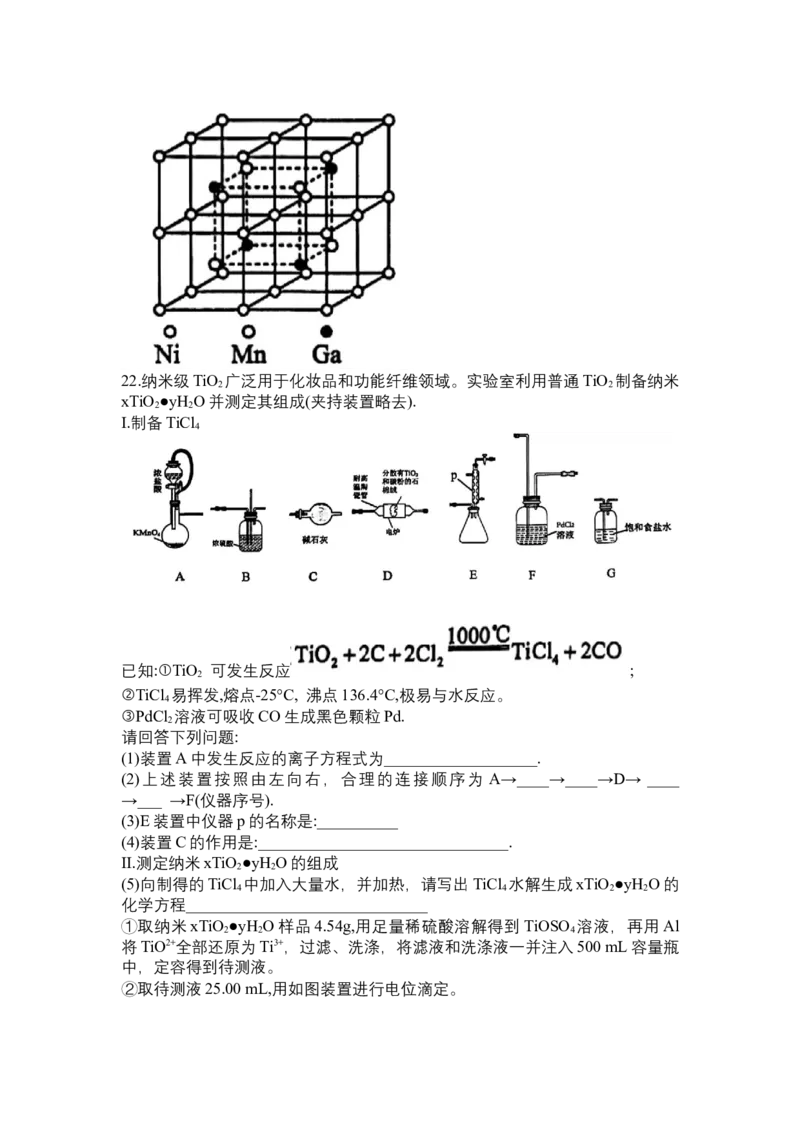
(7)由锰、镍、镓制备的磁性形状记忆型合金的晶胞如图所示,晶胞参数为apm,
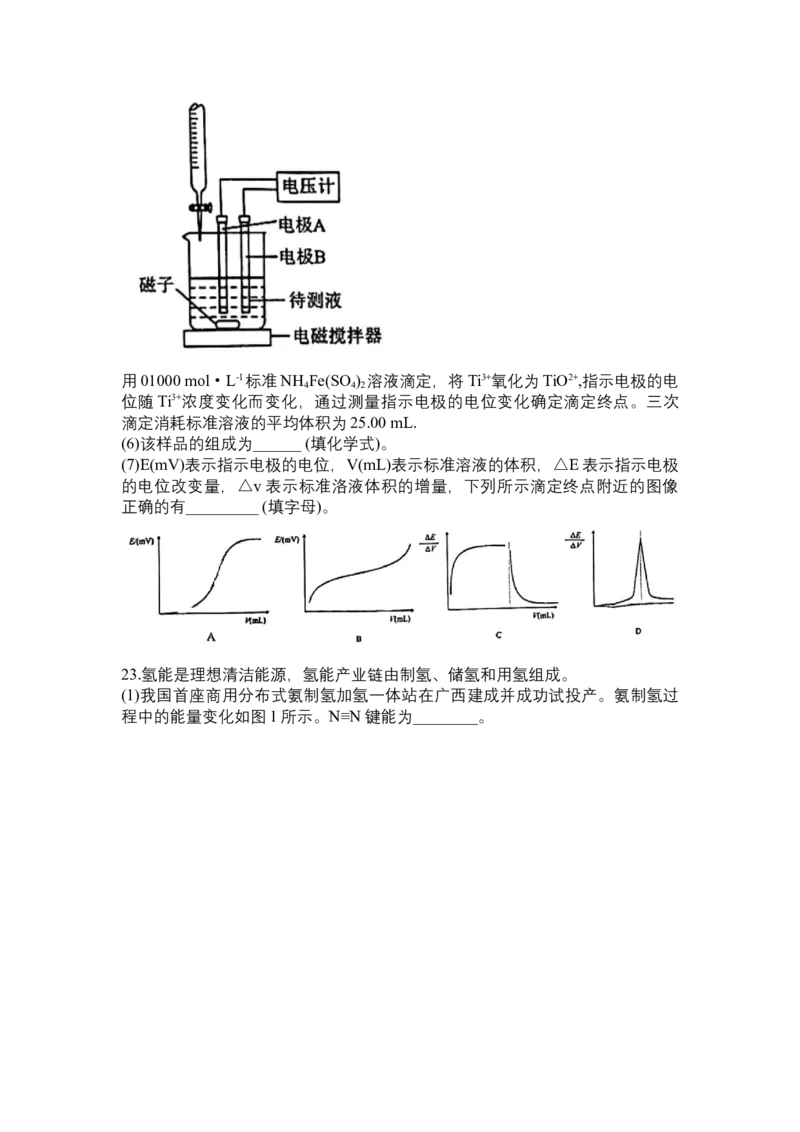
则该晶体的密度为:_______g·cm-3(写出表达式,无需化简)。22.纳米级TiO 广泛用于化妆品和功能纤维领域。实验室利用普通TiO 制备纳米
2 2
xTiO ●yH O并测定其组成(夹持装置略去).
2 2
I.制备TiCl
4
已知:①TiO 可发生反应 ;
2
②TiCl 易挥发,熔点-25°C, 沸点136.4°C,极易与水反应。
4
③PdCl 溶液可吸收CO生成黑色颗粒Pd.
2
请回答下列问题:
(1)装置A中发生反应的离子方程式为___________________.
(2)上述装置按照由左向右,合理的连接顺序为 A→____→____→D→ ____
→___ →F(仪器序号).
(3)E装置中仪器p的名称是:__________
(4)装置C的作用是:_______________________________.
II.测定纳米xTiO ●yH O的组成
2 2
(5)向制得的TiCl 中加入大量水,并加热,请写出TiCl 水解生成xTiO ●yH O的
4 4 2 2
化学方程______________________________
①取纳米xTiO ●yH O样品4.54g,用足量稀硫酸溶解得到TiOSO 溶液,再用Al
2 2 4
将TiO2+全部还原为Ti3+,过滤、洗涤,将滤液和洗涤液一并注入500 mL容量瓶
中,定容得到待测液。
②取待测液25.00 mL,用如图装置进行电位滴定。用01000 mol·L-1标准NH Fe(SO ) 溶液滴定,将Ti3+氧化为TiO2+,指示电极的电
4 4 2
位随Ti3+浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。三次
滴定消耗标准溶液的平均体积为25.00 mL.
(6)该样品的组成为______ (填化学式)。
(7)E(mV)表示指示电极的电位,V(mL)表示标准溶液的体积,△E表示指示电极
的电位改变量,△v表示标准洛液体积的增量,下列所示滴定终点附近的图像
正确的有_________ (填字母)。
23.氢能是理想清洁能源,氢能产业链由制氢、储氢和用氢组成。
(1)我国首座商用分布式氨制氢加氢一体站在广西建成并成功试投产。氨制氢过
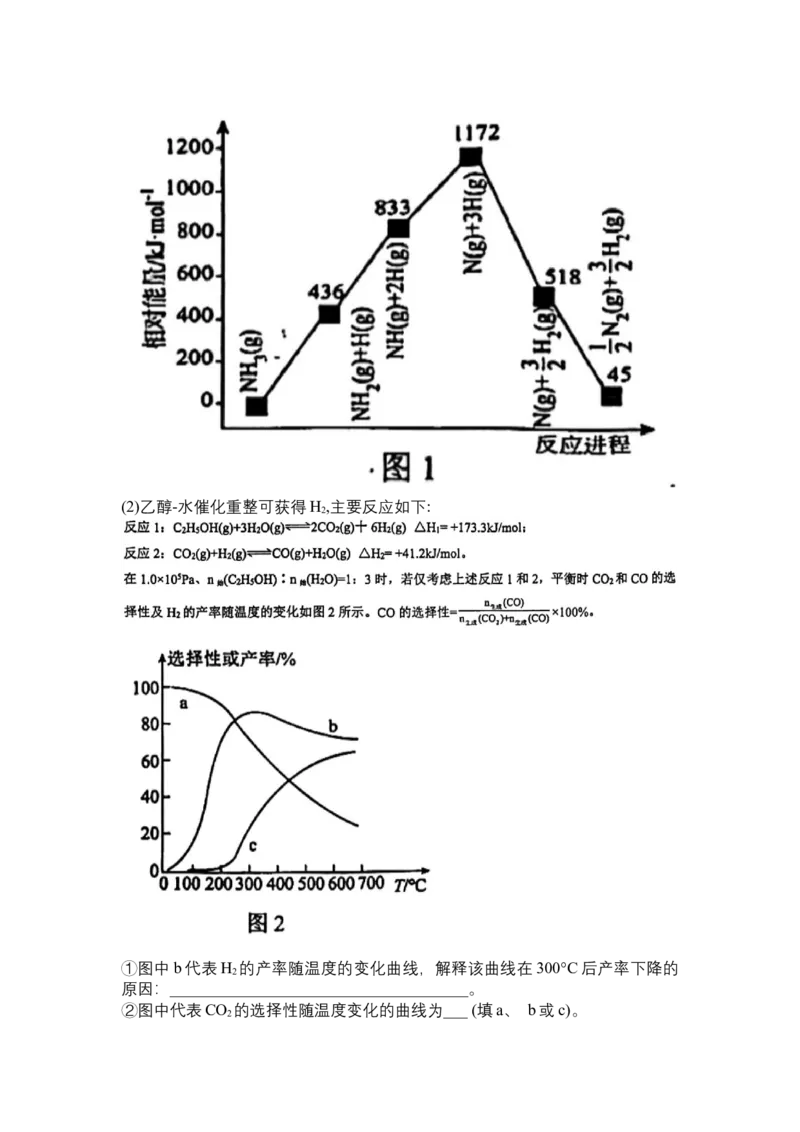
程中的能量变化如图1所示。N≡N键能为________。(2)乙醇-水催化重整可获得H ,主要反应如下:
2
①图中b代表H 的产率随温度的变化曲线,解释该曲线在300°C后产率下降的
2
原因:_____________________________________。
②图中代表CO 的选择性随温度变化的曲线为___ (填a、 b或c)。
2③下列说法错误的是______. (填标号)。
A.一定温度下,增大 的比值,乙醇平衡转化率减小
B.一定温度下,选用高效催化剂,可以提高平衡时H 的转化率
2
C.恒压充入稀有气体,反应2平衡不移动
D.升高温度,反应1与反应2的v 均增大
逆
④TK时,向2L恒容密闭的容器中充入2 mol C H OH(g)和6 mol H O(g),发生反应
2 5 2
1 和反应 2, 5min 后达到平衡状态,测得 C H OH(g)的转化率为 75%,容器内
2 5
CO(g)的体积分数为10%。
TK时,反应2的平衡常数K =______________.(列出计算式即可)。
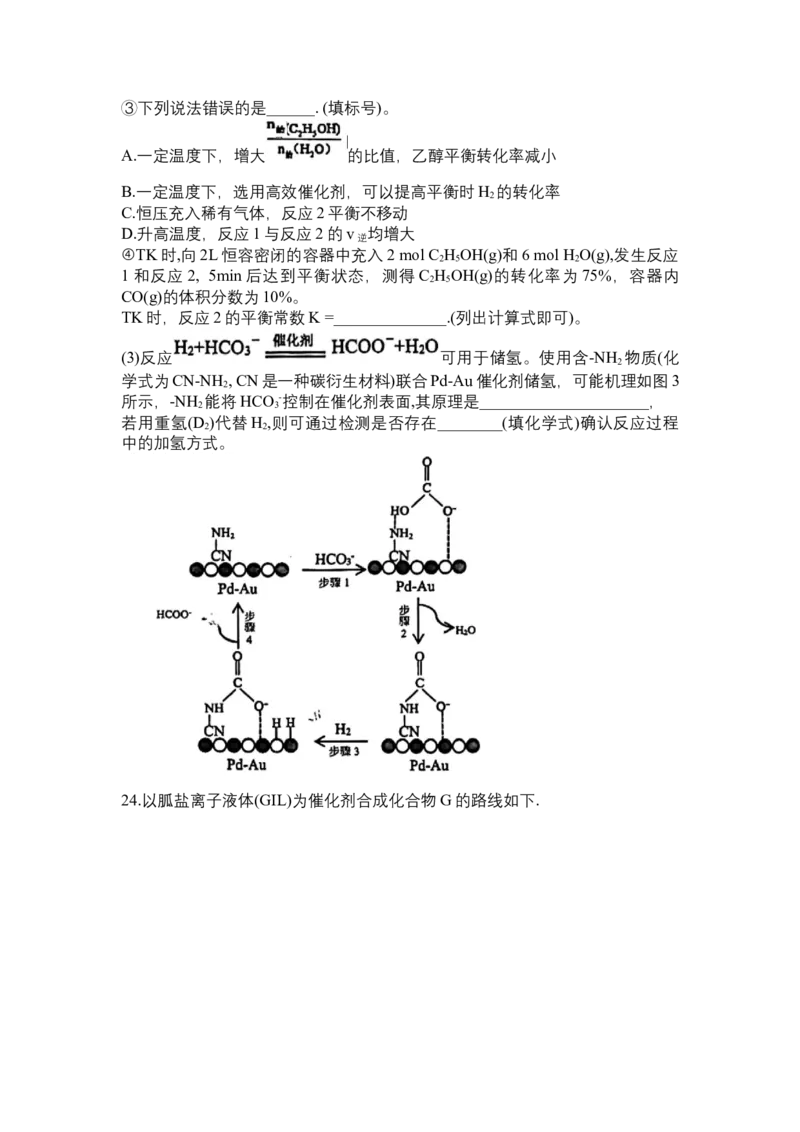
(3)反应 可用于储氢。使用含-NH 物质(化
2
学式为CN-NH , CN是一种碳衍生材料)联合Pd-Au催化剂储氢,可能机理如图3
2
所示,-NH 能将HCO -控制在催化剂表面,其原理是_____________________,
2 3
若用重氢(D )代替H ,则可通过检测是否存在________(填化学式)确认反应过程
2 2
中的加氢方式。
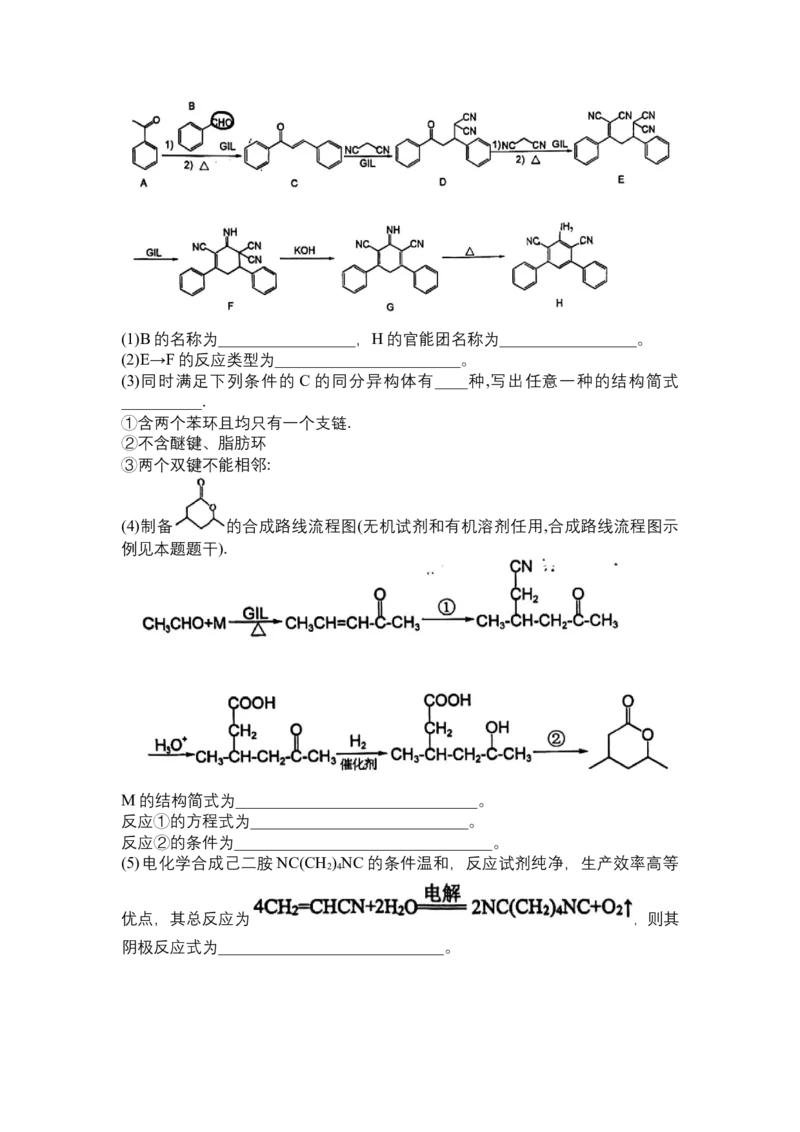
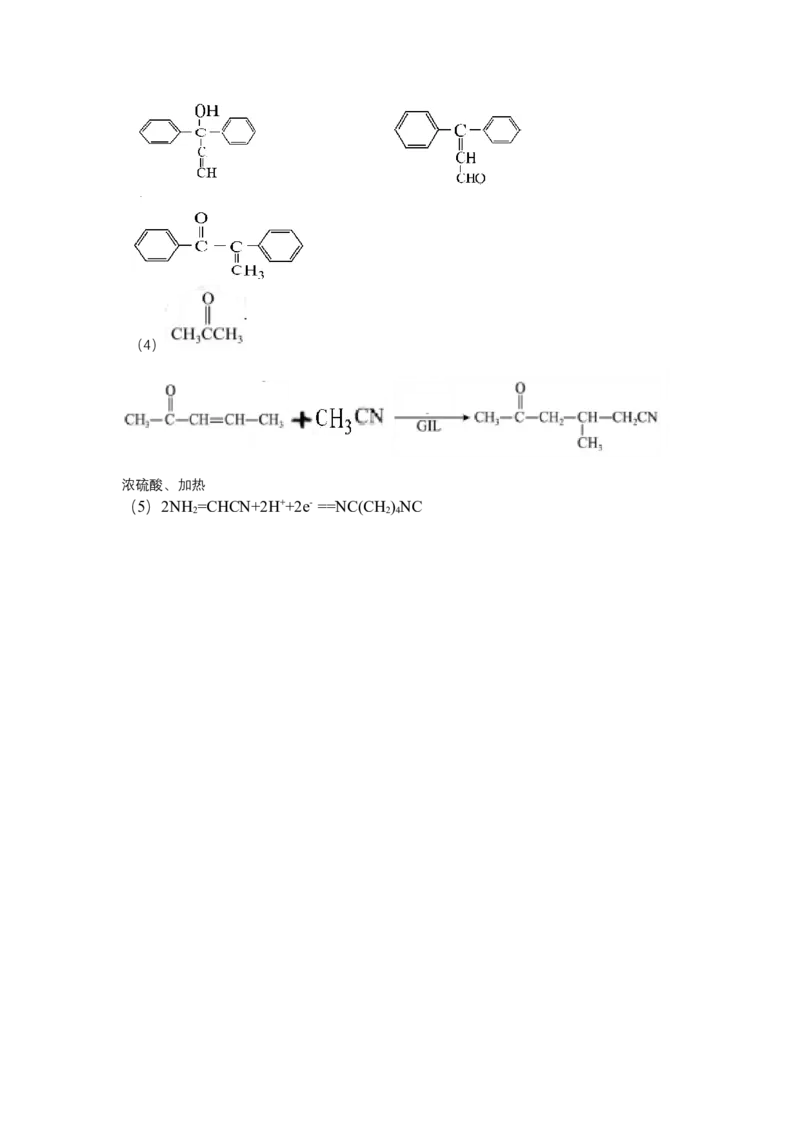
24.以胍盐离子液体(GIL)为催化剂合成化合物G的路线如下.(1)B的名称为_________________,H的官能团名称为_________________。
(2)E→F的反应类型为_______________________。
(3)同时满足下列条件的 C 的同分异构体有____种,写出任意一种的结构简式
__________.
①含两个苯环且均只有一个支链.
②不含醚键、脂肪环
③两个双键不能相邻:
(4)制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示
例见本题题干).
M的结构简式为______________________________。
反应①的方程式为___________________________。
反应②的条件为________________________________。
(5)电化学合成己二胺NC(CH ) NC的条件温和,反应试剂纯净,生产效率高等
2 4
优点,其总反应为 ,则其
阴极反应式为____________________________。化学参考答案
一、选择题
题号 1 2 3 4 5 6 7 8 9 10
答案 A B C C D C B B D C
题号 11 12 13 14 15 16 17 18 19 20
答案 D A D D C A A D B B
21、(1)升温、适当增加硫酸的浓度等(2分)
(2)MnO2+2Fe2++4H+=Mn2++2Fe3++2H O(2分)
2
(3)氢氧化铁(1分)
(4)1012(1分)
(5)Mn2++HCO -+NH ·H O=MnCO ↓+NH ++H O(2分)
3 3 2 3 4 2
(6)溶浸(1分)
(7) (1分)
22.(1)2Mn - +16H++10Cl-=2Mn2++5Cl ↑+8H O(2分)
4 2 2
(2)GBEC(2分)
(3)球形冷凝管(2分)
(4)防止F中的水蒸气进入装置E中使TiCl 水解,除去Cl ,防止污染
4 2
(5)xTiCl +(2x+y)H O=xTiO ·yH O+4xHCl(条件:加热)
4 2 2 2
(6)5TiO ·3H O
2 2
(6)AD
23.(1)946
(2)①300°C以后以反应2为主;(或300°C以后以反应2正向移动的程度大于
反应1)②a ③BC ④
(3)-NH 可以与HCO -形成氢键 CN-NHD或DCOO-
2 3
24.(1)苯甲醛 氨基、氰基
(2)加成
(3)4(4)
浓硫酸、加热
(5)2NH =CHCN+2H++2e- ==NC(CH ) NC
2 2 4