文档内容
2024届高三暑假作业检测试卷
化学
本试题卷分选择题和非选择题两部分,共10页。时量75分钟,满分100 分。
可能用到的相对原子质量:H~1 C~12 N~14 0~16 Ti~48 Ag~108 Ba~137
一、选择题(本题共14 小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的。)
1.“益,古大都会也。有江山之雄,有文物之盛。”成都第31届世界大学生夏季运动会开幕
式上展示的下列文物中,有关叙述错误的是
A.金沙石磬由“石料”雕凿的过程只涉及物理变化
B.蜀锦由蚕丝线“刺绣”而成,蚕丝是人工合成材料
C.青铜面具的主要成分是合金
D.太阳神鸟金饰中“金箔”体现金属具有延展性
★2.下列符号表征错误的是
A.H 分子中σ键的电子云轮廓图:
2
B. H S的VSEPR模型:
2
C. MgCl 的形成过程:
2
D. HCO -的水解方程式:HCO -+H O H O++CO 2-
3 3 2 3 3
★3.下列实验方案能够达到目的的是
4.下列有关物质结构和性质的叙述错误的是
A.甲酸酯、葡萄糖和醛类都能发生银镜反应
B.邻羟基苯甲酸的沸点低于对羟基苯甲酸
C.含1个手性碳原子的分子- -定是手性分子
D.原子半径越小,对应元素的第--电离能和电负性均越大
★5.下列反应的离子方程式正确的是
A.向酸性KMnO 溶液中加入草酸溶液:
4
2MnO -+5C O 2-+16H+= 10CO ↑十2Mn2++8H O
4 2 4 2 2
B. Na S O 溶液与稀硫酸共热:S O 2- +2SO 2- +6H+=4SO ↑+3H O
2 2 3 2 3 4 2 2
学科网(北京)股份有限公司C. Fe与稀硝酸反应,当n(Fe) : n(HNO )=1 : 2时,3Fe+ 2NO -+8H+=3Fe2+ + 2NO↑+4H O
3 3 2
D.向Ba(OH) 溶液中滴加NaHSO 至溶液呈中性:
2 4
Ba2++ OH-+H++SO 2- =BaSO ↓+H O
4 4 2
6.某食品添加剂的主要成分为WZ(RY ) ·12X Y。已知X、Y、Z、R、W为原子序数依次增大的
4 2 2
前20号元素,X、Z的周期序数等于主族序数,Y和R位于同主族,基态X、W原子最外层电子
排布式为ns1。下列叙述正确的是
A.原子半径:W>R>Z>Y> X
B.电负性:Y>R>X> >Z> W
C.常温下,乙、W单质都能与水发生置换反应
D.R的最高价氧化物对应水化物一定有强氧化性
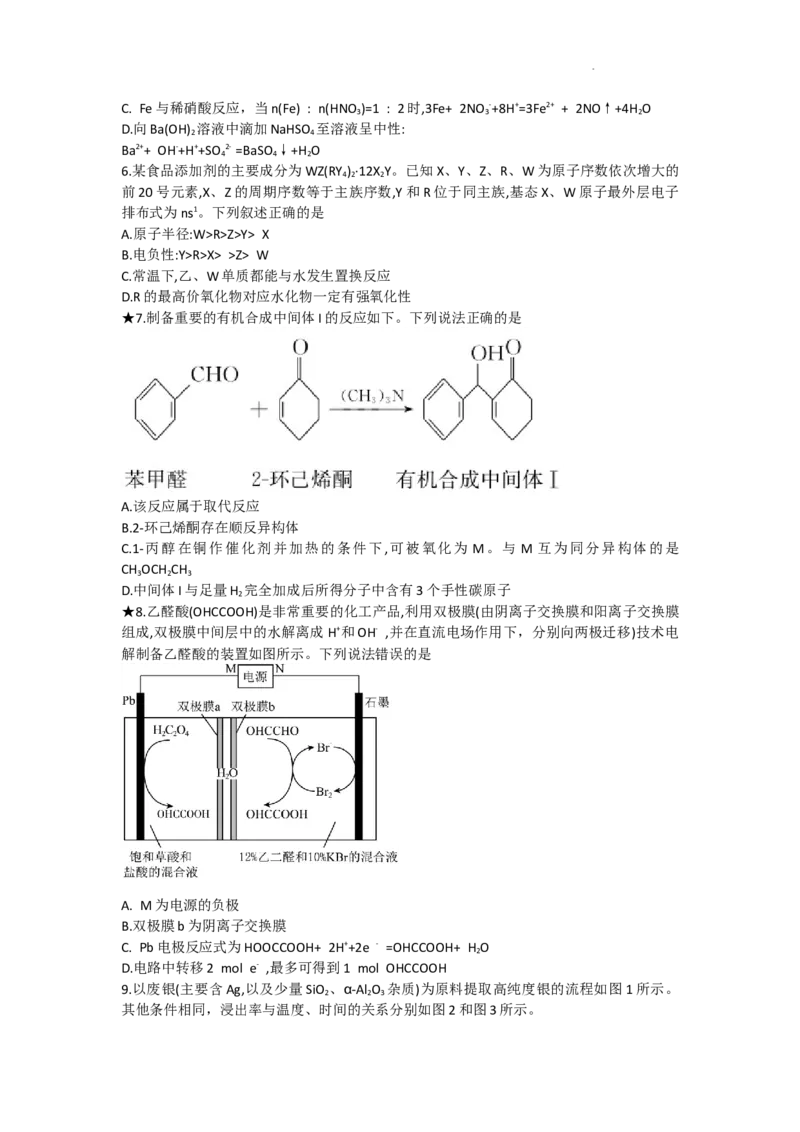
★7.制备重要的有机合成中间体I的反应如下。下列说法正确的是
A.该反应属于取代反应
B.2-环己烯酮存在顺反异构体
C.1-丙醇在铜作催化剂并加热的条件下,可被氧化为 M。与 M 互为同分异构体的是
CH OCH CH
3 2 3
D.中间体I与足量H 完全加成后所得分子中含有3个手性碳原子
2
★8.乙醛酸(OHCCOOH)是非常重要的化工产品,利用双极膜(由阴离子交换膜和阳离子交换膜
组成,双极膜中间层中的水解离成H+和OH- ,并在直流电场作用下,分别向两极迁移)技术电
解制备乙醛酸的装置如图所示。下列说法错误的是
A. M为电源的负极
B.双极膜b为阴离子交换膜
C. Pb电极反应式为HOOCCOOH+ 2H++2e - =OHCCOOH+ H O
2
D.电路中转移2 mol e- ,最多可得到1 mol OHCCOOH
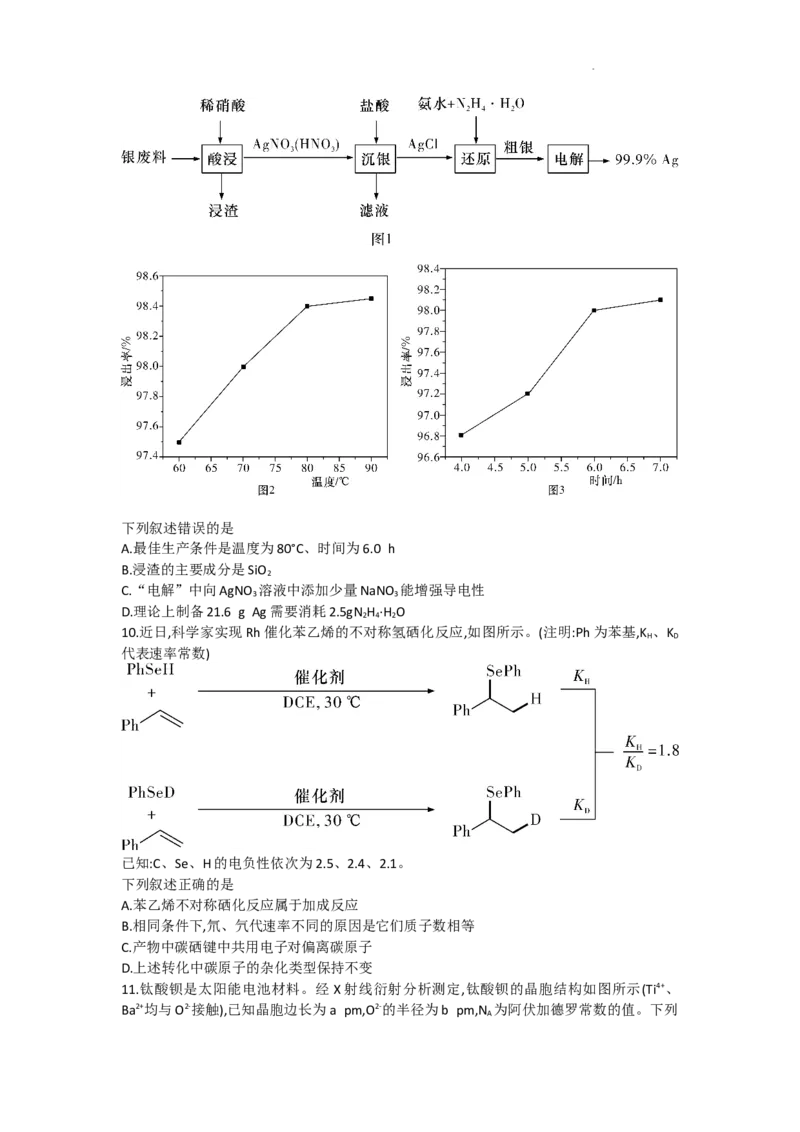
9.以废银(主要含Ag,以及少量SiO 、α-Al O 杂质)为原料提取高纯度银的流程如图1所示。
2 2 3
其他条件相同,浸出率与温度、时间的关系分别如图2和图3所示。
学科网(北京)股份有限公司下列叙述错误的是
A.最佳生产条件是温度为80°C、时间为6.0 h
B.浸渣的主要成分是SiO
2
C.“电解”中向AgNO 溶液中添加少量NaNO 能增强导电性
3 3
D.理论上制备21.6 g Ag需要消耗2.5gN H ·H O
2 4 2
10.近日,科学家实现Rh催化苯乙烯的不对称氢硒化反应,如图所示。(注明:Ph为苯基,K 、K
H D
代表速率常数)
已知:C、Se、H的电负性依次为2.5、2.4、2.1。
下列叙述正确的是
A.苯乙烯不对称硒化反应属于加成反应
B.相同条件下,氘、氕代速率不同的原因是它们质子数相等
C.产物中碳硒键中共用电子对偏离碳原子
D.上述转化中碳原子的杂化类型保持不变
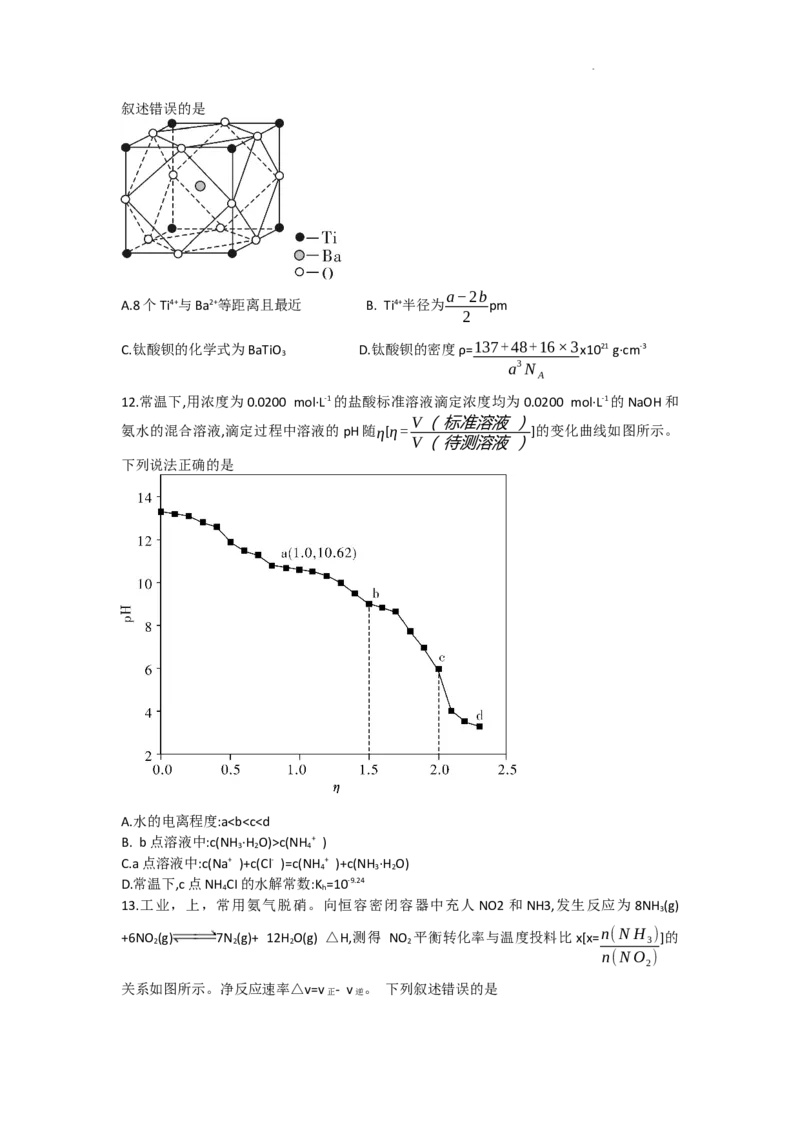
11.钛酸钡是太阳能电池材料。经X射线衍射分析测定,钛酸钡的晶胞结构如图所示(Ti4+、
Ba2+均与O2-接触),已知晶胞边长为a pm,O2-的半径为b pm,N 为阿伏加德罗常数的值。下列
A
学科网(北京)股份有限公司叙述错误的是
a−2b
A.8个Ti4+与Ba2+等距离且最近 B. Ti4+半径为 pm
2
C.钛酸钡的化学式为BaTiO D.钛酸钡的密度ρ= 137+48+16×3 x1021 g·cm-3
3
a3N
A
12.常温下,用浓度为0.0200 mol·L-1的盐酸标准溶液滴定浓度均为0.0200 mol·L-1的NaOH和
V(标准溶液)
氨水的混合溶液,滴定过程中溶液的pH随η[η= ]的变化曲线如图所示。
V(待测溶液)
下列说法正确的是
A.水的电离程度:ac(NH + )
3 2 4
C.a点溶液中:c(Na+ )+c(Cl- )=c(NH + )+c(NH ·H O)
4 3 2
D.常温下,c点NH CI的水解常数:K =10-9.24
4 h
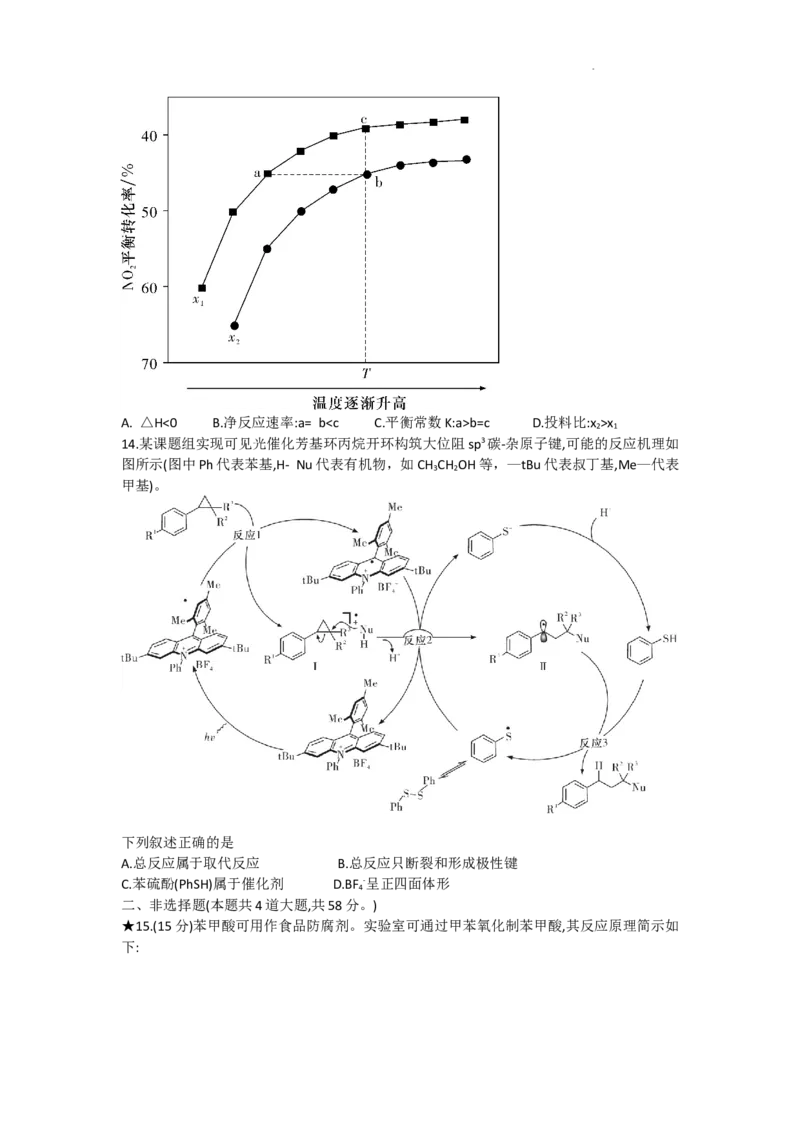
13.工业,上,常用氨气脱硝。向恒容密闭容器中充人NO2和NH3,发生反应为8NH (g)
3
+6NO 2 (g) 7N 2 (g)+ 12H 2 O(g) △H,测得 NO 2 平衡转化率与温度投料比x[x= n(N H 3 )]的
n(NO )
2
关系如图所示。净反应速率△v=v - v 。 下列叙述错误的是
正 逆
学科网(北京)股份有限公司A. △H<0 B.净反应速率:a= bb=c D.投料比:x >x
2 1
14.某课题组实现可见光催化芳基环丙烷开环构筑大位阻sp3碳-杂原子键,可能的反应机理如
图所示(图中Ph代表苯基,H- Nu代表有机物,如CH CH OH等,—tBu代表叔丁基,Me—代表
3 2
甲基)。
下列叙述正确的是
A.总反应属于取代反应 B.总反应只断裂和形成极性键
C.苯硫酚(PhSH)属于催化剂 D.BF -呈正四面体形
4
二、非选择题(本题共4道大题,共58分。)
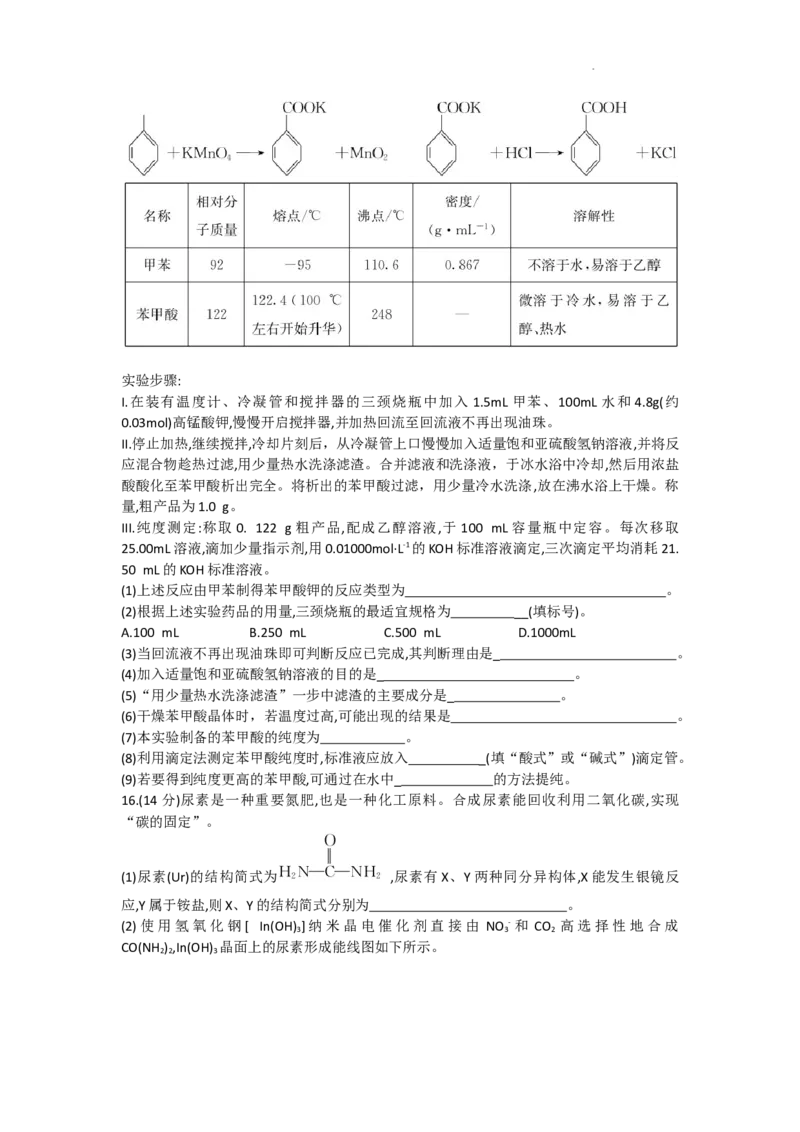
★15.(15分)苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如
下:
学科网(北京)股份有限公司实验步骤:
I.在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入 1.5mL 甲苯、100mL 水和 4.8g(约
0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
II.停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反
应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐
酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称
量,粗产品为1.0 g。
III.纯度测定:称取 0. 122 g粗产品,配成乙醇溶液,于100 mL 容量瓶中定容。每次移取
25.00mL溶液,滴加少量指示剂,用0.01000mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.
50 mL的KOH标准溶液。
(1)上述反应由甲苯制得苯甲酸钾的反应类型为 。
(2)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 __(填标号)。
A.100 mL B.250 mL C.500 mL D.1000mL
(3)当回流液不再出现油珠即可判断反应已完成,其判断理由是_ 。
(4)加入适量饱和亚硫酸氢钠溶液的目的是_ 。
(5)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_ 。
(6)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(7)本实验制备的苯甲酸的纯度为 。
(8)利用滴定法测定苯甲酸纯度时,标准液应放入 _(填“酸式”或“碱式”)滴定管。
(9)若要得到纯度更高的苯甲酸,可通过在水中_ 的方法提纯。
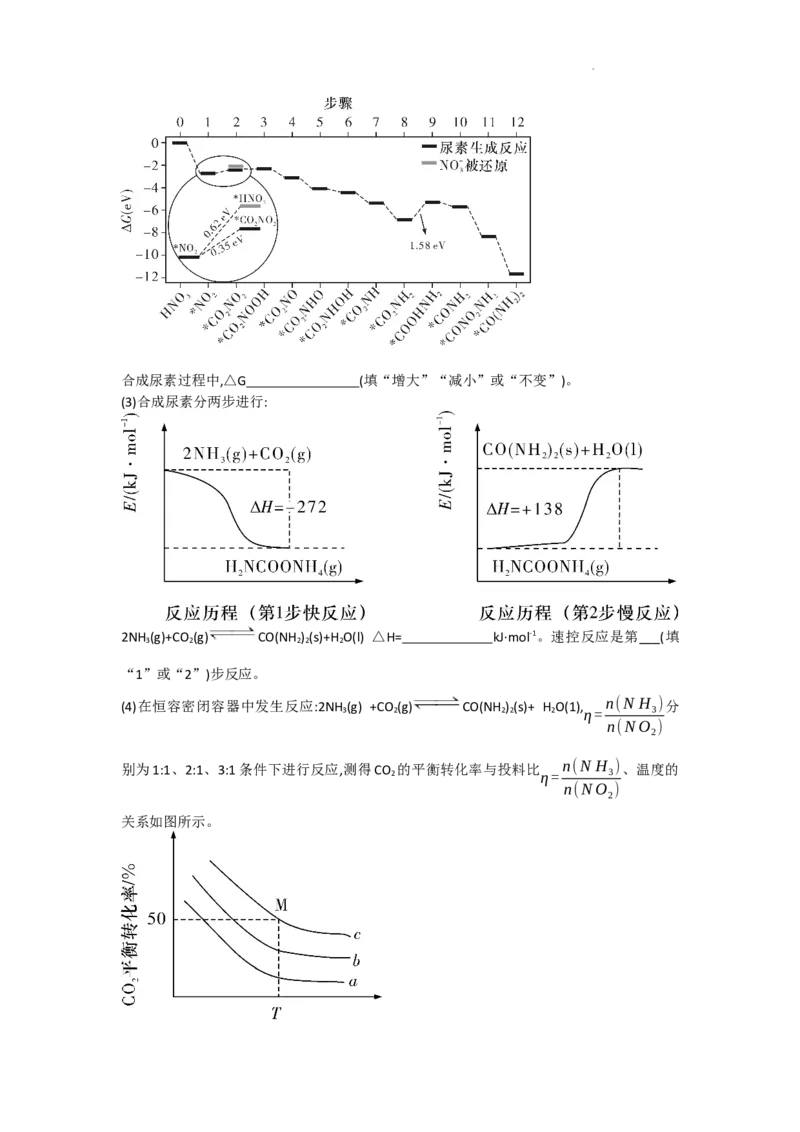
16.(14分)尿素是一种重要氮肥,也是一种化工原料。合成尿素能回收利用二氧化碳,实现
“碳的固定”。
(1)尿素(Ur)的结构简式为 ,尿素有X、Y两种同分异构体,X能发生银镜反
应,Y属于铵盐,则X、Y的结构简式分别为 。
(2)使用氢氧化钢[ In(OH) ]纳米晶电催化剂直接由 NO -和 CO 高选择性地合成
3 3 2
CO(NH ) ,In(OH) 晶面上的尿素形成能线图如下所示。
2 2 3
学科网(北京)股份有限公司合成尿素过程中,△G (填“增大”“减小”或“不变”)。
(3)合成尿素分两步进行:
2NH (g)+CO (g) CO(NH ) (s)+H O(l) △H= kJ·mol-1。速控反应是第___(填
3 2 2 2 2
“1”或“2”)步反应。
(4)在恒容密闭容器中发生反应:2NH 3 (g) +CO 2 (g) CO(NH 2 ) 2 (s)+ H 2 O(1), η= n(N H 3 )分
n(NO )
2
别为1:1、2:1、3:1条件下进行反应,测得CO
2
的平衡转化率与投料比
η=
n(N H
3
)、温度的
n(NO )
2
关系如图所示。
学科网(北京)股份有限公司①在相同投料下,升高温度,CO 的平衡转化率降低的主要原因是_ 。
2
②若M点对应的压强为100 kPa,则M点条件下平衡常数K 为 (不要求带
p
单位,只列计算式)。
(5)聚脲(聚尿素纤维,又称尤纶)在电子、建材等方面有广泛应用。写出合成链状聚脲的化学
方程式: 。
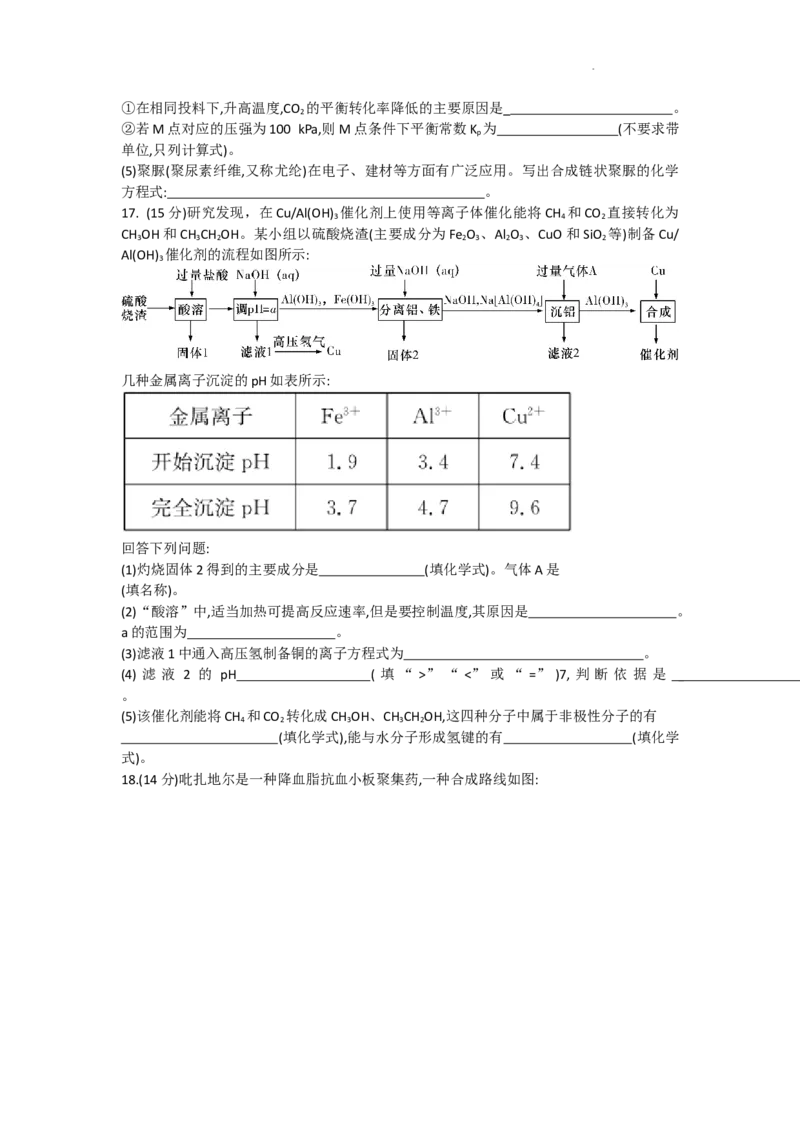
17. (15分)研究发现,在Cu/Al(OH) 催化剂上使用等离子体催化能将CH 和CO 直接转化为
3 4 2
CH OH和CH CH OH。某小组以硫酸烧渣(主要成分为Fe O 、Al O 、CuO和SiO 等)制备Cu/
3 3 2 2 3 2 3 2
Al(OH) 催化剂的流程如图所示:
3
几种金属离子沉淀的pH如表所示:
回答下列问题:
(1)灼烧固体2得到的主要成分是 (填化学式)。气体A是
(填名称)。
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度,其原因是 。
a的范围为 。
(3)滤液1中通入高压氢制备铜的离子方程式为 。
(4) 滤 液 2 的 pH ( 填 “ >” “ <” 或 “ =” )7, 判 断 依 据 是
。
(5)该催化剂能将CH 和CO 转化成CH OH、CH CH OH,这四种分子中属于非极性分子的有
4 2 3 3 2
(填化学式),能与水分子形成氢键的有 (填化学
式)。
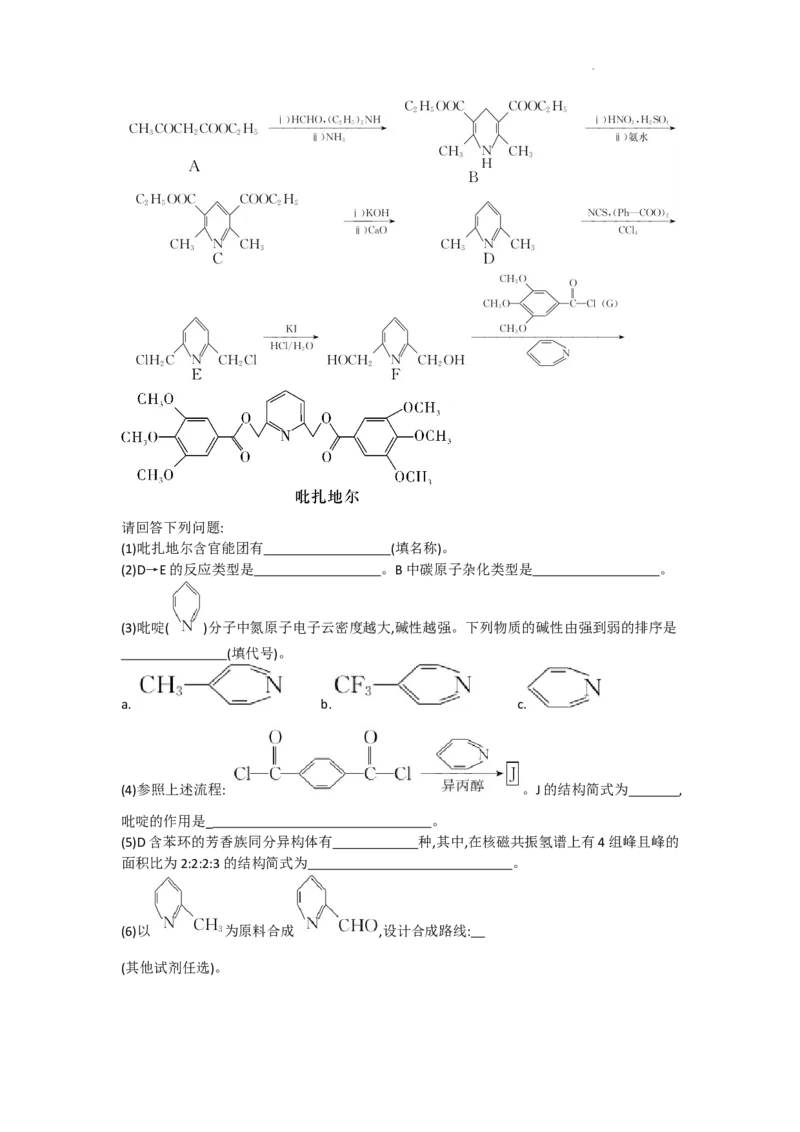
18.(14分)吡扎地尔是一种降血脂抗血小板聚集药,一种合成路线如图:
学科网(北京)股份有限公司请回答下列问题:
(1)吡扎地尔含官能团有 (填名称)。
(2)D→E的反应类型是 。B中碳原子杂化类型是 。
(3)吡啶( )分子中氮原子电子云密度越大,碱性越强。下列物质的碱性由强到弱的排序是
(填代号)。
a. b. c.
(4)参照上述流程: 。J的结构简式为 ,
吡啶的作用是_ 。
(5)D含苯环的芳香族同分异构体有 种,其中,在核磁共振氢谱上有4组峰且峰的
面积比为2:2:2:3的结构简式为 。
(6)以 为原料合成 ,设计合成路线:
(其他试剂任选)。
学科网(北京)股份有限公司