文档内容
2023-2024 学年度第一学期高三年级阶段检测
化学
注意:本试卷分第一部分选择题和第二部分非选择题,共100分,考试时间75分钟。
可能用到的相对原子质量:H1 C12 O16 Na23 A127 S32 Ag108 Br80 Cu64
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1. 能源、航天、信息等科技离不开新技术和新材料的发现和应用。下列有关说法不正确的是
A. 量子通信材料如螺旋碳纳米管、石墨烯等纳米材料属于胶体
B. 航天核心舱搭载的柔性太阳能电池板的核心材料是晶体硅
C. 新一代运载火箭成功应用液氧、煤油发动机,煤油是石油分馏所得混合物
D. 福建舰舰身材料采用低碳合金钢,合金的强度一般高于成分金属
2. 过氧化钠常用作供氧剂: 。下列说法正确的是
A. 为非极性分子 B. 的电子式:
C. 与 互为同素异形体 D. NaOH属于离子化合物,不含有共价键
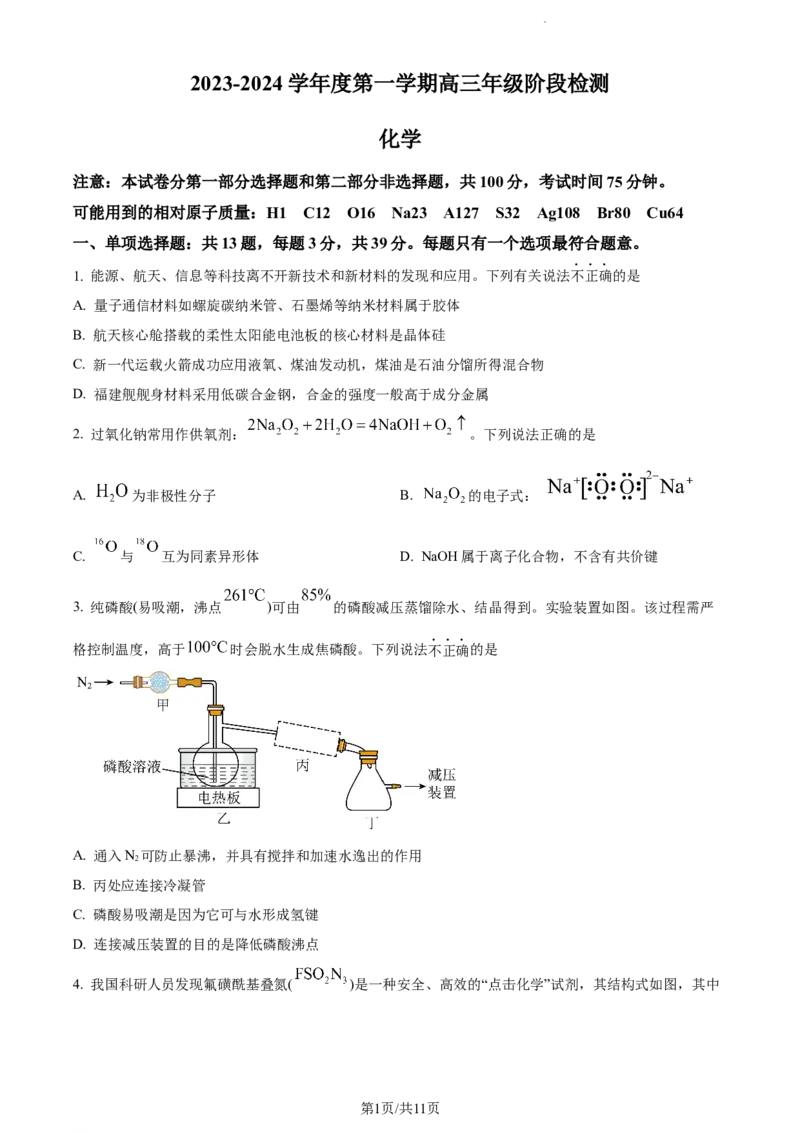
3. 纯磷酸(易吸潮,沸点 )可由 的磷酸减压蒸馏除水、结晶得到。实验装置如图。该过程需严
格控制温度,高于 时会脱水生成焦磷酸。下列说法不正确的是
A. 通入N 可防止暴沸,并具有搅拌和加速水逸出的作用
2
B. 丙处应连接冷凝管
C. 磷酸易吸潮是因为它可与水形成氢键
D. 连接减压装置的目的是降低磷酸沸点
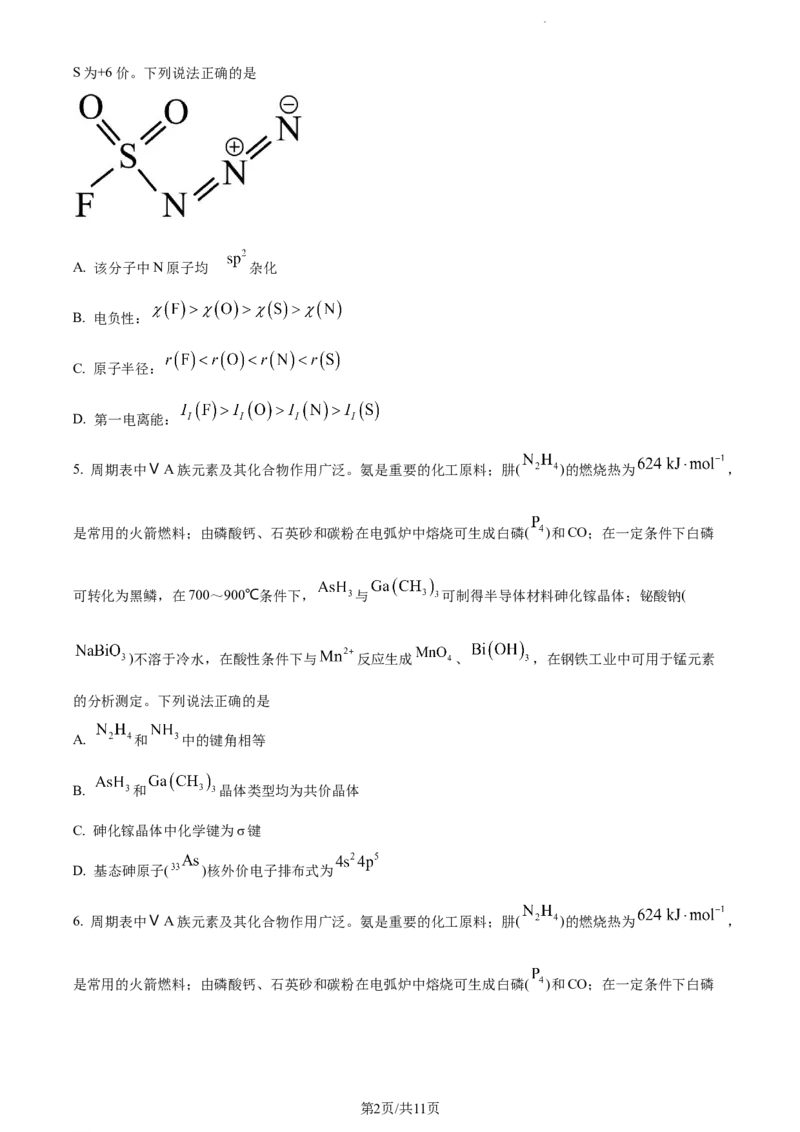
4. 我国科研人员发现氟磺酰基叠氮( )是一种安全、高效的“点击化学”试剂,其结构式如图,其中
第1页/共11页
学科网(北京)股份有限公司S为+6价。下列说法正确的是
为
A. 该分子中N原子均 杂化
B. 电负性:
C. 原子半径:
D. 第一电离能:
5. 周期表中ⅤA族元素及其化合物作用广泛。氨是重要的化工原料;肼( )的燃烧热为 ,
是常用的火箭燃料;由磷酸钙、石英砂和碳粉在电弧炉中熔烧可生成白磷( )和CO;在一定条件下白磷
可转化为黑鳞,在700~900℃条件下, 与 可制得半导体材料砷化镓晶体;铋酸钠(
)不溶于冷水,在酸性条件下与 反应生成 、 ,在钢铁工业中可用于锰元素
的分析测定。下列说法正确的是
A. 和 中的键角相等
B. 和 晶体类型均为共价晶体
C. 砷化镓晶体中化学键为σ键
D. 基态砷原子( )核外价电子排布式为
6. 周期表中ⅤA族元素及其化合物作用广泛。氨是重要的化工原料;肼( )的燃烧热为 ,
是常用的火箭燃料;由磷酸钙、石英砂和碳粉在电弧炉中熔烧可生成白磷( )和CO;在一定条件下白磷
第2页/共11页
学科网(北京)股份有限公司可转化为黑鳞;在700~900℃条件下, 与 可制得半导体材料砷化镓晶体;铋酸钠(
)不溶于冷水,在酸性条件下与 反应生成 、 ,在钢铁工业中可用于锰元素
的分析测定。下列化学反应表示正确的是( )
A. 肼的燃烧热的热化学方程式: kJ⋅mol
B. 制单质磷:
C. 制砷化镓晶体:
D. 铋酸钠氧化 ;
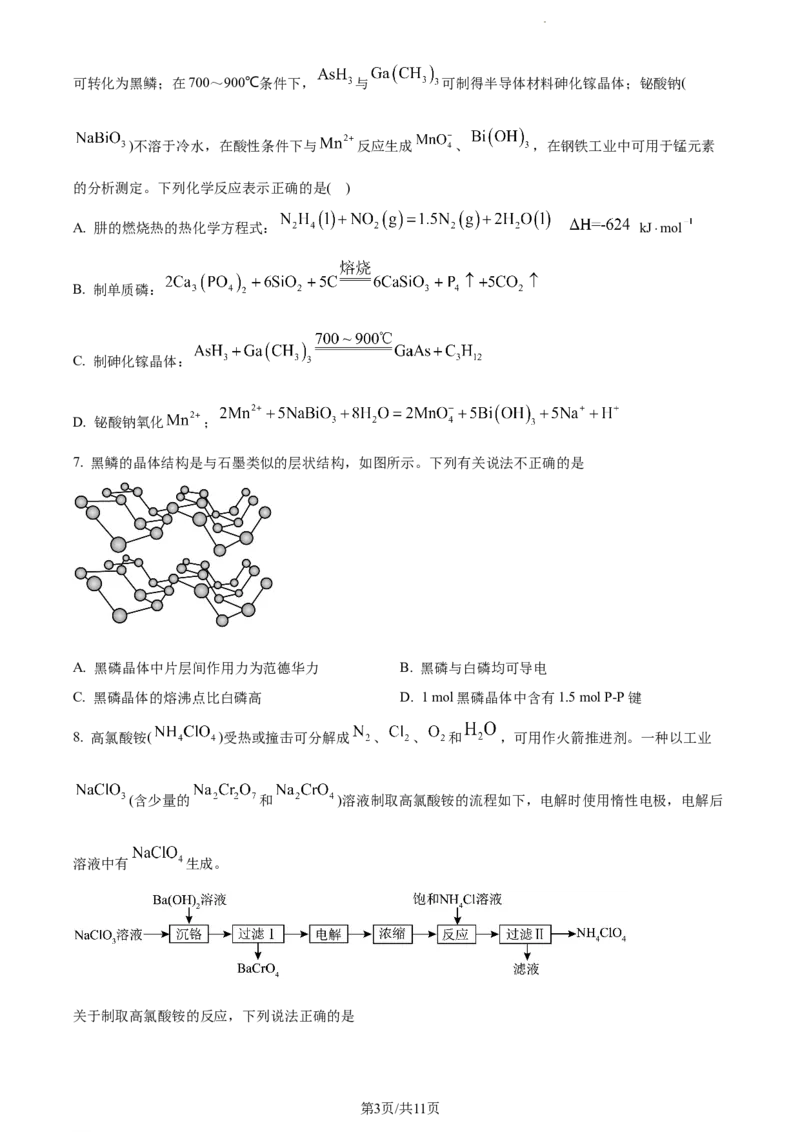
7. 黑鳞的晶体结构是与石墨类似的层状结构,如图所示。下列有关说法不正确的是
A. 黑磷晶体中片层间作用力为范德华力 B. 黑磷与白磷均可导电
C. 黑磷晶体的熔沸点比白磷高 D. 1 mol黑磷晶体中含有1.5 mol P-P键
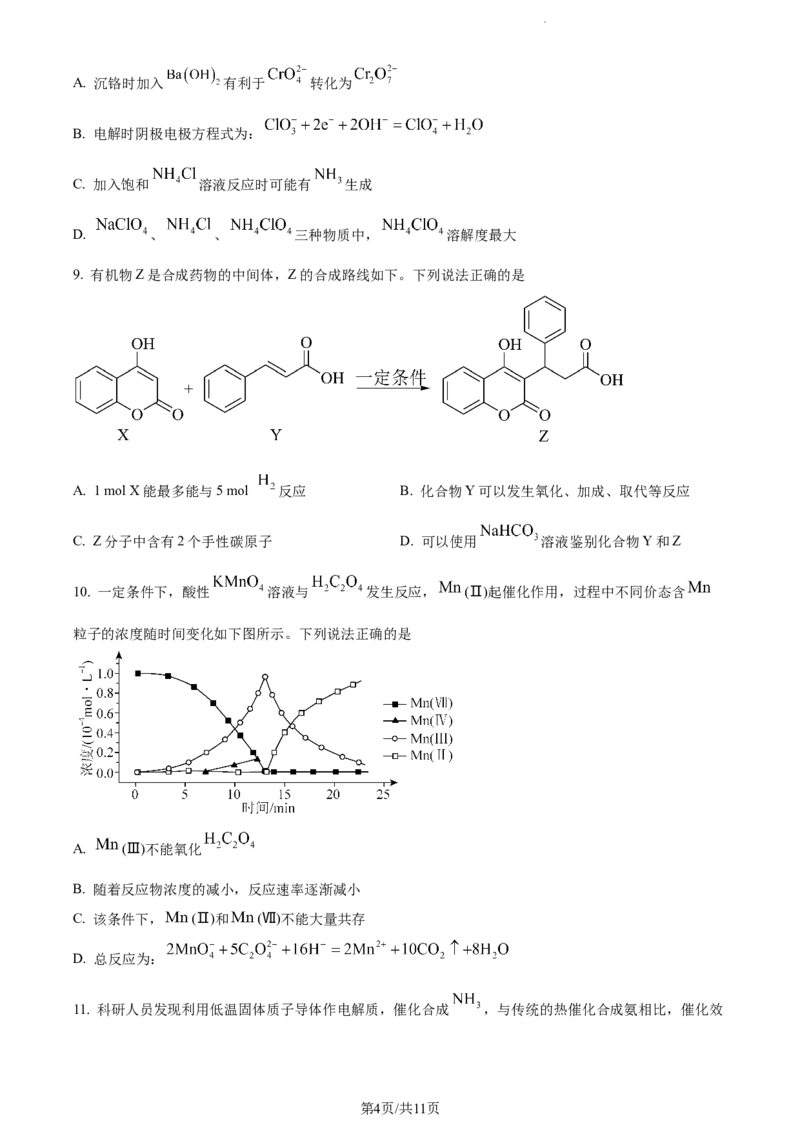
8. 高氯酸铵( )受热或撞击可分解成 、 、 和 ,可用作火箭推进剂。一种以工业
(含少量的 和 )溶液制取高氯酸铵的流程如下,电解时使用惰性电极,电解后
溶液中有 生成。
关于制取高氯酸铵的反应,下列说法正确的是
第3页/共11页
学科网(北京)股份有限公司A. 沉铬时加入 有利于 转化为
B. 电解时阴极电极方程式为:
C. 加入饱和 溶液反应时可能有 生成
D. 、 、 三种物质中, 溶解度最大
9. 有机物Z是合成药物的中间体,Z的合成路线如下。下列说法正确的是
A. 1 mol X能最多能与5 mol 反应 B. 化合物Y可以发生氧化、加成、取代等反应
C. Z分子中含有2个手性碳原子 D. 可以使用 溶液鉴别化合物Y和Z
10. 一定条件下,酸性 溶液与 发生反应, (Ⅱ)起催化作用,过程中不同价态含
粒子的浓度随时间变化如下图所示。下列说法正确的是
A. (Ⅲ)不能氧化
B. 随着反应物浓度的减小,反应速率逐渐减小
C. 该条件下, (Ⅱ)和 (Ⅶ)不能大量共存
D. 总反应为:
11. 科研人员发现利用低温固体质子导体作电解质,催化合成 ,与传统的热催化合成氨相比,催化效
第4页/共11页
学科网(北京)股份有限公司率较高。其合成原理如图甲所示,其他条件不变,电源电压改变与生成 速率的关系如图乙所示,下列
说法不正确的是
A. 是该合成氨装置的阳极
B. 电极出口混合气可能含有 、 、
C. 若H₂的进出口流量差为22.4 L/min(标准状况),则固体质子导体中 的流速为1 mol/min
D. 当电压高于1.2V时,随电压升高, 在阴极放电生成 的速率加快
12. 室温下,下列实验探究方案能达到探究目的的是
选
实验目的 实验方案
项
将溴乙烷、乙醇和烧碱的混合物加热,产生的气体通入溴的
A 证明溴乙烷发生了消去反应
溶液中,观察溶液颜色变化
B 证明 向NaCl、NaI混合溶液中滴加少量 溶液,观察沉淀的颜色
检验NaCl溶液中是否存在KCl 用洁净的铂丝蘸取该溶液,在酒精灯外焰上灼烧,观察火焰是否
C
杂质 出现紫色
比较 和HClO的酸 相同条件下,分别用pH试纸测定0.1 mol/L 溶液、
D
性强弱 0.1 mol/L NaClO溶液的pH,观察pH试纸颜色
A. A B. B C. C D. D
13. 化学链甲烷干重整联合制氢部分工艺的原理如图所示:
第5页/共11页
学科网(北京)股份有限公司将1mol 和 充入干重整反应器,发生:
重整反应:
积炭反应:
研究发现,增大n(FeO)能减少积炭,并增大 的值。下列说法不正确的是
的
A. X 化学式为 ,被还原后可循环利用
.
B 增大n(FeO)能增大 ,推测发生
C. 减少n(FeO),Fe上的积炭会导致蒸汽反应器中产生的 纯度降低
D. 干重整反应器中存在:
非选择题:共4题,共61分
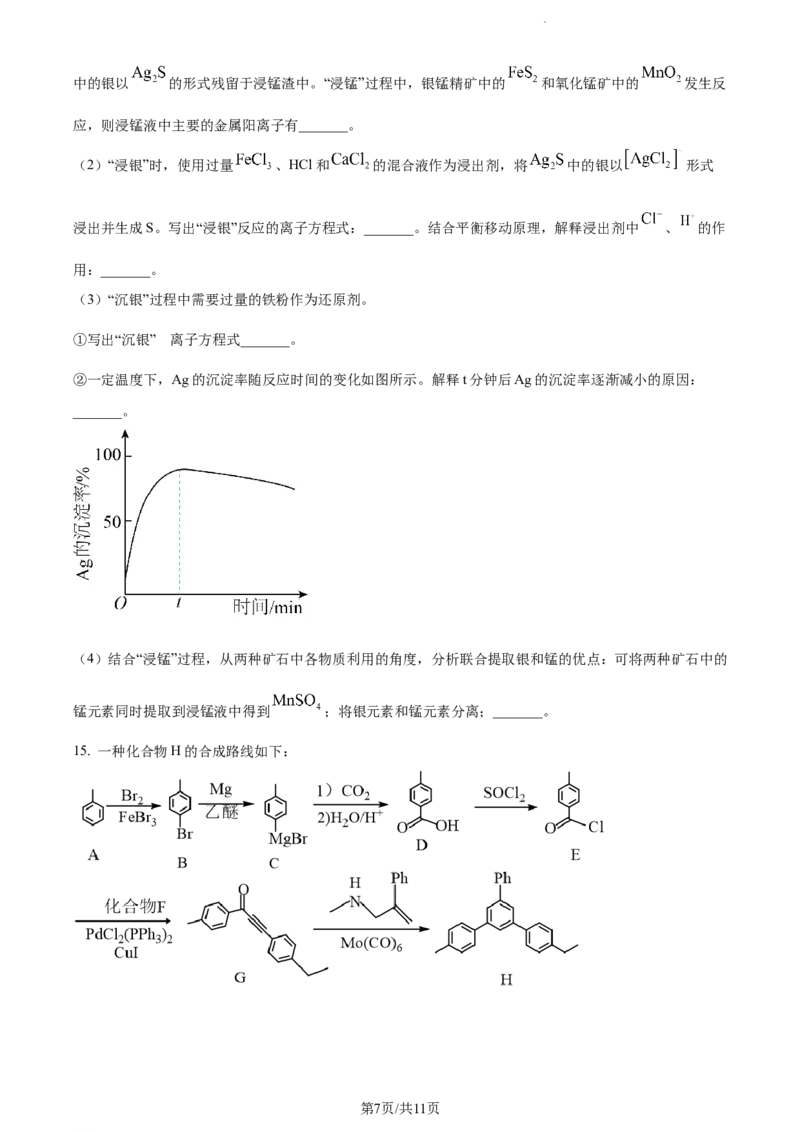
14. 以银锰精矿(主要含 、MnS、 )和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程
示意图如下。
已知:酸性条件下, 的氧化性强于 。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出:矿石
第6页/共11页
学科网(北京)股份有限公司中的银以 的形式残留于浸锰渣中。“浸锰”过程中,银锰精矿中的 和氧化锰矿中的 发生反
应,则浸锰液中主要的金属阳离子有_______。
(2)“浸银”时,使用过量 、HCl和 的混合液作为浸出剂,将 中的银以 形式
浸出并生成S。写出“浸银”反应的离子方程式:_______。结合平衡移动原理,解释浸出剂中 、 的作
用:_______。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
的
①写出“沉银” 离子方程式_______。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:
_______。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优点:可将两种矿石中的
锰元素同时提取到浸锰液中得到 ;将银元素和锰元素分离;_______。
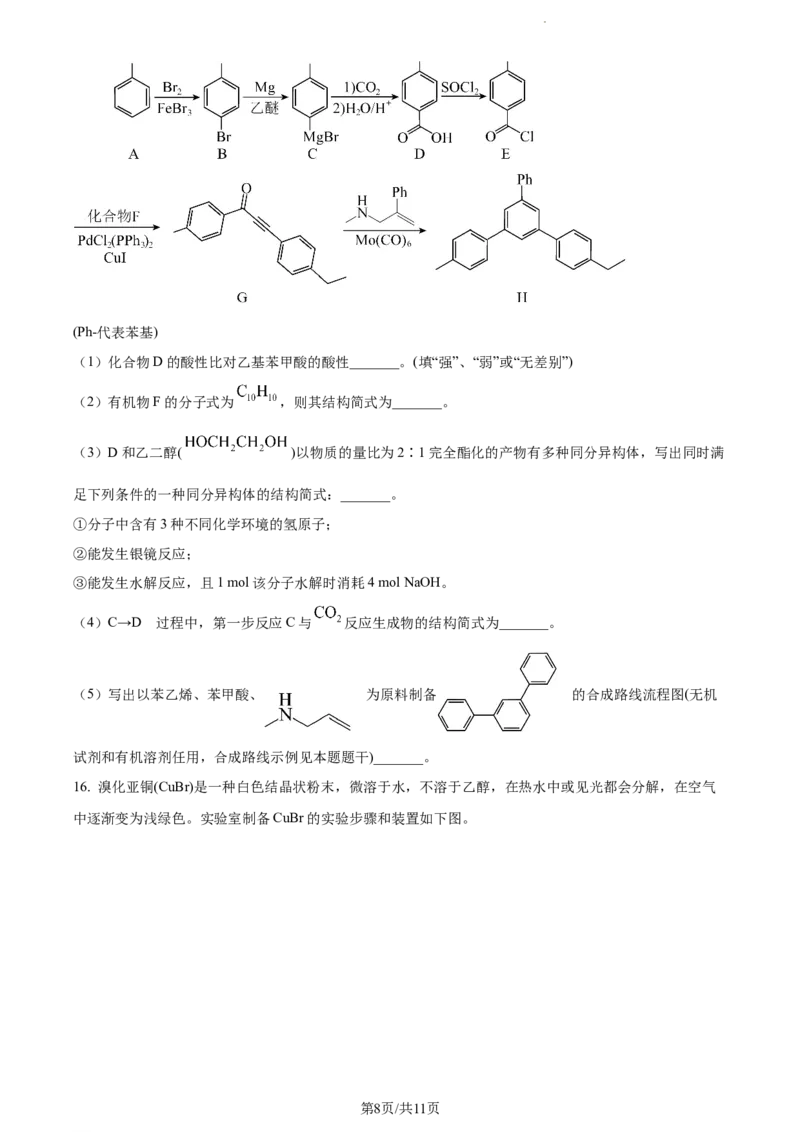
15. 一种化合物H的合成路线如下:
第7页/共11页
学科网(北京)股份有限公司(Ph-代表苯基)
(1)化合物D的酸性比对乙基苯甲酸的酸性_______。(填“强”、“弱”或“无差别”)
(2)有机物F的分子式为 ,则其结构简式为_______。
(3)D和乙二醇( )以物质的量比为2∶1完全酯化的产物有多种同分异构体,写出同时满
足下列条件的一种同分异构体的结构简式:_______。
①分子中含有3种不同化学环境的氢原子;
②能发生银镜反应;
③能发生水解反应,且1 mol该分子水解时消耗4 mol NaOH。
的
(4)C→D 过程中,第一步反应C与 反应生成物的结构简式为_______。
(5)写出以苯乙烯、苯甲酸、 为原料制备 的合成路线流程图(无机
试剂和有机溶剂任用,合成路线示例见本题题干)_______。
16. 溴化亚铜(CuBr)是一种白色结晶状粉末,微溶于水,不溶于乙醇,在热水中或见光都会分解,在空气
中逐渐变为浅绿色。实验室制备CuBr的实验步骤和装置如下图。
第8页/共11页
学科网(北京)股份有限公司回答下列问题:
(1)装置A中的离子方程式为_______。
(2)装置常采用60℃水浴加热,温度不宜过高的原因是_______;加料完成后,60℃水浴加热,以一定速
率搅拌,能提高 吸收率的方法为_______。
(3)欲利用上述装置烧杯中的吸收液(经检测含有 、 )制取较纯净的 晶体。补
充完整制取 晶体的实验方案:向烧杯内的吸收液中,_______,置于真空干燥箱中干燥。(已知:
室温下从饱和 溶液中结晶出 ,34~100℃结晶出 ;可选用试剂: 气
体、20% NaOH溶液、乙醇)
(4)CuBr在空气中氧化所得绿色粉末为 ,为探究该粉末的化学式,现进行如下实验:
准确称取一定质量的绿色粉末,溶于足量乙酸中,用蒸馏水配制成100 mL溶液。
①取25mL溶液,向其中加入足量的 溶液,充分反应后过滤、洗涤、干燥,所得淡黄色固体质量
为0.94 g。
②另取25 mL溶液,向其中加入过量的KI溶液,再用0.400 mol⋅L 标准溶液滴定至终点,消
耗25.00 mL。已知反应的方程式如下: 、 。请确定
该绿色粉末的化学式_______(请写出计算过程)。
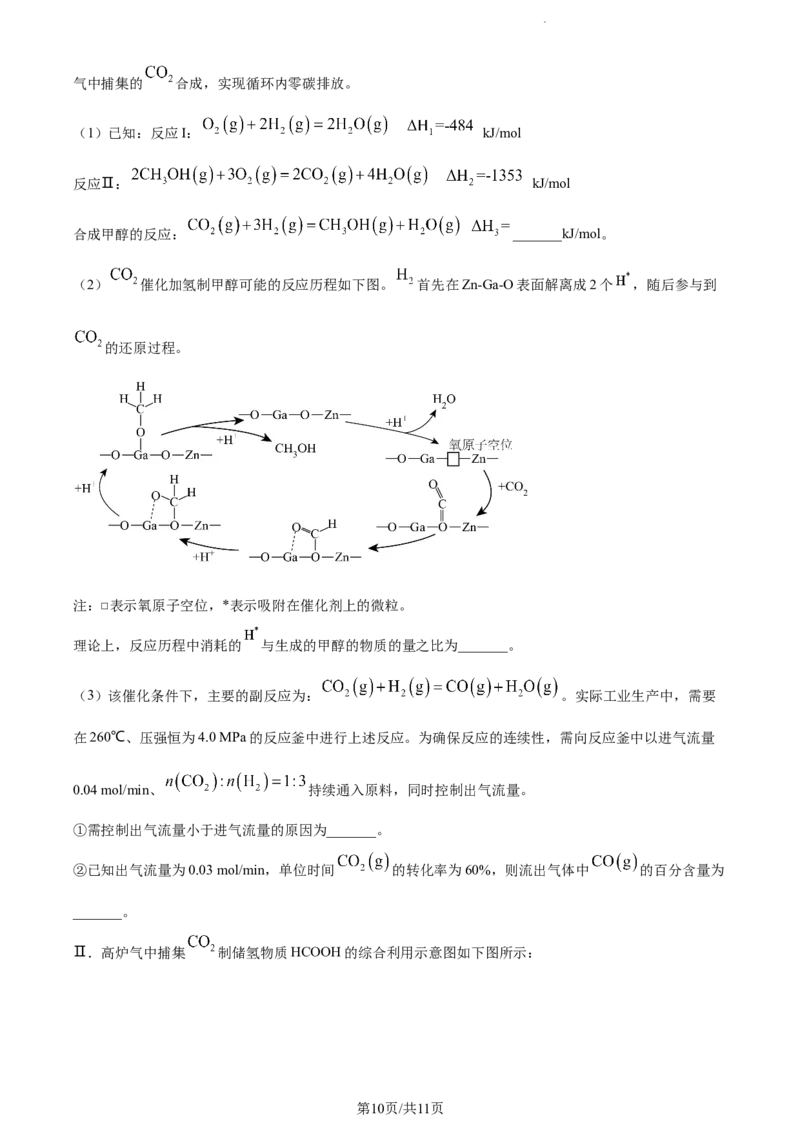
17. 二氧化碳的排放受到环境和能源领域的关注,其综合利用是研究的重要课题。
Ⅰ.第19届亚洲运动会使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,利用焦炉气中的 与从工业尾
第9页/共11页
学科网(北京)股份有限公司气中捕集的 合成,实现循环内零碳排放。
(1)已知:反应I: kJ/mol
反应Ⅱ: kJ/mol
合成甲醇的反应: _______kJ/mol。
(2) 催化加氢制甲醇可能的反应历程如下图。 首先在Zn-Ga-O表面解离成2个 ,随后参与到
的还原过程。
注:□表示氧原子空位,*表示吸附在催化剂上的微粒。
理论上,反应历程中消耗的 与生成的甲醇的物质的量之比为_______。
(3)该催化条件下,主要的副反应为: 。实际工业生产中,需要
在260℃、压强恒为4.0 MPa的反应釜中进行上述反应。为确保反应的连续性,需向反应釜中以进气流量
0.04 mol/min、 持续通入原料,同时控制出气流量。
①需控制出气流量小于进气流量的原因为_______。
②已知出气流量为0.03 mol/min,单位时间 的转化率为60%,则流出气体中 的百分含量为
_______。
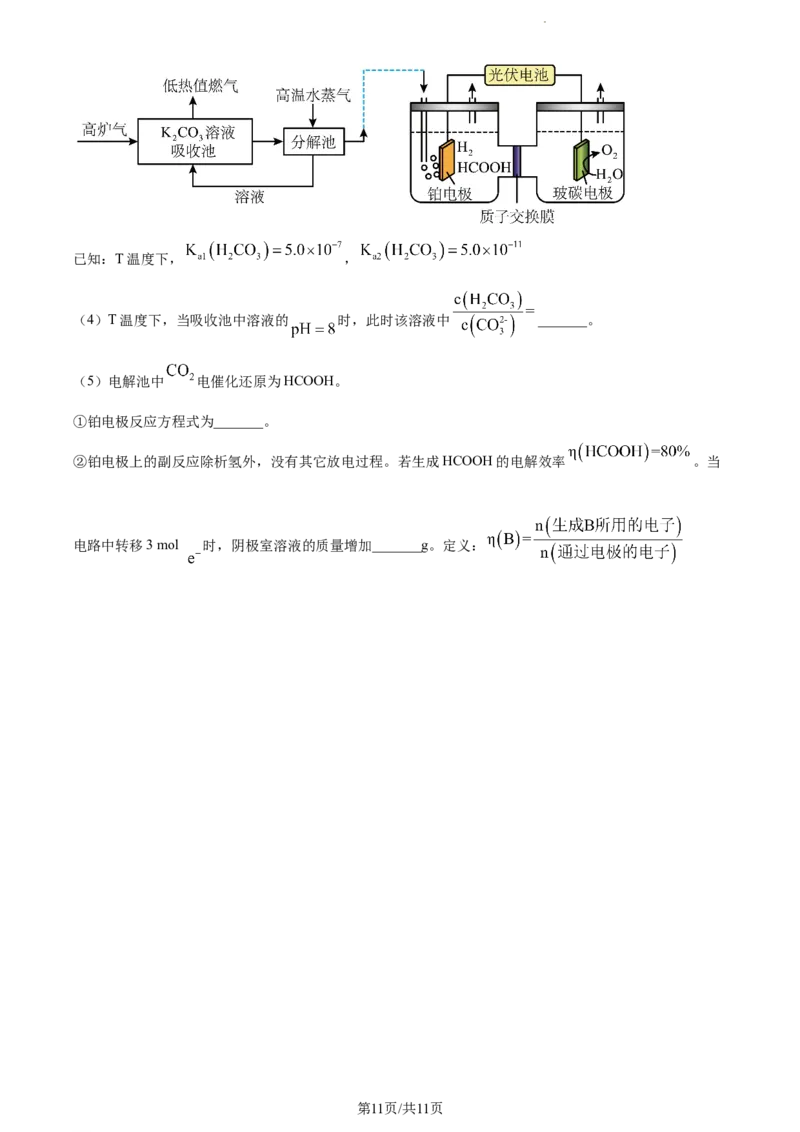
Ⅱ.高炉气中捕集 制储氢物质HCOOH的综合利用示意图如下图所示:
第10页/共11页
学科网(北京)股份有限公司已知:T温度下, ,
(4)T温度下,当吸收池中溶液的 时,此时该溶液中 _______。
(5)电解池中 电催化还原为HCOOH。
①铂电极反应方程式为_______。
②铂电极上的副反应除析氢外,没有其它放电过程。若生成HCOOH的电解效率 。当
电路中转移3 mol 时,阴极室溶液的质量增加_______g。定义:
第11页/共11页
学科网(北京)股份有限公司