文档内容
2023—2024 学年度(上)六校高三期初考试化学试题
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 Si—28 S—32
一、选择题(每题3分,共45分。每小题只有一个选项符合题意)
1.化学与生活密切相关,下列叙述正确的是
A.NO 和碳氢化合物是造成光化学烟雾污染的主要原因
x
B.向2mL蛋白质溶液中加入适量的饱和硫酸钠溶液,产生沉淀,则蛋白质变性
C.工业使用的碳纤维属于新型有机高分子材料
D.氢燃料汽车是利用电解池的原理提供电能
2.下列化学用语表示正确的是
A.异丁烯的键线式: B.SO 2-的中心原子的杂化轨道类型:sp3
4
C.纤维素的分子式:(C H O )n D.BF 的电子式:
6 12 6 3
3.工业上制备下列物质的生产流程合理的是
A.由铝土矿冶炼铝:铝土矿Al O 提纯AlCl 电解Al
2 3 3
B.由NaCl制漂白粉:饱和食盐水电解Cl NaOH溶液漂白粉
2
C.由石英砂制纯硅:石英砂焦炭粗硅HClSiHCl H2纯硅
高温 加热 3 高温
D.工业合成硝酸:N O2 放电NOO2NO H2OHNO
2 2 3
4.探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是
实验方案 现象 结论
向淀粉溶液中加适量稀硫酸,加热,冷却后滴加
A 溶液变蓝 淀粉有剩余
少量碘水
B 用玻璃棒蘸取次氯酸钠溶液点在pH试纸上 试纸变白 次氯酸钠溶液呈中性
向2 mL 0.1 molL-1AgNO 溶液中先滴加4滴 先产生白色沉淀, AgCl转化为AgI,
3
C
再产生黄色沉淀 AgI溶解度小于AgCl
0.1 molL-1KCl溶液,再滴加4滴0.1 molL-1KI溶液
学科网(北京)股份有限公司溶解度
取两份新制氯水,分别滴加AgNO 溶液和淀粉KI 前者有白色沉淀,氯气与水的反应存在
3
D
后者溶液变蓝色 限度
溶液
A.A B.B C.C D.D
5.工业上将Na CO 和Na S 配成溶液,再通入SO 可制取Na S O ,同时放出CO 。下列说
2 3 2 2 2 2 3 2
法不正确的是( )
A.上述反应中氧化剂和还原剂的物质的量比是2:l
B.每生成1 mol Na S O 转移4 mol电子
2 2 3
C.上述反应中的Na CO 和Na S 的物质的量比最佳是1:2
2 3 2
D.Na S O 既是氧化产物,又是还原产物
2 2 3
6.下列有关有机化合物X 的说法不正确的是
A.1mol化合物X 最多能与2molNaOH反应 B.该有机物分子式为C H O
16 12 4
C.在酸性条件下水解,水解产物只有一种 D.分子中两个苯环不一定处于同一平面
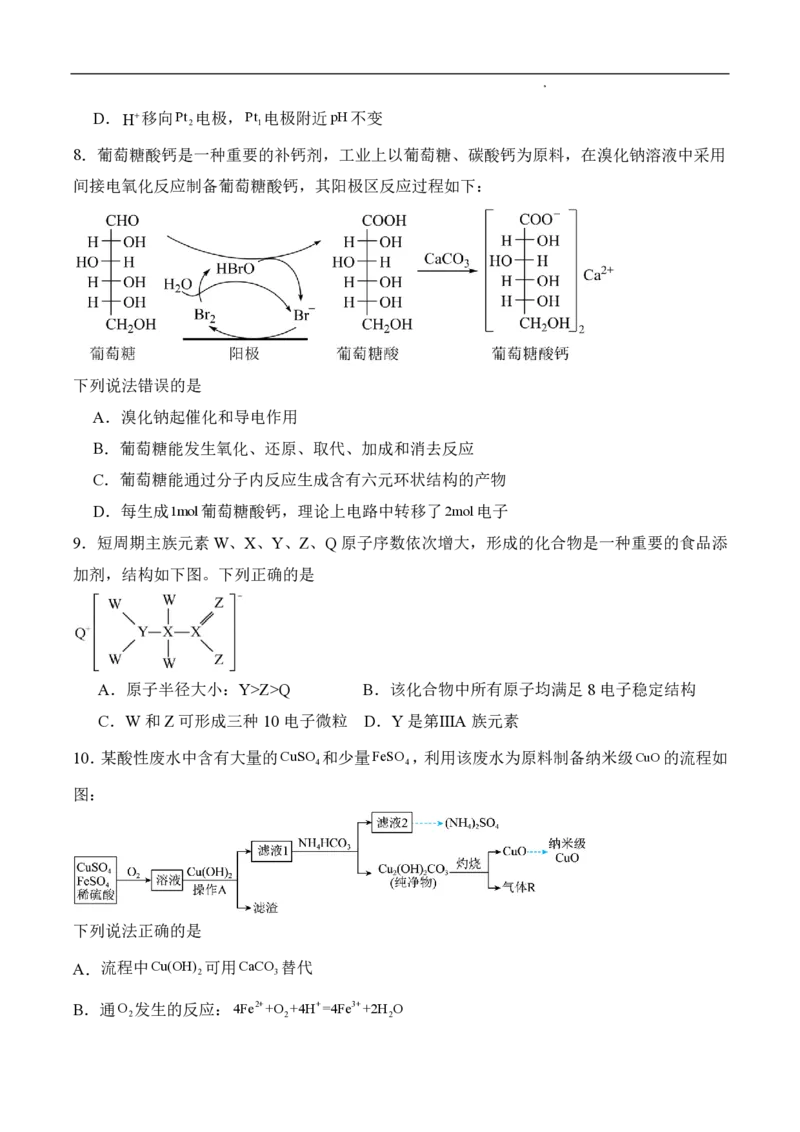
7.党的二十大报告中指出:要“加强污染物协同控制,基本消除重污染天气”。二氧化硫—空
气质子交换膜燃料电池实现了制硫酸、发电、环保二位一体的结合,可以解决酸雨等环境污染
问题,原理如图所示。下列说法正确的是
A.该电池放电时电流流向:Pt 电极负载Pt 电极
1 2
B.Pt 电极附近发生的反应:SO 2e2H O=SO24H
1 2 2 4
C.放电过程中若消耗22.4LO ,理论上可以消除2molSO
2 2
学科网(北京)股份有限公司D.H移向Pt 电极,Pt 电极附近pH不变
2 1
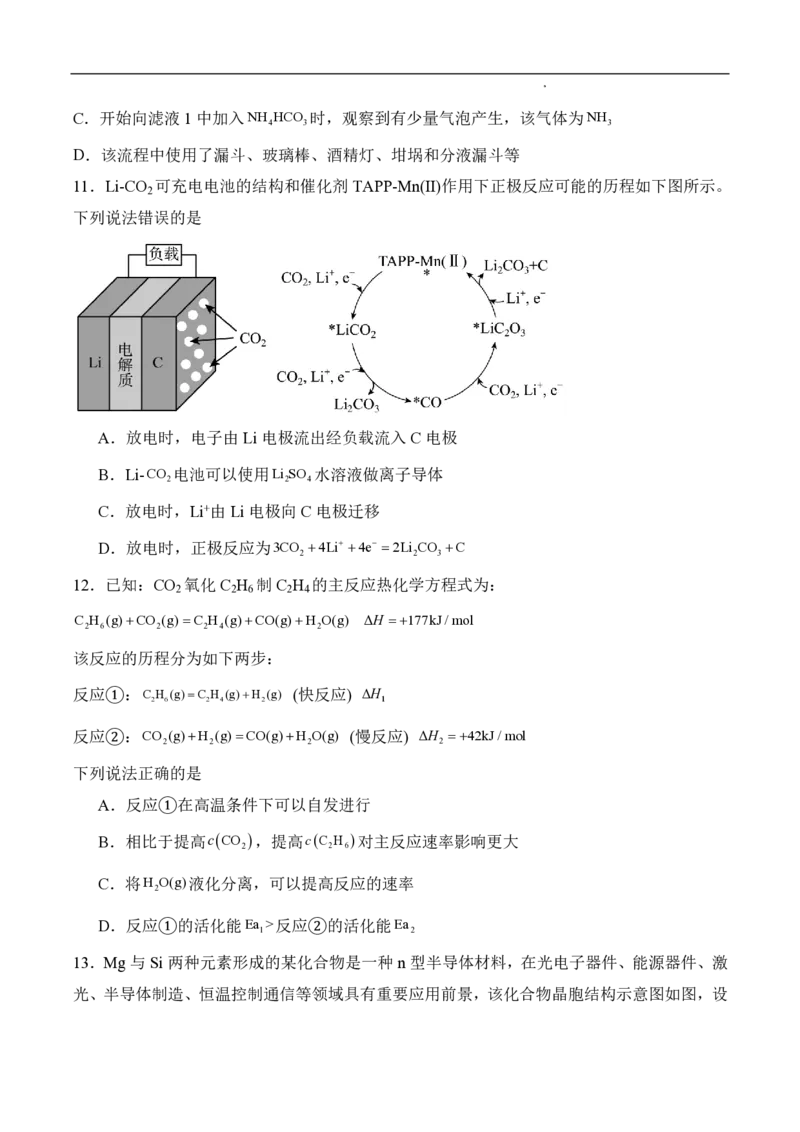
8.葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用
间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如下:
下列说法错误的是
A.溴化钠起催化和导电作用
B.葡萄糖能发生氧化、还原、取代、加成和消去反应
C.葡萄糖能通过分子内反应生成含有六元环状结构的产物
D.每生成1mol葡萄糖酸钙,理论上电路中转移了2mol电子
9.短周期主族元素 W、X、Y、Z、Q 原子序数依次增大,形成的化合物是一种重要的食品添
加剂,结构如下图。下列正确的是
A.原子半径大小:Y>Z>Q B.该化合物中所有原子均满足 8电子稳定结构
C.W和Z可形成三种10电子微粒 D.Y 是第ⅢA 族元素
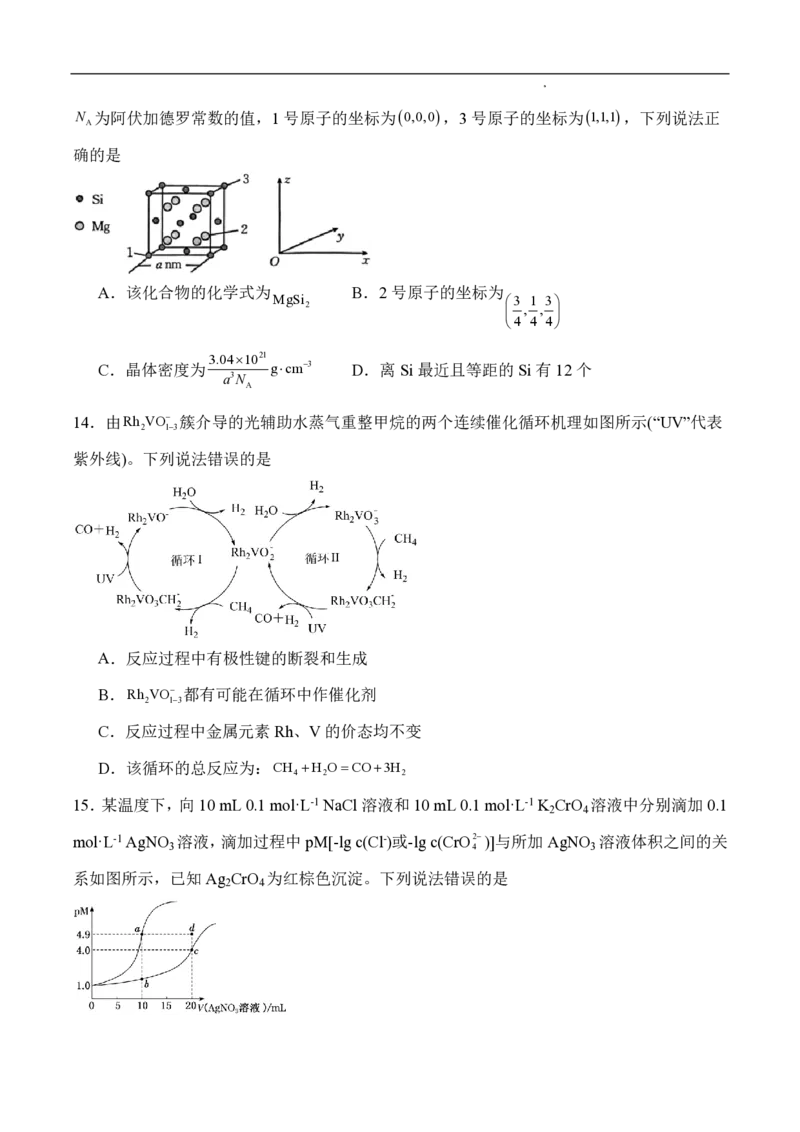
10.某酸性废水中含有大量的CuSO 和少量FeSO ,利用该废水为原料制备纳米级CuO的流程如
4 4
图:
下列说法正确的是
A.流程中Cu(OH) 可用CaCO 替代
2 3
B.通O 发生的反应:4Fe2++O +4H+=4Fe3++2H O
2 2 2
学科网(北京)股份有限公司C.开始向滤液 1中加入NH HCO 时,观察到有少量气泡产生,该气体为NH
4 3 3
D.该流程中使用了漏斗、玻璃棒、酒精灯、坩埚和分液漏斗等
11.Li-CO 可充电电池的结构和催化剂 TAPP-Mn(Ⅱ)作用下正极反应可能的历程如下图所示。
2
下列说法错误的是
A.放电时,电子由Li电极流出经负载流入 C电极
B.Li-CO 电池可以使用Li SO 水溶液做离子导体
2 2 4
C.放电时,Li+由Li电极向C 电极迁移
D.放电时,正极反应为3CO 4Li 4e 2Li CO C
2 2 3
12.已知:CO 氧化C H 制C H 的主反应热化学方程式为:
2 2 6 2 4
C H (g)CO (g)C H (g)CO(g)H O(g) ΔH 177kJ/mol
2 6 2 2 4 2
该反应的历程分为如下两步:
反应①:C H (g)C H (g)H (g) (快反应) ΔH
2 6 2 4 2 1
反应②:CO (g)H (g)CO(g)H O(g) (慢反应) ΔH 42kJ/mol
2 2 2 2
下列说法正确的是
A.反应①在高温条件下可以自发进行
B.相比于提高cCO ,提高cC H 对主反应速率影响更大
2 2 6
C.将H O(g)液化分离,可以提高反应的速率
2
D.反应①的活化能Ea >反应②的活化能Ea
1 2
13.Mg 与Si 两种元素形成的某化合物是一种n型半导体材料,在光电子器件、能源器件、激
光、半导体制造、恒温控制通信等领域具有重要应用前景,该化合物晶胞结构示意图如图,设
学科网(北京)股份有限公司N 为阿伏加德罗常数的值,1号原子的坐标为0,0,0,3号原子的坐标为1,1,1,下列说法正
A
确的是
A.该化合物的化学式为 B.2号原子的坐标为
MgSi 3 1 3
2 , ,
4 4 4
3.041021
C.晶体密度为 gcm3 D.离Si最近且等距的Si有12个
a3N
A
14.由Rh VO 簇介导的光辅助水蒸气重整甲烷的两个连续催化循环机理如图所示(“UV”代表
2 13
紫外线)。下列说法错误的是
A.反应过程中有极性键的断裂和生成
B.Rh VO 都有可能在循环中作催化剂
2 13
C.反应过程中金属元素Rh、V 的价态均不变
D.该循环的总反应为:CH H OCO3H
4 2 2
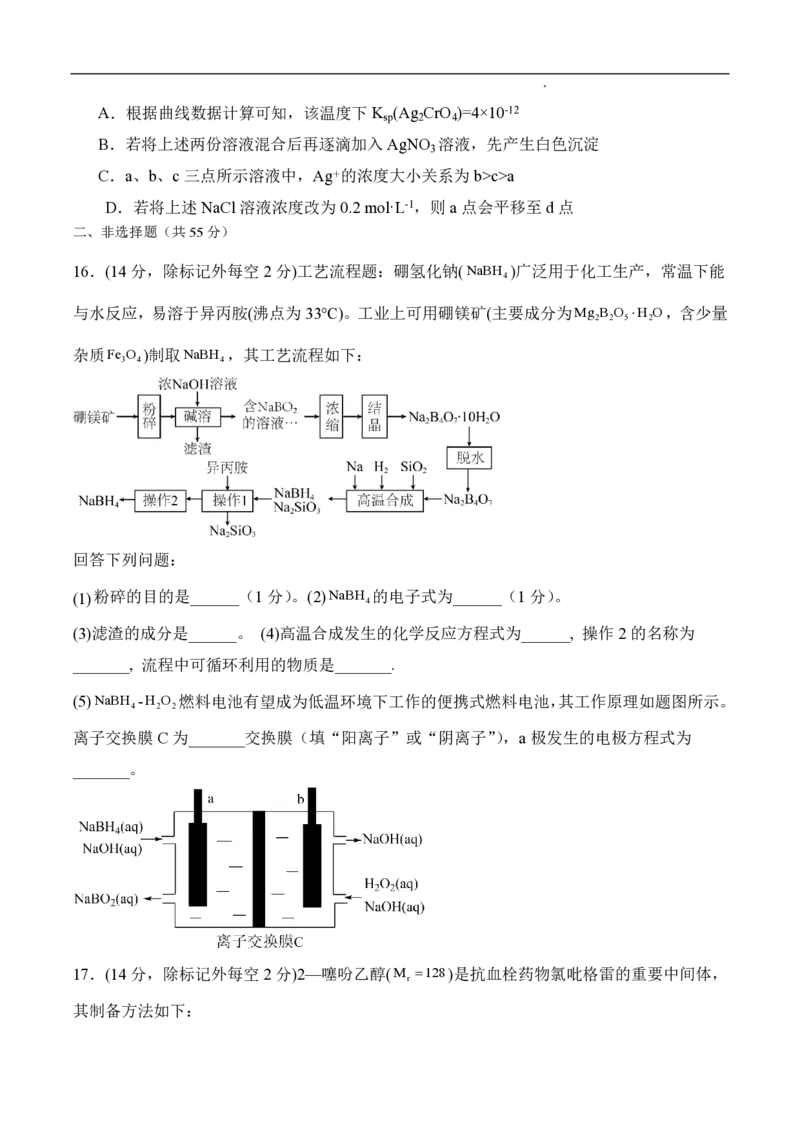
15.某温度下,向10 mL 0.1 mol·L-1 NaCl溶液和10 mL 0.1 mol·L-1 K CrO 溶液中分别滴加0.1
2 4
mol·L-1 AgNO 溶液,滴加过程中 pM[-lg c(Cl-)或-lg c(CrO2)]与所加AgNO 溶液体积之间的关
3 4 3
系如图所示,已知Ag CrO 为红棕色沉淀。下列说法错误的是
2 4
学科网(北京)股份有限公司A.根据曲线数据计算可知,该温度下K (Ag CrO )=4×10-12
sp 2 4
B.若将上述两份溶液混合后再逐滴加入AgNO 溶液,先产生白色沉淀
3
C.a、b、c三点所示溶液中,Ag+的浓度大小关系为b>c>a
D.若将上述NaCl溶液浓度改为 0.2 mol·L-1,则a点会平移至d点
二、非选择题(共55分)
16.(14 分,除标记外每空2分)工艺流程题:硼氢化钠(NaBH )广泛用于化工生产,常温下能
4
与水反应,易溶于异丙胺(沸点为33℃)。工业上可用硼镁矿(主要成分为Mg B O H O,含少量
2 2 5 2
杂质Fe O )制取NaBH ,其工艺流程如下:
3 4 4
回答下列问题:
(1)粉碎的目的是______(1分)。(2)NaBH 的电子式为______(1分)。
4
(3)滤渣的成分是______。 (4)高温合成发生的化学反应方程式为______, 操作2的名称为
_______, 流程中可循环利用的物质是_______.
(5)NaBH -H O 燃料电池有望成为低温环境下工作的便携式燃料电池,其工作原理如题图所示。
4 2 2
离子交换膜C为_______交换膜(填“阳离子”或“阴离子”),a极发生的电极方程式为
_______。
17.(14 分,除标记外每空2分)2—噻吩乙醇(M 128)是抗血栓药物氯吡格雷的重要中间体,
r
其制备方法如下:
学科网(北京)股份有限公司Ⅰ.制钠砂。向烧瓶中加入300mL液体A 和4.60g金属钠,加热至钠熔化后,盖紧塞子,振荡至
大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10℃,加入25mL噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30min。
Ⅳ.水解。恢复室温,加入70mL水,搅拌30min;加盐酸调pH至4~6,继续反应2h,分液;
用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO ,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩
4
和液体A 后,得到产品17.92g。
回答下列问题:
(1)步骤Ⅰ中液体A 可以选择_______(1分)。
a.乙醇 b.水 c.乙酸 d.甲苯
(2)噻吩沸点低于吡咯( )的原因是_______(1分)。
(3)步骤Ⅱ的化学方程式为_______。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是_______。
(5)步骤Ⅳ中用盐酸调节pH的目的是_______。
(6)下列仪器在步骤Ⅴ中无需使用的是_______(填名称):无水MgSO 的作用为_______。
4
(7)产品的产率为_______(用Na计算,精确至0.1%)。
18.(14分,每空2分)我国力争2030年前实现碳达峰,2060 年前实现碳中和。CO 的综合
2
利用是实现碳中和的措施之一。
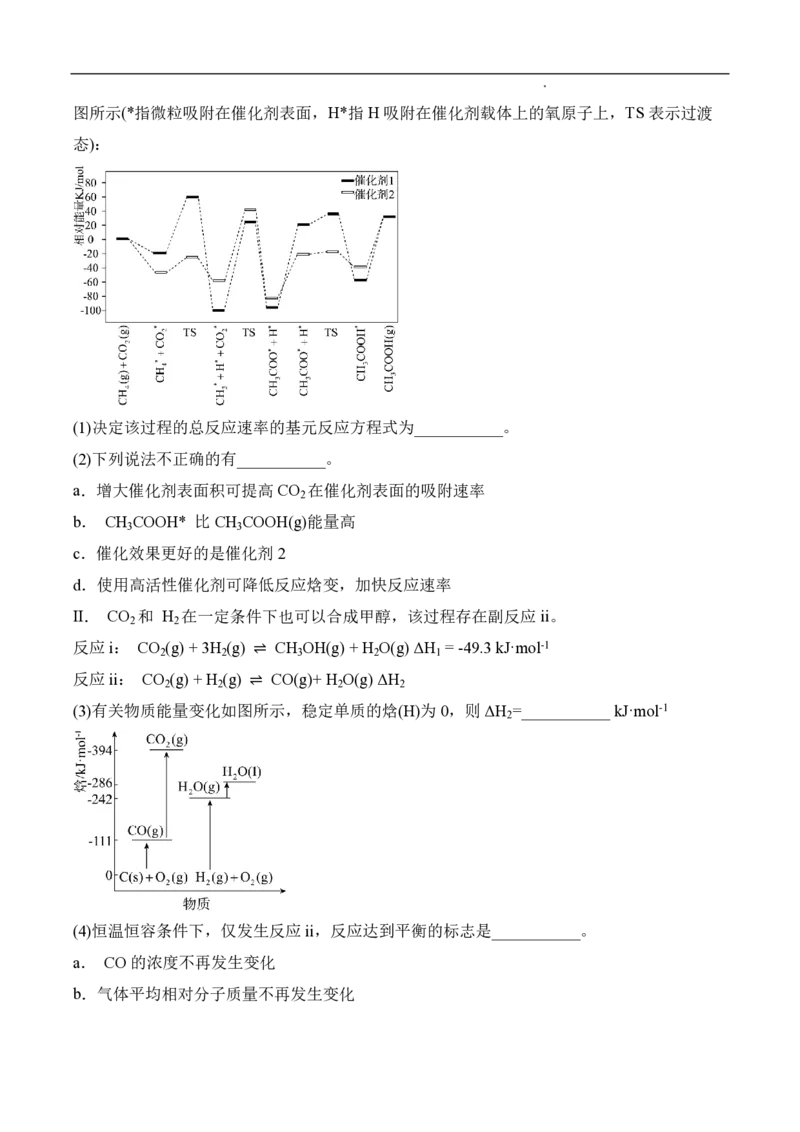
Ⅰ. CO 和CH 在催化剂表面可以合成CH COOH,该反应的历程和相对能量的变化情况如下
2 4 3
学科网(北京)股份有限公司图所示(*指微粒吸附在催化剂表面,H*指H 吸附在催化剂载体上的氧原子上,TS表示过渡
态):
(1)决定该过程的总反应速率的基元反应方程式为___________。
(2)下列说法不正确的有___________。
a.增大催化剂表面积可提高CO 在催化剂表面的吸附速率
2
b. CH COOH* 比CH COOH(g)能量高
3 3
c.催化效果更好的是催化剂2
d.使用高活性催化剂可降低反应焓变,加快反应速率
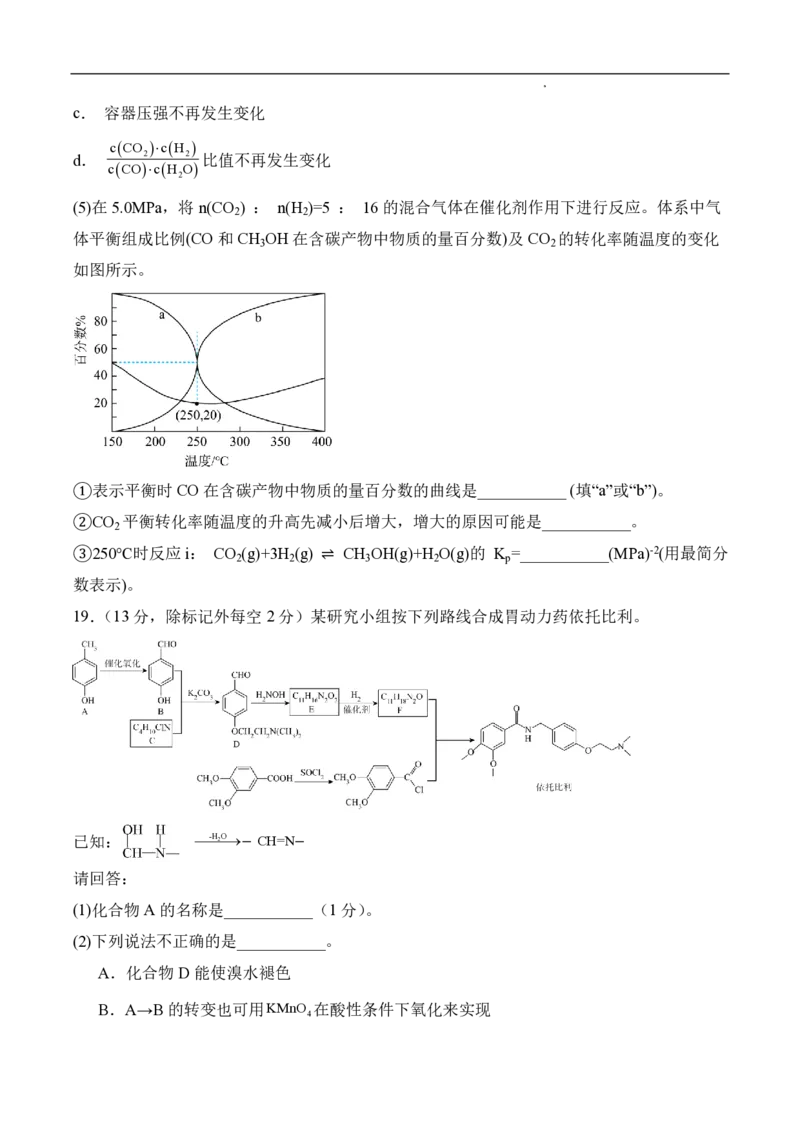
Ⅱ. CO 和 H 在一定条件下也可以合成甲醇,该过程存在副反应ii。
2 2
反应i: CO (g) + 3H (g) ⇌ CH OH(g) + H O(g) ΔH = -49.3 kJ·mol-1
2 2 3 2 1
反应ii: CO (g) + H (g) ⇌ CO(g)+ H O(g) ΔH
2 2 2 2
(3)有关物质能量变化如图所示,稳定单质的焓(H)为0,则ΔH =___________ kJ·mol-1
2
(4)恒温恒容条件下,仅发生反应ii,反应达到平衡的标志是___________。
a. CO 的浓度不再发生变化
b.气体平均相对分子质量不再发生变化
学科网(北京)股份有限公司c. 容器压强不再发生变化
cCO cH
d. 2 2 比值不再发生变化
cCOcH O
2
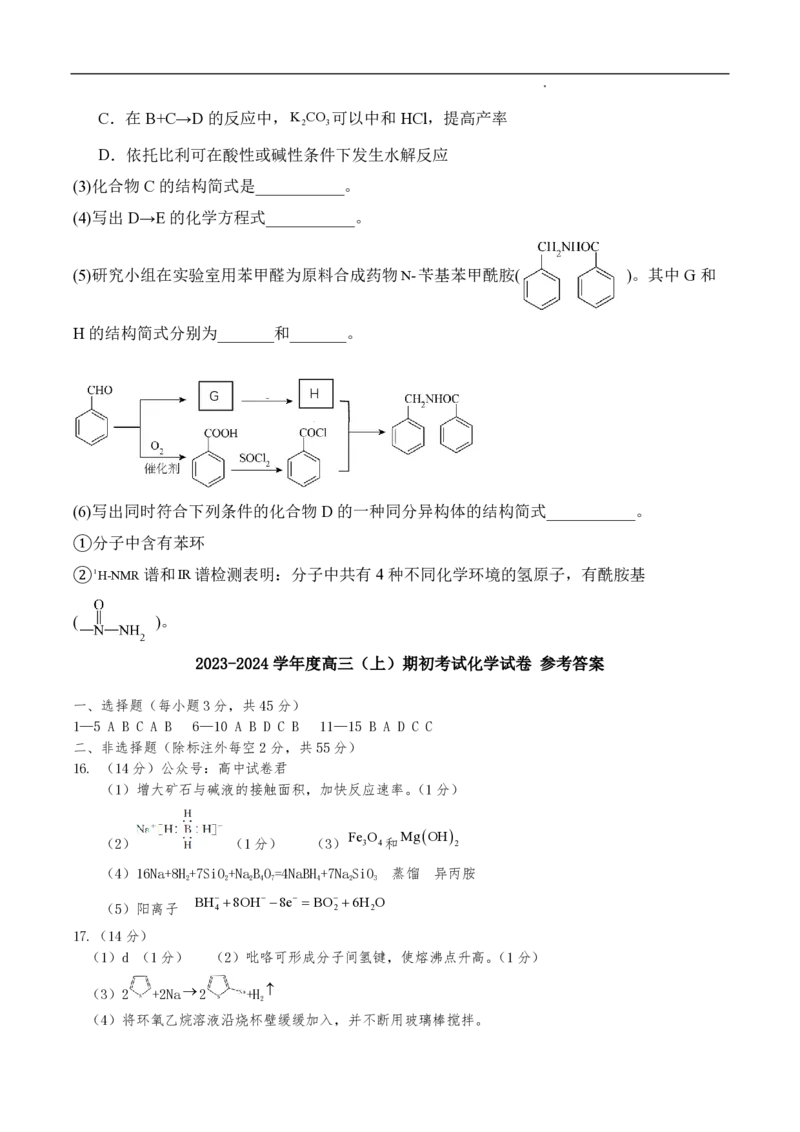
(5)在5.0MPa,将n(CO ) : n(H )=5 : 16的混合气体在催化剂作用下进行反应。体系中气
2 2
体平衡组成比例(CO 和CH OH 在含碳产物中物质的量百分数)及CO 的转化率随温度的变化
3 2
如图所示。
①表示平衡时CO 在含碳产物中物质的量百分数的曲线是___________ (填“a”或“b”)。
②CO 平衡转化率随温度的升高先减小后增大,增大的原因可能是___________。
2
③250℃时反应i: CO (g)+3H (g) ⇌ CH OH(g)+H O(g)的 K =___________(MPa)-2(用最简分
2 2 3 2 p
数表示)。
19.(13分,除标记外每空2分)某研究小组按下列路线合成胃动力药依托比利。
已知: -H2O— CH=N—
请回答:
(1)化合物A 的名称是___________(1分)。
(2)下列说法不正确的是___________。
A.化合物D 能使溴水褪色
B.A→B 的转变也可用KMnO 在酸性条件下氧化来实现
4
学科网(北京)股份有限公司C.在B+C→D 的反应中,K CO 可以中和HCl,提高产率
2 3
D.依托比利可在酸性或碱性条件下发生水解反应
(3)化合物C 的结构简式是___________。
(4)写出D→E的化学方程式___________。
(5)研究小组在实验室用苯甲醛为原料合成药物N-苄基苯甲酰胺( )。其中G 和
H 的结构简式分别为_______和_______。
G H
(6)写出同时符合下列条件的化合物D 的一种同分异构体的结构简式___________。
①分子中含有苯环
②1H-NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,有酰胺基
( )。
2023-2024 学年度高三(上)期初考试化学试卷 参考答案
一、选择题(每小题3分,共45分)
1—5 A B C A B 6—10 A B D C B 11—15 B A D C C
二、非选择题(除标注外每空2分,共55分)
16. (14分)公众号:高中试卷君
(1)增大矿石与碱液的接触面积,加快反应速率。(1分)
Fe O MgOH
(2) (1分) (3) 3 4和 2
(4)16Na+8H+7SiO+NaBO=4NaBH+7NaSiO 蒸馏 异丙胺
2 2 2 4 7 4 2 3
BH8OH8e BO6H O
(5)阳离子 4 2 2
17.(14分)
(1)d (1分) (2)吡咯可形成分子间氢键,使熔沸点升高。(1分)
(3)2 +2Na2 +H
2
(4)将环氧乙烷溶液沿烧杯壁缓缓加入,并不断用玻璃棒搅拌。
学科网(北京)股份有限公司(5)将NaOH中和,促使反应正向进行,提高反应物的转化率。
(6)球形冷凝管、分液漏斗 除去水 (7)70.0%
18.(14分)
(1)CH* + CO*= CHCOO*或CH*+ H* + CO*= CHCOO* +H*
3 2 3 3 2 3
(2)bd (3)+41 (4)ad
(5)①b ②温度升高后,以副反应(或反应ii )为主,副反应(或反应ii )是一个吸热反应,升高温度
平衡正向移动(其他合理答案也可)
1
③ 1372
19.(13分)
(1)对甲基苯酚(或4-甲基苯酚) (1分) (2)B (3)ClCHCHN(CH)
2 2 3 2
(4) + HNOH → + HO
2 2
(5)
(6) (写出其中任意一种即可)
学科网(北京)股份有限公司