文档内容
2023~2024 学年上学期高三年级 9 月联考卷
化 学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B 铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域
内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:高考范围,选择性必修3(占40%)。
5.可能用到的相对原子质量:H1 C12 O16 K39 Mn55 Zn65 Cd112 Sn119
一、选择题(本题共 15 小题,每小题 3 分,共行 45 分。在每小题列出的四个选项中,只有一
项是符合题目要求的)
1.化学与生活、科技、环境密切相关,下列说法错误的是
A.制造化为麒麟芯片的主要材料是SiO B.氯化铵溶液可去除铜器表面的铜绿
2
C.热的纯碱溶液可用于去除餐具表面的油污 D.化石燃料的燃烧会引起大气中CO 含量上升
2
2.下列化学用语或表述正确的是
A.对硝基甲苯的结构简式为 B.甲醛的电子式为
C.乙烯的球棍模型为 D.乙二醇的实验式为C H O
2 6 2
3.下列有机反应方程式书写错误的是
A.2CH CH OHO Cu2CH CHO2H O
3 2 2 3 2
B.CH CH Br CH BrCH Br
2 2 2 2 2
浓硫酸
C.CH CH OHCH COOH CH COOCH CH H O
3 2 3 3 2 3 2
D.2CH CH OH浓硫酸CH CH OCH CH H O
3 2 3 2 2 3 2
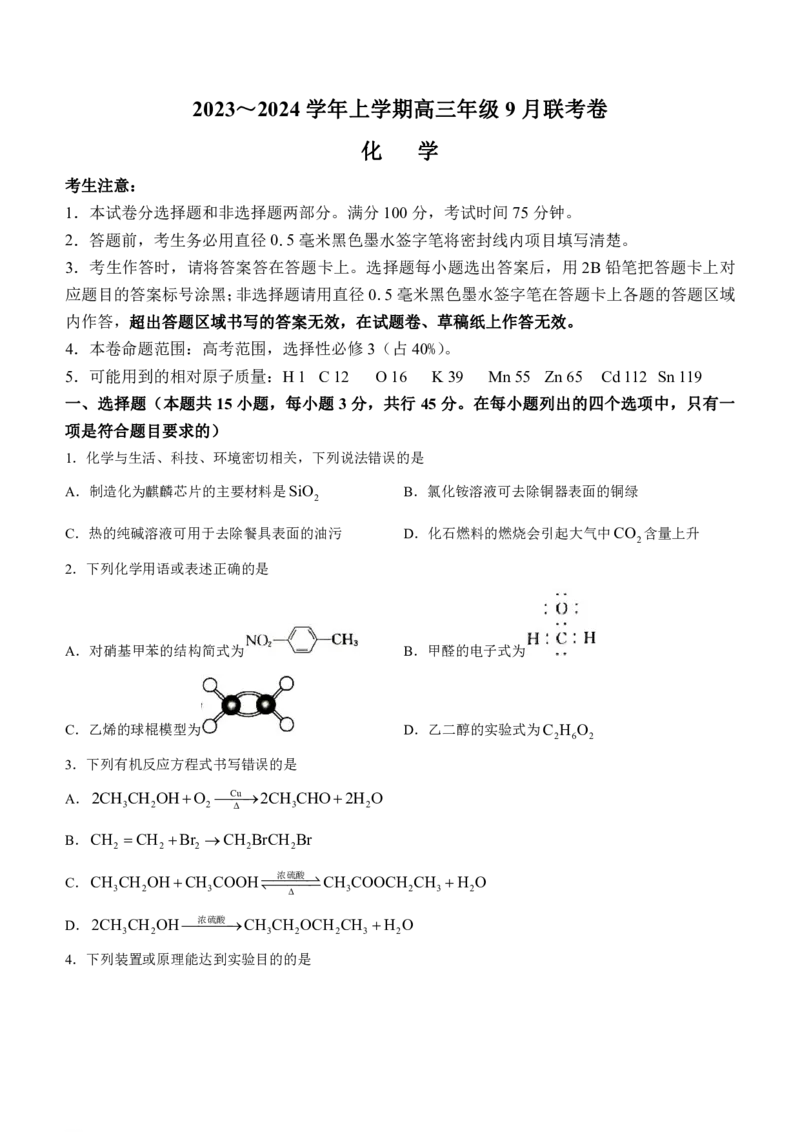
4.下列装置或原理能达到实验目的的是
学科网(北京)股份有限公司甲 乙 丙 丁
A.用装置甲苯萃取碘水中的I B.用装置乙证明溴乙烷发生消去反应
2
C.用装置丙分离甲苯和乙醇 D.用装置丁制取乙烯
5.Na O 可用作供氧剂,反应为2Na O 2CO 2Na CO O ,设N 为阿伏加德罗常数的值。下列
2 2 2 2 2 2 3 2 A
说法错误的是
A.22g CO 中含有键的数目为N
2 A
B.每生成22.4L O 转移电子数目为2N
2 A
C.0.1mol Na O 晶体中含离子数为0.3N
2 2 A
D.1L0.1molL1 Na CO 溶液中CO2的数目小于0.1N
2 3 3 A
6.合成马蔺子甲素的部分路线如图所示,下列说法错误的是
A.该反应为取代反应 B.X与Y均能与FeCl 溶液发生显色反应
3
C.Y的核磁共振氢谱图有10组峰 D.X比Y的亲水性更好
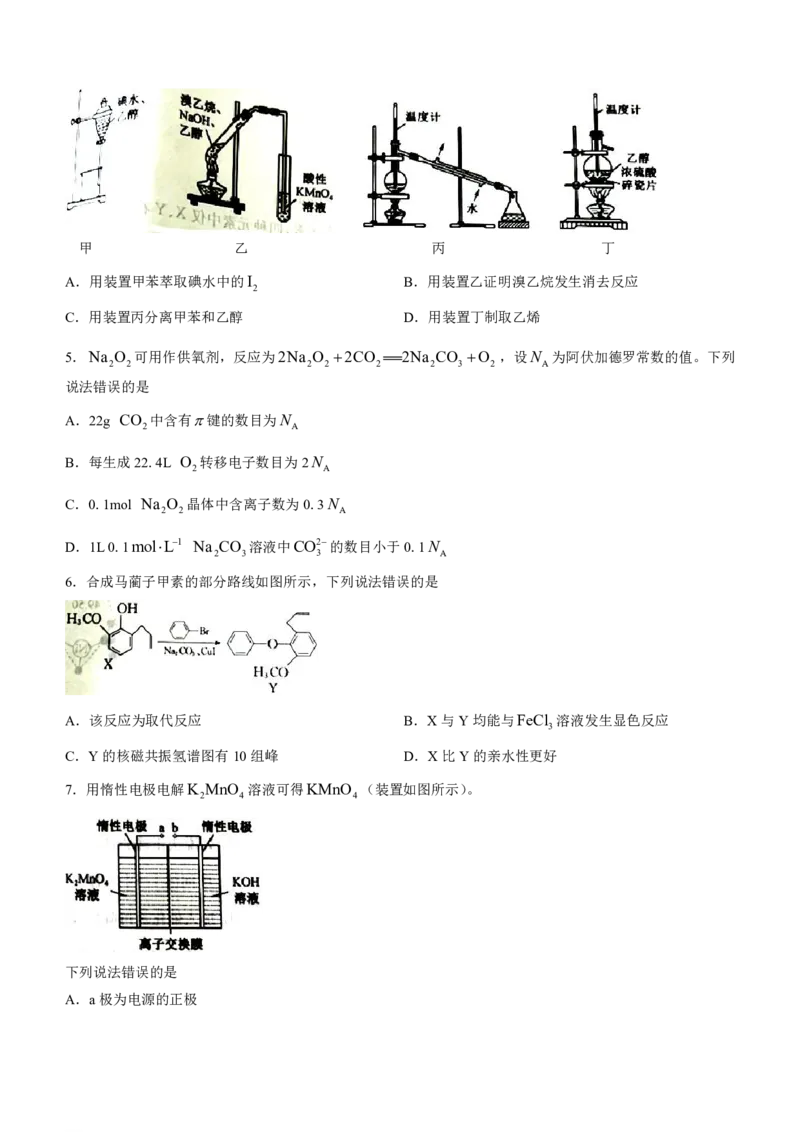
7.用惰性电极电解K MnO 溶液可得KMnO (装置如图所示)。
2 4 4
下列说法错误的是
A.a极为电源的正极
学科网(北京)股份有限公司B.阴极电极反应式为2H O2e H 2OH
2 2
C.离子交换膜应采用阳离子交换膜
D.当电路中有0.2mol电子转移时,阴极室溶液质量增加7.8g
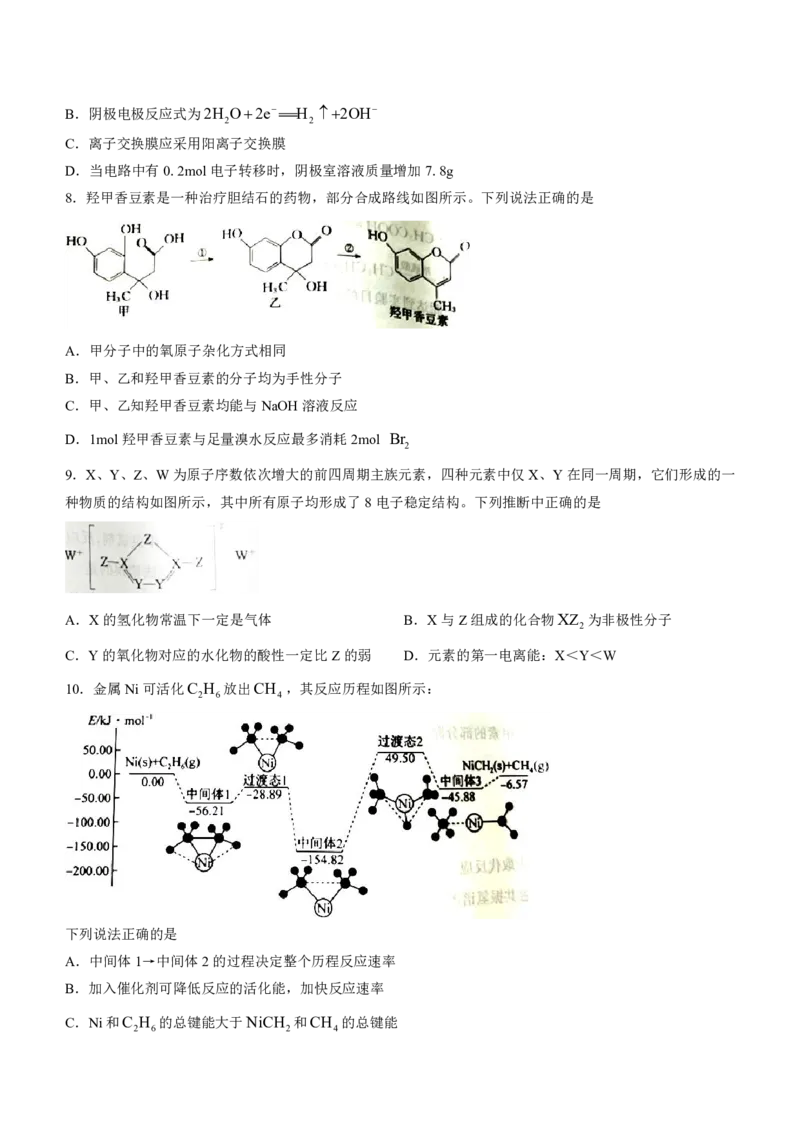
8.羟甲香豆素是一种治疗胆结石的药物,部分合成路线如图所示。下列说法正确的是
A.甲分子中的氧原子杂化方式相同
B.甲、乙和羟甲香豆素的分子均为手性分子
C.甲、乙知羟甲香豆素均能与NaOH溶液反应
D.1mol羟甲香豆素与足量溴水反应最多消耗2mol Br
2
9.X、Y、Z、W为原子序数依次增大的前四周期主族元素,四种元素中仅X、Y在同一周期,它们形成的一
种物质的结构如图所示,其中所有原子均形成了8电子稳定结构。下列推断中正确的是
A.X的氢化物常温下一定是气体 B.X与Z组成的化合物XZ 为非极性分子
2
C.Y的氧化物对应的水化物的酸性一定比Z的弱 D.元素的第一电离能:X<Y<W
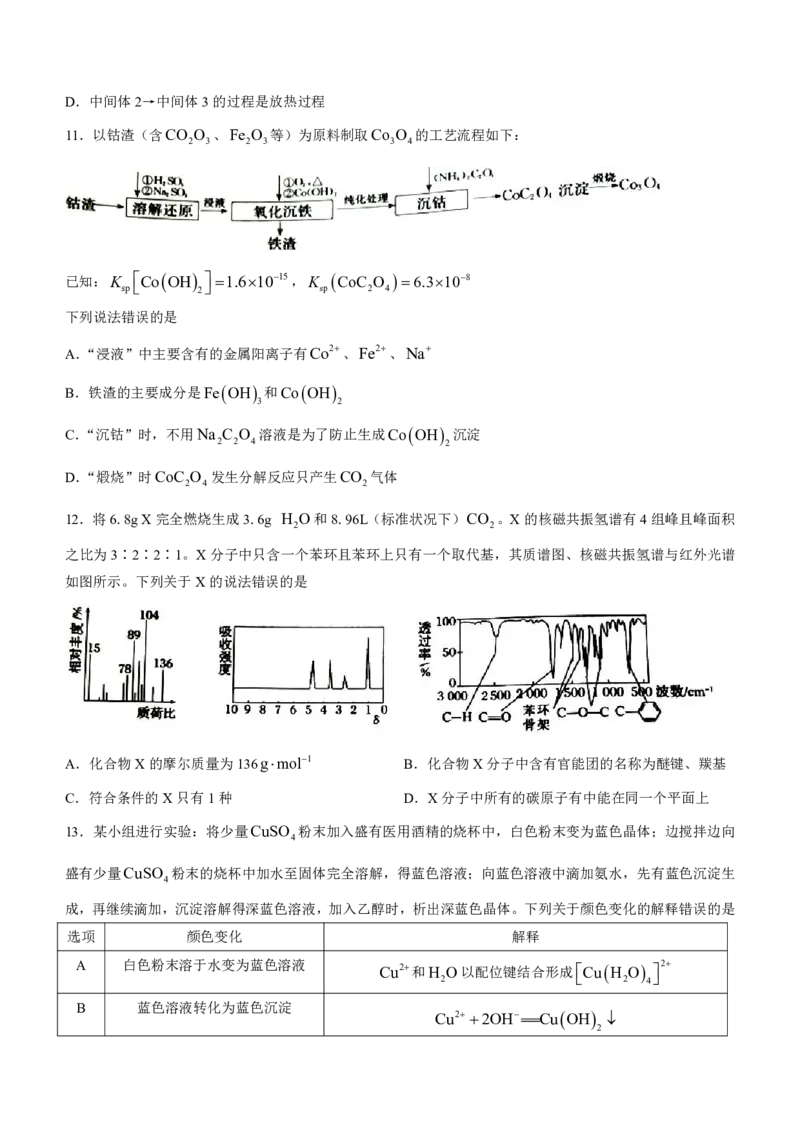
10.金属Ni可活化C H 放出CH ,其反应历程如图所示:
2 6 4
下列说法正确的是
A.中间体1→中间体2的过程决定整个历程反应速率
B.加入催化剂可降低反应的活化能,加快反应速率
C.Ni和C H 的总键能大于NiCH 和CH 的总键能
2 6 2 4
学科网(北京)股份有限公司D.中间体2→中间体3的过程是放热过程
11.以钴渣(含CO O 、Fe O 等)为原料制取Co O 的工艺流程如下:
2 3 2 3 3 4
已知:K Co OH 1.61015,K CoC O 6.3108
sp 2 sp 2 4
下列说法错误的是
A.“浸液”中主要含有的金属阳离子有Co2、Fe2、Na
B.铁渣的主要成分是Fe OH 和Co OH
3 2
C.“沉钴”时,不用Na C O 溶液是为了防止生成Co OH 沉淀
2 2 4 2
D.“煅烧”时CoC O 发生分解反应只产生CO 气体
2 4 2
12.将6.8gX完全燃烧生成3.6g H O和8.96L(标准状况下)CO 。X的核磁共振氢谱有4组峰且峰面积
2 2
之比为3∶2∶2∶1。X分子中只含一个苯环且苯环上只有一个取代基,其质谱图、核磁共振氢谱与红外光谱
如图所示。下列关于X的说法错误的是
A.化合物X的摩尔质量为136gmol1 B.化合物X分子中含有官能团的名称为醚键、羰基
C.符合条件的X只有1种 D.X分子中所有的碳原子有中能在同一个平面上
13.某小组进行实验:将少量CuSO 粉末加入盛有医用酒精的烧杯中,白色粉末变为蓝色晶体;边搅拌边向
4
盛有少量CuSO 粉末的烧杯中加水至固体完全溶解,得蓝色溶液;向蓝色溶液中滴加氨水,先有蓝色沉淀生
4
成,再继续滴加,沉淀溶解得深蓝色溶液,加入乙醇时,析出深蓝色晶体。下列关于颜色变化的解释错误的是
选项 颜色变化 解释
A 白色粉末溶于水变为蓝色溶液 Cu2和H O以配位键结合形成Cu H O 2
2 2 4
B 蓝色溶液转化为蓝色沉淀
Cu2 2OH Cu OH
2
学科网(北京)股份有限公司C 蓝色沉淀转化为深蓝色溶液 Cu OH 溶于氨水生成可溶的Cu NH 2
2 3 4
D 深蓝色溶液得深蓝色晶体 乙醇可以降低Cu NH SO 溶解度,使其析出
3 4 4
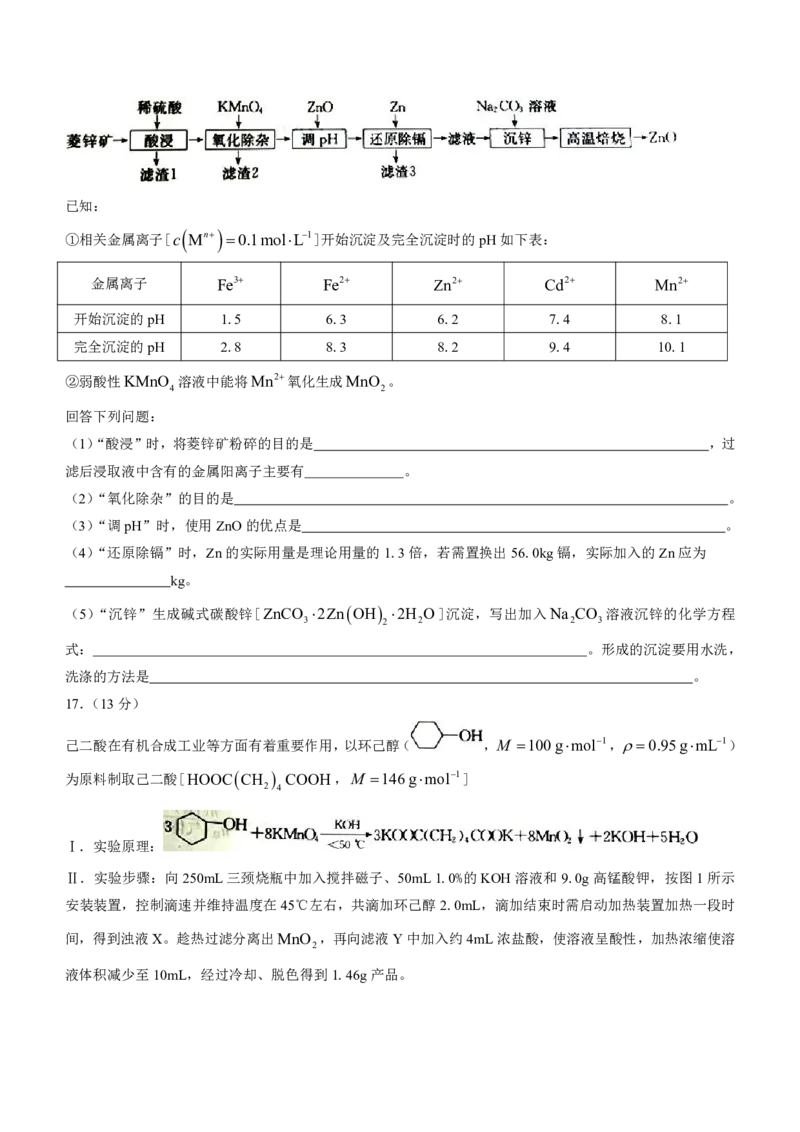
14.一种磁性材料的单晶胞结构如图所示(N 表示阿伏加德罗常数的值),下列说法正确的是
A
A.基态锰原子的价层电子排布式为 Ar 3d54s2 B.该磁性材料的化学式为SnMn C
2
1 1 296
C.体心处碳原子的分数坐标为 , ,1 D.该晶胞的密度为 gcm3
2 2 N a31030
A
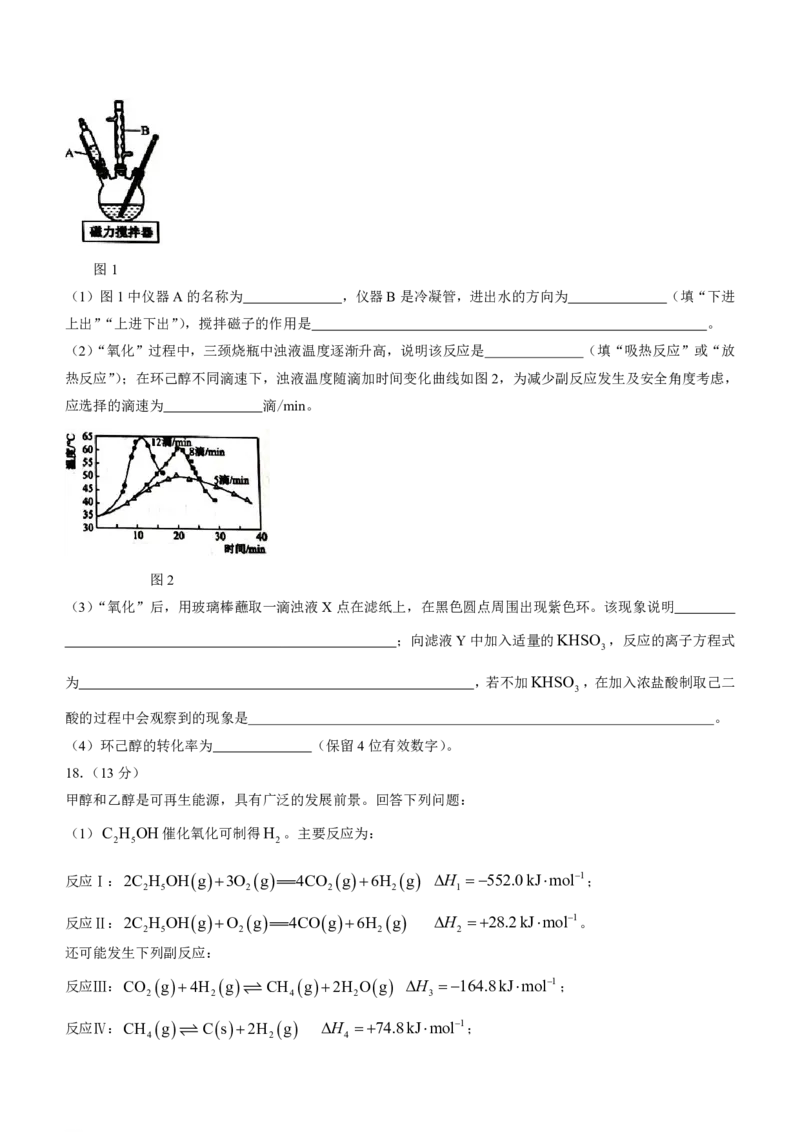
15.25℃时,向某二元弱酸H X溶液中滴加NaOH溶液,所得混合溶液pH与离子浓度变化的关系如图所示。
2
下列说法正确的是
c
HX
A.Q表示pH与lg 的变化关系
c H X
2
B.pH=4.8时,溶液中c
Na
c
H
3c
HX
c
OH
C.K HX 1.0108.6
h
D.当混合溶液呈中性时,c
HX
c
X2
二、非选择题(本题共4小题,共 55分)
16.(14分)
工业上采用菱锌矿(主要成分为ZnCO ,还有含有CdCO 、FeCO 、MnCO 和少量不溶于酸的杂质)制
3 3 3 3
取ZnO,工艺流程如下:
学科网(北京)股份有限公司已知:
①相关金属离子[c Mn 0.1molL1]开始沉淀及完全沉淀时的pH如下表:
金属离子 Fe3 Fe2 Zn2 Cd2 Mn2
开始沉淀的pH 1.5 6.3 6.2 7.4 8.1
完全沉淀的pH 2.8 8.3 8.2 9.4 10.1
②弱酸性KMnO 溶液中能将Mn2氧化生成MnO 。
4 2
回答下列问题:
(1)“酸浸”时,将菱锌矿粉碎的目的是 ,过
滤后浸取液中含有的金属阳离子主要有 。
(2)“氧化除杂”的目的是 。
(3)“调pH”时,使用ZnO的优点是 。
(4)“还原除镉”时,Zn的实际用量是理论用量的1.3倍,若需置换出56.0kg镉,实际加入的Zn应为
kg。
(5)“沉锌”生成碱式碳酸锌[ZnCO 2Zn OH 2H O]沉淀,写出加入Na CO 溶液沉锌的化学方程
3 2 2 2 3
式: 。形成的沉淀要用水洗,
洗涤的方法是 。
17.(13分)
己二酸在有机合成工业等方面有着重要作用,以环己醇( ,M 100gmol1,0.95gmL1)
为原料制取己二酸[HOOC CH COOH,M 146gmol1]
2 4
Ⅰ.实验原理:
Ⅱ.实验步骤:向250mL三颈烧瓶中加入搅拌磁子、50mL1.0%的KOH溶液和9.0g高锰酸钾,按图1所示
安装装置,控制滴速并维持温度在45℃左右,共滴加环己醇2.0mL,滴加结束时需启动加热装置加热一段时
间,得到浊液X。趁热过滤分离出MnO ,再向滤液Y中加入约4mL浓盐酸,使溶液呈酸性,加热浓缩使溶
2
液体积减少至10mL,经过冷却、脱色得到1.46g产品。
学科网(北京)股份有限公司图1
(1)图1中仪器A的名称为 ,仪器B是冷凝管,进出水的方向为 (填“下进
上出”“上进下出”),搅拌磁子的作用是 。
(2)“氧化”过程中,三颈烧瓶中浊液温度逐渐升高,说明该反应是 (填“吸热反应”或“放
热反应”);在环己醇不同滴速下,浊液温度随滴加时间变化曲线如图2,为减少副反应发生及安全角度考虑,
应选择的滴速为 滴/min。
图2
(3)“氧化”后,用玻璃棒蘸取一滴浊液X点在滤纸上,在黑色圆点周围出现紫色环。该现象说明
;向滤液Y中加入适量的KHSO ,反应的离子方程式
3
为 ,若不加KHSO ,在加入浓盐酸制取己二
3
酸的过程中会观察到的现象是 。
(4)环己醇的转化率为 (保留4位有效数字)。
18.(13分)
甲醇和乙醇是可再生能源,具有广泛的发展前景。回答下列问题:
(1)C H OH催化氧化可制得H 。主要反应为:
2 5 2
反应Ⅰ:2C H OH g 3O g 4CO g 6H g H 552.0kJmol1;
2 5 2 2 2 1
反应Ⅱ:2C H OH g O g 4CO g 6H g H 28.2kJmol1。
2 5 2 2 2
还可能发生下列副反应:
反应Ⅲ:CO g 4H g CH g 2H O g H 164.8kJmol1;
2 2 4 2 3
反应Ⅳ:CH g C s 2H g H 74.8kJmol1;
4 2 4
学科网(北京)股份有限公司反应Ⅴ:CO g H g C s H O g H 114.8kJmol1。
2 2 5
研究发现,在实验条件下,乙醇的转化率均接近100%。1105 Pa 下,氧醇比为0.6时,部分气体产物(H 、
2
n H
CO、CO 和CH )的平衡分压p[ p H 2 p ]随温度的变化如图所示(已知:用气体物质的
2 4 2 n 气体 总
总
分压替换浓度计算得到的平衡常数称为分压平衡常数K )。
p
①反应2CO g O g 2CO g 的H 。
2 2
②图中 (填“曲线1”或“曲线2”)表示CO的平衡分压随温度的变化。
③720K时,反应Ⅳ的K ;积碳会覆盖固体催化剂的活性点位,使固体催化剂的活性降低,
p
从1000K开始继续升高温度,固体催化剂的活性先增强后减弱的原因是
。
(2)CO 和H 合成甲醇。反应为CO g 3H g CH OH g H O g H 49.4kJmol1。
2 2 2 2 3 2 1
在恒温恒压条件下,CO 和H 按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,
2 2
测得相关数据如下表。
1.8MPa260℃
反应器
CO 平衡转化率 甲醇的选择性 达到平衡时间是(s)
2
普通反应器(A) 25.0% 80.0% 10.0
分子筛膜催化反应器(B) a>25.0% 100.0% 8.0
已知:
ⅰ.分子筛膜催化反应器(B)具有催化作用、分离出部分水蒸气的双重功能;
n CH OH
ⅱ.CH OH的选择性 3 生成100%。
3 c CO
2 消耗
①在普通反应器(A)中,下列能作为上述反应达到平衡状态的判据是 (填字母)。
A.气体压强不再改变 B.气体的密度不再改变
学科网(北京)股份有限公司C.v CO 3v H D.各物质浓度比不再改变
正 2 逆 2
②在反应器(B)中,CO 的平衡转化率明显高于反应器(A),原因可能是
2
。
19.(15分)
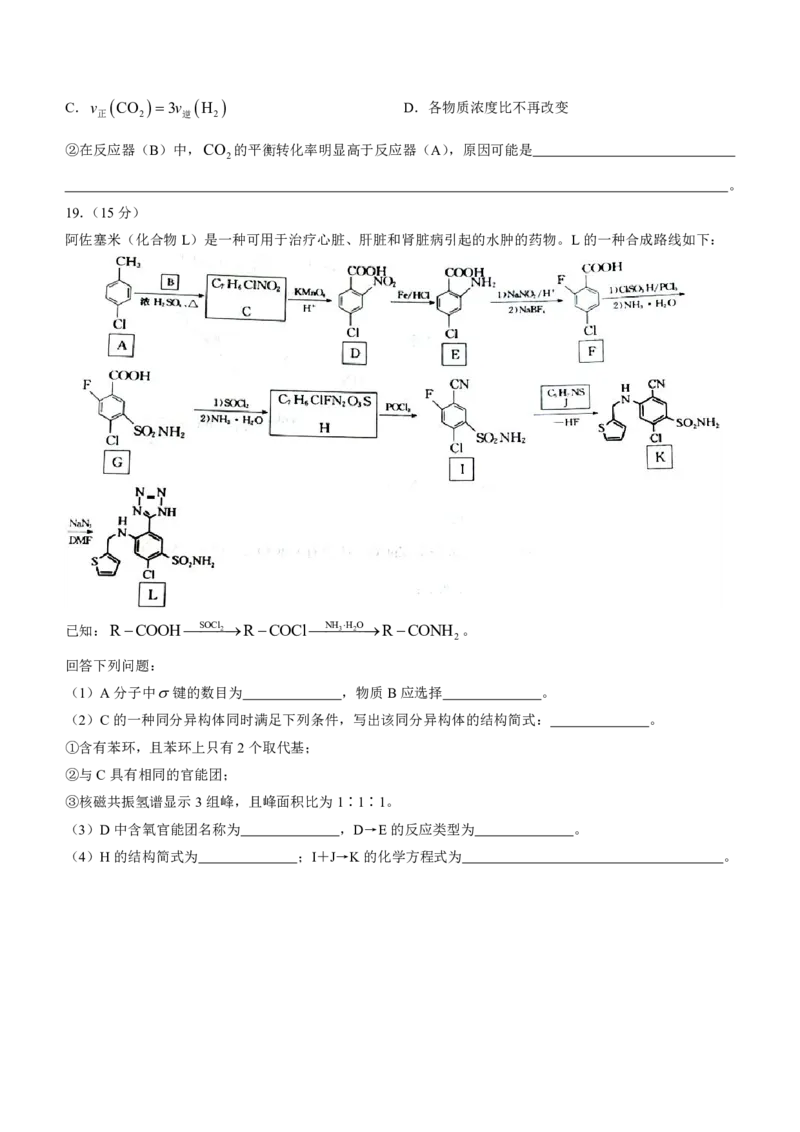
阿佐塞米(化合物L)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。L的一种合成路线如下:
已知:RCOOHSOCl2RCOClNH 3H 2 ORCONH 。
2
回答下列问题:
(1)A分子中键的数目为 ,物质B应选择 。
(2)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
①含有苯环,且苯环上只有2个取代基;
②与C具有相同的官能团;
③核磁共振氢谱显示3组峰,且峰面积比为1∶1∶1。
(3)D中含氧官能团名称为 ,D→E的反应类型为 。
(4)H的结构简式为 ;I+J→K的化学方程式为 。
学科网(北京)股份有限公司