文档内容
上饶市一中 2023-2024 学年上学期高三第一次月考
化学试卷
考试时间:2023年10月 考试时长:75 分钟 满分:100 分
命题人:吴道强 周瑶
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号框
涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号框,回答非选择题时,将答案写在
答题卡上,写在本试卷上无效。
3. 考试结束后,上交答题卡。
可能用到元素的相对分子质量:Al27、Mg24、Cl35.5、B11.
一、单选题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项
中,只有一项是符合题目要求的。
1.2023年文化和自然遗产日的主题是“加强非遗系统性保护,促进可持续发展”。下列叙述错
误的是( )
A.体验江南闺绣画,“画”中颜料所用的铁红,其成分是碱性氧化物
B.鉴赏陶瓷玉器,“陶瓷”是由黏土发生物理变化和化学变化制成
C.“蛟龙”号潜水器所使用的钛合金材料具有强度大、密度小、耐腐蚀等特性
D.5G技术的应用离不开光缆,我国光缆线路总长度超过了三千万千米,光缆的主要成分是
晶体硅
2.下列有关化学用语正确的是( )
A. 中子数为17的氯原子:35Cl B.CaH 的电子式:
17 2
C.次氯酸的结构式:H-O-Cl D.AlCl 是离子化合物
3
3.设N 为阿伏加德罗常数的数值。下列叙述正确的是( )
A
A.1mol羟基(—OH)和1molOH-所含的电子数均为9N
A
B.标准状况下,33.6LSO 和NO 的混合物中含有分子的数目为1.5N
3 2 A
C.1molN 与3molH 在一定条件充分反应,生成NH 分子数目为2N
2 2 3 A
D.0.1molFe和0.1molCu分别与0.1molCl 完全反应,转移电子数均为0.2N
2 A
4.下列反应的离子方程式书写正确的是( )
A.将Na O 加入足量的稀盐酸中:Na O 2H 2Na O H O
2 2 2 2 2 2
上饶一中2023-2024学年高三第一次月考化学试题 第 1 页 共 8 页
{#{QQABAQSAgggoQBJAAAgCUwWQCACQkACCCIoOBAAIMAIAwANABAA=}#}B. 向FeBr 溶液中通入足量氯气:2Fe2++4Br-+3Cl =2Fe3++2Br +6Cl-
2 2 2
C.铜单质与H O 溶液在酸性条件下反应转化为盐:CuO2 4H=Cu2 2H O
2 2 2 2
D.氯化铝溶液中加入过量氨水:Al3++4NH H O=AlO-+4NH++2H O
3 2 2 4 2
5.下列指定溶液中,各组离子可能大量共存的是( )
A.常温下pH=13的溶液中:NH、Ca2+、NO、SO2
4 3 4
B.使石蕊变红的溶液中:Na+、Cl-、SO2、ClO-
4
C.与Al反应放出氢气的溶液:Mg2+、Cl-、K+、SO2
4
D.在中性溶液中:Na+、Al3+、Cl-、HCO
3
6.对于下列实验,不能达到实验目的的是( )
A.用甲图装置可证明ρ(煤油)<ρ(钠)<ρ(水) B.用乙图装置制备Fe(OH)
2
C.用丙图装置制取金属锰 D.用丁图装置制取氯气
7.下列除杂质的操作中错误的是( )
A.CO (SO ),将混合气体通入饱和NaHCO 溶液
2 2 3
B.除去NO 气体中混有的NO气体:通入NaOH溶液中洗气
2
C. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
D. 除去CuCl 溶液中混有的少量FeCl :向混合溶液中加入足量CuO
2 3
8.如图装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管
的胶头,下列与实验事实相符的是( )
A.NH (石蕊溶液)/红色喷泉
3
B.SO (浓NaOH溶液)/红色喷泉
2
C.NO(石蕊溶液)/红色喷泉
D.CO (浓NaOH溶液)/无色喷泉
2
9.下列物质的转化在给定条件下能实现的是( )
上饶一中2023-2024学年高三第一次月考化学试题 第 2 页 共 8 页
{#{QQABAQSAgggoQBJAAAgCUwWQCACQkACCCIoOBAAIMAIAwANABAA=}#}NaOH(aq) CO
2
①Al O NaAlO (aq) Al(OH)
2 3 2 3
Δ
O /点燃 H O
2 2
②S SO H SO
3 2 4
NH 3 ,CO 2 Δ
③饱和NaCl(aq) NaHCO Na CO
3 2 3
HCl(aq) Δ
④Fe O FeCl (aq)无水FeCl
2 3 3 3
石灰乳 煅烧
⑤MgCl (aq) Mg(OH) MgO
2 2
A.①③⑤ B.①②③ C.②④⑤ D.①③④
10.固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图所示。下列叙述
正确的是( )
A.参与反应的物质均只含离子键
B.转化过程中所涉及的元素均呈现了不同价态
C.反应①②③均为氧化还原反应
D.假设每一步均完全转化,每生成4molNH ,同时生成3molO
3 2
11.下图为酸性废水中纳米Fe/Ni复合材料去除NO的过程,溶液中铁以Fe2+形式存在。下
3
列有关说法正确的是( )
A.反应Ⅰ中NO作氧化剂,反应Ⅱ中NO作还原剂
3 2
B.增大单位体积水体中纳米Fe/Ni复合材料的投入量,可提高NO的去除效率
3
C.纳米Fe/Ni复合材料作催化剂,不参与反应
D.假设反应都能彻底进行,反应Ⅰ、Ⅱ消耗的铁的物质的量相同
12.下列实验过程可以达到实验目的的是( )
上饶一中2023-2024学年高三第一次月考化学试题 第 3 页 共 8 页
{#{QQABAQSAgggoQBJAAAgCUwWQCACQkACCCIoOBAAIMAIAwANABAA=}#}选项 实验方案 实验目的
A 向浓HNO 中插入红热的炭,产生红棕色气体 证明炭可与浓HNO 反应生成NO
3 3 2
将SO 通入NaHCO 溶液后,将混合气体依次通
2 3
B 验证非金属性:S>C
入酸性KMnO 溶液、品红溶液、澄清石灰水
4
将SO 和CO 分别通入水中达到饱和,用pH计
2 2
C 确定亚硫酸和碳酸的酸性强弱
立即测定溶液的pH,比较pH大小
D 将反应混合物注入水中观察颜色,溶液变蓝 验证Cu和浓硫酸反应生成CuSO
4
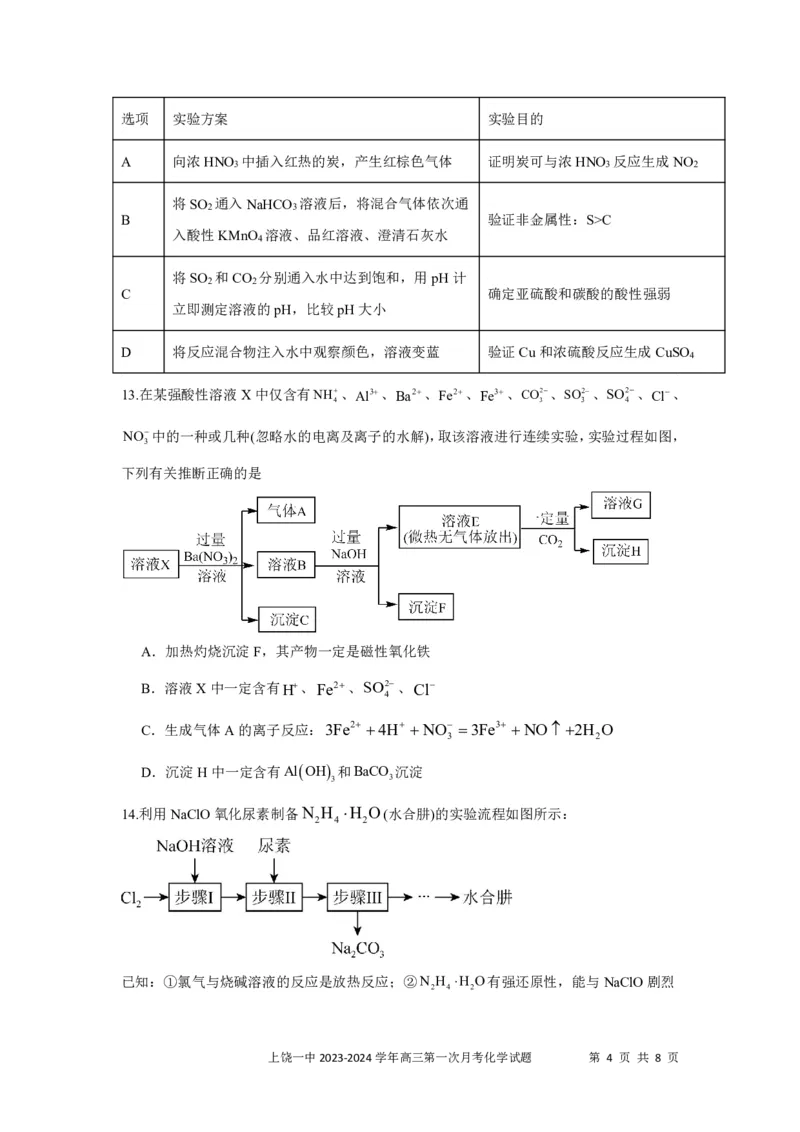
13.在某强酸性溶液X中仅含有NH、Al3、Ba2、Fe2、Fe3、CO2、SO2、SO2、Cl、
4 3 3 4
NO中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图,
3
下列有关推断正确的是
A.加热灼烧沉淀F,其产物一定是磁性氧化铁
B.溶液X中一定含有H、Fe2、SO2、Cl
4
C.生成气体A的离子反应:3Fe2 4H NO 3Fe3 NO2H O
3 2
D.沉淀H中一定含有AlOH 和BaCO 沉淀
3 3
14.利用NaClO氧化尿素制备N H H O(水合肼)的实验流程如图所示:
2 4 2
已知:①氯气与烧碱溶液的反应是放热反应;②N H H O有强还原性,能与NaClO剧烈
2 4 2
上饶一中2023-2024学年高三第一次月考化学试题 第 4 页 共 8 页
{#{QQABAQSAgggoQBJAAAgCUwWQCACQkACCCIoOBAAIMAIAwANABAA=}#}反应生成N 。下列说法正确的是( )
2
A.步骤Ⅱ中可将尿素水溶液逐滴滴入NaClO碱性溶液中
B.步骤Ⅰ中无需控制反应的温度
C.生成水合肼反应的离子方程式为:
ClO CO NH 2H OCl CO2 N H H O2H
2 2 2 3 2 4 2
D.步骤Ⅰ制备NaClO时,测得产物中NaClO与NaClO 的物质的量之比为3∶1,则参与反
3
应的氧化剂与还原剂的物质的量之比为2∶1
15.把一块镁铝合金投入到1mol·L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol·L
-1NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示。下列说
法中错误的是( )
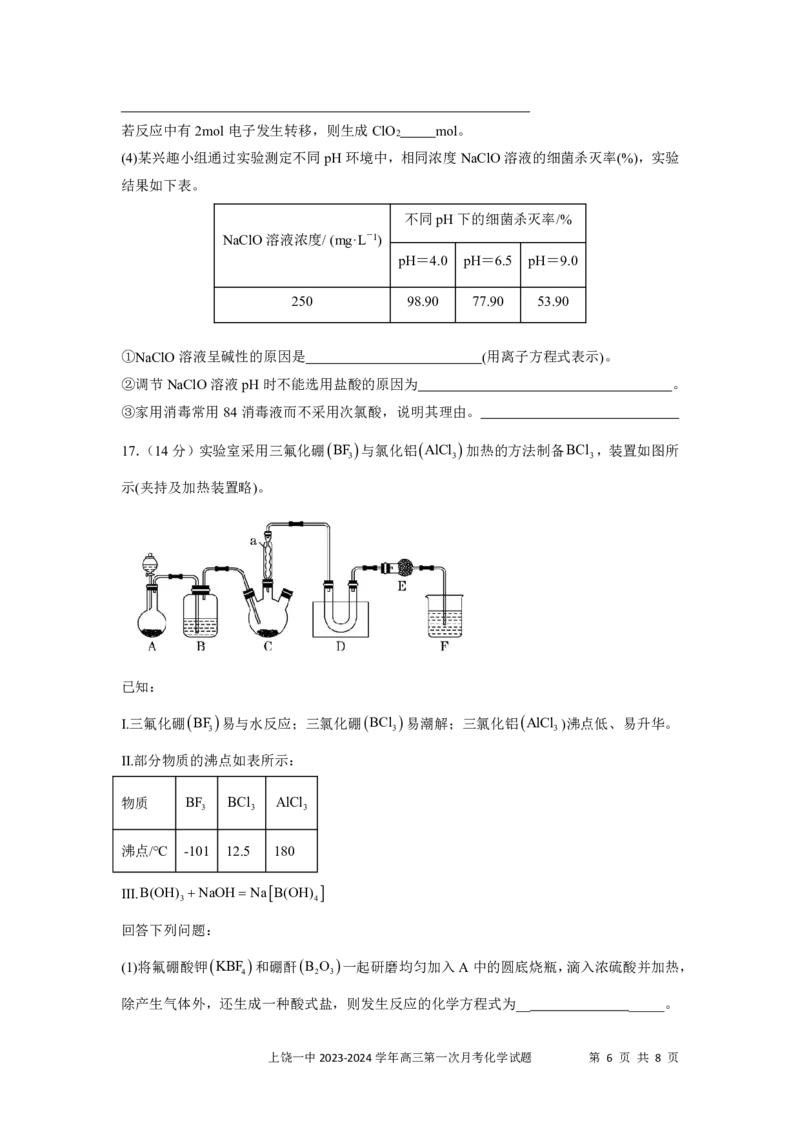
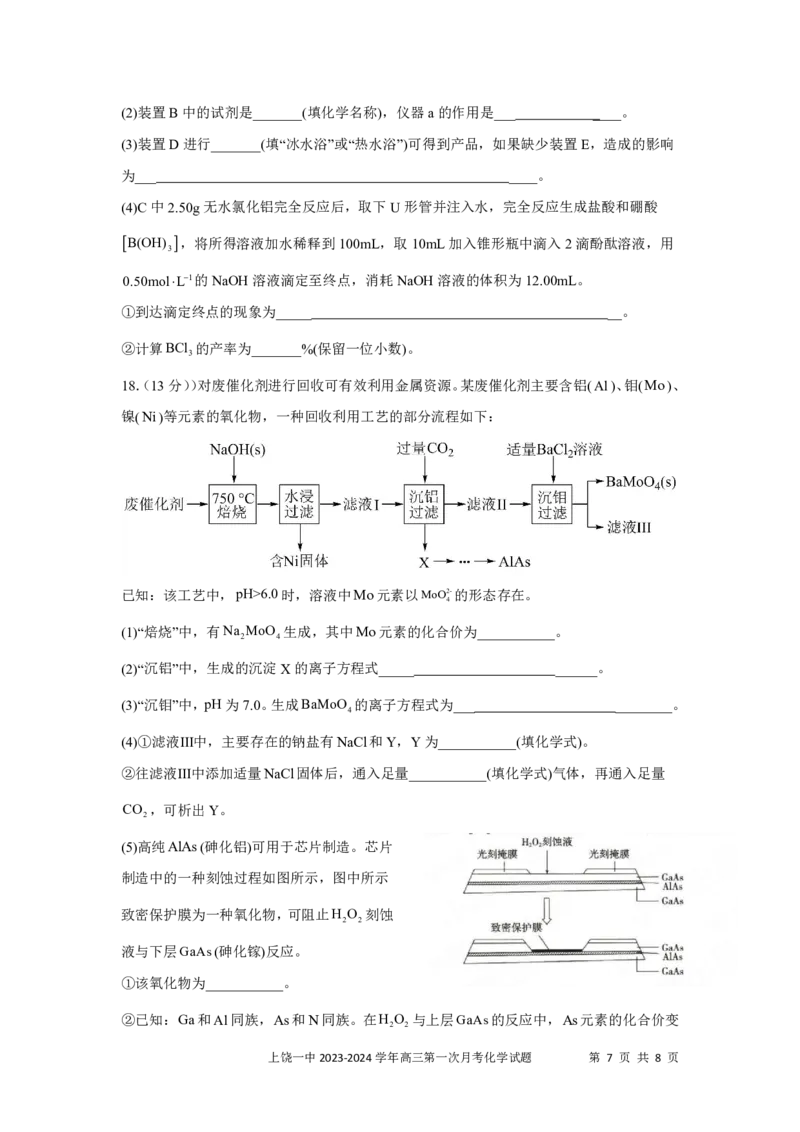
A.盐酸的体积为80mL B.a的取值范围为06.0时,溶液中Mo元素以MoO2-的形态存在。
4
(1)“焙烧”中,有Na MoO 生成,其中Mo元素的化合价为___________。
2 4
(2)“沉铝”中,生成的沉淀X的离子方程式_____ ______。
(3)“沉钼”中,pH为7.0。生成BaMoO 的离子方程式为___ ________。
4
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为___________(填化学式)。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量___________(填化学式)气体,再通入足量
CO ,可析出Y。
2
(5)高纯AlAs(砷化铝)可用于芯片制造。芯片
制造中的一种刻蚀过程如图所示,图中所示
致密保护膜为一种氧化物,可阻止H O 刻蚀
2 2
液与下层GaAs(砷化镓)反应。
①该氧化物为___________。
②已知:Ga和Al同族,As和N同族。在H O 与上层GaAs的反应中,As元素的化合价变
2 2
上饶一中2023-2024学年高三第一次月考化学试题 第 7 页 共 8 页
{#{QQABAQSAgggoQBJAAAgCUwWQCACQkACCCIoOBAAIMAIAwANABAA=}#}为+5价,则该反应的氧化剂与还原剂物质的量之比为___________。
19.(12分)小组同学探究+3价铬元素和+6价铬元素的相互转化。
资料:Cr3(绿色)、CrOH (灰绿色,不溶于水)、CrO2 (橙色)、CrO2(黄色)、Ag CrO (砖
3 2 7 4 2 4
红色,难溶于水)
实验Ⅰ:向2mL0.1mol/LCr SO 溶液中滴入2mL3%H O 溶液,无明显变化,得到溶液a.取
2 4 3 2 2
少量溶液a,加入AgNO 溶液,未观察到砖红色沉淀。
3
实验Ⅱ:向溶液a中加入2mL10%NaOH溶液,产生少量气泡,水浴加热,有大量气泡产生,
经检验气体为O ,溶液最终变为黄色。取少量黄色溶液,加入稀硫酸调节溶液的pH约为3,
2
再加入AgNO 溶液,有砖红色沉淀生成。
3
(1)实验Ⅱ中加入稀硫酸的目的是_____ ______。
(2)甲同学认为实验Ⅱ中溶液变黄生成CrO2的原因是H O 将+3价铬元素氧化为CrO2,乙
4 2 2 4
同学认为该说法不严谨。
乙的理由是_____ ______。
(3)对比实验I和Ⅱ,小组同学研究碱性环境对+3价铬元素或H O 性质的影响。
2 2
①提出假设:
假设a:碱性增强,H O 的氧化性增强
2 2
假设b:___________。
②H O 参与的电极反应式是_____ ______,据此分析,假设a不成立。
2 2
实验Ⅲ:向实验Ⅱ中的黄色溶液中加入稀硫酸,溶液变为橙色,再加入3%H O 溶液,溶液
2 2
最终变为绿色,有气泡生成。
(4)实验Ⅲ中溶液由橙色变为绿色的离子方程式是____ _______。
(5)综上,H O 在+3价铬元素和+6价铬元素相互转化中的作用是______ _____。
2 2
上饶一中2023-2024学年高三第一次月考化学试题 第 8 页 共 8 页
{#{QQABAQSAgggoQBJAAAgCUwWQCACQkACCCIoOBAAIMAIAwANABAA=}#}