文档内容
2022年9月联盟校入学统一检测卷
高三年级 化学
命题单位:临桂中学
(考试时间90分钟,满分100分)
注意事项:
1.答卷前,考生务必将自己的姓名、座位号、考籍号填写在试卷和答题卡上。
2.考生作答时,请在答题卡上作答,在本试卷上作答无效。
可能用到的相对原子质量:H-1 C-12 O-16 P-31 Cl-35.5 Mn-55 Fe-56 Cu-64 Zn-65 Se-79
第 卷(选择题 共40分)
I
一、单项选择题(本大题共20小题,每小题2分,共40分。在每小题列出的四个选项
中,只有一个选项符合题目要求,错选、多选或未选均不得分。温馨提示:请在答
题卡上作答,在本试卷上作答无效。)
. 年 月,嫦娥五号任务顺利完成,化学功不可没。下列说法正确的是
1 2022 3
.探测器装有太阳能电池板,该电池能将太阳能转化为电能
A
.返回器带回的月壤中含有 ,它与地球上 的性质完全相同
3 4
B He He
.运载火箭使用了煤油液氧推进剂,其中煤油是由石油分馏而得,这个过程属于化学变化
C
.嫦娥五号所携带的国旗主要成分为国产高性能芳纶纤维材料,该材料是高分子材料,属于
D
纯净物
.下列过程在一定条件下能自发进行但不能用熵增解释的是
2 ,
.花香四溢 .冰块融化 . 风化 .水蒸气冷凝
A B C Na2CO3·10H2O D
.下列应用与盐类水解无关的是
3
.用热的纯碱溶液去除废铁屑油污 .配制 溶液时需将 溶于 浓溶液
A B Na2S Na2S NaOH
.用硫酸铝溶液和碳酸氢钠溶液混合灭火 .用 溶液刻蚀铜制电路板
C D FeCl3
.合成氨反应为 ()+ () () =- 。
-1
4 :N2 g 3H2 g 2NH3 g ∆H 92.4kJ·mol
下列有关该反应的说法正确的是
.催化剂增大了正、逆反应的活化能 .升高温度,该反应的平衡常数增大
A B
.正反应的活化能小于逆反应的活化能 .升温或增压均可提高 的平衡转化率
C D H2
.设 为阿伏加德罗常数的值。下列说法正确的是
5 NA
. 的盐酸与足量 共热,转移的电子数为
A 50ml12mol/L MnO2 0.3NA
.电解精炼铜时,若阳极质量减少 ,则阴极得到的电子数为
B 64g 2NA
. 和 于密闭容器中充分反应后,其分子总数为
C 0.1molH2 0.1molI2 0.2NA
.反应 + = + + 生成 时,转移的电子数为
D KIO3 6HI KI 3I2 3H2O 3molI2 6NA
.化合物 (结构式如图所示)是常用的还原剂,其中 、、是原子序数依次减小的不同短周期
6 M X Y Z
的主族元素, 与 、与 均能形成原子个数比为 :和 :的化合物, 原子的最外层电子
X W Z W 1 1 2 1 W
数是电子层数的 倍。下列叙述正确的是 -
3 Z
. 元素位于第三周期第 族
A Z ⅦA
. 和 形成的化合物的水溶液呈酸性
B X Z X+ Y
.化合物 不能与 反应 Z
C . 的最高 M 价氧化物 Z2 对 W 应 2 的水化物为一元弱酸 Z Z
D Y
高三化学试卷 第 页 (共 页)
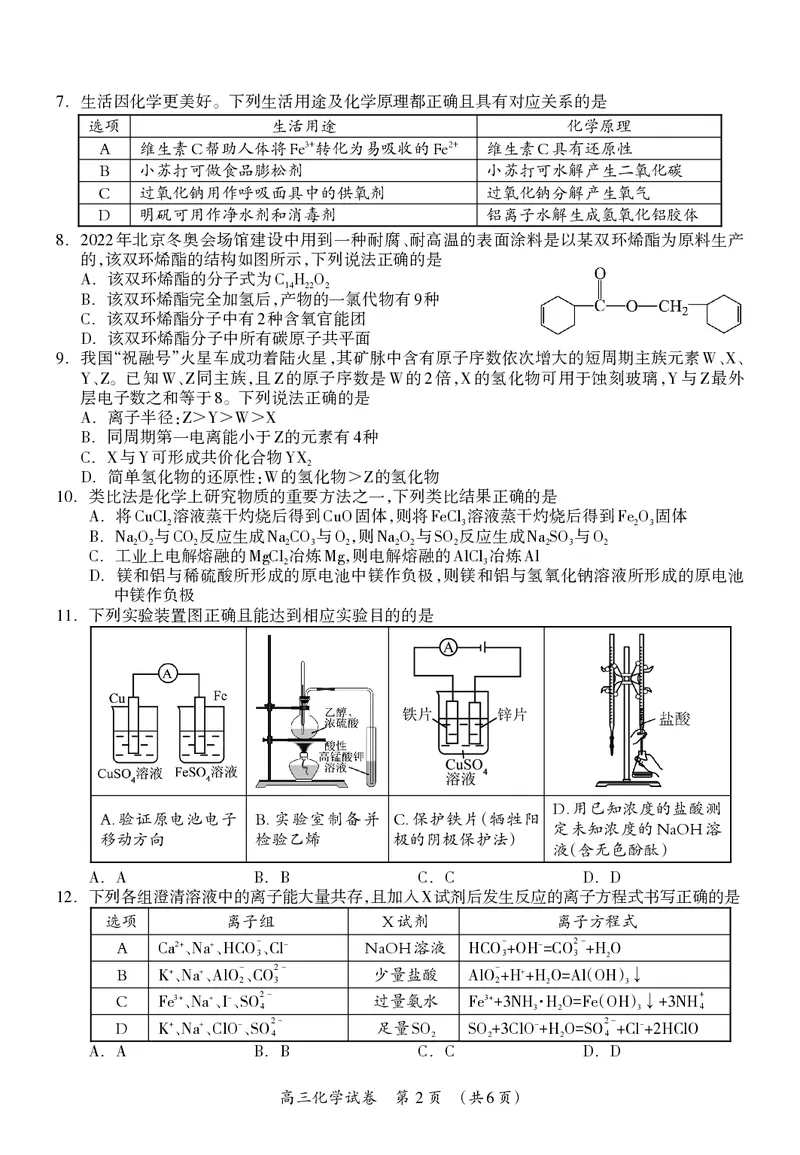
1 6.生活因化学更美好。下列生活用途及化学原理都正确且具有对应关系的是
7
选项 生活用途 化学原理
A 维生素C帮助人体将Fe3+转化为易吸收的Fe2+ 维生素C具有还原性
B 小苏打可做食品膨松剂 小苏打可水解产生二氧化碳
C 过氧化钠用作呼吸面具中的供氧剂 过氧化钠分解产生氧气
D 明矾可用作净水剂和消毒剂 铝离子水解生成氢氧化铝胶体
. 年北京冬奥会场馆建设中用到一种耐腐、耐高温的表面涂料是以某双环烯酯为原料生产
8 2022
的,该双环烯酯的结构如图所示,下列说法正确的是
.该双环烯酯的分子式为
A C14H22O2
.该双环烯酯完全加氢后,产物的一氯代物有 种
B 9
.该双环烯酯分子中有 种含氧官能团
C 2
.该双环烯酯分子中所有碳原子共平面
D
.我国“祝融号”火星车成功着陆火星,其矿脉中含有原子序数依次增大的短周期主族元素 、、
9 W X
、。已知 、同主族,且 的原子序数是 的 倍, 的氢化物可用于蚀刻玻璃, 与 最外
Y Z W Z Z W 2 X Y Z
层电子数之和等于 。下列说法正确的是
8
.离子半径:> > >
A Z Y W X
.同周期第一电离能小于 的元素有 种
B Z 4
. 与 可形成共价化合物
C . X 简单 Y 氢化物的还原性: 的 YX 氢 2 化物> 的氢化物
D W Z
.类比法是化学上研究物质的重要方法之一,下列类比结果正确的是
10
.将 溶液蒸干灼烧后得到 固体,则将 溶液蒸干灼烧后得到 固体
A CuCl2 CuO FeCl3 Fe2O3
. 与 反应生成 与 ,则 与 反应生成 与
B Na2O2 CO2 Na2CO3 O2 Na2O2 SO2 Na2SO3 O2
.工业上电解熔融的 冶炼 ,则电解熔融的 冶炼
C MgCl2 Mg AlCl3 Al
.镁和铝与稀硫酸所形成的原电池中镁作负极,则镁和铝与氢氧化钠溶液所形成的原电池
D
中镁作负极
.下列实验装置图正确且能达到相应实验目的的是
11
D.用已知浓度的盐酸测
A.验证原电池电子 B.实验室制备并 C.保护铁片(牺牲阳
定未知浓度的NaOH溶
移动方向 检验乙烯 极的阴极保护法)
液(含无色酚酞)
. . . .
A A B B C C D D
.下列各组澄清溶液中的离子能大量共存,且加入 试剂后发生反应的离子方程式书写正确的是
12 X
选项 离子组 X试剂 离子方程式
A
Ca 2+
、Na+、HCO-
3
、Cl- NaOH溶液 HCO-
3
+OH-=CO2
3
-+H
2
O
B K + 、Na+、AlO- 2 、CO2 3 - 少量盐酸 AlO- 2 +H++H 2 O= A ( l OH ) 3↓
C
3+
、Na+、
-
、SO2- 过量氨水
3+
( ) H+
Fe I 4 Fe +3NH3·H2O=Fe OH 3↓+3N 4
D
+
、Na+、
-
、SO2- 足量
-
O2-+Cl-+2HClO
K ClO 4 SO2 SO2+3ClO +H2O=S 4
. . . .
A A B B C C D D
高三化学试卷 第 页 (共 页)
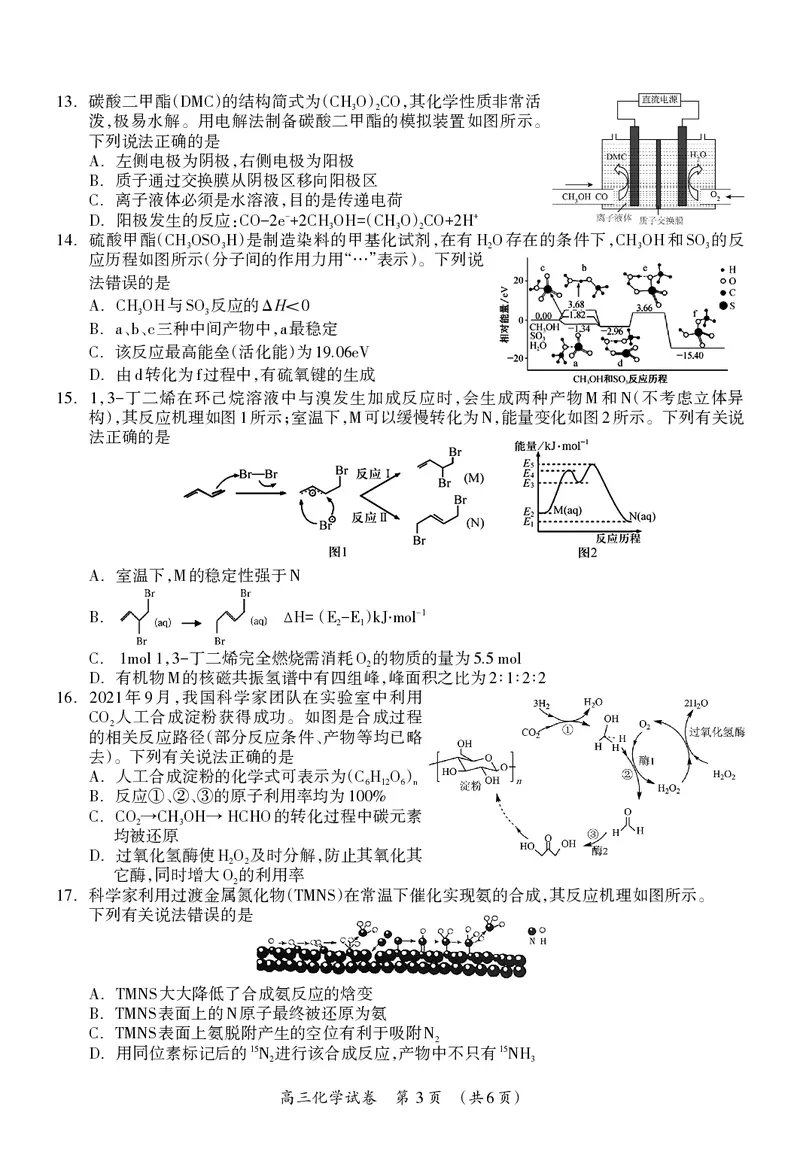
2 6.碳酸二甲酯( )的结构简式为( ) ,其化学性质非常活
13 DMC CH3O 2CO
泼,极易水解。用电解法制备碳酸二甲酯的模拟装置如图所示。
下列说法正确的是
.左侧电极为阴极,右侧电极为阳极
A
.质子通过交换膜从阴极区移向阳极区
B
.离子液体必须是水溶液,目的是传递电荷
C
.阳极发生的反应: ( )
- +
D CO-2e +2CH3OH= CH3O 2CO+2H
.硫酸甲酯( )是制造染料的甲基化试剂,在有 存在的条件下, 和 的反
14 CH3OSO3H H2O CH3OH SO3
应历程如图所示(分子间的作用力用“…”表示)。下列说
法错误的是
. 与 反应的 <
A CH3OH SO3 ΔH 0
. 、、三种中间产物中,最稳定
B a b c a
.该反应最高能垒(活化能)为
C 19.06eV
.由 转化为 过程中,有硫氧键的生成
D d f
. , 丁二烯在环己烷溶液中与溴发生加成反应时,会生成两种产物 和 (不考虑立体异
15 1 3- M N
构),其反应机理如图 所示;室温下, 可以缓慢转化为 ,能量变化如图 所示。下列有关说
1 M N 2
法正确的是
.室温下, 的稳定性强于
A M N
. ( )
-1
B ∆H= E2-E1 kJ‧mol
. , 丁二烯完全燃烧需消耗 的物质的量为
C 1mol1 3- O2 5.5mol
.有机物 的核磁共振氢谱中有四组峰,峰面积之比为 ∶∶∶
D M 2 1 2 2
. 年 月,我国科学家团队在实验室中利用
16 2021 9
人工合成淀粉获得成功。如图是合成过程
CO2
的相关反应路径(部分反应条件、产物等均已略
去)。下列有关说法正确的是
.人工合成淀粉的化学式可表示为( )
A C6H12O6 n
.反应 、 、 的原子利用率均为
B ① ② ③ 100%
. 的转化过程中碳元素
C CO2→CH3OH→HCHO
均被还原
.过氧化氢酶使 及时分解,防止其氧化其
D H2O2
它酶,同时增大 的利用率
O2
.科学家利用过渡金属氮化物( )在常温下催化实现氨的合成,其反应机理如图所示。
17 TMNS
下列有关说法错误的是
. 大大降低了合成氨反应的焓变
A TMNS
. 表面上的 原子最终被还原为氨
B TMNS N
. 表面上氨脱附产生的空位有利于吸附
C TMNS N2
.用同位素标记后的 进行该合成反应,产物中不只有
15 15
D N2 NH3
高三化学试卷 第 页 (共 页)
3 6.常温下,向 的 溶液中持续通入 气体。通入 的体积( )与溶液中水电离
18 1LpH=10 NaOH CO2 CO2 V
出的( )的关系如图所示。下列叙述不正确的是
-
c OH ···
. 点溶液中:水电离出的( )
- -10 -1
A a c OH =1×10 mol·L
. 点溶液中:PH>7
B b
. 点溶液中:(
+
) ( O-) ( O2-)
C c c Na >c HC 3 >c C 3
. 点溶液中:(
+
) (
+
) ( O2-) ( O-) (
-
)
D d c Na +c H =2c C 3 +c HC 3 +c OH
.某化学小组的同学测定 溶液在先升温再降温过程中的 (不将虑温度变化过
19 0.1mol/LNa2SO3 pH
程中溶液体积的变化),数据如右表,下列有关说法 时刻 ① ② ③ ④
中正确的是
温度/℃ 25 30 40 25
. 与 的 值不相等
A ① ④ KW pH 9.66 9.52 9.37 9.25
. 的 与 不同,是 O2-浓度减小造成的
B ④ pH ① S 3
. 的过程中,温度和浓度的变化对水解平衡移动方向的影响一致
C ①→③
. 溶液中存在水解平衡:O2-+2HO HSO+2OH-
D Na2SO3 S 3 2 ⇌ 2 3
.已知常温下二元弱酸 溶液中, 、 、 的分布分数()随 变化如图所示[如 分布
- 2- 2-
20 H2A H2A HA A δ pH A
2-
分数:( ) c(A ) ],下列有关说法错误的是
2-
δ A = - 2-
c(H2A)+ c(HA )+ c(A )
.曲线 代表 ,曲线 代表
2-
A x H2A z A
+
. 从 升高至 ,c(H ) 的值一直减小
B pH 3 4
c(H2A)
. 点对应的溶液中水电离出的( )
+ -12.7 -1
C n c H =10 mol·L
.将浓度均为 的 溶液与 溶液等体
-1
D 0.05mol·L NaHA Na2A
积混合后,所得溶液
pH>4.3
第 卷(非选择题 共60分)
II
二、必考题(本题共4小题,共60分)
.( 分)摩尔盐( ) ( ) 是一种常见的复盐。以下是摩尔盐的制备流程。请回答
21 14 NH4 2Fe SO4 2·6H2O
相关问题。
取适量的废铁屑于锥形瓶
加入 -1 在滤液中加入一定量的
中,加 15mL3mol·L
溶液,小 1 火 5m 加 L 热 10 煮 % 沸 Na2CO ,3 → H2SO4 ,水浴加热至反 → ( NH4 ) 2SO4 固体,加热浓
2min 应完成,趁热抽滤 缩,冷却结晶,抽滤并洗涤
分离并洗涤
步骤 :铁屑的净化 步骤 : 步骤 :摩尔盐的制备
1 2 3
()步骤 的名称应为 。
1 2
()抽滤装置如图所示。和普通过滤相比,抽滤的优点是 。
2
()加热浓缩时所用到的主要仪器中属于硅酸盐材质的有酒精灯、玻
3
璃棒和 。
()生成摩尔盐的化学反应方程式为 。
4
()步骤 抽滤后用乙醇洗涤的原因是 。
5 3
() +含量是影响产品品质的关键指标。定量测定方法是:取 产品于烧杯中,加入适量
3
6 Fe 1.00g
盐酸溶解,并加入 滴 溶液,定容至 ,取溶液置于比色管中,与标准色阶进行目
3 KSCN 50mL
视比色,确定产品级别。可以根据颜色确定产品级别的原理是 。
高三化学试卷 第 页 (共 页)
4 6()取 所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在 容量瓶中定容。
7 28.00g 250mL
取 于锥形瓶中,用 的 ,溶液滴定至终点。平行操作三次,消耗
-1
25.00mL 0.1mol·L KMnO4
溶液的平均体积为 。此样品中 含量为 。下列操作可能
2+
KMnO4 16.00mL Fe %
导致测定结果偏大的是 。
.配溶液定容时俯视刻度线 .取摩尔盐溶液的滴定管没有润洗
A B
.取待测液的锥形瓶洗净后未干燥 .酸式滴定管滴定前读数正确,滴定后仰视读数
C D
.( 分)锌灰是热镀锌厂和电解锌厂在生产
22 15
过程中产生的一种副产品,主要成分为
、 ,还含有 、 、 和 。
ZnO ZnCl2 SiO2 CuO PbO FeO
工业上利用锌灰制 晶体,进而
ZnSO4·7H2O
获取 ,并探索氢电极增压还原氧化锌电
ZnO
解法制锌的方法,工艺流程如图所示:
已知: + ==== 。
+ -
Cu Cl CuCl↓
回答下列问题:
()酸浸时,应选用 (填“浓硫酸”或“稀硫酸”)。
1
()滤渣 的主要成分有 。
2 1
()写出“沉铜”时的离子方程式:
3
。
()“氧化”后,加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是
4
。
()氢电极增压还原氧化锌的装置如图所示,储罐内 溶解后形
5 ZnO
成 ( )2-离子,每溶解 需消耗 。
Zn OH 4 1 mol ZnO mol KOH
电解池中的总反应离子方程式为 。
()该工艺废水中含有 +,排放前需处理。向废水中加入 和 组成的缓
2
6
冲溶液调节 ,通入
Zn
发生反应:
2
++ ()
CH
+
3CO
+
O
。
H
处理
CH
后
3C
的
O
废
ON
水
a
中部分微
pH H2S Zn H2S ZnS s 2H
粒浓度如下表所示。 微粒 HS CHCOOH CHCOO-
2 3 3
浓度/(mol·L-1) 0.10 0.05 0.10
则处理后的废水的 = ,( +)= 。
2
pH c Zn
[已知:( )= - ,( )= -,( )= - ,( )= -]
23 7 14 5
Ksp ZnS 1.0×10 Ka1 H2S 1.0×10 Ka2 H2S 1.0×10 Ka CH3COOH 2.0×10
.( 分)研究 的综合利用、实现 资源化,是能源领域的重要发展方向,也是力争 年
23 16 CO2 CO2 2030
前实现碳达峰、 年前实现碳中和的方向之一。
2060
已知:反应 : () () () ()
Ⅰ CO2 g +H2 g →CO g +H2O g ΔH1=+41.2kJ/mol
反应 : () () () ()
Ⅱ 2CO g +4H2 g →C2H4 g +2H2O g ΔH2=-332kJ/mol
反应 : () () () ()
Ⅲ 2CO2 g +6H2 g →C2H4 g +4H2O g ΔH3
()反应 中, 。
1 Ⅲ ΔH3= kJ/mol
()在体积为 的刚性密闭容器中,充入 和 ,发生反应 ,能判断反应达到平衡
2 2L 1molCO 2molH2 Ⅱ
状态的是 (填字母序号)。
. v( )v( ) .容器内压强保持不变
a 2 H2 = H2O b
.c(CO)保持不变 . 的质量分数保持不变
c d C2H4
c(H2)
()在体积为 的恒压密闭容器中,起始充入 ()
3 2L 1molCO2 g
和 (),发生反应 ,该反应在不同温度下达到平
3molH2 g Ⅲ
衡时,各组分的体积分数随温度的变化如图所示。
表示 和 的体积分数随温度变化的曲线分别是
① H2 C2H4
(填字母序号)。
高三化学试卷 第 页 (共 页)
5 6、、 三点对应的化学平衡常数 、 、 由大到小的顺序为 ,判断的理
②A B C KA KB KC
由是 。
时,反应达到平衡后,容器中气体的总物质的量为 ,()的平衡转化率
③240℃ mol H2 g
为 。若平衡时总压为 ,该反应的平衡常数 (列出计算式。用平衡
P Kp=
分压代替平衡浓度计算,分压 总压 物质的量分数)。
= ×
三、选考题(从两题中任选一题作答,共 分)
15
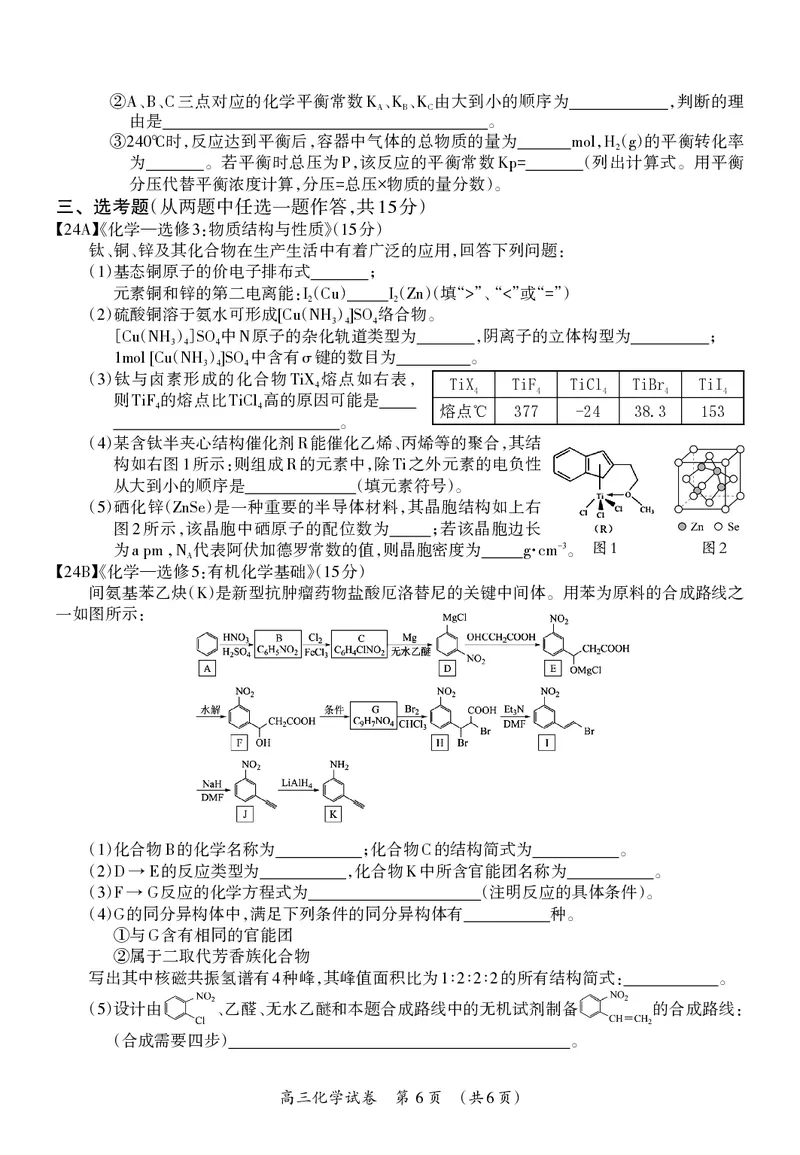
【 】《化学—选修 :物质结构与性质》( 分)
24A 3 15
钛、铜、锌及其化合物在生产生活中有着广泛的应用,回答下列问题:
()基态铜原子的价电子排布式 ;
1
元素铜和锌的第二电离能:( ) ( )(填“ ”、“ ”或“ ”)
I2 Cu I2 Zn > < =
()硫酸铜溶于氨水可形成 ( ) 络合物。
2 [ ( )] 中 原子 [C 的 u 杂 N 化 H3 轨 4] 道 SO 类 4 型为 ,阴离子的立体构型为 ;
Cu NH3 4 SO4 N
( ) 中含有 键的数目为 。
1mol[Cu NH3 4]SO4 σ
()钛与卤素形成的化合物 熔点如右表, TiX TiF TiCl TiBr TiI
3 TiX4 4 4 4 4 4
则 的熔点比 高的原因可能是
TiF4 TiCl4 熔点℃ 377 -24 38.3 153
。
()某含钛半夹心结构催化剂 能催化乙烯、丙烯等的聚合,其结
4 R
构如右图 所示:则组成 的元素中,除 之外元素的电负性
1 R Ti
从大到小的顺序是 (填元素符号)。
()硒化锌( )是一种重要的半导体材料,其晶胞结构如上右
5 ZnSe
图 所示,该晶胞中硒原子的配位数为 ;若该晶胞边长
2
为 代表阿伏加德罗常数的值,则晶胞密度为 。 图1 图2
-3
【 】《化学
a
—
pm
选
,
修
NA
:有机化学基础》( 分)
g·cm
24B 5 15
间氨基苯乙炔( )是新型抗肿瘤药物盐酸厄洛替尼的关键中间体。用苯为原料的合成路线之
K
一如图所示:
()化合物 的化学名称为 ;化合物 的结构简式为 。
1 B C
() 的反应类型为 ,化合物 中所含官能团名称为 。
2 D→E K
() 反应的化学方程式为 (注明反应的具体条件)。
3 F→G
() 的同分异构体中,满足下列条件的同分异构体有 种。
4 G
与 含有相同的官能团
① G
属于二取代芳香族化合物
②
写出其中核磁共振氢谱有 种峰,其峰值面积比为 ∶∶∶ 的所有结构简式: 。
4 1 2 2 2
()设计由 、乙醛、无水乙醚和本题合成路线中的无机试剂制备 的合成路线:
5
(合成需要四步) 。
高三化学试卷 第 页 (共 页)
6 6