文档内容
1
吉林省普通高中 G8 教考联盟 2024-2025 学年上学期期末考试
高一年级 化学
本试卷共8页。考试结束后,将答题卡交回。
注意事项:1.答卷前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生信息条形
码粘贴区。
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草
稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 Cl-35.5 S-32 Fe-56
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合题目要
求。
1.下列说法错误的是
A.在进行钠在空气中燃烧和钠与水反应的实验时,应佩戴护目镜
B.钛合金、耐热合金等新型合金广泛应用于航空航天、生物工程等领域
C.考古时利用14C测定一些文物的年代,1H用于制造氢弹
D.漂白液既可以作棉、麻、纸张的漂白剂,又可以做游泳池的消毒剂
2.物质分类观是化学学科的核心观念,下列物质的性质及分类分析正确的是
A.NaO 属于碱性氧化物,NO 属于酸性氧化物
2 2 2
B.HPO (次磷酸)与足量的NaOH反应后只生成NaH PO ,故HPO 属于一元酸
3 2 2 2 3 2
C.胶体与溶液的本质区别是能否产生丁达尔效应
D.液态HCl不能导电,所以HCl是非电解质
3.下列离子方程式与所述事实相符且正确的是
A.向Ca(HCO ) 溶液中加入过量NaOH溶液:Ca2++HCO-+OH-=CaCO↓+H O
3 2 3 3 2
B.向CaCl 溶液中通入CO:Ca2++CO +H O=CaCO↓+2H+
2 2 2 2 3
C.NaO 用作呼吸面罩供氧剂的原理:NaO+CO=Na CO+O
2 2 2 2 2 2 3 2
D.NaH用作生氢剂的原理:NaH + H O=NaOH +H↑
2 2
4.已知:①SeO+4KI+4HNO =Se+2I +4KNO +2H O
2 3 2 3 2
②Se+2HSO (浓)=2SO↑+SeO +2H O
2 4 2 2 2
③Se+4HNO(浓)=SeO +4NO↑+2H O 下列有关叙述正确的是
3 2 2 2
A.SeO、HSO (浓)、I 的氧化性由强到弱的顺序是HSO (浓)>SeO > I
2 2 4 2 2 4 2 2
B.反应①中Se是氧化产物, I 是还原产物
2
C.反应①中每有2 mol I 生成,转移电子数目约为8×6.02×1023
2
D.反应②③中,等量的Se消耗浓HSO 和浓HNO 的物质的量之比为2 :1
2 4 3
5.对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
选项 粒子组 判断和分析
第1页1
A Na+、Cu2+、Cl-、OH- 能大量共存,粒子间不反应
B Na+、Fe2+、H+、HO 能大量共存,粒子间不反应
2 2
C H+、K+、CO2-、SO 2- 不能大量共存,因2H++CO2-=CO↑+H O
3 4 3 2 2
D Na+、MnO -、Cl-、H+ 不能大量共存,因2MnO -+10Cl-+14H+=2Mn2++5Cl↑+7H O
4 4 2 2
6.设N 为阿伏加德罗常数的值。下列说法正确的是
A
A.18 g H18O和2HO的混合物中,所含中子数为9N
2 2 A
B.1 mol Cl 与足量的Fe反应,转移的电子数为3N
2 A
C.1 mol·L-1 Ca(NO ) 溶液中含有的NO -数目为2N
3 2 3 A
D.标准状况下,22.4 L HO所含分子数目为N
2 A
7.下列关于NaCO、NaHCO 的叙述正确的是
2 3 3
①分别向等浓度的NaCO 和NaHCO 溶液中滴加1~2滴酚酞溶液,溶液均变红且NaHCO 溶液颜色更深
2 3 3 3
②分别向等浓度的NaCO 和NaHCO 溶液滴加稀盐酸,NaHCO 溶液产生CO 气体较快
2 3 3 3 2
③除去NaHCO 固体中的NaCO:将固体加热至恒重
3 2 3
④能用澄清石灰水鉴别NaCO、NaHCO 溶液
2 3 3
⑤相同温度下,溶解度:NaCONaHCO
2 3 3
A.①③ B.②⑥ C.④⑤ D.⑥
8.下列关于物质的检验,叙述正确的是
A.检验某无色溶液中含有Cl-:取少量溶液于试管中,滴加适量盐酸酸化的硝酸银溶液,若产生白色沉
淀,则含有Cl-
B.检验某无色溶液中含有SO 2-:取少量溶液于试管中,加入氯化钡溶液,若有白色沉淀产生,则含有
4
SO 2-
4
C.检验某溶液中含有K+:用洁净的铁丝蘸取待测液,放在酒精灯上灼烧,透过蓝色钴玻璃,若火焰呈
紫色,则含有K+
D.检验某溶液中含有CO2-:取少量溶液于试管中,加入适量稀盐酸,若产生无色气体,则含有CO2-
3 3
9.下列说法不正确的是
A.NaOH中含有极性键和离子键
B.HO+与OH-具有相同的质子数和电子数
3
C.NaO 的电子式为
2 2
D.O 和O 是氧元素的同素异形体
2 3
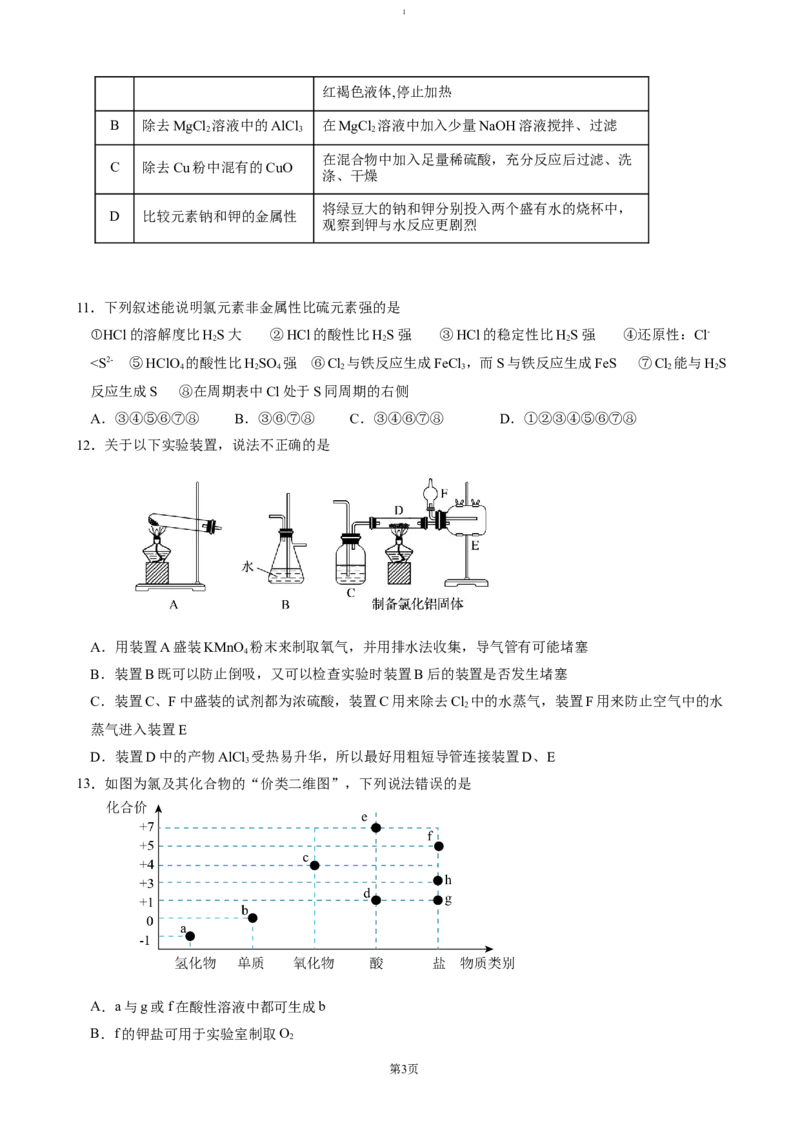
10.下列实验操作不能达到实验目的的是
实验目的 实验操作或现象
A 制备Fe(OH)
3
胶体 将饱和的FeCl
3
溶液滴入沸水中,并继续煮沸至生成
第2页1
红褐色液体,停止加热
B 除去MgCl 溶液中的AlCl 在MgCl 溶液中加入少量NaOH溶液搅拌、过滤
2 3 2
在混合物中加入足量稀硫酸,充分反应后过滤、洗
C 除去Cu粉中混有的CuO
涤、干燥
将绿豆大的钠和钾分别投入两个盛有水的烧杯中,
D 比较元素钠和钾的金属性
观察到钾与水反应更剧烈
11.下列叙述能说明氯元素非金属性比硫元素强的是
①HCl的溶解度比HS大 ②HCl的酸性比HS强 ③HCl的稳定性比HS强 ④还原性:Cl-
2 2 2
Na>Cl
(8)
17.(除标记外每空2分,共14分)
(1) (全对给2分,物质写对给1分,气体符号不扣分)
酸性 还原性(无顺序,每个1分)
去除Cl 中的HCl
2
(2) ②③①(共2分,有错不给分)
(3) 确认(确保,保证等均可)F的黄色溶液中无Cl ,排除Cl 对溴置换碘实验的干扰
2 2
Br +2KI=I +2KBr
2 2
原子核外电子层数依次增多,原子半径逐渐增大 (电子层和原子半径写一个给1分,写全给2分,写错不
给分)
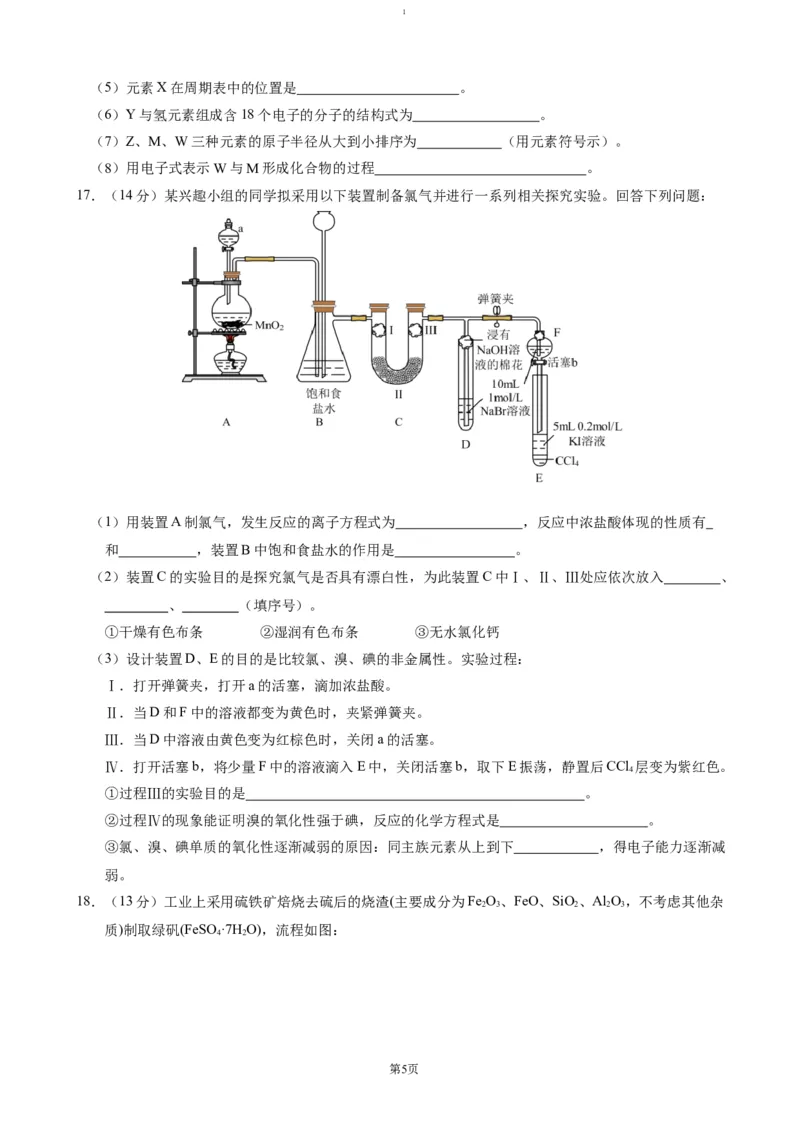
17.(除标记外每空2分,共13分)
(1)稀硫酸(硫酸、浓硫酸、硫酸溶液等均可)
第7页1
(2)SiO
2
(3)KSCN溶液(或其他答案合理即可给分)
(4)Al(SO )+8NaOH=2Na[Al(OH) ]+3Na SO (全对给2分,物质写对给1分)
2 4 3 4 2 4
(5)Fe+2Fe3+=3Fe2+ Fe+2H+ = Fe2+ +H ↑ (两个反应没有顺序)
2
(6)冷却结晶 1分
19.(12分)
(1)3.99 mol/L (单位不写扣1分)
(2) ↑
(3)500mL容量瓶(只写容量瓶不给分)
(4)62.5
(5) ③④(少写给1分,写错不给分)
(6) (全对给2分,物质写对给1分,加热条件也给分,光照、气体符号不扣分)
第8页