文档内容
B.中国“深海一号”平台成功实现从深海中开采石油和天然气,石油和天然气都是混合物
高一化学4月月考试题
C.我国实现了高性能纤维锂离子电池的规模化制备,锂离子电池放电时将化学能转化为电能
一、单选题(每题2分)
1.人类对能源的利用经历了柴薪、煤炭和石油时期,现正向新能源方向高质量发展。下列有关能源的 D.以硅树脂为基体的自供电软机器人成功挑战马里亚纳海沟,硅树脂是一种高分子材料
7.高分子材料在生产生活中应用广泛。下列说法错误的是
叙述错误的是
A.芦苇可用于制造黏胶纤维,其主要成分为纤维素
A.木材与煤均含有碳元素 B.石油裂化可生产汽油
B.聚氯乙烯通过加聚反应制得,可用于制作不粘锅的耐热涂层
C.燃料电池将热能转化为电能 D.太阳能光解水可制氢
C.淀粉是相对分子质量可达几十万的天然高分子物质
2.有关石油和煤的说法不正确的是
D.大豆蛋白纤维是一种可降解材料
A.石油加工可获得乙烯 B.煤加工可获得苯
8.“稀土之父”徐光宪先生提出了稀土串级萃取理论,其基本操作是利用有机络合剂把稀土离子从水
C.石油的分馏、裂化裂解均为物理变化 D.煤的干馏、气化和液化均为化学变化
3.化学在文物的研究和修复中有重要作用。下列说法错误的是 相富集到有机相再进行分离。分离时可用的玻璃装置是
A.竹简的成分之一纤维素属于天然高分子 B.龟甲的成分之一羟基磷灰石属于无机物
C.古陶瓷修复所用的熟石膏,其成分为Ca(OH) D.古壁画颜料中所用的铁红,其成分为Fe O
2 2 3
4.龙是中华民族重要的精神象征和文化符号。下列与龙有关的历史文物中,主要材质为有机高分子的 A. B. C. D.
是
A B C D
9.下列烷烃在光照条件下与氯气发生反应,只生成3种一氯代物的是
A.正戊烷 B.
C. D.
二、不定项选择(每题有1或2个选项符合题意)
鎏金铁芯铜 云龙纹瓷
红山玉龙 云龙纹丝绸
龙 瓶 10.某营养补充剂的结构如图所示。W、X、Y、Z为原子序数依次增大的短周期元素,X、Y、Z同周
A.A B.B C.C D.D
期, 的电子总数为23,R是血红蛋白中重要的金属元素。下列说法正确的是
5.科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是
A.利用CO 合成了脂肪酸:实现了无机小分子向有机高分子的转变
2
B.发现了月壤中的“嫦娥石[(Ca Y)Fe(PO)]”:其成分属于无机盐
8 4 7
C.研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能
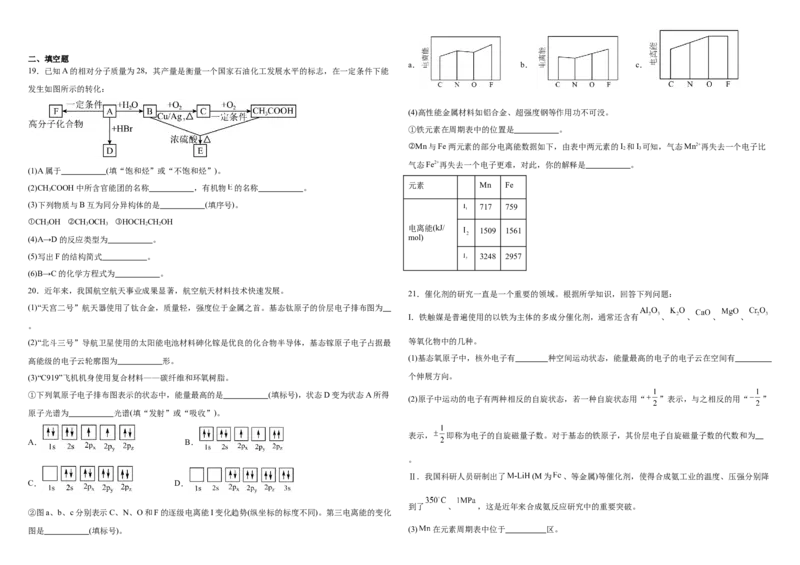
D.革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀 A.电负性:
6.近年我国在科技领域不断取得新成就。对相关成就所涉及的化学知识理解错误的是 B.第一电离能:
A.我国科学家实现了从二氧化碳到淀粉的人工合成,淀粉是一种单糖 C.简单氢化物的热稳定性:D.基态原子的未成对电子数: B.最简单氢化物的热稳定性:Z”或“<”) 。
22.I.现有A、B、C三种烃,其球棍模型如图:
(2)潜艇中使用的液氨-液氧燃料电池的工作原理如图所示,电极a的电极反应式为 ,该电
池工作时消耗11.2LNH (标准状况下),则电极b通过 mol氧气。
(1)等物质的量的以上物质完全燃烧时耗去O 的量最多的是 (填对应字母)。 3
2
(2)①将B气体通入酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,该反应类型是 ;
②一定条件下,B使溴的四氯化碳溶液褪色,该反应类型是 ,1-丁烯( )也能
发生类似的反应,请写出1-丁烯与Br 发生该反应的化学方程式 。
2
Ⅱ.如图所示,U形管的左端用橡胶塞封闭,充有甲烷和氯气(体积比为1∶4)的混合气体,假定氯气在
Ⅱ.有氧条件下,NH 催化还原NO是主要的烟气脱硝技术。
3
水中的溶解可以忽略不计。将封闭有甲烷和氯气混合气体的装置放置在有漫射光的地方让混合气体缓
(3)在以Fe O 为主的催化剂上可能发生的反应过程如图,写出总反应的化学方程式: 。
2 3
慢反应一段时间。
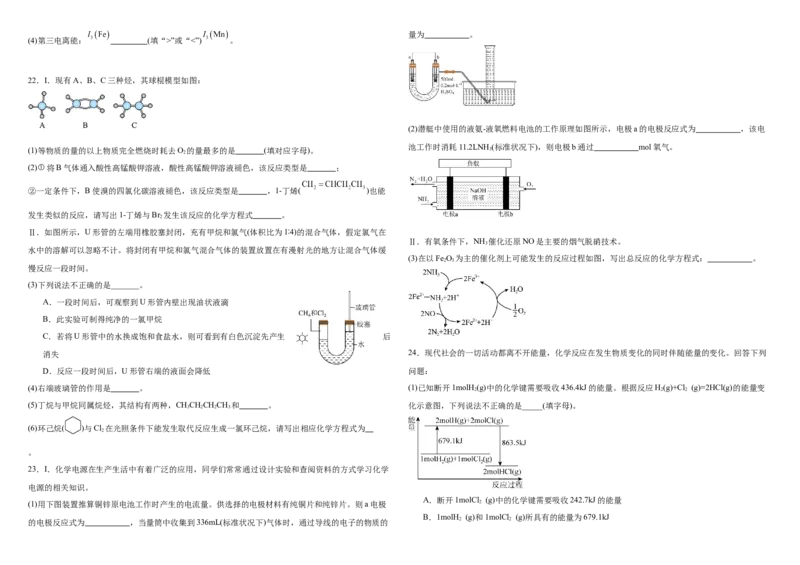
(3)下列说法不正确的是_______。
A.一段时间后,可观察到U形管内壁出现油状液滴
B.此实验可制得纯净的一氯甲烷
C.若将U形管中的水换成饱和食盐水,则可看到有白色沉淀先产生 后
消失 24.现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随能量的变化。回答下列
D.反应一段时间后,U形管右端的液面会降低 问题:
(4)右端玻璃管的作用是 。 (1)已知断开1molH (g)中的化学键需要吸收436.4kJ的能量。根据反应H(g)+Cl (g)=2HCl(g)的能量变
2 2 2
(5)丁烷与甲烷同属烷烃,其结构有两种,CHCHCHCH 和 。 化示意图,下列说法不正确的是_____(填字母)。
3 2 2 3
(6)环己烷( )与Cl 在光照条件下能发生取代反应生成一氯环己烷,请写出相应化学方程式为
2
。
23.I.化学电源在生产生活中有着广泛的应用,同学们常常通过设计实验和查阅资料的方式学习化学
电源的相关知识。
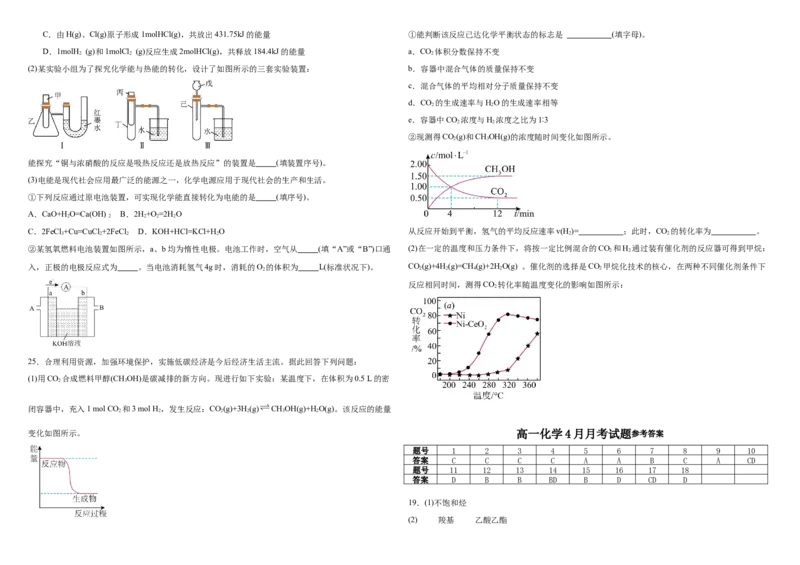
A.断开1molCl (g)中的化学键需要吸收242.7kJ的能量
(1)用下图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则a电极 2
B.1molH (g)和1molCl (g)所具有的能量为679.1kJ
的电极反应式为 ,当量筒中收集到336mL(标准状况下)气体时,通过导线的电子的物质的 2 2C.由H(g)、Cl(g)原子形成1molHCl(g),共放出431.75kJ的能量 ①能判断该反应已达化学平衡状态的标志是 (填字母)。
D.1molH (g)和1molCl (g)反应生成2molHCl(g),共释放184.4kJ的能量 a.CO 体积分数保持不变
2 2 2
(2)某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置: b.容器中混合气体的质量保持不变
c.混合气体的平均相对分子质量保持不变
d.CO 的生成速率与HO的生成速率相等
2 2
e.容器中CO 浓度与H 浓度之比为1∶3
2 2
②现测得CO(g)和CHOH(g)的浓度随时间变化如图所示。
2 3
能探究“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是 (填装置序号)。
(3)电能是现代社会应用最广泛的能源之一,化学电源应用于现代社会的生产和生活。
①下列反应通过原电池装置,可实现化学能直接转化为电能的是 (填序号)。
A.CaO+H O=Ca(OH) B.2H+O =2H O
2 2 2 2 2
C.2FeCl +Cu=CuCl +2FeCl D.KOH+HCl=KCl+H O 从反应开始到平衡,氢气的平均反应速率v(H )= ;此时,CO 的转化率为 。
3 2 2 2 2 2
②某氢氧燃料电池装置如图所示,a、b均为惰性电极。电池工作时,空气从 (填“A”或“B”)口通 (2)在一定的温度和压力条件下,将按一定比例混合的CO 和H 通过装有催化剂的反应器可得到甲烷:
2 2
入,正极的电极反应式为 。当电池消耗氢气4g时,消耗的O 的体积为 L(标准状况下)。 CO(g)+4H(g)=CH (g)+2HO(g) 。催化剂的选择是CO 甲烷化技术的核心,在两种不同催化剂条件下
2 2 2 4 2 2
反应相同时间,测得CO 转化率随温度变化的影响如图所示:
2
25.合理利用资源,加强环境保护,实施低碳经济是今后经济生活主流。据此回答下列问题:
(1)用CO 合成燃料甲醇(CHOH)是碳减排的新方向。现进行如下实验:某温度下,在体积为0.5 L的密
2 3
闭容器中,充入1 mol CO 和3 mol H ,发生反应:CO(g)+3H(g) CHOH(g)+H O(g)。该反应的能量
2 2 2 2 3 2
变化如图所示。 高一化学4月月考试题参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C C C C A A B C A CD
题号 11 12 13 14 15 16 17 18
答案 D B B BD B D CD D
19.(1)不饱和烃
(2) 羧基 乙酸乙酯(3)②
(3)4NH +4NO+O 4N+6H O
(4)加成反应 3 2 2 2
(5) 24.(1)3d10 4s1
(2) 硼 哑铃状
(6)2CH CHOH+O 2CHCHO+2H O
3 2 2 3 2
(3)A
25.(1) acd 0.375mol·L-1min-1 75%
20.(1)
(2) Ni-CeO 320℃
2
(2)哑铃
(3) D 发射 b
(4) 第四周期第VIII族 Mn2+的价层电子排布式为3d5,3d轨道半充满,较稳定,Fe2+的价层电
子排布式为3d6,再失去一个电子则为半充满稳定状态,所以Mn2+再失去1个电子比Fe2+再失去1个电
子难
21.(1) 5 3
(2)+2或-2
(3)
(4) <
22.(1)C
(2) 氧化反应 加成反应
(3)BC
(4)平衡压强
(5)
(6) +HCl
23.(1) 0.03mol
(2) 0.375