文档内容
高一化学 月考
4
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符
合题目要求的。
1.材料是人类赖以生存和发展的物质基础。下列物质的主要成分属于有机合成材料的是
A.瓷器 B.有机玻璃制成的飞机 C.“蛟龙号”潜水器耐压球壳 D.光导纤维
风挡
2.下列化学用语表达正确的是
A.CH CI的电子式: B.环己烷的分子式:C H
3 6 12
C.乙炔的结构简式:CHCH D.乙醇的分子结构模型:
3.物质的性质决定其用途,下列说法错误的是
A.氮气可用作保护气,是因为常温下氮气的化学性质很稳定
B.液氨可用作制冷剂,是因为液氨汽化时要吸收大量的热
C.二氧化硫可用来漂白纸浆,是因为二氧化硫具有强氧化性
D.水玻璃可用作防火剂,是因为水玻璃具有耐高温的特性
4.下列各组物质的鉴别方法错误的是
A.用BaCl 溶液鉴别AgNO 溶液和Na SO 溶液
2 3 2 4
B.用加热法鉴别NH CI固体和NaCl固体
4
C.用打磨过的Al片鉴别浓硫酸和稀硫酸
D.用品红溶液鉴别SO 和CO
2 2
5.下列反应对应的方程式正确的是
A.少量乙酸和碳酸钠溶液反应:H++CO 2-=HCO -
3 3
B.丙烯与单质溴发生加成反应:CH =CH-CH +Br →CH Br-CH -CH Br
2 3 2 2 2 2
C.少量SO 与NaClO溶液反应:SO +H O+2ClO-=2HClO+SO 2-
2 2 2 3
D.过量的铁粉与稀硝酸反应:3Fe+8H++2NO -=3Fe2++2NO↑+4H O
3 2
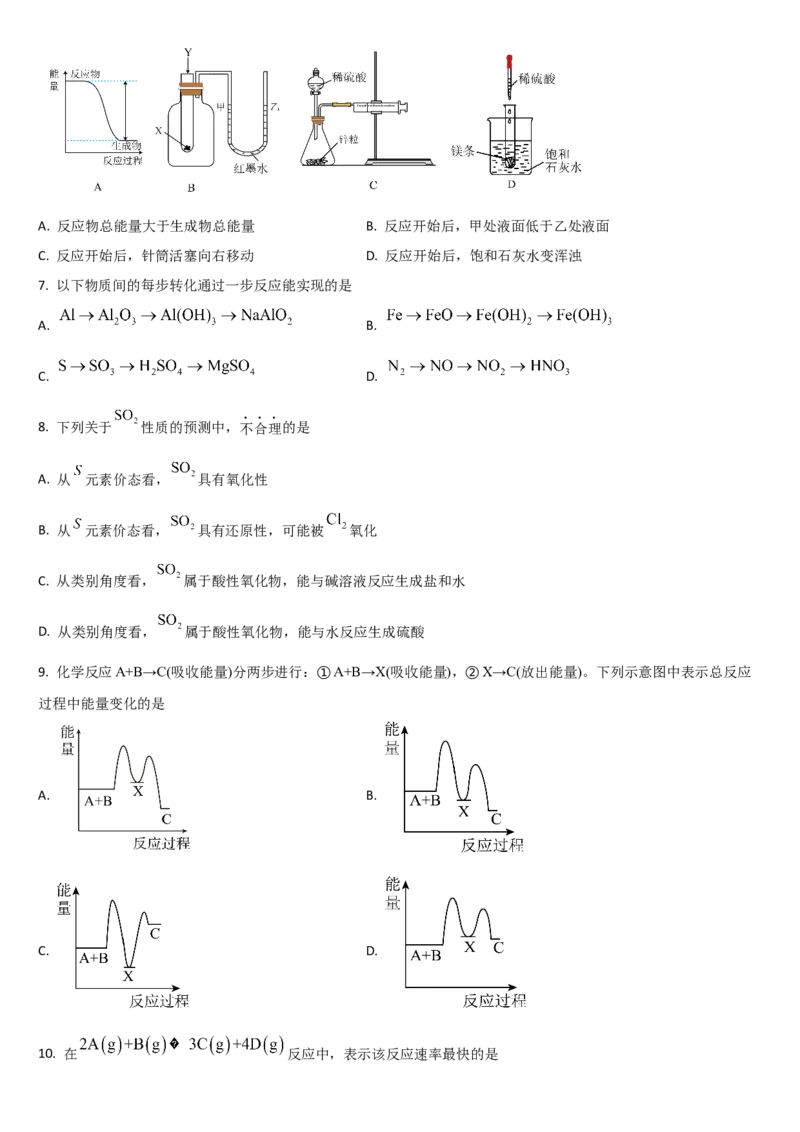
6. 下列实验现象或图像信息不能说明相应的化学反应是放热反应的是A. 反应物总能量大于生成物总能量 B. 反应开始后,甲处液面低于乙处液面
C. 反应开始后,针筒活塞向右移动 D. 反应开始后,饱和石灰水变浑浊
7. 以下物质间的每步转化通过一步反应能实现的是
A. B.
C. D.
8. 下列关于 性质的预测中,不合理的是
A. 从 元素价态看, 具有氧化性
B. 从 元素价态看, 具有还原性,可能被 氧化
C. 从类别角度看, 属于酸性氧化物,能与碱溶液反应生成盐和水
D. 从类别角度看, 属于酸性氧化物,能与水反应生成硫酸
9. 化学反应A+B→C(吸收能量)分两步进行:①A+B→X(吸收能量),②X→C(放出能量)。下列示意图中表示总反应
过程中能量变化的是
A. B.
C. D.
10. 在 反应中,表示该反应速率最快的是A. B.
.
C D.
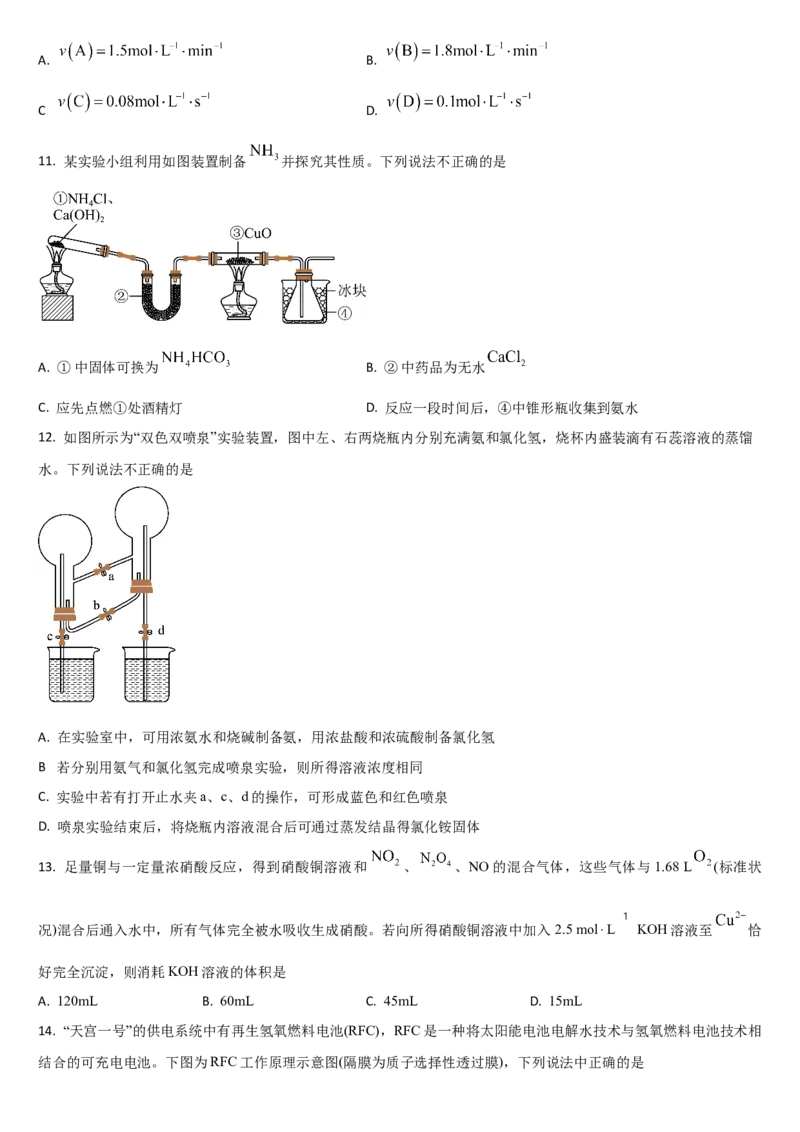
11. 某实验小组利用如图装置制备 并探究其性质。下列说法不正确的是
A. ①中固体可换为 B. ②中药品为无水
C. 应先点燃①处酒精灯 D. 反应一段时间后,④中锥形瓶收集到氨水
12. 如图所示为“双色双喷泉”实验装置,图中左、右两烧瓶内分别充满氨和氯化氢,烧杯内盛装滴有石蕊溶液的蒸馏
水。下列说法不正确的是
A. 在实验室中,可用浓氨水和烧碱制备氨,用浓盐酸和浓硫酸制备氯化氢
.
B 若分别用氨气和氯化氢完成喷泉实验,则所得溶液浓度相同
C. 实验中若有打开止水夹a、c、d的操作,可形成蓝色和红色喷泉
D. 喷泉实验结束后,将烧瓶内溶液混合后可通过蒸发结晶得氯化铵固体
13. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和 、 、NO的混合气体,这些气体与1.68 L (标准状
况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 2.5 mol⋅L KOH溶液至 恰
好完全沉淀,则消耗KOH溶液的体积是
A. 120mL B. 60mL C. 45mL D. 15mL
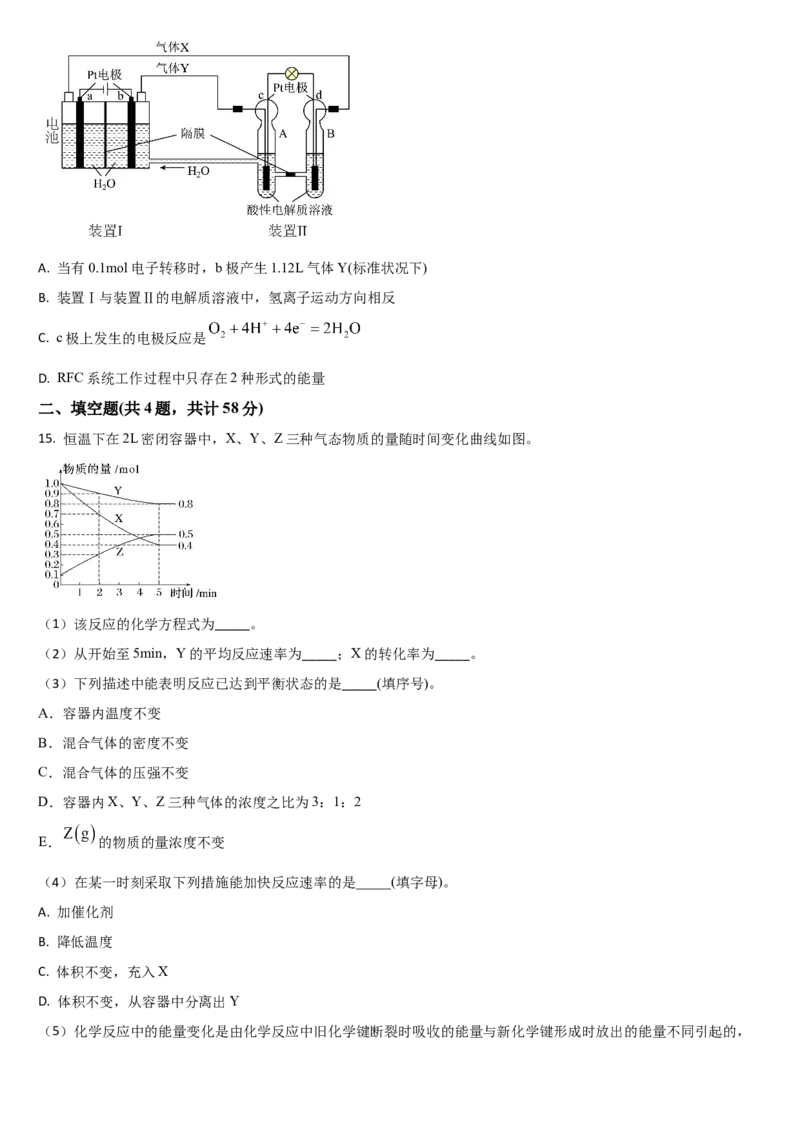
14. “天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相
结合的可充电电池。下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是A. 当有0.1mol电子转移时,b极产生1.12L气体Y(标准状况下)
B. 装置Ⅰ与装置Ⅱ的电解质溶液中,氢离子运动方向相反
C. c极上发生的电极反应是
D. RFC系统工作过程中只存在2种形式的能量
二、填空题(共4题,共计58分)
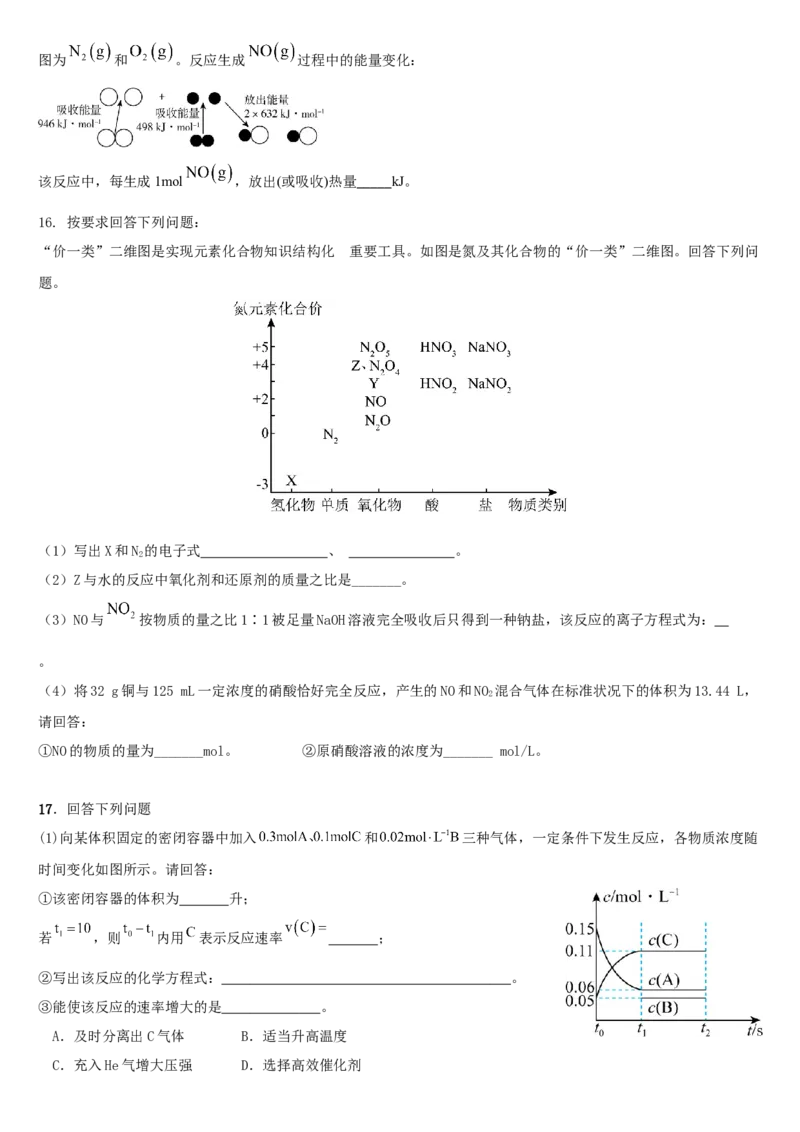
15. 恒温下在2L密闭容器中,X、Y、Z三种气态物质的量随时间变化曲线如图。
(1)该反应的化学方程式为_____。
(2)从开始至5min,Y的平均反应速率为_____;X的转化率为_____。
(3)下列描述中能表明反应已达到平衡状态的是_____(填序号)。
A.容器内温度不变
B.混合气体的密度不变
C.混合气体的压强不变
D.容器内X、Y、Z三种气体的浓度之比为3:1:2
E. 的物质的量浓度不变
(4)在某一时刻采取下列措施能加快反应速率的是_____(填字母)。
A. 加催化剂
B. 降低温度
C. 体积不变,充入X
D. 体积不变,从容器中分离出Y
(5)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,图为 和 。反应生成 过程中的能量变化:
该反应中,每生成1mol ,放出(或吸收)热量_____kJ。
16. 按要求回答下列问题:
“价一类”二维图是实现元素化合物知识结构化 的重要工具。如图是氮及其化合物的“价一类”二维图。回答下列问
题。
(1)写出X和N 的电子式 、 。
2
(2)Z与水的反应中氧化剂和还原剂的质量之比是_______。
(3)NO与 按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该反应的离子方程式为:
。
(4)将32 g铜与125 mL一定浓度的硝酸恰好完全反应,产生的NO和NO 混合气体在标准状况下的体积为13.44 L,
2
请回答:
①NO的物质的量为_______mol。 ②原硝酸溶液的浓度为_______ mol/L。
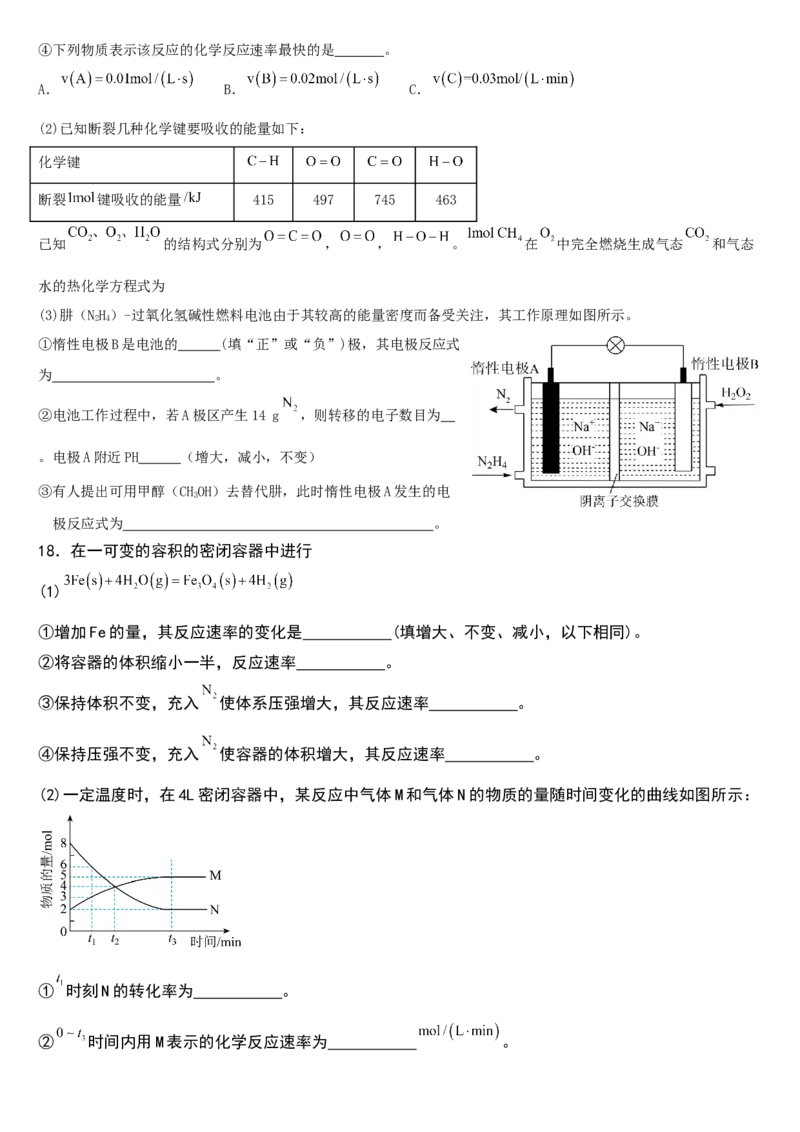
17.回答下列问题
(1)向某体积固定的密闭容器中加入 和 三种气体,一定条件下发生反应,各物质浓度随
时间变化如图所示。请回答:
①该密闭容器的体积为 升;
若 ,则 内用 表示反应速率 ;
②写出该反应的化学方程式: 。
③能使该反应的速率增大的是 。
A.及时分离出C气体 B.适当升高温度
C.充入He气增大压强 D.选择高效催化剂④下列物质表示该反应的化学反应速率最快的是 。
A. B. C.
(2)已知断裂几种化学键要吸收的能量如下:
化学键
断裂 键吸收的能量 415 497 745 463
已知 的结构式分别为 , , 。 在 中完全燃烧生成气态 和气态
水的热化学方程式为
(3)肼(NH)-过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
2 4
①惰性电极B是电池的 (填“正”或“负”)极,其电极反应式
为 。
②电池工作过程中,若A极区产生14 g ,则转移的电子数目为
。电极A附近PH (增大,减小,不变)
③有人提出可用甲醇(CHOH)去替代肼,此时惰性电极A发生的电
3
极反应式为 。
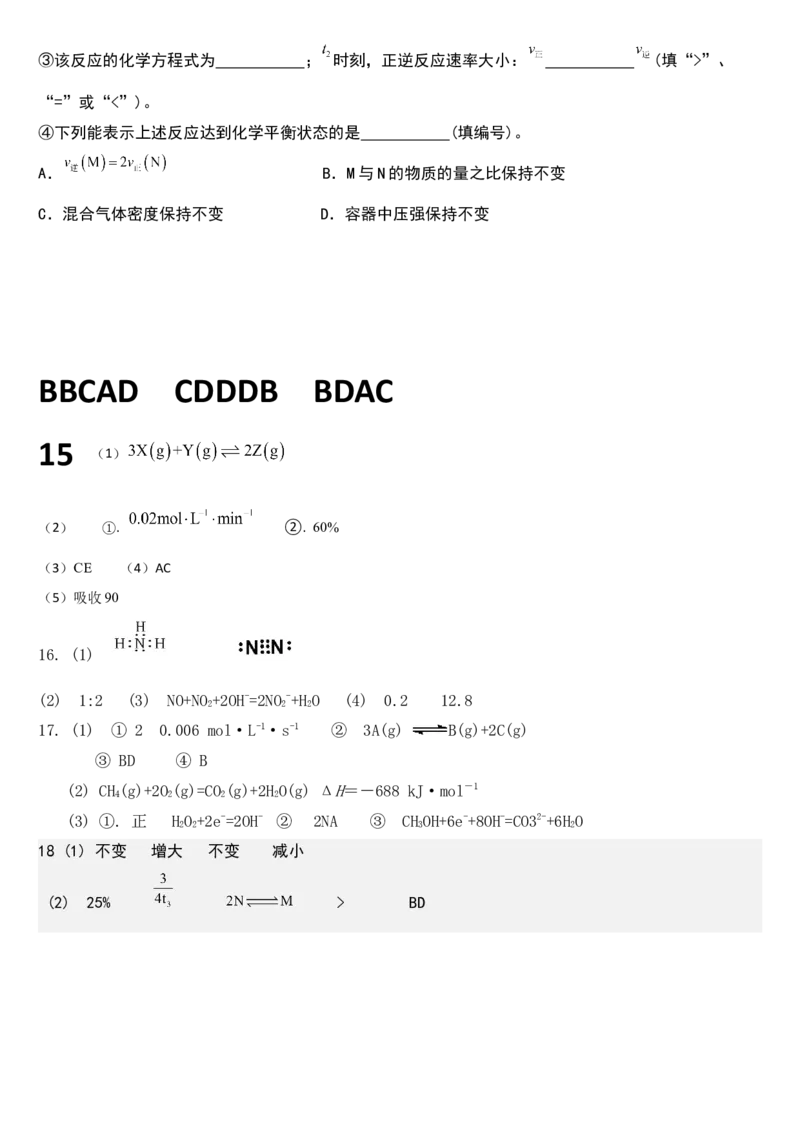
18.在一可变的容积的密闭容器中进行
(1)
①增加Fe的量,其反应速率的变化是 (填增大、不变、减小,以下相同)。
②将容器的体积缩小一半,反应速率 。
③保持体积不变,充入 使体系压强增大,其反应速率 。
④保持压强不变,充入 使容器的体积增大,其反应速率 。
(2)一定温度时,在4L密闭容器中,某反应中气体M和气体N的物质的量随时间变化的曲线如图所示:
① 时刻N的转化率为 。
② 时间内用M表示的化学反应速率为 。③该反应的化学方程式为 ; 时刻,正逆反应速率大小: (填“>”、
“=”或“<”)。
④下列能表示上述反应达到化学平衡状态的是 (填编号)。
A. B.M与N的物质的量之比保持不变
C.混合气体密度保持不变 D.容器中压强保持不变
BBCAD CDDDB BDAC
15
(1)
(2) ①. ②. 60%
(3)CE (4)AC
(5)吸收90
16. (1)
(2) 1:2 (3) NO+NO +2OH-=2NO -+H O (4) 0.2 12.8
2 2 2
17. (1) ① 2 0.006 mol·L-1·s-1 ② 3A(g) B(g)+2C(g)
③ BD ④ B
(2) CH (g)+2O (g)=CO (g)+2H O(g) ΔH=-688 kJ·mol-1
4 2 2 2
(3) ①. 正 H O +2e-=2OH- ② 2NA ③ CH OH+6e-+8OH-=CO32-+6H O
2 2 3 2
18 (1) 不变 增大 不变 减小
(2) 25% > BD