文档内容
长春外国语学校2024-2025学年第二学期高一年级期中考试
4.下列指定反应的离子方程式正确的是( )
化学试卷
A.铅酸蓄电池放电时的负极反应:Pb - 2e- = Pb2+
B.少量SO 通入Ca(ClO) 溶液中:SO +H O+Ca2++2ClO-=CaSO ↓+2HClO
出题人 :孙晓微 审题人:罗睿 2 2 2 2 3
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 4页。考试结束后, C.Fe(OH)
2
与足量稀硝酸反应:Fe(OH)
2
+2H+=Fe2++2H
2
O
将答题卡交回。 D.向硅酸钠溶液中通入少量CO 气体:SiO2-+CO +H O=HSiO↓+CO 2-
2 3 2 2 2 3 3
注意事项:
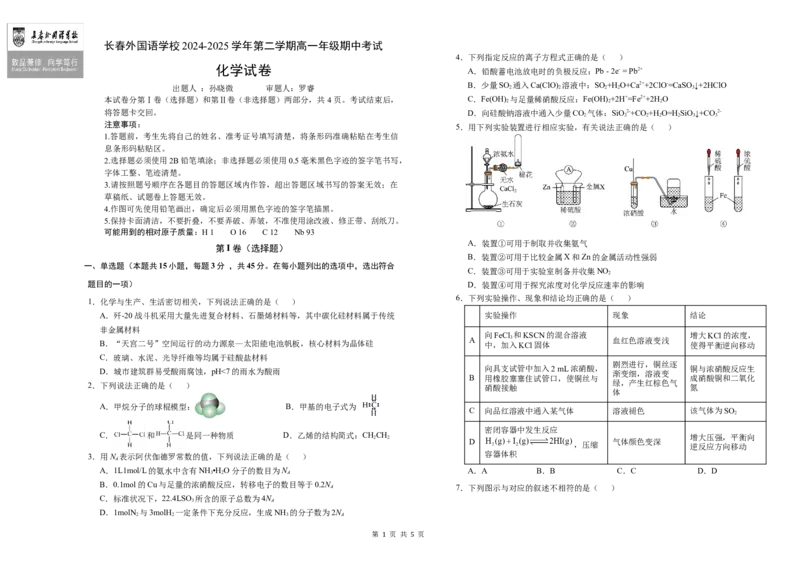
5.用下列实验装置进行相应实验,有关说法正确的是( )
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信
息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,
字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在
草稿纸、试题卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:H 1 O 16 C 12 Nb 93
A.装置①可用于制取并收集氨气
第I卷(选择题)
B.装置②可用于比较金属X和Zn的金属活动性强弱
一、单选题(本题共15小题,每题3分 ,共45分。在每小题列出的选项中,选出符合
C.装置③可用于实验室制备并收集NO
2
题目的一项) D.装置④可用于探究浓度对化学反应速率的影响
6.下列实验操作、现象和结论均正确的是( )
1.化学与生产、生活密切相关,下列说法正确的是( )
A.歼-20战斗机采用大量先进复合材料、石墨烯材料等,其中碳化硅材料属于传统 实验操作 现象 结论
非金属材料
向FeCl 和KSCN的混合溶液 增大KCl的浓度,
A 3 血红色溶液变浅
B.“天宫二号”空间运行的动力源泉—太阳能电池帆板,核心材料为晶体硅 中,加入KCl固体 使得平衡逆向移动
C.玻璃、水泥、光导纤维等均属于硅酸盐材料
剧烈进行,铜丝逐
向具支试管中加入2 mL浓硝酸, 铜与浓硝酸反应生
D.城市建筑群易受酸雨腐蚀,pH<7的雨水为酸雨 渐变细,溶液变
B 用橡胶塞塞住试管口,使铜丝与 成硝酸铜和二氧化
绿,产生红棕色气
2.下列说法正确的是( ) 硝酸接触 氮
体
A.甲烷分子的球棍模型: B.甲基的电子式为
C 向品红溶液中通入某气体 溶液褪色 该气体为SO
2
密闭容器中发生反应
C. 和 是同一种物质 D.乙烯的结构简式:CH 2 CH 2 增大压强,平衡向
D 气体颜色变深
,压缩 逆反应方向移动
容器体积
3.用N 表示阿伏伽德罗常数的值,下列说法正确的是( )
A
A.1L1mol/L的氨水中含有NH •H O分子的数目为N A.A B.B C.C D.D
3 2 A
B.0.1mol的Cu与足量的浓硝酸反应,转移电子的数目等于0.2N
A 7.下列图示与对应的叙述不相符的是( )
C.标准状况下,22.4LSO 所含的原子总数为4N
3 A
D.1molN 与3molH 一定条件下充分反应,生成NH 的分子数为2N
2 2 3 A
第 页 共 页
1 5已知:若键能是断裂1 mol键所吸收的能量或形成1 mol键所放出的能量,几种物
质中化学键的键能如下表所示。
HO中 O 中 H 中H- HO 中O- HO 中O-
化学键 2 2 2 2 2 2 2
H-O键 O=O键 H键 O键 H键
键能kJ/mol 463 496 436 138 463
若反应过程中分解了2 mol水,则下列说法不正确的是( )
A.总反应为 B.过程Ⅰ吸收了926kJ能量
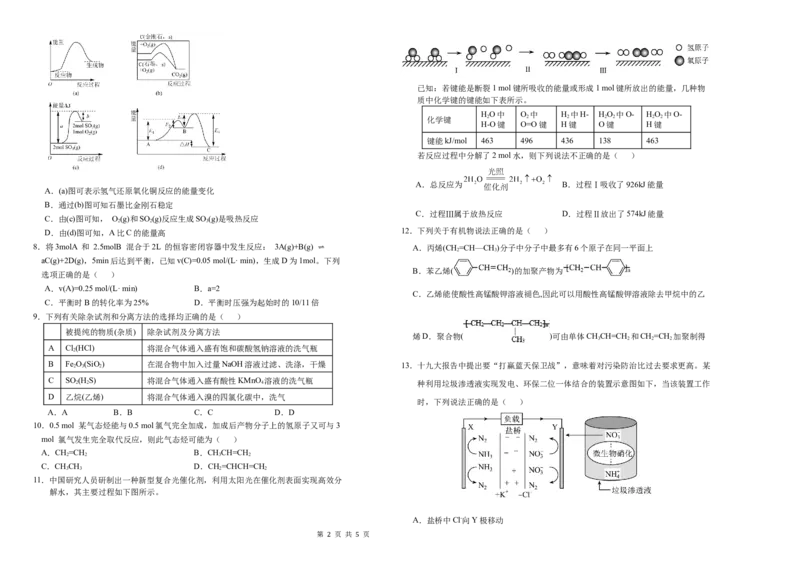
A.(a)图可表示氢气还原氧化铜反应的能量变化
B.通过(b)图可知石墨比金刚石稳定
C.过程Ⅲ属于放热反应 D.过程Ⅱ放出了574kJ能量
C.由(c)图可知, O(g)和SO (g)反应生成SO (g)是吸热反应
2 2 3
D.由(d)图可知,A比C的能量高 12.下列关于有机物说法正确的是( )
8.将3molA 和 2.5molB 混合于2L 的恒容密闭容器中发生反应: 3A(g)+B(g) ⇌ A.丙烯(CH=CH—CH)分子中分子中最多有6个原子在同一平面上
2 3
aC(g)+2D(g),5min后达到平衡,已知v(C)=0.05 mol/(L· min),生成D为1mol。下列
B.苯乙烯( )的加聚产物为
选项正确的是( )
A.v(A)=0.25 mol/(L· min) B.a=2
C.乙烯能使酸性高锰酸钾溶液褪色,因此可以用酸性高锰酸钾溶液除去甲烷中的乙
C.平衡时B的转化率为25% D.平衡时压强为起始时的10/11倍
9.下列有关除杂试剂和分离方法的选择均正确的是( )
被提纯的物质(杂质) 除杂试剂及分离方法
烯D.聚合物( )可由单体CHCH=CH 和CH=CH 加聚制得
3 2 2 2
A Cl(HCl) 将混合气体通入盛有饱和碳酸氢钠溶液的洗气瓶
2
B Fe 2 O 3 (SiO 2 ) 在混合物中加入过量NaOH溶液过滤、洗涤,干燥 13.十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某
C SO (H S) 将混合气体通入盛有酸性KMnO 溶液的洗气瓶
2 2 4 种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作
D 乙烷(乙烯) 将混合气体通入溴的四氯化碳中,洗气
时,下列说法正确的是( )
A.A B.B C.C D.D
10.0.5 mol 某气态烃能与0.5 mol氯气完全加成,加成后产物分子上的氢原子又可与3
mol 氯气发生完全取代反应,则此气态烃可能为( )
A.CH=CH B.CHCH=CH
2 2 3 2
C.CHCH D.CH=CHCH=CH
3 3 2 2
11.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分
解水,其主要过程如下图所示。
A.盐桥中Cl-向Y极移动
第 页 共 页
2 5B.电路中流过7.5 mol电子时,共产生标准状况下N 的体积为16.8L (1)下面列出了几组物质,请将物质的合适组号填写在空格上。
2
C.电流由X极沿导线流向Y极
①D与T ②O
2
与O
3
③CH
4
和CH
3
CH
2
CH
3
④CH
2
=CHCH
3
和CH
2
=CH
2
D.电池总反应为:5NH +3NO —=4N +6H O+3OH- ⑤CHCHCH(CH ) 和CHCHCHCHCH ⑥CH CHOH和
3 3 2 2 3 2 3 2 3 2 2 2 3 3 2
14.已知X(g)和Y(g)可以相互转化:2X(g)⇌Y(g) ΔH<0。现将一定量X(g)和Y(g)的混 互为同位素的是 ;互为同系物的是 ;互为同分异构体的是
合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关 ;互为同素异形体的是 。
(2)丙烯(CH=CHCH)是一种重要的化工原料,回答下列问题
系如图所示。则下列说法不正确的是( ) 2 3
①等质量的甲烷、乙烷和丙烯,完全燃烧时耗氧量最多的物质是 。
②丙烯分子中共平面的原子最多有 个。
③丙烯能合成高分子材料聚丙烯,其反应的化学方程式为 。
(3)某单烯烃与H 加成后的产物为 ,则该单烯烃可能的结构
2
简式有 种。
17.(12分)减少汽车尾气中氮氧化物NO 的排放,可有效保护环境。
x
Ⅰ.以液化气(以丁烷计,丁烷的化学式为C H )、甲醇代替汽油。
A.若混合气体的压强不变,则说明反应已达化学平衡状态 4 10
(1)已知1gC H 完全燃烧生成CO 和液态水,放出50KJ的热量。则C H 在O 中完全燃
4 10 2 4 10 2
B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点
烧的热化学方程式为 。
C.反应进行至25 min时,曲线发生变化的原因是增加Y的浓度
Ⅱ.安装汽车尾气净化装置,将NO 转化为无污染的N。
x 2
D.25~30 min内用X表示的平均化学反应速率是0.08 mol·L-1·min-1 (2)活性炭可对汽车尾气进行处理,原理为: 。下列情
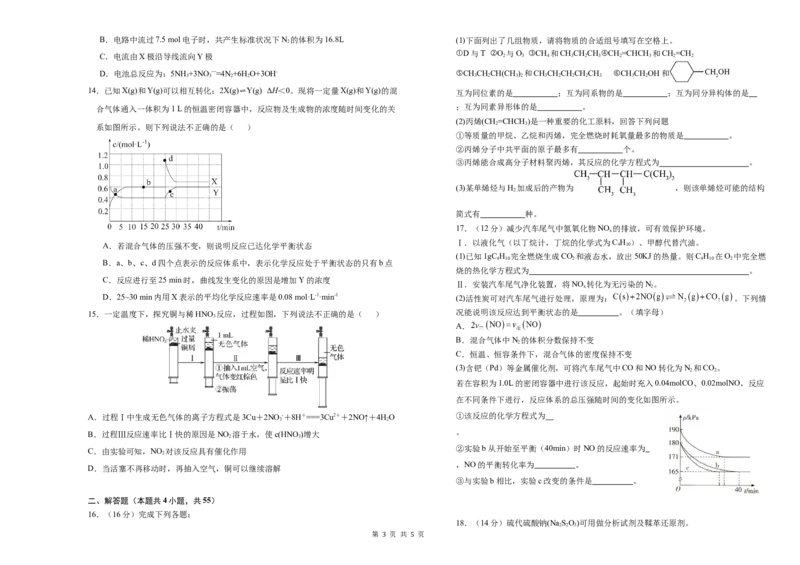
15.一定温度下,探究铜与稀HNO 反应,过程如图,下列说法不正确的是( ) 况能说明该反应达到平衡状态的是 。(填字母)
3
A.
B.混合气体中N 的体积分数保持不变
2
C.恒温、恒容条件下,混合气体的密度保持不变
(3)含钯(Pd)等金属催化剂,可将汽车尾气中CO和NO转化为N 和CO。
2 2
若在容积为1.0L的密闭容器中进行该反应,起始时充入0.04molCO、0.02molNO,反应
在不同条件下进行,反应体系的总压强随时间的变化如图所示。
A.过程Ⅰ中生成无色气体的离子方程式是3Cu+2NO -+8H+===3Cu2++2NO↑+4HO ①该反应的化学方程式为
3 2
B.过程Ⅲ反应速率比Ⅰ快的原因是NO 溶于水,使c(HNO )增大 。
2 3
②实验b从开始至平衡(40min)时NO的反应速率为
C.由实验可知,NO 对该反应具有催化作用
2
,NO的平衡转化率为 。
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
③与实验b相比,实验c改变的条件是 。
二、解答题(本题共4小题,共55)
16.(16分)完成下列各题:
18.(14分)硫代硫酸钠(Na SO)可用做分析试剂及鞣革还原剂。
2 2 3
第 页 共 页
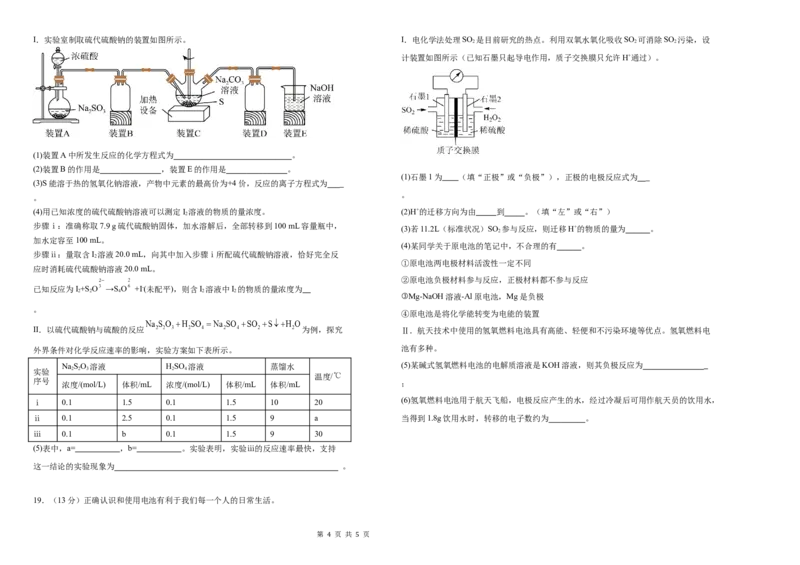
3 5I.实验室制取硫代硫酸钠的装置如图所示。 I.电化学法处理SO 是目前研究的热点。利用双氧水氧化吸收SO 可消除SO 污染,设
2 2 2
计装置如图所示(已知石墨只起导电作用,质子交换膜只允许H+通过)。
(1)装置A中所发生反应的化学方程式为 。
(2)装置B的作用是 ,装置E的作用是 。
(1)石墨1为 (填“正极”或“负极”),正极的电极反应式为
(3)S能溶于热的氢氧化钠溶液,产物中元素的最高价为+4价,反应的离子方程式为
。
。
(4)用已知浓度的硫代硫酸钠溶液可以测定I 溶液的物质的量浓度。 (2)H+的迁移方向为由 到 。(填“左”或“右”)
2
步骤ⅰ:准确称取7.9 g硫代硫酸钠固体,加水溶解后,全部转移到100 mL容量瓶中,
(3)若11.2L(标准状况)SO 参与反应,则迁移H+的物质的量为 。
2
加水定容至100 mL。
(4)某同学关于原电池的笔记中,不合理的有 。
步骤ⅱ:量取含I 溶液20.0 mL,向其中加入步骤ⅰ所配硫代硫酸钠溶液,恰好完全反
2
①原电池两电极材料活泼性一定不同
应时消耗硫代硫酸钠溶液20.0 mL。
②原电池负极材料参与反应,正极材料都不参与反应
已知反应为I+S O →SO +I-(未配平),则含I 溶液中I 的物质的量浓度为
2 2 4 2 2
③Mg-NaOH溶液-Al原电池,Mg是负极
。
④原电池是将化学能转变为电能的装置
II.以硫代硫酸钠与硫酸的反应 为例,探究 Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电
外界条件对化学反应速率的影响,实验方案如下表所示。 池有多种。
NaSO 溶液 HSO 溶液 蒸馏水 (5)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为
实验 2 2 3 2 4
温度/
序号 浓度/(mol/L) 体积/mL 浓度/(mol/L) 体积/mL 体积/mL ;
(6)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,
ⅰ 0.1 1.5 0.1 1.5 10 20
ⅱ 0.1 2.5 0.1 1.5 9 a 当得到1.8g饮用水时,转移的电子数约为 。
ⅲ 0.1 b 0.1 1.5 9 30
(5)表中,a= ,b= 。实验表明,实验ⅲ的反应速率最快,支持
这一结论的实验现象为 。
19.(13分)正确认识和使用电池有利于我们每一个人的日常生活。
第 页 共 页
4 5( )负极( 分)
- +
2 2 2
长春外国语学校2024-2025学年第二学期高一年级期中考试 (1)左( 分1) 右H (O +分2)e+ 2 H (=2H)O ( )①②③ ( )
-
2
2 1 1 3 1mol 4 5 H -2e
化学答案
-
2
+(2O)H = 2H O 或
一、 单选题(每题3分,共45分) 23
A
6 0.2N ( 1.204×10 )
题号 1 2 3 4 5 6 7 8 9 10
答案 B C B D B B C D B B
题号 11 12 13 14 15
答案 C D D C B
二、 解答题(除特殊标记每空2分)
( 分)
16 16
(1) ① ③④ ⑤ ②
甲烷或
4 2 3
(2) CH 7 n CH =CHCH
(4)(3 分)
17 12
(1)
(2)BC
使用了催化剂
(3)
50%( 分)
18 14 浓
2 3 2 4 2 4 2 2
(1)Na SO作+安H全SO瓶(,防)=倒Na吸S O + S O吸↑收+多H余O的 或尾气处理
2
(2) SO ( )
- 2-
2
(3)3S+6OH=2S + +3H O
-1
(4)0.25mol·L( 分) ( 分) 实验 中出现浑浊所需时间最短
(5)( 分2)0 1 2.5 1 III
第 页 共 页
19 13
5 5