文档内容
第二章 化学反应速率与化学平衡
第一节 化学反应速率
一、化学反应速率
1、化学反应速率:定量描述________________程度的物理量。
2、表示方法:用单位时间内反应物浓度 ________________或生成物浓度的
________________来表示。
(1)表达式:V=Δc/Δt
(2)单位:mol/(L·min)或mol/(L·s)
3、化学反应速率的测定
(1)测定原理:利用与化学反应中任何一种化学物质的________________相关的可观测量
进行测定。
(2)测定方法
①直接观察测定:如________________和________________等。
②科学仪器测定:在溶液中,当反应物或生成物本身有较明显的颜色时,可利用
________________和________________变化间的比例关系测量反应速率。
4、化学反应速率的计算
(1)公式法:
v==
v(反应物)= v(生成物)=
(2)运用同一反应中“速率之比等于化学计量数之比”的规律进行计算。
对于一个化学反应:mA+nB===________________,v(A)=-,v(B)=-,v(C)=,v(D)
=,
且有:===。
(3)“三段式”法
①求解化学反应速率计算题的一般步骤:
写出有关反应的化学方程式;找出各物质的________________、某时刻量;转化量之比等
于化学计量数之比;
先根据已知条件列方程计算:
反应: mA(g)+nB(g) = pC(g)
起始浓度/mol·L-1: a b c
转化浓度/mol·L-1 : x
某时刻(t s)浓度/mol·L-1: ________________再利用化学反应速率的定义式求算:
v(A)= mol·L-1·s-1; v(B)= mol·L-1·s-1; v(C)= mol·L-1·s-1。
②计算中注意以下量的关系。
对反应物: ________________ =c(某时刻); 对生成物:________________=c(某时
刻);
学科网(北京)股份有限公司转化率=×100%。
二、影响化学反应速率的因素
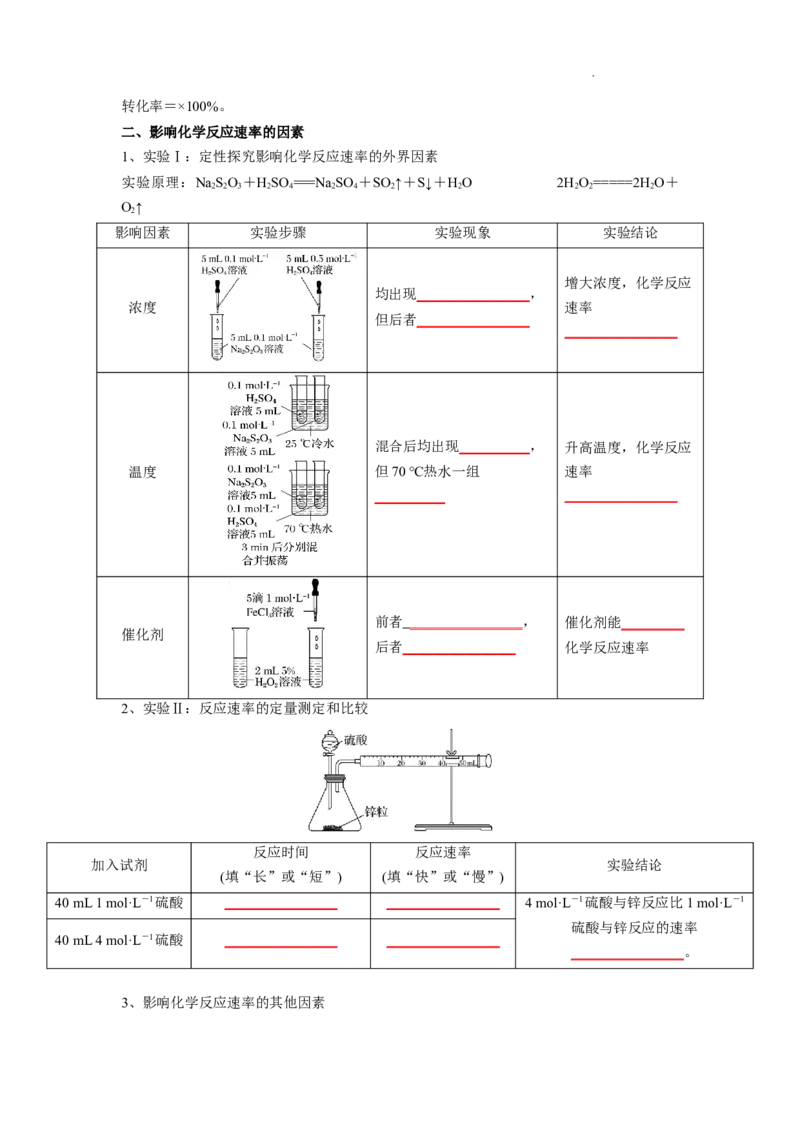
1、实验Ⅰ:定性探究影响化学反应速率的外界因素
实验原理:NaSO +HSO ===NaSO +SO ↑+S↓+HO 2H O=====2HO+
2 2 3 2 4 2 4 2 2 2 2 2
O↑
2
影响因素 实验步骤 实验现象 实验结论
增大浓度,化学反应
均出现________________,
浓度 速率
但后者________________
________________
混合后均出现__________, 升高温度,化学反应
温度 但70 ℃热水一组 速率
__________ ________________
前者 _______________ _, 催化剂能_________
催化剂
后者________________ 化学反应速率
2、实验Ⅱ:反应速率的定量测定和比较
反应时间 反应速率
加入试剂 实验结论
(填“长”或“短”) (填“快”或“慢”)
40 mL 1 mol·L-1硫酸 ________________ ________________ 4 mol·L-1硫酸与锌反应比1 mol·L-1
硫酸与锌反应的速率
40 mL 4 mol·L-1硫酸 ________________ ________________
________________。
3、影响化学反应速率的其他因素
学科网(北京)股份有限公司(1)浓度:底物浓度越大,化学反应速率________________。
(2)温度:当其他条件相同时,________________反应速率增大,________________反应
速率减小。
(3)催化剂:同一反应,用不同催化剂,反应速率不相同。
(4)压强:对有气体参加的反应,压强对化学反应速率的影响可简化理解如下
①对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成________________,
其他条件不变时,增大压强,气体体积________________,浓度________________。
②对于有气体参加的化学反应,在相同温度下,增大压强 ,反应速率________________;
减小压强 ,反应速率________________。
三、活化能
1、有效碰撞:能够________________的碰撞。
2、无效碰撞:不能够________________的碰撞。
3、活化分子:能够发生________________的分子。
4、活化能:活化分子具有的平均能量与反应物分子具有的________________。
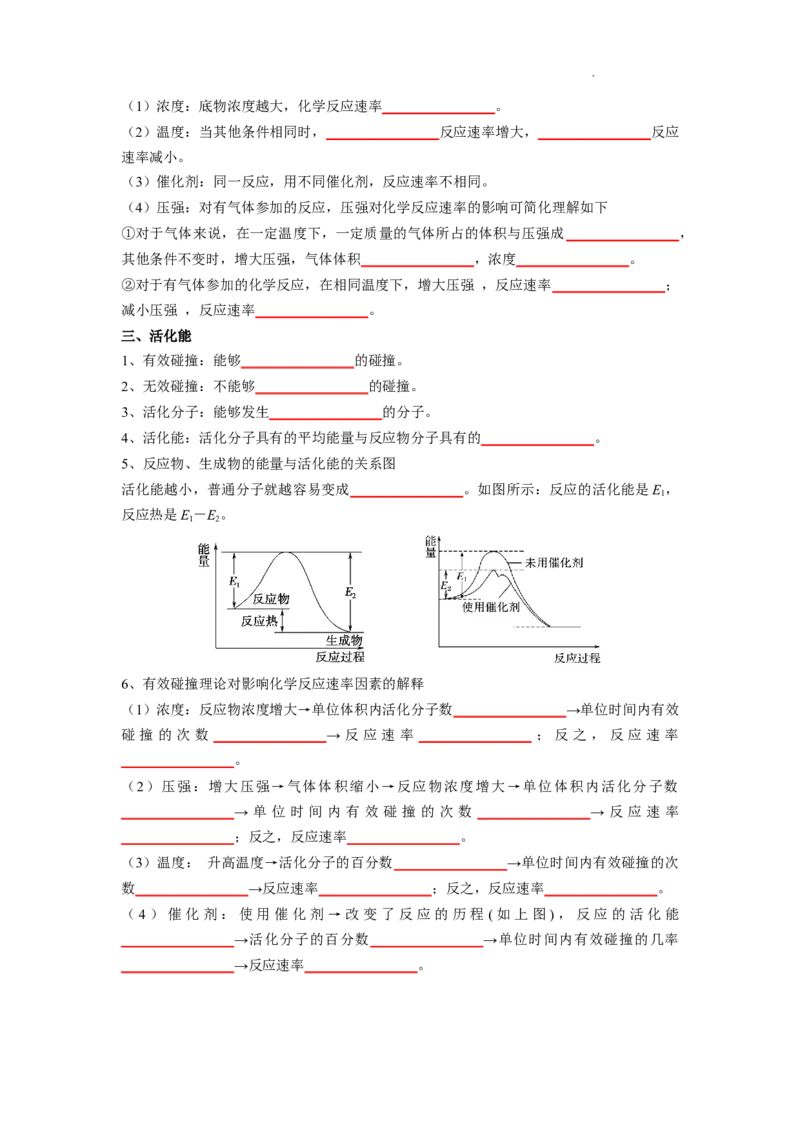
5、反应物、生成物的能量与活化能的关系图
活化能越小,普通分子就越容易变成________________。如图所示:反应的活化能是E ,
1
反应热是E-E。
1 2
6、有效碰撞理论对影响化学反应速率因素的解释
(1)浓度:反应物浓度增大→单位体积内活化分子数________________→单位时间内有效
碰 撞 的 次 数 ________________→ 反 应 速 率 ________________ ; 反 之 , 反 应 速 率
________________。
(2)压强:增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数
________________→ 单 位 时 间 内 有 效 碰 撞 的 次 数 ________________→ 反 应 速 率
________________;反之,反应速率________________。
(3)温度: 升高温度→活化分子的百分数________________→单位时间内有效碰撞的次
数________________→反应速率________________;反之,反应速率________________。
(4)催化剂:使用催化剂→改变了反应的历程 (如上图),反应的活化能
________________→活化分子的百分数________________→单位时间内有效碰撞的几率
________________→反应速率________________。
学科网(北京)股份有限公司第二节 化学平衡
一、化学平衡状态
1、可逆反应:在相同条件下,既能向________________方向进行,同时又能向
________________方向进行的反应。
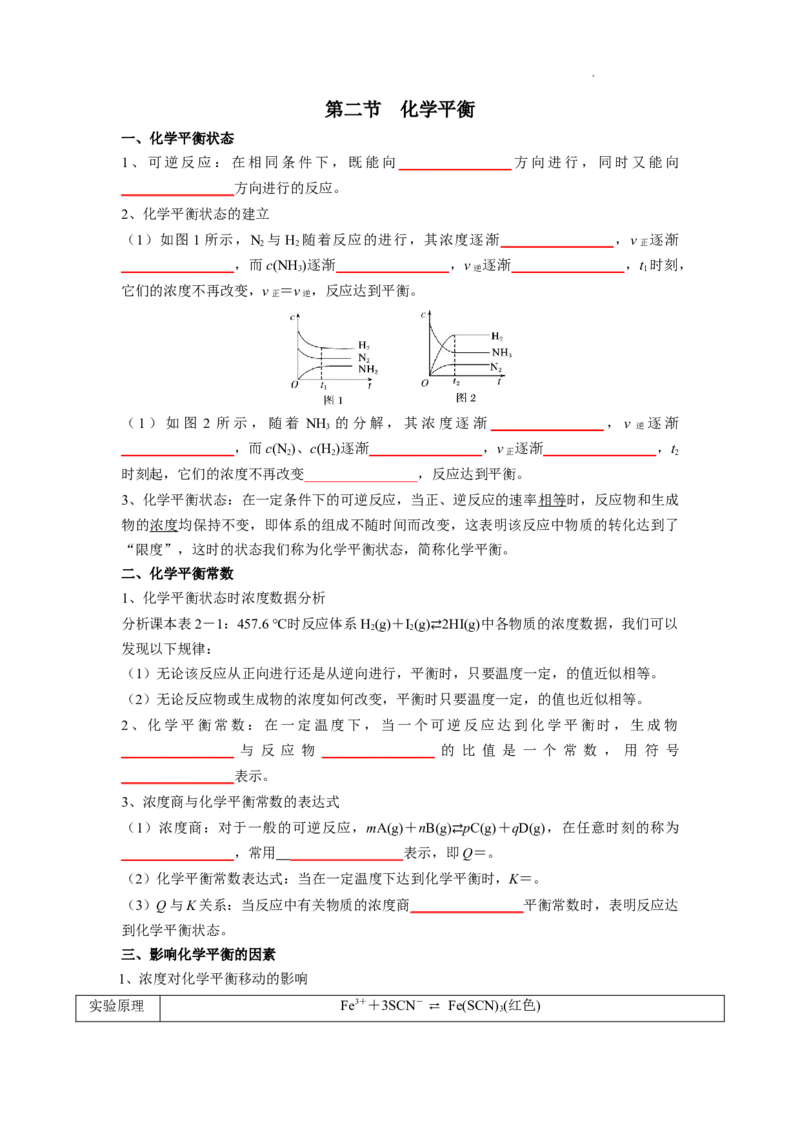
2、化学平衡状态的建立
(1)如图 1所示,N 与H 随着反应的进行,其浓度逐渐________________,v 逐渐
2 2 正
________________,而c(NH )逐渐________________,v 逐渐________________,t 时刻,
3 逆 1
它们的浓度不再改变,v =v ,反应达到平衡。
正 逆
(1)如图 2 所示,随着 NH 的分解,其浓度逐渐________________,v 逐渐
3 逆
________________,而c(N )、c(H )逐渐________________,v 逐渐________________,t
2 2 正 2
时刻起,它们的浓度不再改变________________,反应达到平衡。
3、化学平衡状态:在一定条件下的可逆反应,当正、逆反应的速率相等时,反应物和生成
物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了
“限度”,这时的状态我们称为化学平衡状态,简称化学平衡。
二、化学平衡常数
1、化学平衡状态时浓度数据分析
分析课本表2-1:457.6 ℃时反应体系H(g)+I(g) 2HI(g)中各物质的浓度数据,我们可以
2 2
发现以下规律:
⇄
(1)无论该反应从正向进行还是从逆向进行,平衡时,只要温度一定,的值近似相等。
(2)无论反应物或生成物的浓度如何改变,平衡时只要温度一定,的值也近似相等。
2、化学平衡常数:在一定温度下,当一个可逆反应达到化学平衡时,生成物
________________ 与 反 应 物 ________________ 的 比 值 是 一 个 常 数 , 用 符 号
________________表示。
3、浓度商与化学平衡常数的表达式
(1)浓度商:对于一般的可逆反应,mA(g)+nB(g) pC(g)+qD(g),在任意时刻的称为
________________,常用 _______________ _表示,即Q=。
⇄
(2)化学平衡常数表达式:当在一定温度下达到化学平衡时,K=。
(3)Q与K关系:当反应中有关物质的浓度商________________平衡常数时,表明反应达
到化学平衡状态。
三、影响化学平衡的因素
1、浓度对化学平衡移动的影响
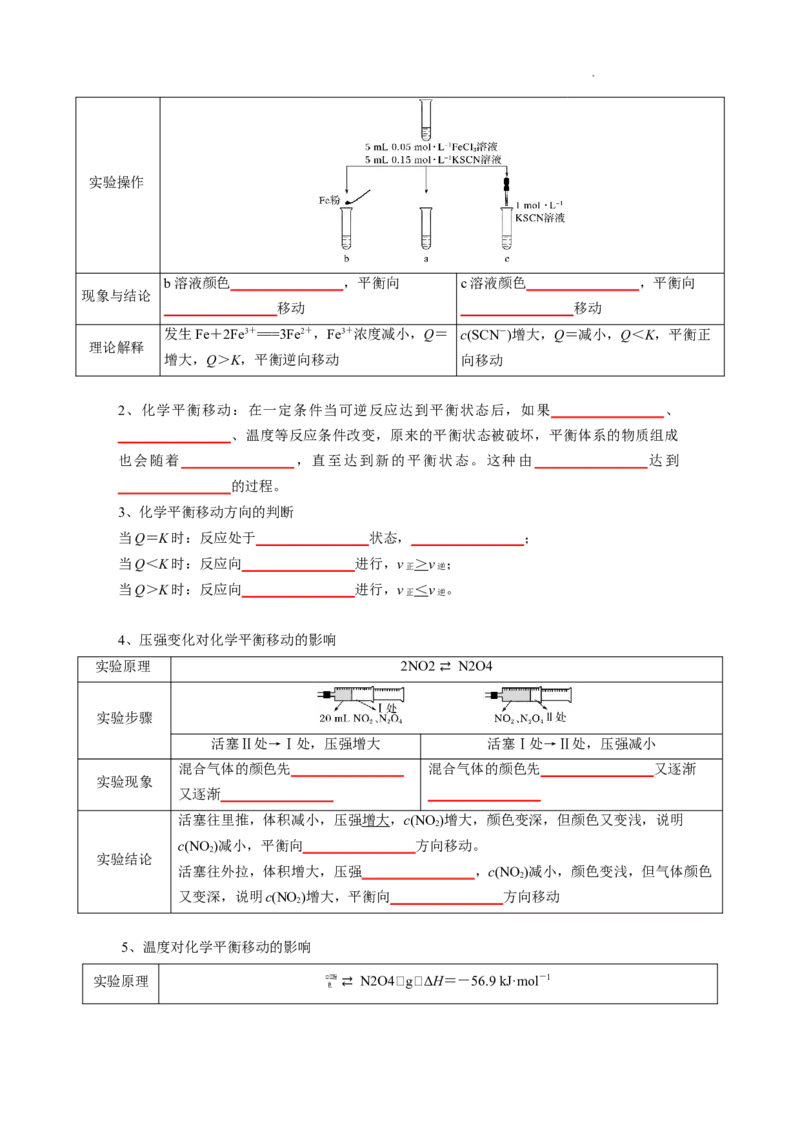
实验原理 Fe3++3SCN- ⇄ Fe(SCN) 3 (红色)
学科网(北京)股份有限公司实验操作
b溶液颜色________________,平衡向 c溶液颜色________________,平衡向
现象与结论
________________移动 ________________移动
发生Fe+2Fe3+===3Fe2+,Fe3+浓度减小,Q= c(SCN-)增大,Q=减小,Q<K,平衡正
理论解释
增大,Q>K,平衡逆向移动 向移动
2、化学平衡移动:在一定条件当可逆反应达到平衡状态后,如果________________、
________________、温度等反应条件改变,原来的平衡状态被破坏,平衡体系的物质组成
也会随着________________,直至达到新的平衡状态。这种由________________达到
________________的过程。
3、化学平衡移动方向的判断
当Q=K时:反应处于________________状态,________________;
当Q<K时:反应向________________进行,v >v ;
正 逆
当Q>K时:反应向________________进行,v <v 。
正 逆
4、压强变化对化学平衡移动的影响
实验原理 2NO2 N2O4
⇄
实验步骤
活塞Ⅱ处→Ⅰ处,压强增大 活塞Ⅰ处→Ⅱ处,压强减小
混合气体的颜色先________________ 混合气体的颜色先________________又逐渐
实验现象
又逐渐________________ ________________
活塞往里推,体积减小,压强增大,c(NO )增大,颜色变深,但颜色又变浅,说明
2
c(NO )减小,平衡向________________方向移动。
2
实验结论
活塞往外拉,体积增大,压强________________,c(NO )减小,颜色变浅,但气体颜色
2
又变深,说明c(NO )增大,平衡向________________方向移动
2
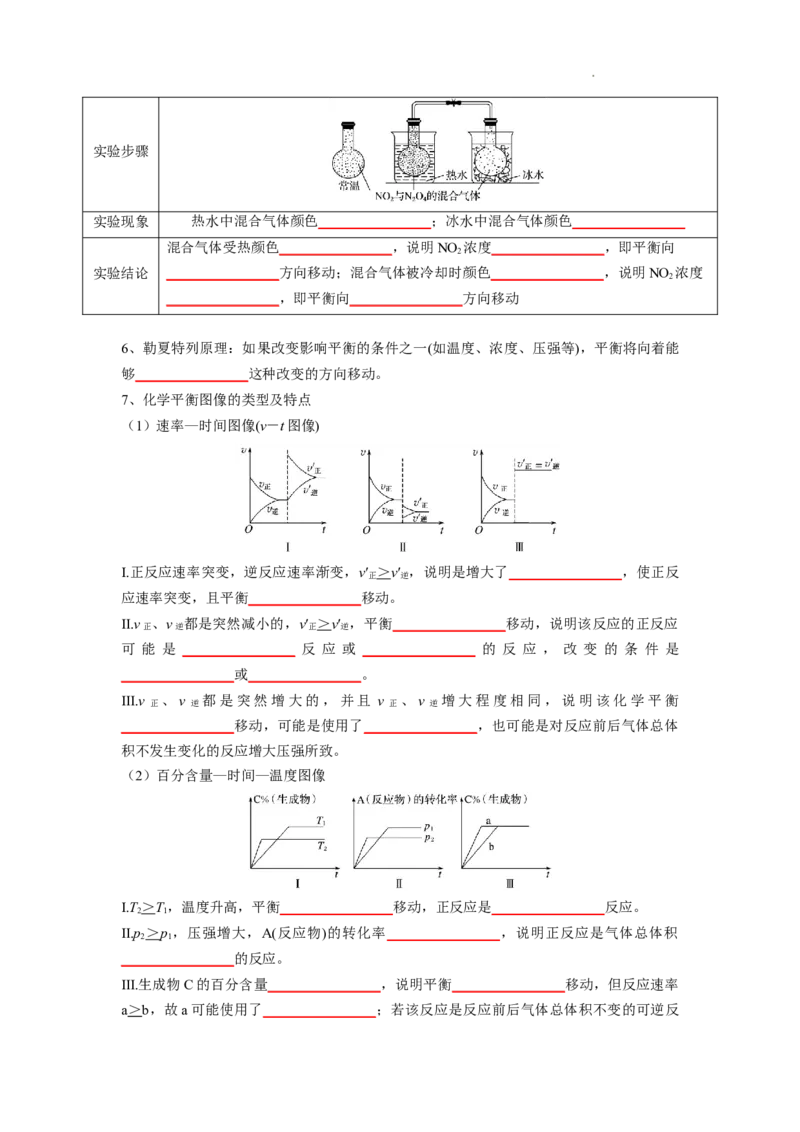
5、温度对化学平衡移动的影响
实验原理 红棕 N2O4gΔH=-56.9 kJ·mol-1
色
⇄
学科网(北京)股份有限公司实验步骤
实验现象 热水中混合气体颜色________________;冰水中混合气体颜色________________
混合气体受热颜色________________,说明NO 浓度________________,即平衡向
2
实验结论 ________________方向移动;混合气体被冷却时颜色________________,说明NO 浓度
2
________________,即平衡向________________方向移动
6、勒夏特列原理:如果改变影响平衡的条件之一(如温度、浓度、压强等),平衡将向着能
够________________这种改变的方向移动。
7、化学平衡图像的类型及特点
(1)速率—时间图像(v-t图像)
Ⅰ.正反应速率突变,逆反应速率渐变,v′ >v′ ,说明是增大了________________,使正反
正 逆
应速率突变,且平衡________________移动。
Ⅱ.v 、v 都是突然减小的,v′ >v′ ,平衡________________移动,说明该反应的正反应
正 逆 正 逆
可 能 是 ________________ 反 应 或 ________________ 的 反 应 , 改 变 的 条 件 是
________________或________________。
Ⅲ.v 、v 都是突然增大的,并且 v 、v 增大程度相同,说明该化学平衡
正 逆 正 逆
________________移动,可能是使用了________________,也可能是对反应前后气体总体
积不发生变化的反应增大压强所致。
(2)百分含量—时间—温度图像
Ⅰ.T>T,温度升高,平衡________________移动,正反应是________________反应。
2 1
Ⅱ.p >p ,压强增大,A(反应物)的转化率________________,说明正反应是气体总体积
2 1
________________的反应。
Ⅲ.生成物C的百分含量________________,说明平衡________________移动,但反应速率
a>b,故a可能使用了________________;若该反应是反应前后气体总体积不变的可逆反
学科网(北京)股份有限公司应,a也可能是增大了压强。
第三节 化学反应的方向
1、自发过程和自发反应的比较
自发过程 自发反应
在一定条件下,________________,就能自 在给定的条件下,可以________________进
含义
发进行的过程。 行到显著程度的化学反应。
具有________________,即过程的某个方向在一定条件下自发进行,而该过程逆方向在该条
特征
件下肯定________________
举例 高山流水,自由落体,冰雪融化 钢铁生锈
可被用来完成有用功。如H 燃烧可设计成________________。
2
应用
非自发过程要想发生,必须对它做功。如通电将水分解为________________ 。
2、化学反应进行方向的判据
(1)焓变与反应的方向
放热反应过程中体系能量________________,因此具有________________进行的倾向,科
学家提出用________________来判断反应进行的方向,这就是________________。
①多数放热反应是自发进行的。例如燃烧反应、中和反应等。②有些吸热反应也可以自发
进行,如:
2NO(g) 4NO (g)+O(g) ΔH=+109.8 kJ·mol-1。
2 5 2 2
(2)熵变与反应的方向
⇄
①体系的熵值:体系的________________越大,体系的熵值就________________。
②同一物质的熵值:S(g)>S(l)>S(s),同一条件下,不同物质的________________不同。
(3)熵判据:体系有自发地向混乱度________________(即熵增)的方向转变的倾向,因此
可用________________来判断反应进行的方向。
3、自由能与化学反应的方向
(1)自由能:符号为________________,单位为kJ·mol-1。
(2)自由能变化与焓变、熵变的关系:ΔG= Δ H - T Δ S 。ΔG不仅与________________有关,
还与________________。
(3)反应方向与自由能的关系
①当ΔG<0时,反应________________;
②当ΔG=0时,反应________________;
③当ΔG>0时,反应________________。
第四节 化学反应的调控
1、合成氨反应的特点
合成氨反应:N(g)+3H(g) 2NH (g)。已知298 K时:ΔH=-92.4 kJ·mol-1,ΔS=-
2 2 3
⇄
学科网(北京)股份有限公司198.2 J·mol-1·K-1。
(1)自发性:常温(298 K)下, _______________ _,能自发进行。
(2)可逆性:反应为________________反应。
(3)体积变化(熵变):ΔS<0,正反应是气体体积 ________________ 的反应。
(4)焓变:ΔH<0,是________________反应。
2、工业合成氨的适宜条件
外部条件 工业合成氨的适宜条件
压强 ________________MPa
温度 ________________℃
催化剂 使用________________作催化剂
浓度 氨及时从混合气中分离出去,剩余气体________________;及时________________
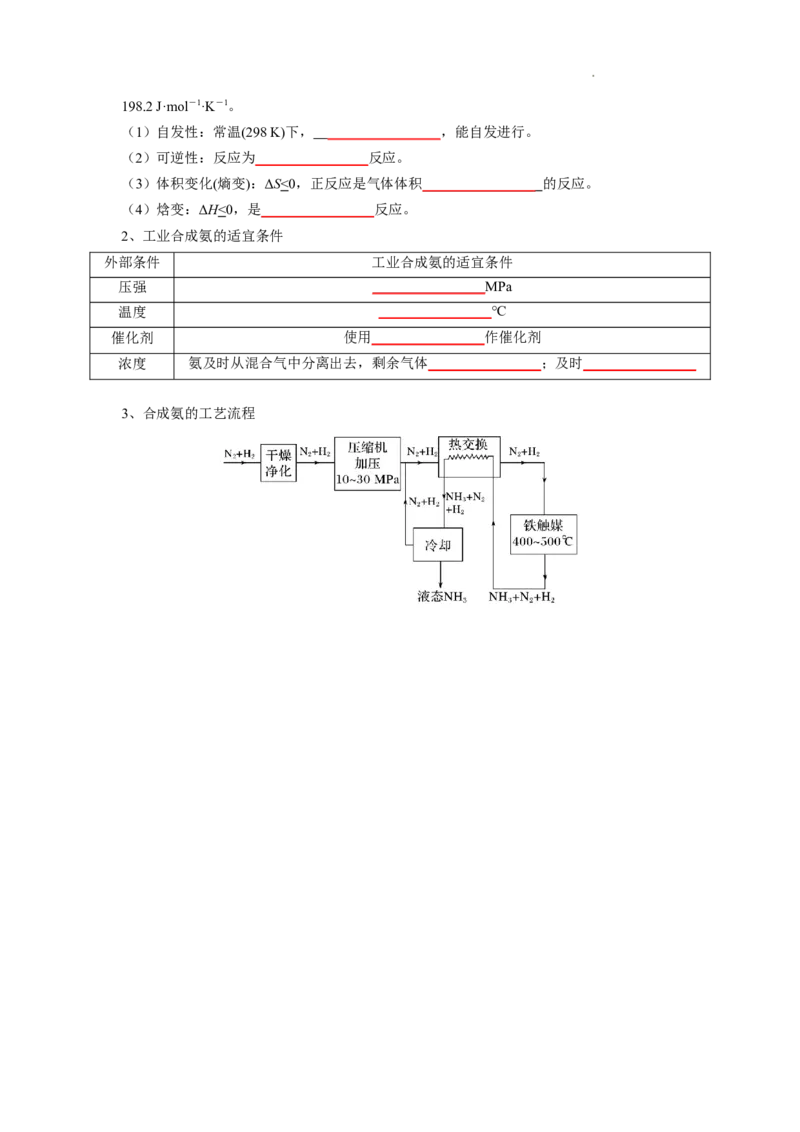
3、合成氨的工艺流程
学科网(北京)股份有限公司