文档内容
高中化学人教版(2019)选择性必修1 第二章测试卷
一、单选题
1.某一可逆反应A+3B 2C,改变下列条件一定能加快反应速率的是( )
A. 增大反应物的量 B. 升高温度
C. 增大压强 D. 使
用催化剂
2.在10L密闭容器中,1molA和3molB在一定条件下反应:A(g)+xB(g) 2C(g),2min后反应达到平衡
时,测得混合气体共3.4mol,生成0.4molC,则下列计算结果错误的是( )
A. 平衡时,物质的量比A:B:C=2:11:4 B. x值等于4
C. A的转化率20% D. B的平均反应速率为0.04mol·L-1·min-1
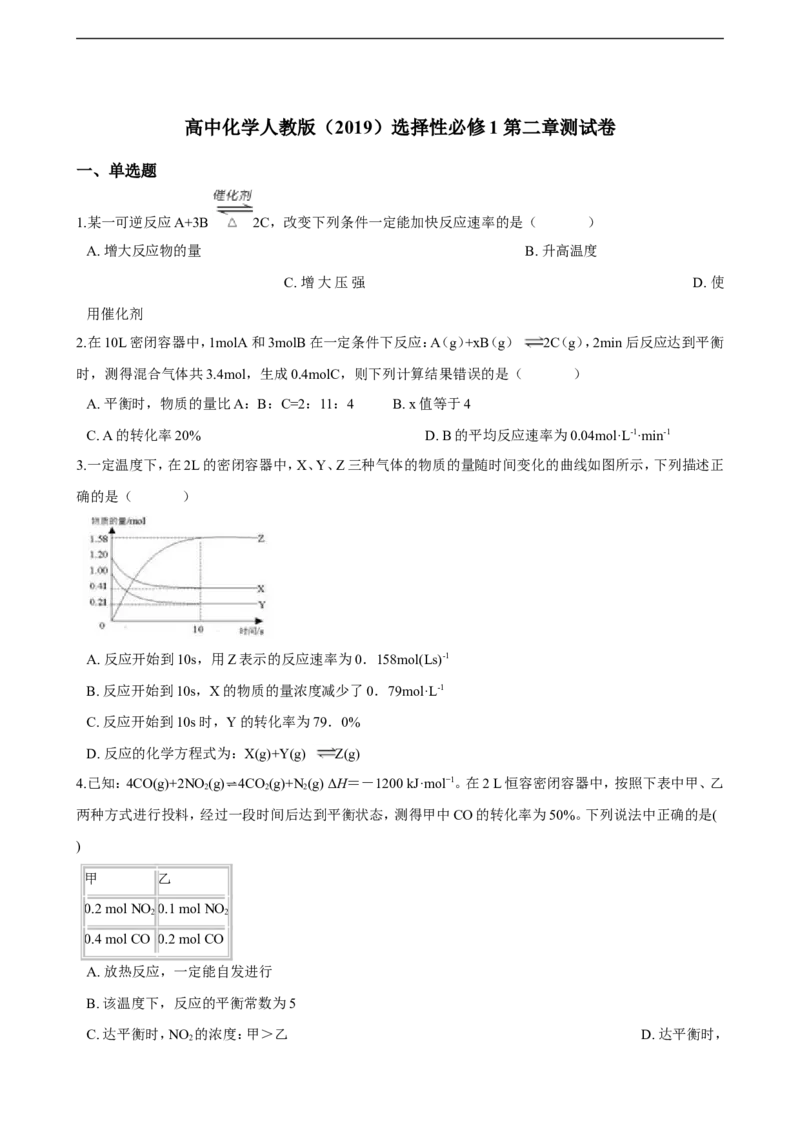
3.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正
确的是( )
21cnjy.com
A. 反应开始到10s,用Z表示的反应速率为0.158mol(Ls)-1
B. 反应开始到10s,X的物质的量浓度减少了0.79mol·L-1
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g) Z(g)
【来源:21·世纪·教育·网】
4.已知:4CO(g)+2NO
2
(g)⇌4CO
2
(g)+N
2
(g) ΔH=-1200 kJ·mol−1。在2 L恒容密闭容器中,按照下表中甲、乙
两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%。下列说法中正确的是(
)
21·世纪*教育网
甲 乙
0.2 mol NO 0.1 mol NO
2 2
0.4 mol CO 0.2 mol CO
A. 放热反应,一定能自发进行
B. 该温度下,反应的平衡常数为5
C. 达平衡时,NO 的浓度:甲>乙 D. 达平衡时,
2N 的体积分数:甲<乙
2
5.在一定温度下,可逆反应:A(g)+B (g) 2AB(g),达到平衡的标志是( )
2 2
A. 容器的总压强不随时间而变化
B. 单位时间内生成nmolA 同时就有2nmolAB生成
2
C. 单位时间内有nmolB 发生反应的同时有nmolAB分解
2
D. 单位时间内有nmolA 生成的同时有nmolB 生成
2 2 【出处:21教育名师】
6.恒温条件下,物质的量之比为 2∶1 的 SO 和 O 的混合气体在容积为 2 L 的恒容密闭容器中发生反应:
2 2
2SO (g)+O(g) 2SO (g),该反应为放热反应,n(SO )随时间变化关系如下表:
2 2 3 2
时间/min 0 1 2 3 4 5
n(SO )/mol0.200.160.130.110.080.08
2
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到平衡时,用 SO 表示的平均反应速率为 0.01 mol/(L·min)
3
D. 容器内达到平衡状态时的压强与起始时的压强之比为 5∶4
【版权所有:21教育】
7.如图为某化学反应的速率与时间的关系示意图。在t 时刻升高温度或增大压强,速率的变化都符合示意图
1
的反应是( )
21教育名师原创作品
A. 2SO (g)+O(g) 2SO (g) △H<0 B. 4NH (g)+5O(g) 4NO(g)+6H O(g) △H<0
2 2 3 3 2 2
C. H(g)+l(g) 2HI(g) △H>O D. 2A(g)+B(g) 2C(g) △H>O
2 2
8.将V mL 0.1 mol·L-1的Fe (SO ) 溶液与2 mL 0.1 mol·L-1KI溶液混合,待充分反应后,下列方法可证明该
1 2 4 3
反应具有一定限度的是 ( )
A. 若 V < 1 加 入 淀
1
粉
B. 若V≤1 加入KSCN溶液
1
C. 若 V≥1 加 入 AgNO 溶
1 3
液 D. 加入Ba(NO ) 溶液
3 2
9.下列事实中,不能用勒夏特列原理解释的是( )①Fe(SCN) 溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③
3
实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO 加压后颜色先变深后变浅 ⑤加入催化剂有利于
2
合成氨的反应 ⑥由H(g)、I(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨
2 2
的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧ B. ①③⑤⑦ C. ②⑤⑥⑦ D. ②③⑦⑧
10.某反应2AB(g) C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS
应为( )
A. ΔH <0,ΔS>0 B. ΔH <0,ΔS<0 C. ΔH >0,ΔS>0 D. ΔH >0,ΔS<0
11.下列内容与结论相对应的是( )
内 容 结 论
AHO(g)变成HO(l) △S>0
2 2
B硝酸铵溶于水可自发进行 因为△S<0
C一个反应的△H>0,△S>0 反应一定不自发进行
H(g)+F (g)=2HF(g)△H=-271kJ•mol-1
2 2
D 反应在任意外界条件下均可自发进行
△S=8J•mol-1•K-1
A. A B. B C. C D. D
12.下列说法正确的是()
A. 在其他外界条件不变的情况下,增大压强能增大活化分子的百分数
B. 室温下不能自发进行,说明该反应的△H <0
C. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
D. 常温下,K [Al(OH) ]=1×10-33。欲使溶液中c(Al3+)≤ 1×10-6 mol/L,需调节溶液的pH≥5
SP 3
13.工业上用H 和N 合成氨的反应是放热反应,在氨的实际合成生产时温度常控制在700K左右,原因是(
2 2
)
2-1-c-n-j-y
A. 高温有利于提高反应的转化率 B.
高温可加快反应的限度
C. 700K时反应催化剂活性最强
D. 高温可加才可以自发向右进行
二、综合题
14.把0.6 mol W气体和0.5 mol X气体混合于2 L密闭容器中,使它们发生如下反应:4W(g)+3X(g)
2Y(g)+nZ(g)。2 min末已生成0.2 mol Y,若测知以Z的浓度变化表示的反应速率为0.002 5 mol·L-1·s-1 ,
试计算:(1)前2 min内用W的浓度变化表示的平均反应速率为________。
(2)2 min末时X的浓度为________。
(3)化学反应方程式中n=________。
(4)2 min末,恢复到反应前温度,体系内压强是反应前压强的________倍。(用分数表示)
15.碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
(1)Ⅰ.在25℃、101kPa时,1.00g C H(l)燃烧生成CO 和HO(l)时,放出41.8kJ的热量,表示C H(l)燃烧热
6 6 2 2 6 6
的热化学方程式为________。
(2)Ⅱ.乙二醇(HOCHCHOH)气相氧化法
2 2
已知:2H(g)+O(g) 2HO(g) ΔH=-484kJ/mol
2 2 2
OHC-CHO(g)+2H (g) HOCH CHOH(g) ΔH=-78kJ/mol
2 2 2
则乙二醇气相氧化反应HOCH CHOH(g)+O (g) OHC-CHO(g)+2H O(g)的ΔH=________;相同温度下,
2 2 2 2
该反应的化学平衡常数K=________(用含K、K 的代数式表示)。
1 2
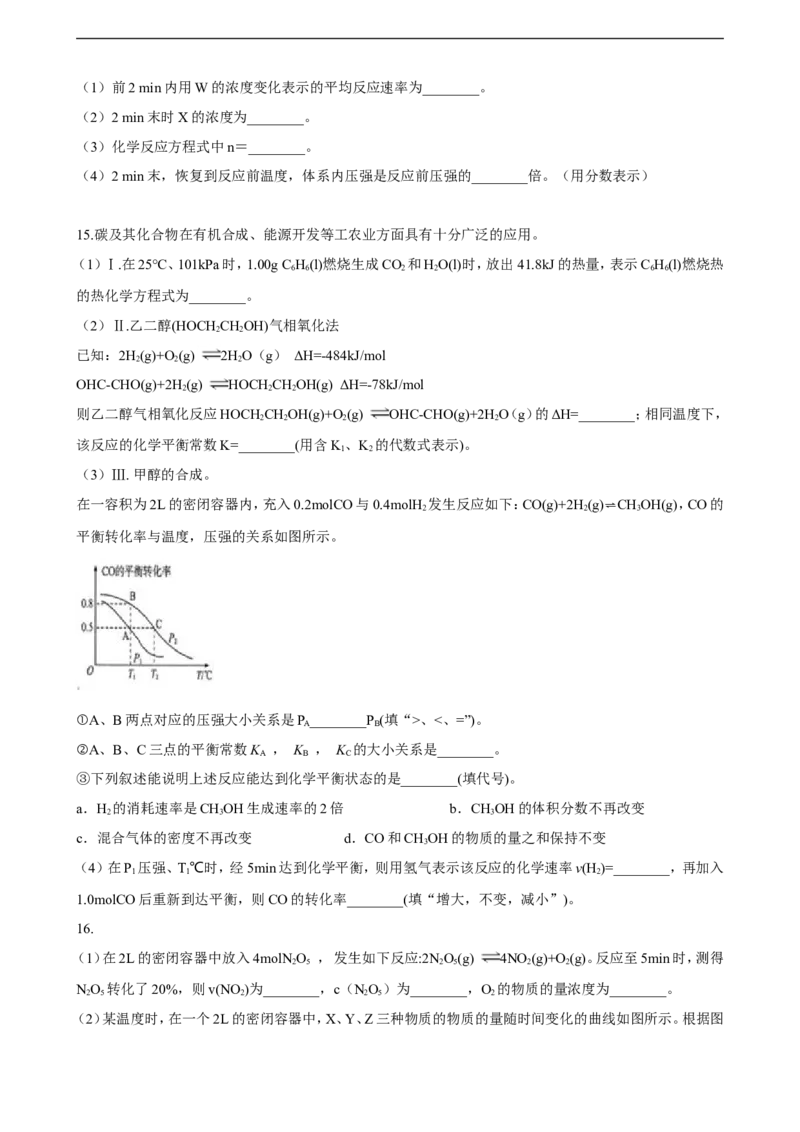
(3)Ⅲ. 甲醇的合成。
在一容积为2L的密闭容器内,充入0.2molCO与0.4molH
2
发生反应如下:CO(g)+2H
2
(g)⇌CH
3
OH(g),CO的
平衡转化率与温度,压强的关系如图所示。
①A、B两点对应的压强大小关系是P ________P (填“>、<、=”)。
A B
②A、B、C三点的平衡常数K , K , K 的大小关系是________。
A B C
③下列叙述能说明上述反应能达到化学平衡状态的是________(填代号)。
a.H 的消耗速率是CHOH生成速率的2倍 b.CHOH的体积分数不再改变
2 3 3
c.混合气体的密度不再改变 d.CO和CHOH的物质的量之和保持不变
3
(4)在P 压强、T℃时,经5min达到化学平衡,则用氢气表示该反应的化学速率v(H )=________,再加入
1 1 2
1.0molCO后重新到达平衡,则CO的转化率________(填“增大,不变,减小”)。
16.
(1)在2L的密闭容器中放入4molN O , 发生如下反应:2N O(g) 4NO (g)+O(g)。反应至5min时,测得
2 5 2 5 2 2
NO 转化了20%,则v(NO )为________,c(NO)为________,O 的物质的量浓度为________。
2 5 2 2 5 2
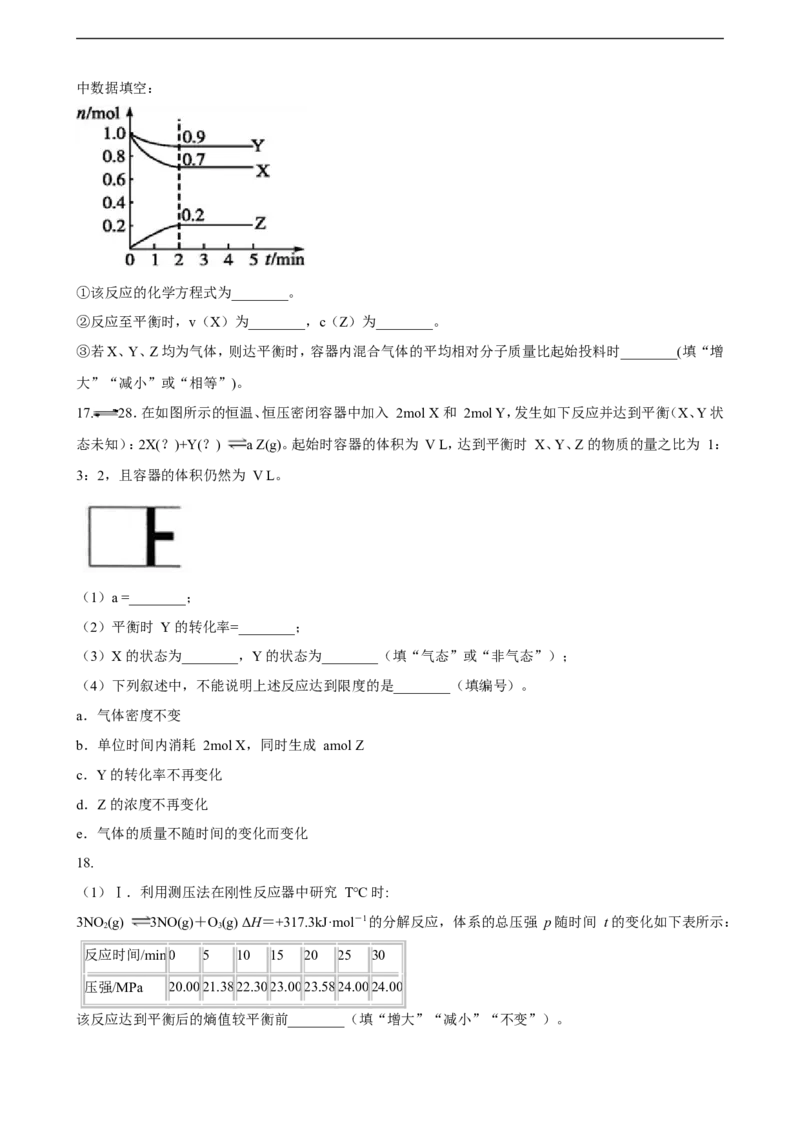
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
①该反应的化学方程式为________。
②反应至平衡时,v(X)为________,c(Z)为________。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时________(填“增
大”“减小”或“相等”)。
21教育网
17. 28.在如图所示的恒温、恒压密闭容器中加入 2mol X 和 2mol Y,发生如下反应并达到平衡(X、Y 状
态未知):2X(?)+Y(?) a Z(g)。起始时容器的体积为 V L,达到平衡时 X、Y、Z 的物质的量之比为 1:
3:2,且容器的体积仍然为 V L。
(1)a =________;
(2)平衡时 Y 的转化率=________;
(3)X 的状态为________,Y 的状态为________(填“气态”或“非气态”);
(4)下列叙述中,不能说明上述反应达到限度的是________(填编号)。
a.气体密度不变
b.单位时间内消耗 2mol X,同时生成 amol Z
c.Y 的转化率不再变化
d.Z 的浓度不再变化
e.气体的质量不随时间的变化而变化
18.
(1)Ⅰ.利用测压法在刚性反应器中研究 T℃ 时:
3NO (g) 3NO(g)+O(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
2 3
反应时间/min0 5 10 15 20 25 30
压强/MPa 20.0021.3822.3023.0023.5824.0024.00
该反应达到平衡后的熵值较平衡前________(填“增大”“减小”“不变”)。(2)若降低反应温度,则平衡后体系压强 p________24.00 MPa(填“大于”“等于”“小于”),原因是
________。15min 时,反应物的转化率 α=________%
www.21-cn-jy.com
(3)Ⅱ.一定条件下,在体积为 2 L 的密闭容器中发生反应:2NO (g) 2NO(g)+O (g) ΔH>0。投入 2 mol
2 2
NO 发生反应。实验测得:v =k c2(NO ),v =k c2(NO)·c(O),k 、k 为速率常数,受温度影响。在温度为
2 正 正 2 逆 逆 2 正 逆
T℃ 时 NO 的转化率随时间变化的结果如图所示。
2 21*cnjy*com
①要提高 NO 转化率,可采取的措施是________ 、________。
2
②前2min内,以NO 表示该反应的化学反应速率为________。
2
③计算 A 点处v / v =________(保留一位小数)。
正 逆
19.目前工业合成氨的原理是:
N
2
(g)+3H
2
(g) ⇌2NH
3
(g)△H=﹣93.0kJ/mol 回答下列问题:
(1)在恒温恒容密闭容器中进行的工业合成氨反应,下列能表示达到平衡状态的是 .
A.混合气体的压强不再发生变化
B.混合气体的平均相对分子质量不再发生变化
C.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
D.单位时间内断开3a个H﹣H键的同时形成6a个N﹣H键
E.反应容器中N、NH 的物质的量的比值不再发生变化
2 3 【来源:21cnj*y.co*m】
(2)理论上,为了增大平衡时H 的转化率,可采取的措施是 .
2
A.增大压强
B.使用合适的催化剂
C.升高温度
D.及时分离出产物中的NH
3
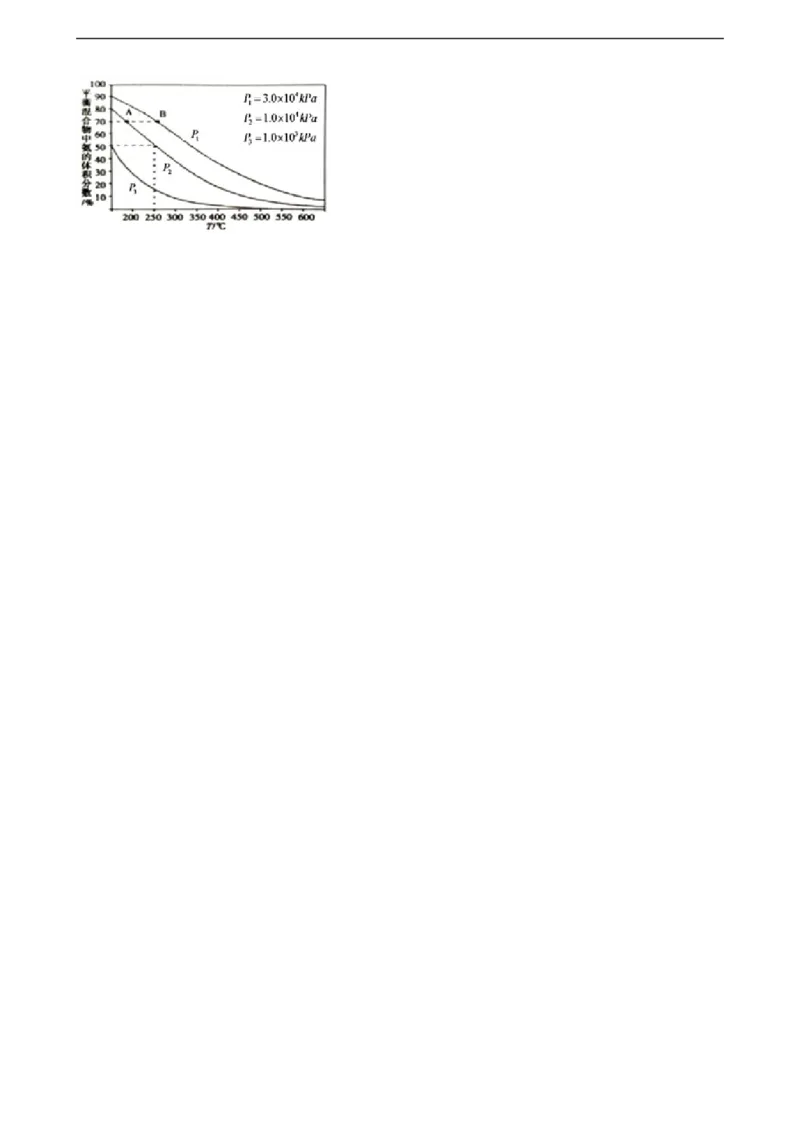
(3)如图为合成氨反应,在使用相同的催化剂,不同温度和压强条件下进行反应,初始时N 和H 的体积比
2 2
为1:3时的平衡混合物中氨的体积分数.
21*cnjy*com
分别用v (NH )和v (NH )表示从反应开始到平衡状态A、B时的反应速率,则v (NH )________ v
A 3 B 3 A 3 B
(NH )(填“>”、“<”或“=”);该反应的平衡常数K ________K(填“>”、“<”或“=”);在
3 A B
250℃、1.0×104kPa下达到平衡,H 的转化率为________ %(计算结果保留小数点后一位).
2答案解析部分
一、单选题
1. B
解析:A. 固体和纯液体增大反应物的量,浓度不变,速率不变,A不符合题意;
B. 升高温度,活化分子百分数增加,反应速率加快,B符合题意;
C. 增大压强,对固体和液体速率不影响,C不符合题意;
D. 使用催化剂,可能加快或减慢反应速率,D不符合题意。
故答案为:B
分析:A. 固体和纯液体参加反应时,一般认为其浓度不发生变化;
B. 升高温度,正逆反应速率同时增大;
C. 压强改变, 不会改变固体和液体的反应速率;
D. 催化剂在未特别说明的条件下,一般是指加快反应的催化剂。
2. A
解析:
混合气体共3.4mol=0.8mol+(3-0.2x)mol+0.4mol,解得x=4。
A.根据方程式知,生成0.4molC需要0.2molA、0.8molB,平衡时,A、B、C的物质的量分别为(1-0.2)
mol=0.8mol、(3-0.8)mol=2.2mol、0.4mol,A、B、C的物质的量之比=0.8mol:2.2mol:0.4mol=2:11:1,故A符
合题意;
B.根据计算可知x=4,故B不符合题意;
C.A的转化率= ×100%=20%,故C不符合题意;
D.平衡时B的平均反应速率= =0.04moL·L-1·min-1 , 故D不符合题意。
故答案为:A
分析:A.根据三段式数据计算各物质的物质的量;
B.x=4;C.转化率= ×100%;
D.根据公式 计算。
3. C
解析:A.Z物质的物质的量变化为1.58mol,V= = =0.079mol/(L.s),A不符合题意;
B.10s时,X的物质的量浓度减少了(1.20-0.41) 2=0.0395mol/L,B不符合题意;
C.10s时,Y的物质的量减少了1.00-0.21=0.79mol,转化率α= ,C符合题意;
D.X、Y、Z物质的量变化分别为:0.79mol、0.79mol、1.58mol,故反应的化学方程式为:X(g)+Y(g) 2 Z(g)
。。
故答案为:C
分析:A.代入V= 计算;
B.注意容器体积为2L;
C.转化率=该物质转化的物质的量/该物质反应总的物质的量x100%;
D.根据反应速率和化学计量数成正比计算可得。
4. C
解析:A.已知反应为放热反应,ΔH<0,ΔS<0,根据反应自发进行的判断依据ΔG=ΔH-TΔS,当低温时有自
发进行的倾向,高温时不利于自发进行,A不符合题意;
B.根据甲中CO的转化率为50% ,二氧化氮和一氧化碳的起始物质的量为0.2mol、0.4mol,容器的体积为
2L,根据 , 可以得到二氧化氮和一氧化碳的起始物质的量浓度为0.1mol/L、0.2mol/L,列出三段式,
该反应的平衡常数 , B不符合题意;C.由三段式可知甲的NO 转化为50%,因甲的平衡相对乙加压,增大压强平衡向正反应方向移动,则乙的
2
NO 转化为小于50%,则NO 的浓度:甲>乙,C符合题意;
2 2
D.甲的投入量为乙的两倍,甲的平衡相对乙加压,增大压强平衡向正反应方向移动,所以甲N2的体积分
数大于乙N 的体积分数,D不符合题意。
2
故答案为:C
分析:A.根据反ΔG=ΔH-TΔS进行判断;
B.根据三段式进行计算;
C.注意三段式的应用;
D.根据勒夏特列原理判断:如果改变影响平衡的一个条件(如浓度,压强或温度等),平衡就向能够减弱这种
改变的方向移动。
5. B
解析:A.该反应前后气体总物质的量不变,则无论该反应是否达到平衡状态,压强始终不变,所以不能根据
压强判断平衡状态,故A不符合题意;
21·cn·jy·com
B.单位时间内生成n mol A 的同时生成2n molAB,则同时消耗n mol A , A 的正逆反应速率相等,则该
2 2 2
反应达到平衡状态,故B符合题意;
C.单位时间内有nmolB 发生反应,同时有nmolAB分解即有0.5nmolB 生成,B 的正逆反应速率不相等,故
2 2 2
C不符合题意;
D. 单位时间内有nmolA 生成,同时有nmolB 生成,均表示逆速率,无法判断正逆速率是否相同,故D不符
2 2
合题意;
故答案为:B。
分析:可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不
变、百分含量不变以及由此引起的一系列物理量不变。
6. B
解析:A.因为容器容积不变,气体的总质量不变,所以气体的密度始终不变,因此密度不能作为判断平衡状
态的依据,A不符合题意;
B.根据表中数据,反应进行到第3分钟时没有达到平衡状态,反应向正反应方向进行,则正反应速率大于
逆反应速率,B符合题意;
C.根据表格数据,第4min时反应达到平衡,消耗二氧化硫为0.20mol-0.08mol=0.12mol,则生成的SO 为
3
0.12mol,其浓度是0.06mol/L,则用SO 表示的平均反应速率=0.06mol/L÷4min=0.015 mol/(L•min),C不符
3
合题意;
D.开始SO2和O2的物质的量分别为0.2mol、0.1mol,根据表格数据,平衡时SO 、O、SO 的物质的量分别
2 2 3
为0.08mol、0.04mol、0.12mol,根据压强之比等于物质的量之比,平衡时的压强与起始时的压强之比为:(0.08+0.04+0.12)/(0.2+0.1)=4:5,D不符合题意。
故答案为:B
分析:A.该装置条件下,混合气体密度为定值;
B.第三分钟时反应未达到平衡状态,向正反应方向进行;
C.根据v= 计算;
D.根据压强之比等于物质的量之比计算。
7. B
解析:A.该反应的ΔH<0,为放热反应,逆反应方向,气体分子数增大,A不符合题意;
B.该反应的ΔH<0,为放热反应,逆反应方向,气体分子数减小,B符合题意;
C.该反应的ΔH>0,为吸热反应,反应前后气体分子数不变,C不符合题意;
D.该反应的ΔH>0,为吸热反应,D不符合题意;
故答案为:B
分析:由反应速率图可知,当升高温度或增大压强时,平衡均逆向移动,因此说明该反应为放热反应,且逆
反应方向,气体分子数减小;据此结合选项所给反应进行分析。
8. B
解析:A.加入淀粉,通过溶液变蓝,可证明反应生成I , 无法证明是否存在Fe3+或I- , A不符合题意;
2
B.若V≤1,则溶液中I-过量,加入KSCN后,溶液变成血红色,说明溶液中含有Fe3+ , 可证明该反应具有一
1
定限度,B符合题意;
C.溶液中的SO 2-能与Ag+反应生成Ag SO 沉淀,干扰I-的检验,故无法证明该反应是否存在一定限度,C不
4 2 4
符合题意;
D.加入Ba(NO ) 溶液,无法检验溶液中是否存在Fe3+或I- , 故无法证明该反应是否存在一定限度,D不符
3 2
合题意;
故答案为:B
分析:Fe (SO ) 与KI反应的离子方程式为2Fe3++2I-=2Fe2++I;要证明该反应具有一定限度,则可在Fe3
2 4 3 2
+过量的情况下,检验是否存在I-;或在I-过量的情况下,检验是否存在Fe3+;据此结合选项进行分析。
9. C
解析:①Fe(SCN) 溶液中加入固体KSCN后,SCN-离子浓度增大,平衡 正向进
3
行,Fe(SCN) 浓度增大,颜色变深,能用勒夏特列原理解释;
3
②向稀盐酸中加入少量蒸馏水,盐酸为强酸,不存在电离平衡,稀释盐酸溶液,溶液中氢离子浓度降低,不
能用勒夏特列原理解释;③实验室常用排饱和食盐水的方法收集氯气,Cl
2
+H
2
O⇌HCl+HClO,平衡逆向进行,减小氯气溶解度,能用
勒夏特列原理解释;
④2NO 2⇌N
2
O
4
, 加压瞬间NO
2
浓度增大,颜色加深,随之平衡正向进行,NO
2
浓度有所减小,颜色又变浅,
但是NO 的浓度相比原来的浓度较大,因此颜色比原来深,所以压强增大平衡正向进行,颜色先变深后变浅,
2
能用勒夏特列原理解释;
⑤催化剂只能同等程度地改变正逆反应速率,对化学平衡无影响,不能用勒夏特列原理解释;
⑥由H、I(g)、HI气体组成的平衡,反应前后气体体积不变,加压后平衡不移动,体积减小颜色变深,不能用
2 2
勒夏特列原理解释;
⑦合成氨反应为放热反应,升高温度不利用平衡向正反应方向移动,但升温却可提高反应速率,不可用勒夏
特列原理解释;
⑧合成氨的反应中,将混合气体中的氨气液化,减小了生成物浓度,平衡向着正向移动,能用勒夏特列原理
解释;
综上所述,②⑤⑥⑦不能用勒夏特列原理解释;
故答案为:C。
分析:勒夏特列原理指的是在可逆反应中,改变某一因素反应会向减弱这种因素的方向进行。
10. C
解析:A、ΔH<0,ΔS>0,正向任何温度下都自发进行,A不符合题意;
B、ΔH<0,ΔS<0,正向低温下能进行,B不符合题意;
C、ΔH>0,ΔS>0,在高温时能自发进行,其逆反应在低温下能自发进行,C符合题意;
D、ΔH>0,ΔS<0正向任何温度都不能自发反应,D不符合题意;
故答案为:C
分析:焓变、熵变及温度有关的吉布斯自由能判据:ΔG= ΔH- TΔS。
当ΔH<0,ΔS>0时,ΔG>0,自发过程,过程能正向进行;
当ΔH>0,ΔS<0时,ΔG<0,非自发过程,过程能向逆方向进行;
ΔH<0,ΔS<0或ΔH>0,ΔS>0时反应的自发性取决于温度,低温时焓变为主,高温时熵变为主。当ΔG=0,处
于平衡状态。
11. D
解析:A.HO由气态变为液态,体系的混乱度减小,ΔS<0,A不符合题意;
2
B.物质溶解的过程中,体系的混乱度增大,ΔS>0,B不符合题意;
C.当ΔH-TΔS<0时,反应可自发进行,若一个反应的ΔH>0,ΔS>0,则在高温条件下,反应可自发进行,C不
符合题意;
D.该反应中,ΔH<0,ΔS>0,在任意温度下,都能满足ΔH-TΔS<0,故该反应在任意外界条件下都能自发进行,D符合题意;
故答案为:D
分析:A.物质由气态变为液态,其混乱度减小;
B.溶解过程中,体系的混乱度增大;
C.根据复合判据分析;
D.根据复合判据分析;
12. D
解析:A.在其他外界条件不变的情况下,增大压强能增大单位体积内的活化分子数,但是活化分子的百分
数不变,A不符合题意;
B. 室温下不能自发进行,反应△S>0,△H-T△S>0,说明该反应的△H
>0,B不符合题意;
C.加入催化剂,降低反应的活化能,但是不能改变反应物、生成物的能量,因此反应的活化能也就不变,C不
符合题意;
D.K [Al(OH) ]=c(Al3+)·c3(OH-)=1×10-33 , 由于c(Al3+)≤1×10-6 mol/L,所以c3(OH-)> =1×10-27 , 所
SP 3
以c(OH-)>1×10-9mol/L,c(H+)< =10-5mol/L,所以pH≥5,D符合题意;
故答案为:D。
分析:A. 增大压强 只能增大单位体积内活化分子数,而活化分子百分数不变。
B.反应是否自发要用复合判据判定即△H-T△S大于0反应一定非自发,小于0一定自发。
C.催化剂降低了反应的活化能,不改变反应热。
13. C
解析:N
2
+3H 2⇌2NH
3
△H<0,该反应是放热的可逆反应,要使平衡向正反应方向移动,应降低温度,但温度
过低反应速率过小,不利于工业生成效益;温度越高,反应速率越大,所以应适当升高温度,使反应速率增
大;使用催化剂也能增大反应速率,但在700K左右时催化剂的活性最大,所以选择采用700K左右的温度。
故选C.
分析:根据温度对反应速率、化学平衡及催化剂的影响分析,升高温度加快反应速率,使平衡向吸热方向移
动,据此分析.
二、综合题
14. (1)0.1 mol·L-1·min-1
(2)0.1 mol·L-1
(3)6(4)
解析:(1)前2min内用W表示的反应速率 ;
(2)由分析可知,2min末时X的浓度为0.1mol/L;
(3)由反应速率之比等于化学计量系数之比可得, , 解得n=6;
( 4)由于压强之比等于物质的量之比,也等于物质的量浓度之比,令2min末体系内的压强为p,反应前的压
强为p0,则 ;
分析:以Z的浓度变化表示的反应速率为0.0025mol/(L·s),则2min内生成Z的浓度为0.0025mol/(L·s)×2×6
0s=0.3mol/L,可得平衡三段式如下:
据此结合题干设问分析作答。
15. (1)C H(l)+O (g)=6CO (g)+3HO(l) △H=-3260.4 kJ/mol
6 6 2 2 2
(2)-406kJ/mol;
(3)<;K =K >K ;b
A B C
(4)0.02mol/(L·min);减小
解析:(1)Ⅰ.在25℃、101kPa时,1.00g C H(l)燃烧生成CO 和HO(l)时,放出41.8kJ的热量,78g苯燃烧放
6 6 2 2
出78×41.8kJ=3260.4 kJ的热量,表示C H(l)燃烧热的热化学方程式为:C H(l)+O (g)=6CO (g)+3HO(l)
6 6 6 6 2 2 2
△H=-3260.4 kJ/mol;
(2)Ⅱ.已知:①2H
2
(g)+O
2
(g)⇌ 2H
2
O(g) ΔH=-484kJ/mol
②OHC-CHO(g)+2H
2
(g) ⇌HOCH
2
CH
2
OH(g) ΔH=-78kJ/mol
由盖斯定律:①-②,则乙二醇气相氧化反应 HOCH
2
CH
2
OH(g)+O
2
(g) ⇌OHC-CHO(g)+2H
2
O(g)的ΔH=-484kJ/mol+78kJ/mol= -406kJ/mol;相同温度下,该反应的化学平衡常数K= ;
( 3)Ⅲ. (1)①CO(g)+2H
2
(g)⇌CH
3
OH(g)是气体体积减小的反应,压强增大,CO的平衡转化率增大,A、B两
点对应的压强大小关系是PA0,升高温度、减小NO或O 的浓度以及增大容器的体积,均
2 2 2
能使平衡向正反应方向移动,提高NO 的转化率;②反应进行到2min时NO 的转化率为0.4,则参加反应的
2 2
NO 的物质的量为0.8mol,前2min内,以NO 表示该反应的化学反应速率为 =0.2mol·L-1·min-1;
2 2
③T℃ 时反应达到平衡时NO 的转化率为0.5,则:
2 2·1·c·n·j·y
2NO (g) 2NO(g)+ O(g)
2 2
起 始 2 0 0
(mol)
转 化 1 1 0.5
(mol)
平 衡 1 1 0.5
(mol)
平衡时v =v , 即k c2(NO ) =k c2(NO)·c(O),故 = = =0.25;A点处
正 逆 正 2 逆 2
NO 的转化率为0.3,则:
2
2NO (g) NO(g)+ O(g)
2 2
起 始 2 0 0
(mol)
转 化 0.6 0.6 0.3
(mol)
平 衡 1.4 0.6 0.3
(mol)
此时, = × =0.25× ≈9.1。
分析:(1)该反应是气体体积增大的反应,熵增加;
(2)该反应是吸热反应,降低温度平衡向逆反应方向移动,压强减小;根据三段式计算反应物的转化率;
( 3)该反应是吸热反应,升高温度平衡向正反应方向移动,以及减小生成物的浓度平衡向正反应方向移动;
根据反应速率的定义计算二氧化氮的反应速率;根据A处的正逆反应速率之比计算其数值即可。
19. (1)A,B,E(2)A,D
(3)<;>;66.7
解析:解:(1)A.混合气体的压强不再发生变化,在恒温恒容密闭容器中,因为合成氨是气体分子数目减小
的反应,混合气体的压强不再发生变化,说明达到平衡状态,故A正确;
B.反应前后气体的物质的量不相等,混合气体的相对分子质量不再发生变化,可说明气体的总物质的量不
变,说明达到平衡状态,故B正确;
C.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比,三种物质的浓度比恰好等于化学方
程式中各物质的化学计量数之比可能只是某一时刻的比值,不能证明是否达到平衡,故C错误;
D.无论是否达到平衡状态,都存在单位时间内断开3a个H﹣H键的同时形成6a个N﹣H键,不能说明达到
平衡状态,故D错误;
E.反应容器中N、NH 的物质的量的比值不再发生变化,说明各物质浓度不变,反应达到平衡状态,故E正
2 3
确;
故选:ABE;(2)A.增大压强,平衡向正方向移动,氢气的转化率提高,故A正确;
B.催化剂只能够同等程度加快反应速率,但是平衡不移动,氢气转化率不变,故B错误;
C.合成氨为放热反应,升高温度平衡逆向移动,氢气的转化率降低,故C错误;
D.及时分离出产物中的NH , 减少生成物浓度,平衡正向移动,氢气转化率提高,故D正确;
3
故选:AD;(3)温度越大,压强越大,反应速率越大,由图可知,B对应的温度、压强大,则反应速率大;合成
氨的反应是放热的,所以温度升高,速率加快,反应的平衡常数减小,因为A点温度低,所以k >k ;
A B
在250℃、1.0×104kPa下达到平衡,氨气的体积分数是50%,则设N 的转化量为x,
2
N
2
+ 3H 2⇌2NH
3
,
初始1 3 0
量:
变化x 3x 2x
量:
平衡1﹣x3﹣3x2x
量:
=50%,解得x= ,氢气的转化率= ×100%=66.7%;
故答案为:<;>;66.7.
分析:(1)达到平衡时,正逆反应速率相等,各物质的浓度不变,以此衍生的一些物理量也不变,以此判断是
否达到平衡状态;(2)为了提高氢气的转化率,应使平衡向正反应移动,结合反应的特点分析选项判断平衡
移动的方向,然后进行判断;(3)温度越大,压强越大,反应速率越大;平衡常数只受温度的影响,升高温度
平衡向吸热方向移动,吸热反应平衡常数增大;
21世纪教育网版权所有