文档内容
第二章 第一节 第2课时 钠的重要氧化物 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共60分)
1. 能与CO 反应放出氧气的物质是( )
2
A.NaO B.NaO
2 2 2
C.NaOH D.NaCl
2. 下列关于氧化钠和过氧化钠的叙述中,正确的是( )
A.都属于碱性氧化物
B.都能与水发生化合反应
C.水溶液的成分相同
D.与二氧化碳反应生成不同的盐
3. 下列对于NaO、NaO 的比较,正确的是( )
2 2 2
A.NaO、NaO都是钠的氧化物,都是碱性氧化物
2 2 2
B.NaO、NaO 都是易溶于水(与水反应)的白色固体
2 2 2
C.NaO 在和CO 的反应中既是氧化剂又是还原剂
2 2 2
D.NaO、NaO均可作供氧剂
2 2 2
4. 向紫色石蕊溶液中加入过量NaO 粉末,振荡。正确的叙述是( )
2 2
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为NaO 与石蕊发生氧化还原反应而无气泡产生
2 2
5. 下列叙述中正确的是( )
①NaO与NaO 都能和水反应生成碱,它们都是碱性氧化物
2 2 2
②NaO与CO 发生化合反应生成NaCO,NaO 与CO 发生置换反应生成O
2 2 2 3 2 2 2 2
③NaO主要有氧化性,NaO 主要有还原性
2 2 2
④NaO 可作供氧剂,而NaO不能
2 2 2
⑤NaO 是强氧化剂,NaO是一种碱性氧化物
2 2 2
A.都正确 B.②③④⑤
C. ②③⑤ D.④⑤
6. 下列有关钠及其化合物的性质说法正确的是( )
A.CO 气体使NaO 固体变白,CO 气体被还原
2 2 2 2
B.除去NaHCO 固体中的NaCO,可以将固体加热至恒重
3 2 3
C.NaO 吸收CO 产生O,所以NaO 可用作呼吸面具供氧剂
2 2 2 2 2 2
D.钠与水反应Na+2HO===Na++2OH−+H ↑
2 2
7. 下列关于过氧化钠和氧化钠性质异同点的叙述中错误的是( )
1
学科网(北京)股份有限公司A.长期置于空气中最终所得固体产物相同
B.都能与二氧化碳或水发生化合反应
C.与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物
8. 对于反应2NaO+2HO===4NaOH+O↑,下列说法中正确的是( )
2 2 2 2
A.NaO 是氧化剂,HO是还原剂
2 2 2
B.NaO 既是氧化剂,又是还原剂
2 2
C.该反应中电子转移的数目为4e-
D.每有18 g HO与足量NaO 反应,则固体增重4 g
2 2 2
9.下列对于NaO、NaO 的比较正确的一项是( )
2 2 2
A.NaO、NaO都是钠的氧化物,都是碱性氧化物
2 2 2
B.NaO、NaO 都是易溶于水(与水反应)的白色固体
2 2 2
C.NaO 在和CO 的反应中既是氧化剂又是还原剂
2 2 2
D.NaO、NaO均可做供氧剂
2 2 2
10.下列判断正确的是( )
A.可用水来确定某NaO粉末中是否含有NaO
2 2 2
B.可用CO 来确定某NaO粉末中是否含有NaO
2 2 2 2
C.可利用在空气中加热的方法除去NaO中的NaO
2 2 2
D.将足量的NaO、NaO分别加到酚酞溶液中,最终溶液均为红色
2 2 2
11.在溶液中加入足量NaO 后仍能大量共存的离子组是( )
2 2
A.NH、Ba2+、Cl-、NO -
3
B.K+、Na+、Cl-、SO 2-
4
C.Ca2+、Mg2+、NO -、HCO -
3 3
D.Na+、Cl-、CO2-、SO 2-
3 3
12.下列离子方程式正确的是( )
A.过氧化钠投入水中:O2-+2HO===4OH-+O↑
2 2 2
B.CO 通入NaCO 溶液中:CO+CO2-+HO===2 HCO -
2 2 3 2 3 2 3
C.澄清石灰水中通入足量的CO:Ca2++2OH-+CO===CaCO ↓+HO
2 2 3 2
D.小苏打溶液中加入过量的石灰水:2 HCO-+Ca2++2OH-===CaCO ↓+CO2-+2HO
3 3 3 2
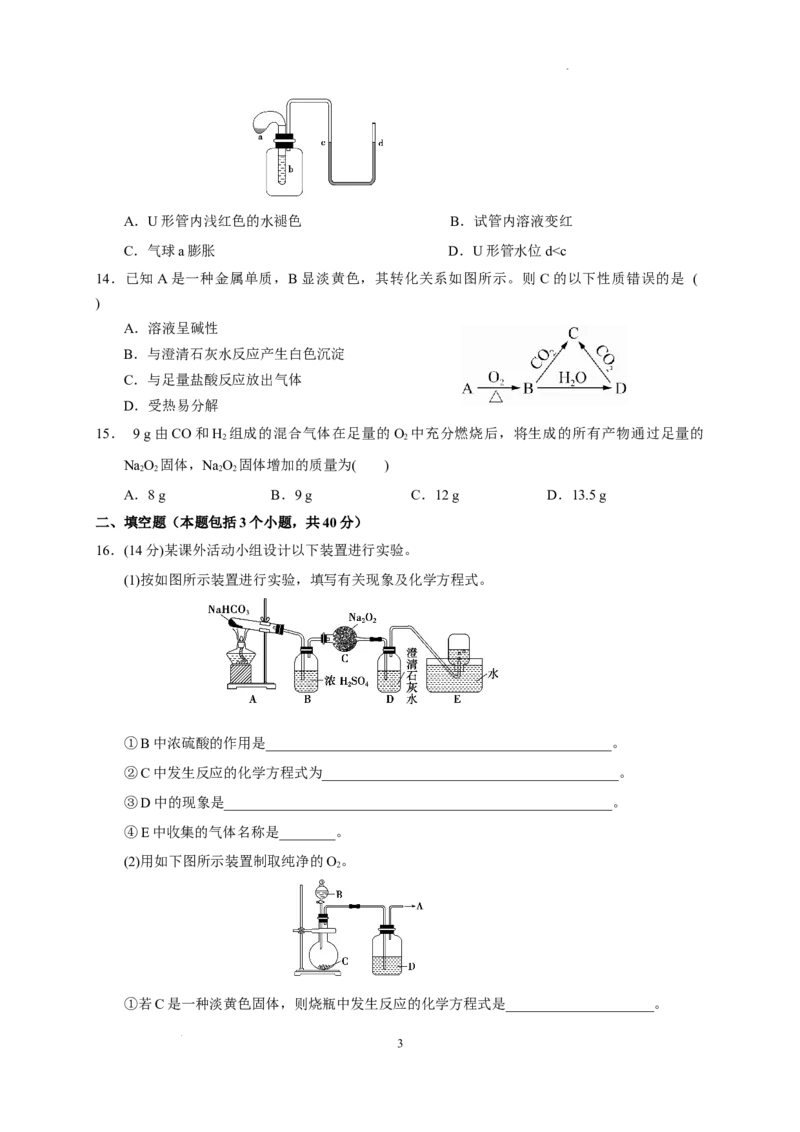
13.如图装置,试管中盛有水,气球a中盛有干燥的NaO 颗粒,U形管中注有浅红色的水,将气
2 2
球用橡皮筋紧缚在试管口。实验时将气球中的NaO 抖落到试管b的水中,将发现的现象是(
2 2
)
2
学科网(北京)股份有限公司A.U形管内浅红色的水褪色 B.试管内溶液变红
C.气球a膨胀 D.U形管水位dc。
14.答案:D
解析:由题意知A为Na,B为NaO,C为NaCO,D为NaOH。NaCO 受热不分解,D项错误。
2 2 2 3 2 3
15.答案:B
解析:CO在氧气中完全燃烧生成CO ,生成的CO 再与NaO 反应,有关反应为2CO+O2CO ,
2 2 2 2 2 2
2CO +2NaO===2Na CO +O ,总方程式为2CO+2NaO===2Na CO ,质量增重为CO的质量;
2 2 2 2 3 2 2 2 2 3
H 在氧气中完全燃烧生成 HO,HO 再与 NaO 反应,有关反应为 2H +O2HO,2HO+
2 2 2 2 2 2 2 2 2
2NaO===4NaOH+O↑,总方程式为2H +2NaO===4NaOH,质量增重为H 的质量。综上分析,
2 2 2 2 2 2 2
最终固体增重为CO与H 的总质量,故9 g CO和H 的混合气燃烧后,将生成的所有产物再通过足
2 2
量的NaO 固体,充分反应后,固体增加的质量是9 g。
2 2
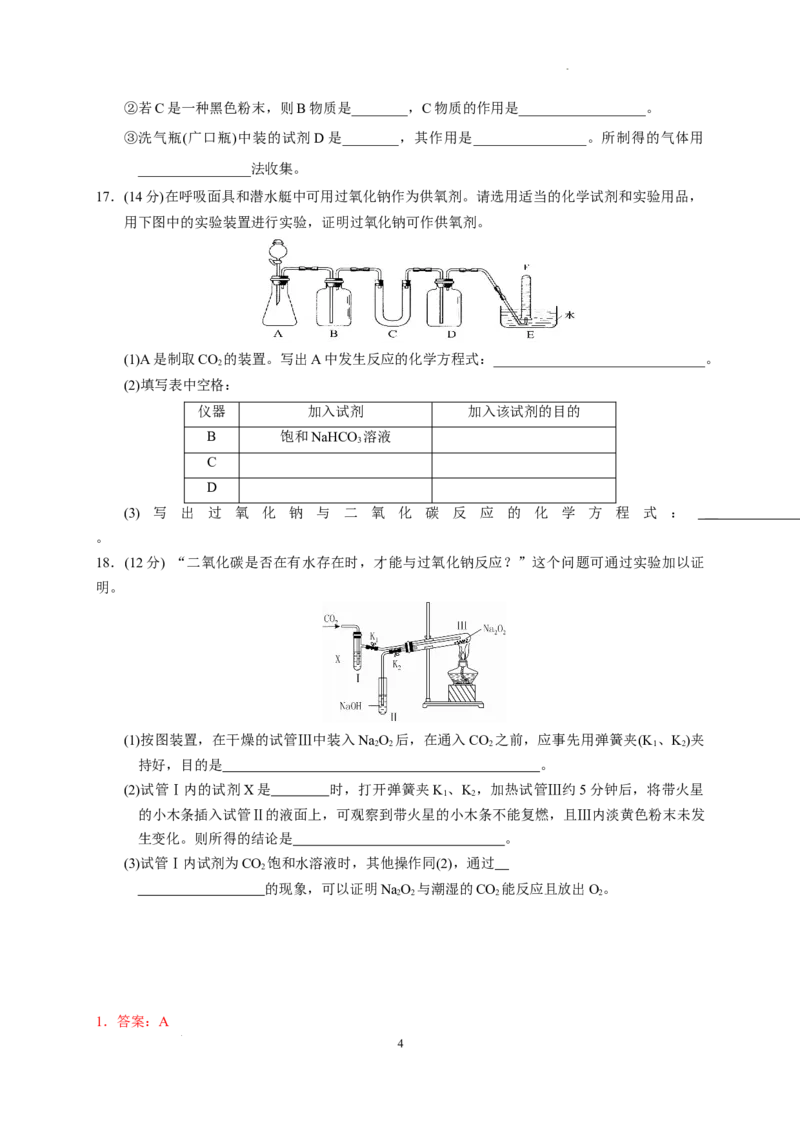
16.答案:(1)①干燥二氧化碳 ②2CO +2NaO===2Na CO +O ③澄清石灰水变浑浊 ④氧
2 2 2 2 3 2
气
(2)①2NaO+2HO===4NaOH+O↑
2 2 2 2
②HO 做催化剂 ③浓硫酸 除去O 中的水蒸气 向上排空气
2 2 2
解析: (1)NaHCO 受热分解生成CO 和水蒸气,而CO 通过浓HSO 干燥后与C中的NaO 反应产
3 2 2 2 4 2 2
6
学科网(北京)股份有限公司生O ,未完全反应的CO 会使澄清石灰水变浑浊。(2)O 可用淡黄色固体(Na O)与水反应制得,也
2 2 2 2 2
可由黑色固体(MnO )和液体(H O)作用制得。由于上述方法制氧气都是在水溶液中进行的,所以要
2 2 2
得到干燥、纯净的O 则应干燥后再收集。
2
17.答案: (1) CaCO +2HCl===CaCl +HO+CO↑
3 2 2 2
(2)
仪器 加入试剂 加入该试剂的目的
B (饱和NaHCO 溶液) 除去CO 气体中混入的HCl气体
3 2
C 过氧化钠 与CO 和水气反应,产生O
2 2
D NaOH溶液 吸收未反应的CO
2
(注:C中实际加入过氧化钠和石棉绒的混合物,这里只要求学生填写化学试剂)
(3) 2Na O+2CO=2NaCO+O
2 2 2 2 3 2
解析:本题以过氧化钠性质为知识纽带,考查二氧化碳的制法,除杂,氧气的收集,各装置的作用
及试剂的选择等知识。
18.答案:(1)防止试管Ⅲ内的过氧化钠和外界相通时发生吸潮现象
(2)浓硫酸 过氧化钠与干燥的CO 不反应
2
(3)带火星的小木条在试管Ⅱ的液面上复燃且剧烈燃烧,同时,Ⅲ内固体由淡黄色变为白色
解析: (1)本题旨在利用对比实验,探究NaO 与CO 反应的环境,故实验步骤中,首先让NaO 与
2 2 2 2 2
干燥CO 反应,必须保证整个环境中不能有 HO进入。(2)根据题意可看出此时应当提供干燥二氧
2 2
化碳,故试管Ⅰ内的试剂X是浓硫酸。
7
学科网(北京)股份有限公司8
学科网(北京)股份有限公司