文档内容
第六章 化学反应与能量(单元测试)
一、选择题(本题共16小题,每小题3分,共48分。)
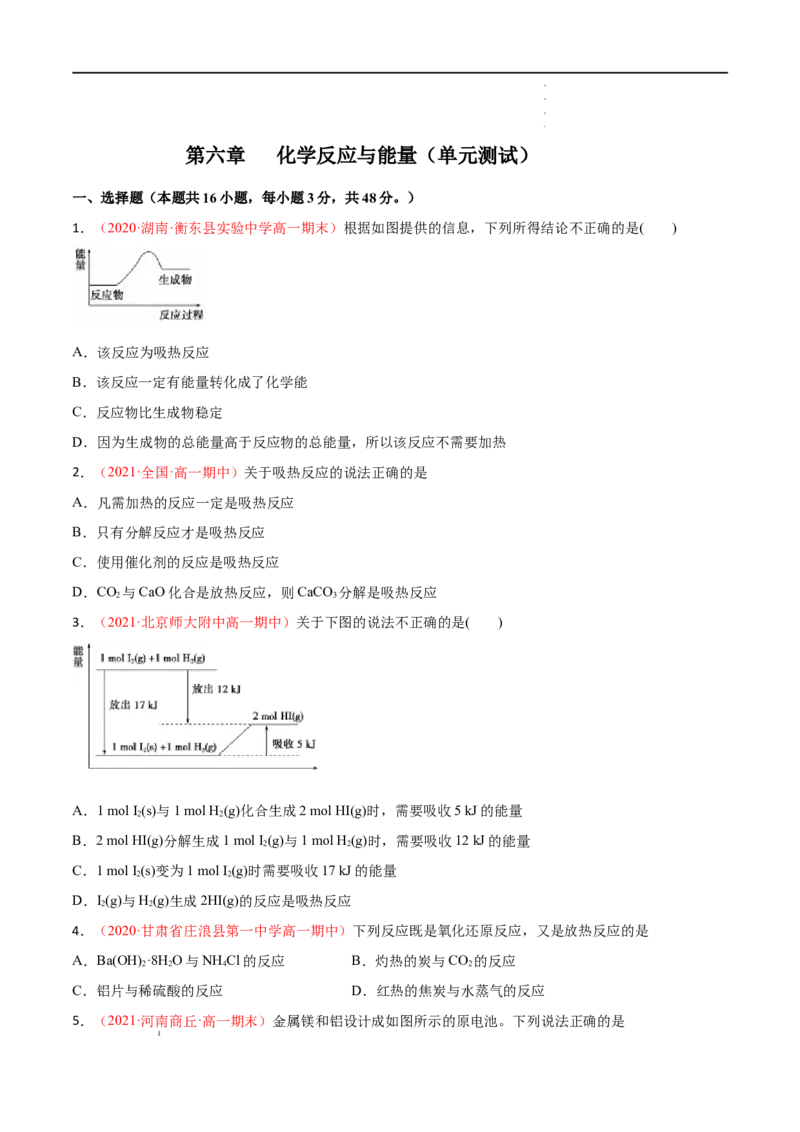
1.(2020·湖南·衡东县实验中学高一期末)根据如图提供的信息,下列所得结论不正确的是( )
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比生成物稳定
D.因为生成物的总能量高于反应物的总能量,所以该反应不需要加热
2.(2021·全国·高一期中)关于吸热反应的说法正确的是
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO 与CaO化合是放热反应,则CaCO 分解是吸热反应
2 3
3.(2021·北京师大附中高一期中)关于下图的说法不正确的是( )
A.1 mol I (s)与1 mol H (g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
2 2
B.2 mol HI(g)分解生成1 mol I (g)与1 mol H (g)时,需要吸收12 kJ的能量
2 2
C.1 mol I (s)变为1 mol I (g)时需要吸收17 kJ的能量
2 2
D.I(g)与H(g)生成2HI(g)的反应是吸热反应
2 2
4.(2020·甘肃省庄浪县第一中学高一期中)下列反应既是氧化还原反应,又是放热反应的是
A.Ba(OH) ·8H O与NH Cl的反应 B.灼热的炭与CO 的反应
2 2 4 2
C.铝片与稀硫酸的反应 D.红热的焦炭与水蒸气的反应
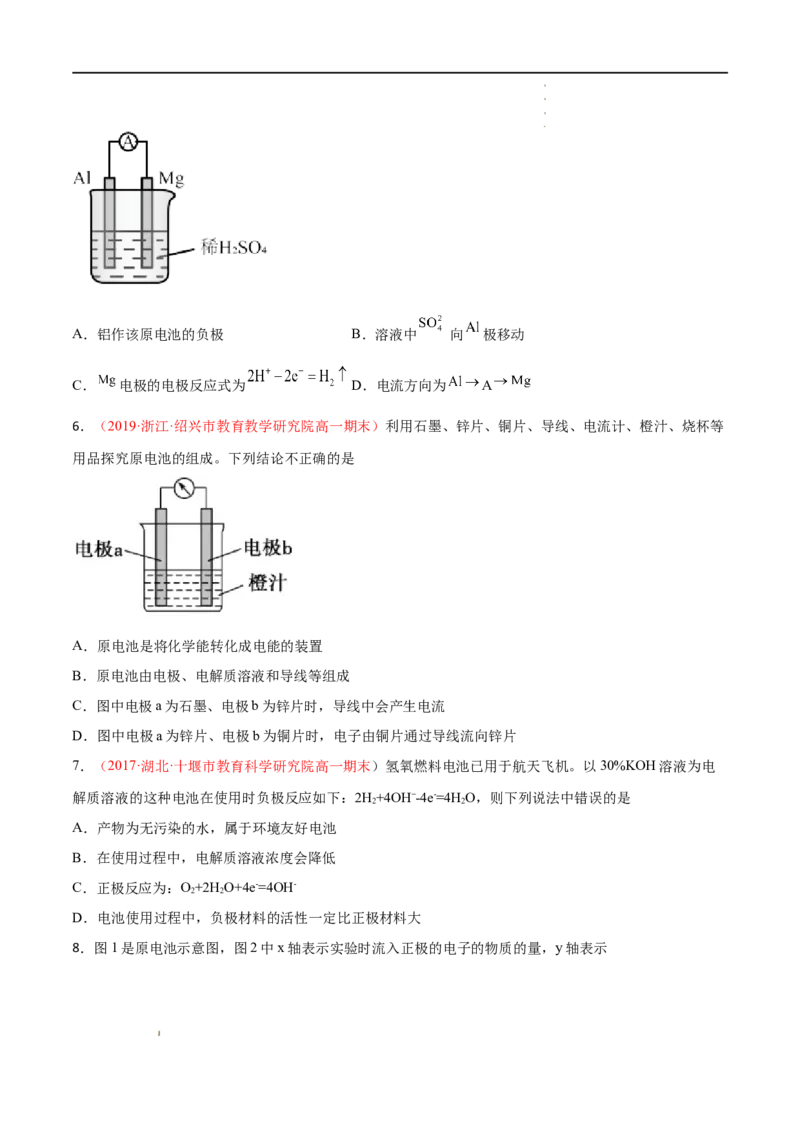
5.(2021·河南商丘·高一期末)金属镁和铝设计成如图所示的原电池。下列说法正确的是
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司A.铝作该原电池的负极 B.溶液中 向 极移动
C. 电极的电极反应式为 D.电流方向为 A
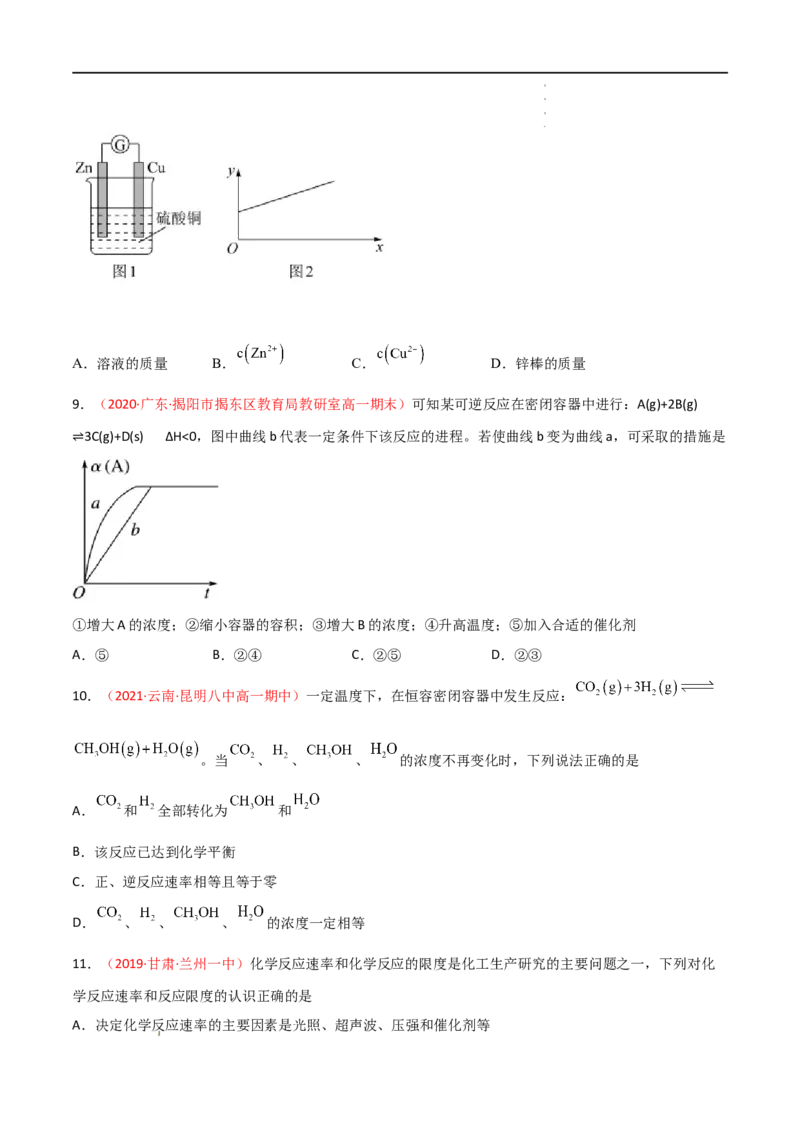
6.(2019·浙江·绍兴市教育教学研究院高一期末)利用石墨、锌片、铜片、导线、电流计、橙汁、烧杯等
用品探究原电池的组成。下列结论不正确的是
A.原电池是将化学能转化成电能的装置
B.原电池由电极、电解质溶液和导线等组成
C.图中电极a为石墨、电极b为锌片时,导线中会产生电流
D.图中电极a为锌片、电极b为铜片时,电子由铜片通过导线流向锌片
7.(2017·湖北·十堰市教育科学研究院高一期末)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电
解质溶液的这种电池在使用时负极反应如下:2H+4OH–-4e-=4H O,则下列说法中错误的是
2 2
A.产物为无污染的水,属于环境友好电池
B.在使用过程中,电解质溶液浓度会降低
C.正极反应为:O+2H O+4e-=4OH-
2 2
D.电池使用过程中,负极材料的活性一定比正极材料大
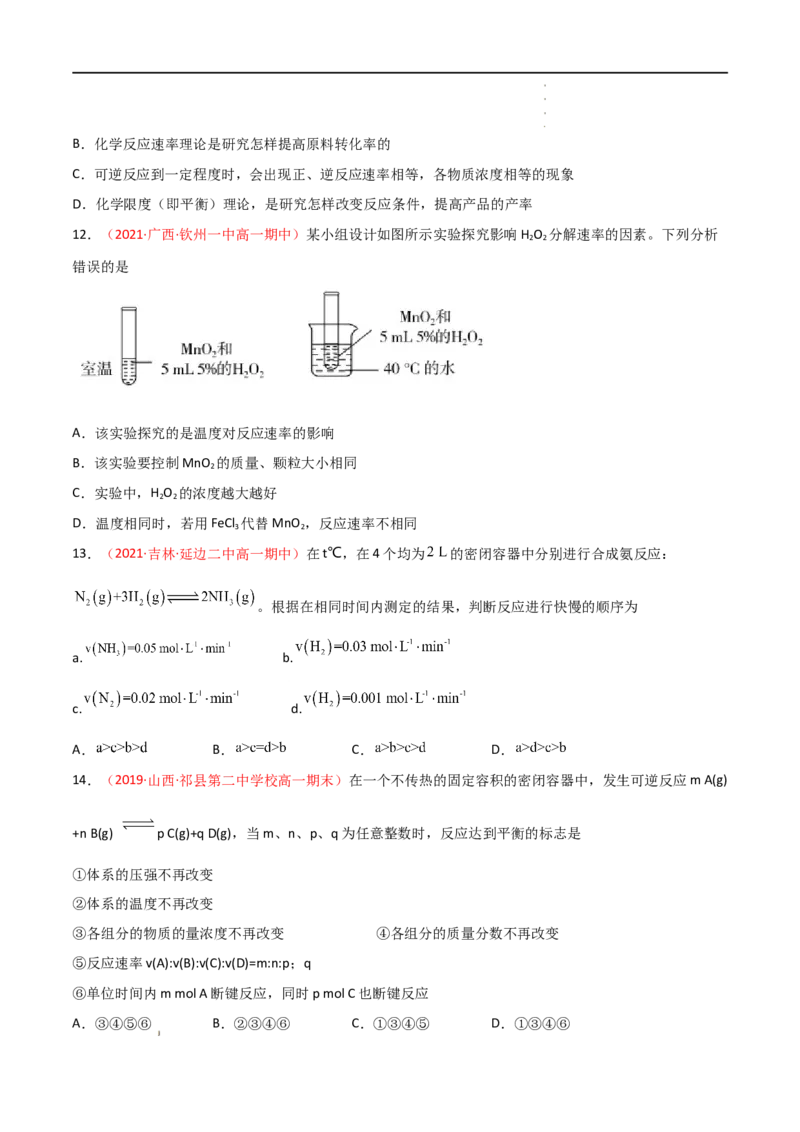
8.图1是原电池示意图,图2中x轴表示实验时流入正极的电子的物质的量,y轴表示
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司A.溶液的质量 B. C. D.锌棒的质量
9.(2020·广东·揭阳市揭东区教育局教研室高一期末)可知某可逆反应在密闭容器中进行:A(g)+2B(g)
3C(g)+D(s) ΔH<0,图中曲线b代表一定条件下该反应的进程。若使曲线b变为曲线a,可采取的措施是
⇌
①增大A的浓度;②缩小容器的容积;③增大B的浓度;④升高温度;⑤加入合适的催化剂
A.⑤ B.②④ C.②⑤ D.②③
10.(2021·云南·昆明八中高一期中)一定温度下,在恒容密闭容器中发生反应:
。当 、 、 、 的浓度不再变化时,下列说法正确的是
A. 和 全部转化为 和
B.该反应已达到化学平衡
C.正、逆反应速率相等且等于零
D. 、 、 、 的浓度一定相等
11.(2019·甘肃·兰州一中)化学反应速率和化学反应的限度是化工生产研究的主要问题之一,下列对化
学反应速率和反应限度的认识正确的是
A.决定化学反应速率的主要因素是光照、超声波、压强和催化剂等
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司B.化学反应速率理论是研究怎样提高原料转化率的
C.可逆反应到一定程度时,会出现正、逆反应速率相等,各物质浓度相等的现象
D.化学限度(即平衡)理论,是研究怎样改变反应条件,提高产品的产率
12.(2021·广西·钦州一中高一期中)某小组设计如图所示实验探究影响H O 分解速率的因素。下列分析
2 2
错误的是
A.该实验探究的是温度对反应速率的影响
B.该实验要控制MnO 的质量、颗粒大小相同
2
C.实验中,H O 的浓度越大越好
2 2
D.温度相同时,若用FeCl 代替MnO ,反应速率不相同
3 2
13.(2021·吉林·延边二中高一期中)在t℃,在4个均为 的密闭容器中分别进行合成氨反应:
。根据在相同时间内测定的结果,判断反应进行快慢的顺序为
a. b.
c. d.
A. B. C. D.
14.(2019·山西·祁县第二中学校高一期末)在一个不传热的固定容积的密闭容器中,发生可逆反应m A(g)
+n B(g) p C(g)+q D(g),当m、n、p、q为任意整数时,反应达到平衡的标志是
①体系的压强不再改变
②体系的温度不再改变
③各组分的物质的量浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p;q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.①③④⑥
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司15.(2021·浙江·诸暨中学高一期中)下列由实验现象所得结论错误的是
A.向浓HNO 中插入红热的炭,产生红棕色气体,证明炭可与浓HNO 反应生成NO
3 3 2
B.向酸性KMnO 溶液中加入Fe O 粉末,紫色褪去,证明Fe O 中含Fe(Ⅱ)
4 3 4 3 4
C.向NaHSO 溶液中滴加氢硫酸,产生淡黄色沉淀,证明 具有氧化性
3
D.取5 mL0.1 mol·L-1KI溶液于试管中,加入1 mL0.1 mol·L-1FeCl 溶液,充分反应后滴入5滴15% KSCN溶液,
3
若溶液变血红色,则KI与FeCl 的反应有一定限度
3
16.(2021·广东·广州市第八十九中学高一期中)在密闭容器中进行如下反应:2SO (g)+O (g) 2SO (g),已
2 2 3
知反应过程中某一时刻SO 、O 、SO :的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达⇌平衡时,可
2 2 3
能存在的数据是
A.SO 为0.4mol/L B.SO 为0.3mol/L
2 2
C.SO 、SO 均为0.15mol/lL D.SO 为0.4mol/L
2 3 3
二、非选择题(本题共4小题,共52分。)
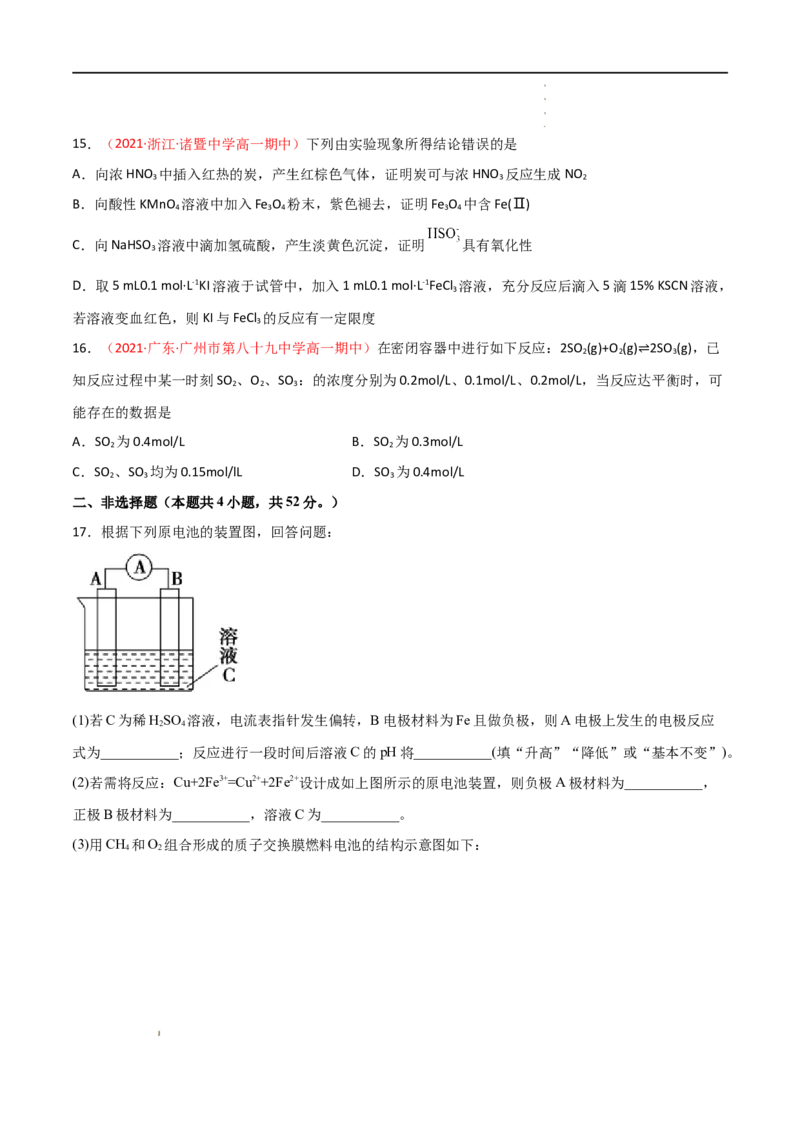
17.根据下列原电池的装置图,回答问题:
(1)若C为稀HSO 溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应
2 4
式为___________;反应进行一段时间后溶液C的pH将___________(填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,则负极A极材料为___________,
正极B极材料为___________,溶液C为___________。
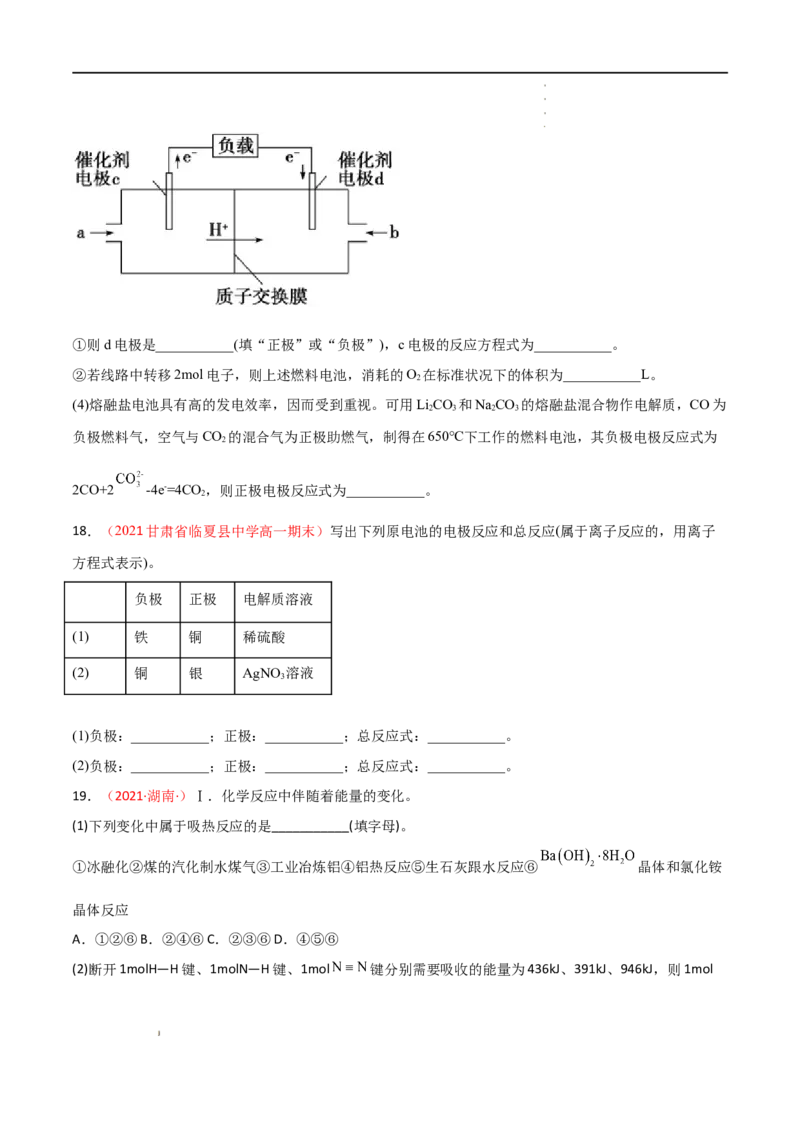
(3)用CH 和O 组合形成的质子交换膜燃料电池的结构示意图如下:
4 2
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司①则d电极是___________(填“正极”或“负极”),c电极的反应方程式为___________。
②若线路中转移2mol电子,则上述燃料电池,消耗的O 在标准状况下的体积为___________L。
2
(4)熔融盐电池具有高的发电效率,因而受到重视。可用LiCO 和NaCO 的熔融盐混合物作电解质,CO为
2 3 2 3
负极燃料气,空气与CO 的混合气为正极助燃气,制得在650℃下工作的燃料电池,其负极电极反应式为
2
2CO+2 -4e-=4CO ,则正极电极反应式为___________。
2
18.(2021甘肃省临夏县中学高一期末)写出下列原电池的电极反应和总反应(属于离子反应的,用离子
方程式表示)。
负极 正极 电解质溶液
(1) 铁 铜 稀硫酸
(2) 铜 银 AgNO 溶液
3
(1)负极:___________;正极:___________;总反应式:___________。
(2)负极:___________;正极:___________;总反应式:___________。
19.(2021·湖南·)Ⅰ.化学反应中伴随着能量的变化。
(1)下列变化中属于吸热反应的是___________(填字母)。
①冰融化②煤的汽化制水煤气③工业冶炼铝④铝热反应⑤生石灰跟水反应⑥ 晶体和氯化铵
晶体反应
A.①②⑥B.②④⑥C.②③⑥D.④⑤⑥
(2)断开1molH—H键、1molN—H键、1mol 键分别需要吸收的能量为436kJ、391kJ、946kJ,则1mol
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司完全反应生成 ,理论上能放出能量___________kJ。
Ⅱ.化学反应的快慢和限度对人类生产、生活有重要的意义。
(3)如图所示,500℃时A、B、C三种气体在密闭容器中反应时的浓度变化,分析图像,回答问题:
①该反应的方程式为___________。
②在其他条件下,测得A的反应速率为0.05mol/(L·min),此时的反应与500℃时相比,___________。
A.比500℃时慢B.比500℃时快C.和500℃时速率一样
(4)某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
序 锌的质 锌的形 反应前溶液的温
其他试剂
号 量/g 态 度/℃
1 1.0 粒状 0.5 60 20 无
2 1.0 粉末 0.5 60 20 无
3 1.0 粒状 0.5 60 20
2滴 溶
液
4 1.0 粉末 0.8 60 30
2滴 溶
液
在此4组实验中,速率最快的是___________(填实验序号);
实验1和2表明___________对反应速率有影响;
实验1和3表明___________对反应速率有影响。
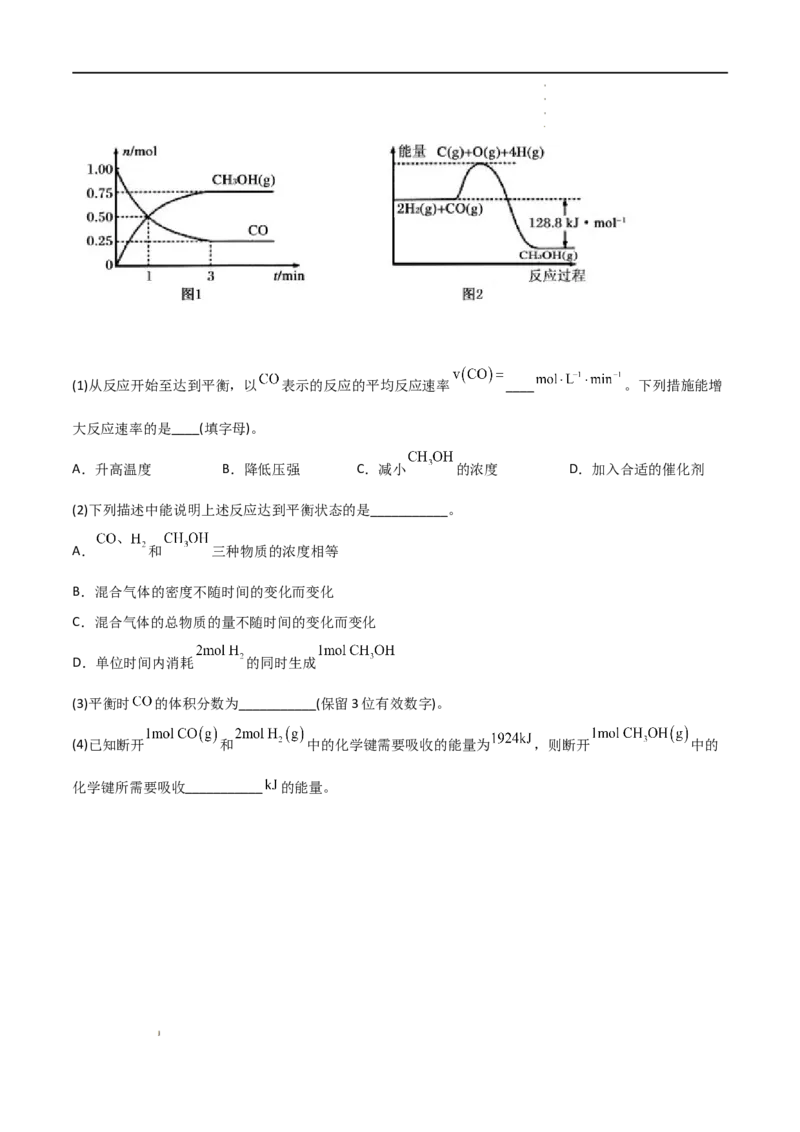
20.(2021·海南·海口嘉勋高级中学)在 的恒容密闭容器中充入 和 ,一定条件下发生
反应: ,测得 和 的物质的量变化如图1所示,反应过程中的
能量变化如图2所示。
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司(1)从反应开始至达到平衡,以 表示的反应的平均反应速率 ____ 。下列措施能增
大反应速率的是____(填字母)。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
(2)下列描述中能说明上述反应达到平衡状态的是___________。
A. 和 三种物质的浓度相等
B.混合气体的密度不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗 的同时生成
(3)平衡时 的体积分数为___________(保留3位有效数字)。
(4)已知断开 和 中的化学键需要吸收的能量为 ,则断开 中的
化学键所需要吸收___________ 的能量。
学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司学学学学 科科科科 网网网网 (((( 北北北北 京京京京 )))) 股股股股 份份份份 有有有有 限限限限 公公公公 司司司司