文档内容
第四章 第二节 第1课时 电解原理 测试题
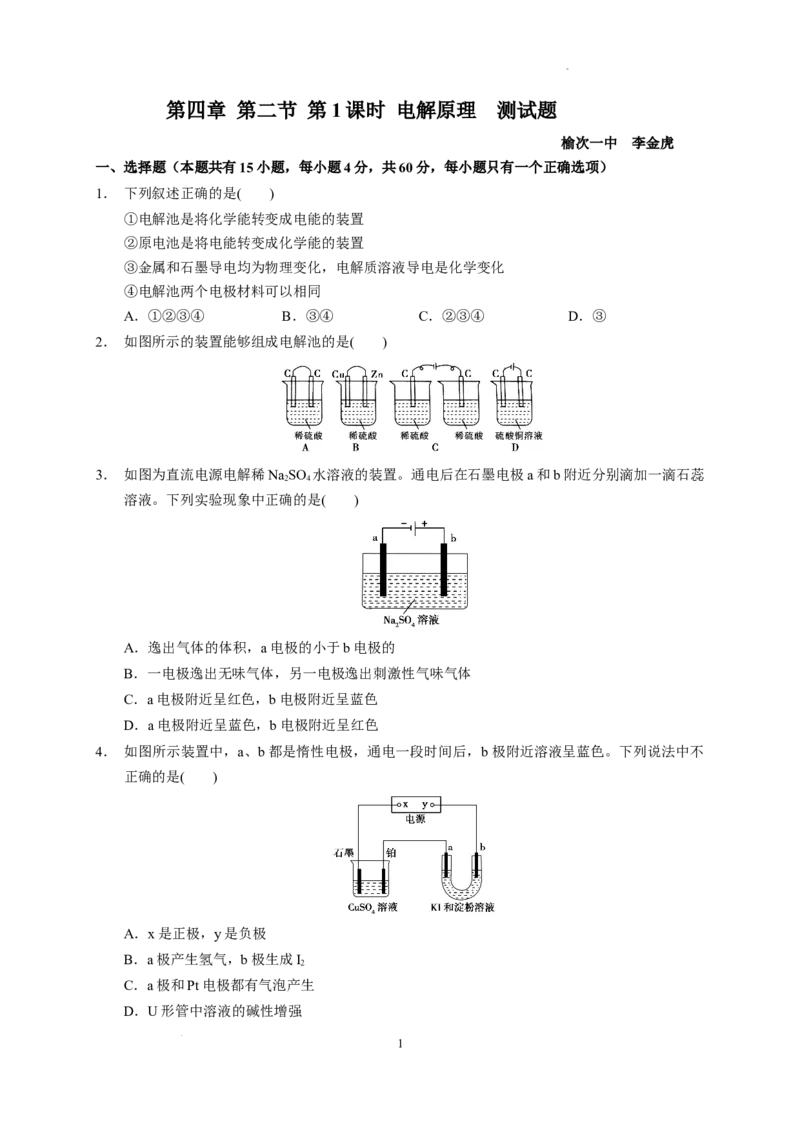
榆次一中 李金虎
一、选择题(本题共有15小题,每小题4分,共60分,每小题只有一个正确选项)
1. 下列叙述正确的是( )
①电解池是将化学能转变成电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④电解池两个电极材料可以相同
A.①②③④ B.③④ C.②③④ D.③
2. 如图所示的装置能够组成电解池的是( )
3. 如图为直流电源电解稀NaSO 水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊
2 4
溶液。下列实验现象中正确的是( )
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
4. 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。下列说法中不
正确的是( )
A.x是正极,y是负极
B.a极产生氢气,b极生成I
2
C.a极和Pt电极都有气泡产生
D.U形管中溶液的碱性增强
1
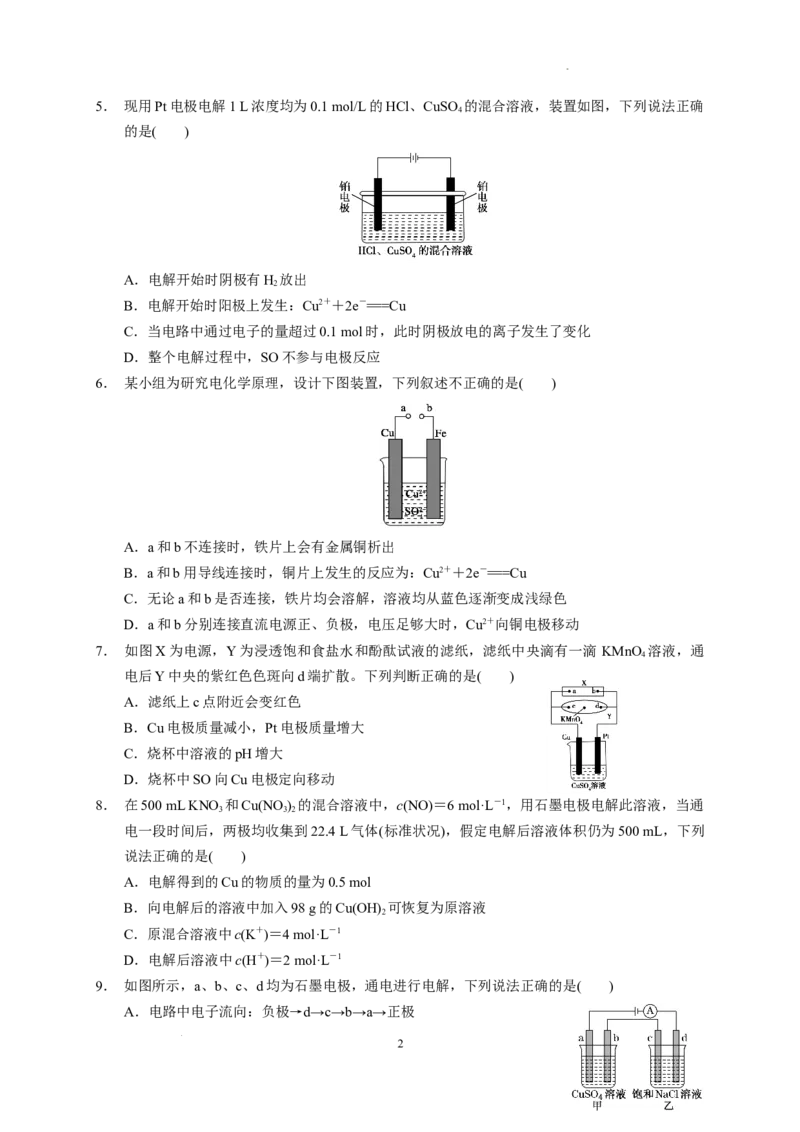
学科网(北京)股份有限公司5. 现用Pt电极电解1 L浓度均为0.1 mol/L的HCl、CuSO 的混合溶液,装置如图,下列说法正确
4
的是( )
A.电解开始时阴极有H 放出
2
B.电解开始时阳极上发生:Cu2++2e-===Cu
C.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化
D.整个电解过程中,SO不参与电极反应
6. 某小组为研究电化学原理,设计下图装置,下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
7. 如图X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴 KMnO 溶液,通
4
电后Y中央的紫红色色斑向d端扩散。下列判断正确的是( )
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.烧杯中溶液的pH增大
D.烧杯中SO向Cu电极定向移动
8. 在500 mL KNO 和Cu(NO ) 的混合溶液中,c(NO)=6 mol·L-1,用石墨电极电解此溶液,当通
3 3 2
电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列
说法正确的是( )
A.电解得到的Cu的物质的量为0.5 mol
B.向电解后的溶液中加入98 g的Cu(OH) 可恢复为原溶液
2
C.原混合溶液中c(K+)=4 mol·L-1
D.电解后溶液中c(H+)=2 mol·L-1
9. 如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )
A.电路中电子流向:负极→d→c→b→a→正极
2
学科网(北京)股份有限公司B.a、c两极产生气体的物质的量相等
C.SO向b电极移动,Cl-向c电极移动
D.电解一段时间,向甲中加CuO可以恢复甲溶液
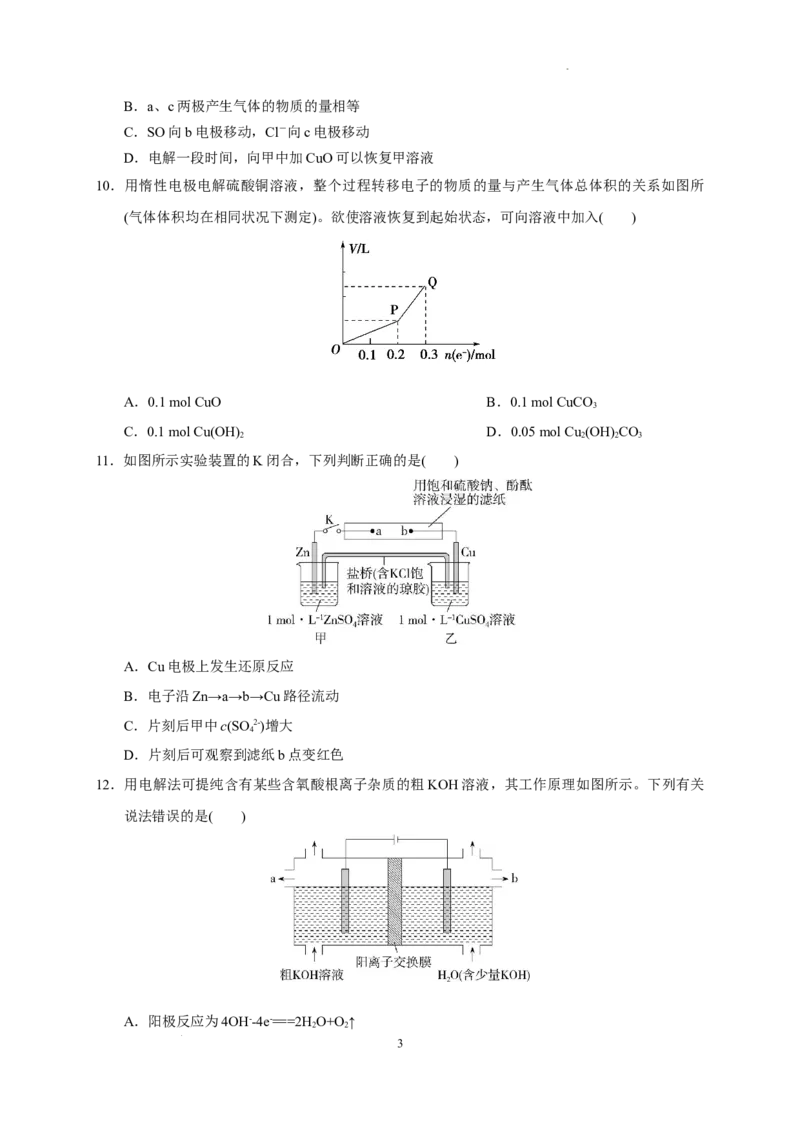
10.用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所
(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
A.0.1 mol CuO B.0.1 mol CuCO
3
C.0.1 mol Cu(OH) D.0.05 mol Cu (OH) CO
2 2 2 3
11.如图所示实验装置的K闭合,下列判断正确的是( )
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲中c(SO 2-)增大
4
D.片刻后可观察到滤纸b点变红色
12.用电解法可提纯含有某些含氧酸根离子杂质的粗KOH溶液,其工作原理如图所示。下列有关
说法错误的是( )
A.阳极反应为4OH--4e-===2HO+O↑
2 2
3
学科网(北京)股份有限公司B.通电后阴极区附近溶液pH会减小
C.K+通过阳离子交换膜从阳极区移向阴极区
D.提纯的KOH溶液从b出口导出
13. 用惰性电极电解M(NO) 的水溶液,当阴极增重a g时,在阳极上产生了b L气体(标准状况
3 x
下),则M的相对原子质量为( )
22.4ax 11.2ax 5.6ax 2.5ax
A. B. C. D.
b b b b
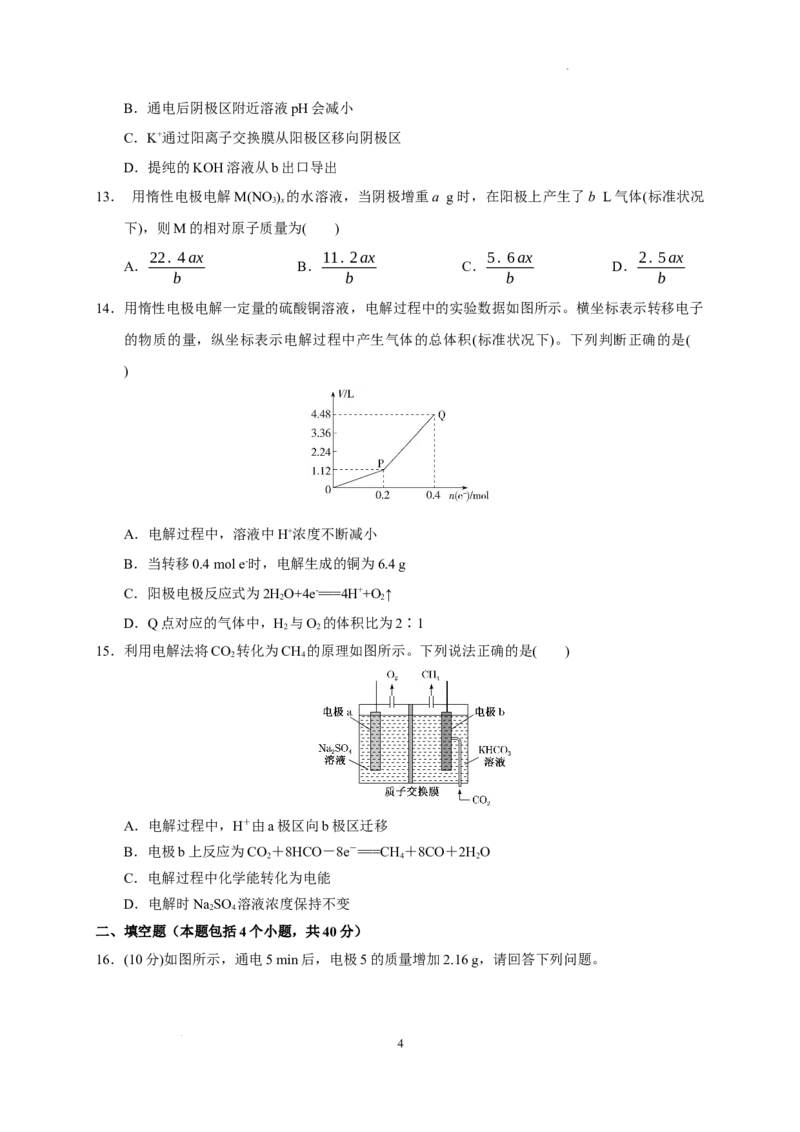
14.用惰性电极电解一定量的硫酸铜溶液,电解过程中的实验数据如图所示。横坐标表示转移电子
的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况下)。下列判断正确的是(
)
A.电解过程中,溶液中H+浓度不断减小
B.当转移0.4 mol e-时,电解生成的铜为6.4 g
C.阳极电极反应式为2HO+4e-===4H++O ↑
2 2
D.Q点对应的气体中,H 与O 的体积比为2∶1
2 2
15.利用电解法将CO 转化为CH 的原理如图所示。下列说法正确的是( )
2 4
A.电解过程中,H+由a极区向b极区迁移
B.电极b上反应为CO+8HCO-8e-===CH +8CO+2HO
2 4 2
C.电解过程中化学能转化为电能
D.电解时NaSO 溶液浓度保持不变
2 4
二、填空题(本题包括4个小题,共40分)
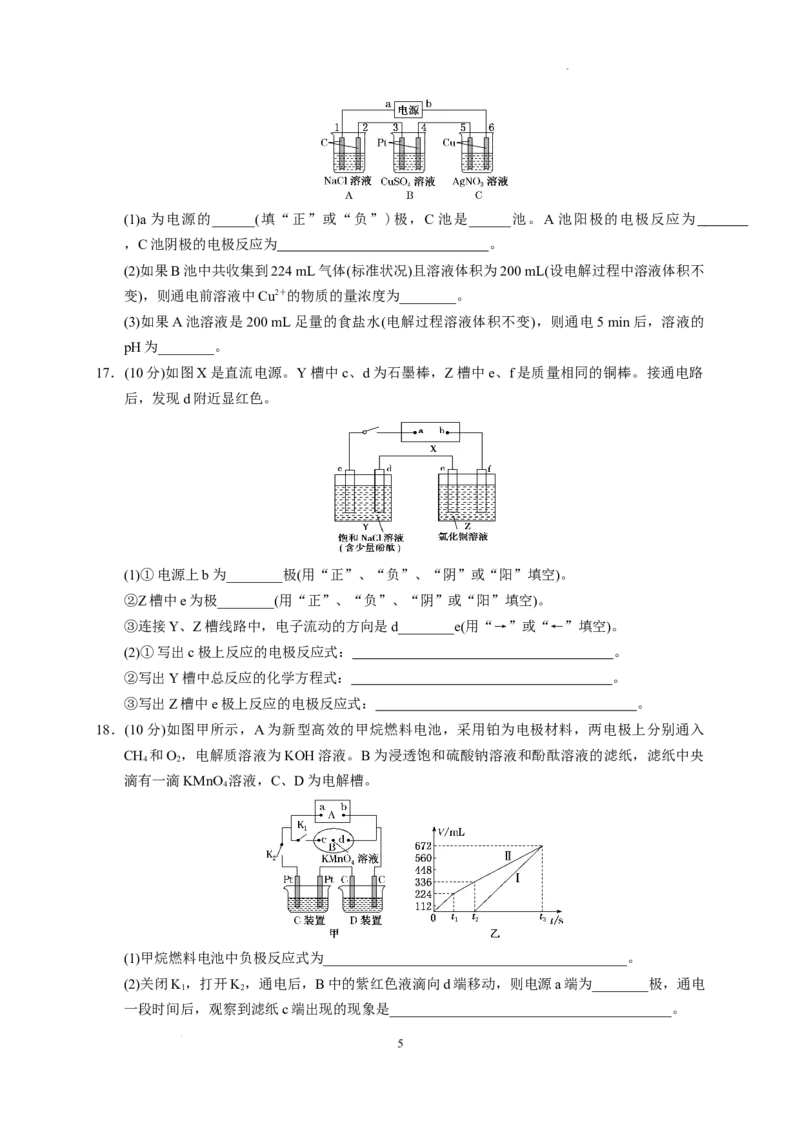
16.(10分)如图所示,通电5 min后,电极5的质量增加2.16 g,请回答下列问题。
4
学科网(北京)股份有限公司(1)a 为电源的______(填“正”或“负”)极,C 池是______池。A 池阳极的电极反应为
,C池阴极的电极反应为 。
(2)如果B池中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不
变),则通电前溶液中Cu2+的物质的量浓度为________。
(3)如果A池溶液是200 mL足量的食盐水(电解过程溶液体积不变),则通电5 min后,溶液的
pH为________。
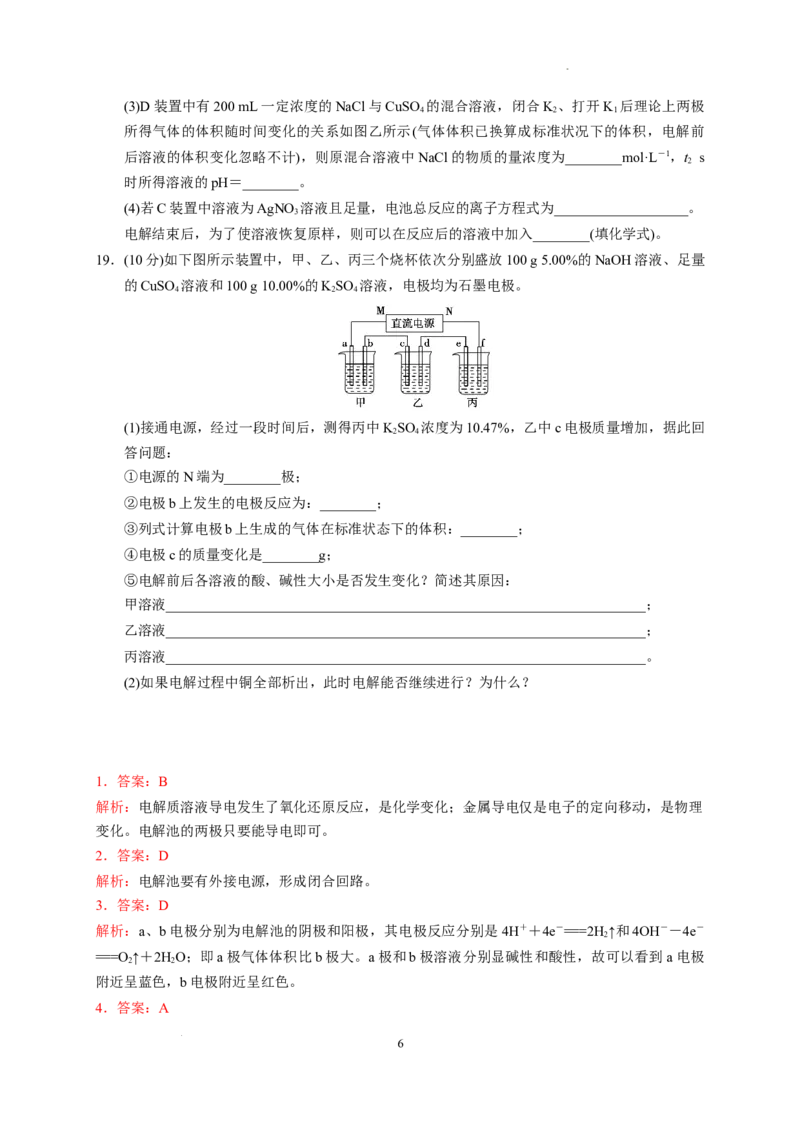
17.(10分)如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路
后,发现d附近显红色。
(1)①电源上b为________极(用“正”、“负”、“阴”或“阳”填空)。
②Z槽中e为极________(用“正”、“负”、“阴”或“阳”填空)。
③连接Y、Z槽线路中,电子流动的方向是d________e(用“→”或“←”填空)。
(2)①写出c极上反应的电极反应式: 。
②写出Y槽中总反应的化学方程式: 。
③写出Z槽中e极上反应的电极反应式: 。
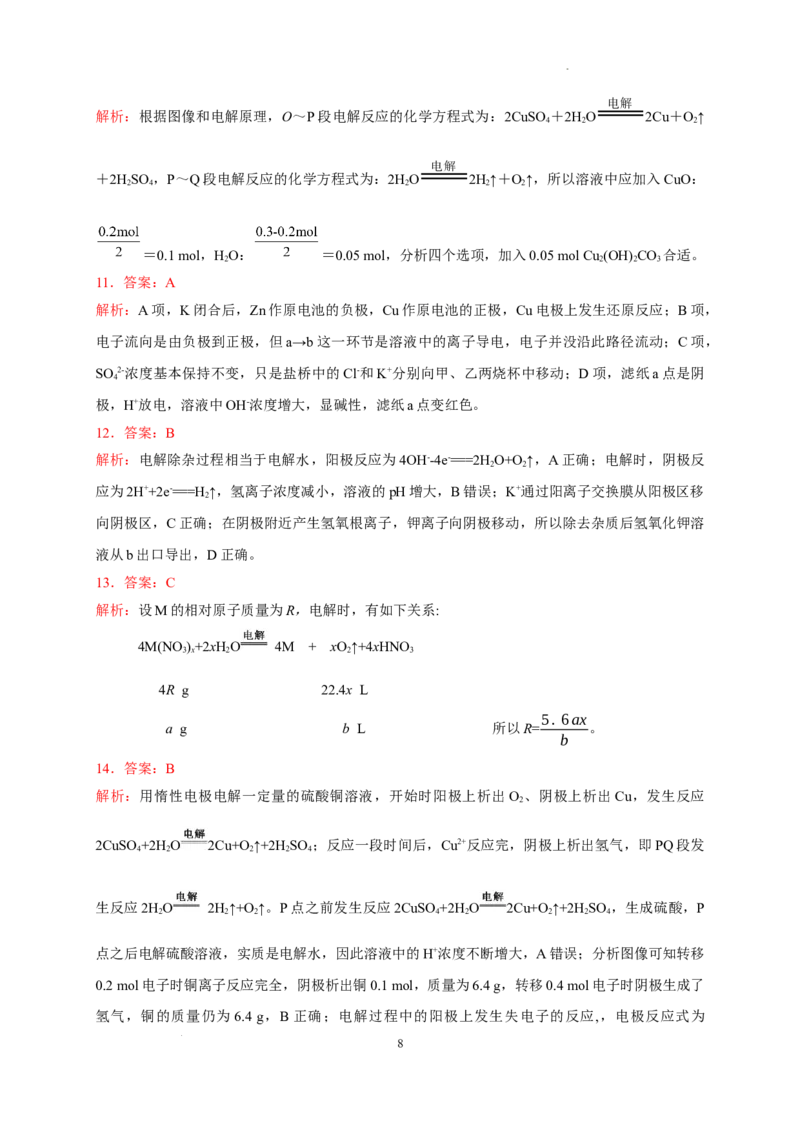
18.(10分)如图甲所示,A为新型高效的甲烷燃料电池,采用铂为电极材料,两电极上分别通入
CH 和O ,电解质溶液为KOH溶液。B为浸透饱和硫酸钠溶液和酚酞溶液的滤纸,滤纸中央
4 2
滴有一滴KMnO 溶液,C、D为电解槽。
4
(1)甲烷燃料电池中负极反应式为___________________________________________。
(2)关闭K,打开K,通电后,B中的紫红色液滴向d端移动,则电源a端为________极,通电
1 2
一段时间后,观察到滤纸c端出现的现象是________________________________________。
5
学科网(北京)股份有限公司(3)D装置中有200 mL一定浓度的NaCl与CuSO 的混合溶液,闭合K 、打开K 后理论上两极
4 2 1
所得气体的体积随时间变化的关系如图乙所示(气体体积已换算成标准状况下的体积,电解前
后溶液的体积变化忽略不计),则原混合溶液中NaCl的物质的量浓度为________mol·L-1,t s
2
时所得溶液的pH=________。
(4)若C装置中溶液为AgNO 溶液且足量,电池总反应的离子方程式为___________________。
3
电解结束后,为了使溶液恢复原样,则可以在反应后的溶液中加入________(填化学式)。
19.(10分)如下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量
的CuSO 溶液和100 g 10.00%的KSO 溶液,电极均为石墨电极。
4 2 4
(1)接通电源,经过一段时间后,测得丙中KSO 浓度为10.47%,乙中c电极质量增加,据此回
2 4
答问题:
①电源的N端为________极;
②电极b上发生的电极反应为:________;
③列式计算电极b上生成的气体在标准状态下的体积:________;
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化?简述其原因:
甲溶液____________________________________________________________________;
乙溶液____________________________________________________________________;
丙溶液____________________________________________________________________。
(2)如果电解过程中铜全部析出,此时电解能否继续进行?为什么?
1.答案:B
解析:电解质溶液导电发生了氧化还原反应,是化学变化;金属导电仅是电子的定向移动,是物理
变化。电解池的两极只要能导电即可。
2.答案:D
解析:电解池要有外接电源,形成闭合回路。
3.答案:D
解析:a、b电极分别为电解池的阴极和阳极,其电极反应分别是4H++4e-===2H ↑和4OH--4e-
2
===O ↑+2HO;即a极气体体积比b极大。a极和b极溶液分别显碱性和酸性,故可以看到a电极
2 2
附近呈蓝色,b电极附近呈红色。
4.答案:A
6
学科网(北京)股份有限公司解析:淀粉遇碘变蓝→b极生I ,即确定b极发生反应2I--2e-===I ,则b极是阳极,x是负极,y
2 2
是正极,a 极 H+放电,发生反应 2H++2e-===H ↑,产生氢气,U 形管中总反应式为 2KI+
2
2HO=====2KOH+H↑+I ,溶液的碱性增强,故A错误,B、D正确;石墨为阴极,铂为阳极,
2 2 2
电极反应分别是Cu2++2e-===Cu,4OH--4e-===2H O+O↑,C正确。
2 2
5.答案:D
解析:依据放电顺序阴极先放电的是Cu2+,故阴极开始析出的是Cu,阳极先放电的是Cl-,故阳
极开始产生的是Cl ,答案A、B错;由阴极反应Cu2++2e-===Cu,n(Cu2+)=0.1 mol,当电路中通
2
过电子的量达到0.2 mol时,此时Cu2+消耗完毕,阴极放电离子变为H+。所以C错;阳极先是Cl-
放电,当Cl-消耗完毕。此时HO电离产生的OH-开始在阳极放电,SO不参与电极反应。
2
6.答案:D
解析:a和b不连接时,铁片与Cu2+直接发生置换反应,有金属铜析出,A项正确。a和b用导线
连接时.该装置形成原电池,铜片作正极,铁片作负极失去电子形成 Fe2+,因此无论a和b是否连
接。铁片均会溶解,溶液均从蓝色逐渐变成浅绿色,所以 B、C项正确。若a和b分别连接直流电
源正、负极,a作阳极,铜片失去电子生成Cu2+,Cu2+向铁电极移动。
7.答案:A
解析:本题考查电解原理,意在考查考生对电化学基础知识融会贯通及正确复述、再现、辨认的能
力。由图可知,该装置为电解装置,由通电后Y中央的紫红色色斑向d端扩散知,d为阳极(MnO
向阳极移动),b为电源的正极,a为电源的负极。Y为浸透饱和食盐水和酚酞试液的滤纸,c点H+
放电,则OH-浓度增大,所以滤纸上c点附近会变红色,故A项正确;Cu电极上Cu2+得到电子生
成Cu,Pt电极上OH-失去电子,故Cu电极质量增大,Pt电极质量不变,B项错误;Pt电极上OH
-失去电子,故烧杯中溶液的pH减小,C项错误;Cu电极为阴极,Pt电极为阳极,烧杯中SO向Pt
电极定向移动,D项错误。
8.答案:B
解析:石墨作电极电解此溶液,当通电一段时间后,两极均收集到 22.4 L气体(标准状况),n(O )=
2
=1 mol,阳极发生2HO-4e-===O ↑+4H+,生成1 mol氧气转移4 mol电子,阴极发生Cu2++2e
2 2
-===Cu、2H++2e-===H ↑,生成1 mol氢气,转移2 mol电子,因此还要转移2 mol电子生成1
2
mol铜,电解得到的Cu的物质的量为1 mol,故A错误;根据电解原理和原子守恒,溶液中减少的
原子有铜、氧、氢,向电解后的溶液中加入 1 mol Cu(OH) ,可恢复为原溶液,质量为98 g,故B
2
正确;c(Cu2+)==2 mol·L-1,由电荷守恒可知,原混合溶液中c(K+)为6 mol·L-1-2 mol·L-1×2=2
mol·L-1,故C错误;开始电解时发生2Cu2++2HO=====2Cu+O↑+4H+,n(H+)=2n(Cu)=2×1
2 2
mol=2 mol,当Cu2+消耗完后,电解HNO 、KNO 溶液,实质上是电解水,n(H+)=2 mol不变,
3 3
电解后溶液中c(H+)为=4 mol·L-1,故D错误。
9.答案:D
解析:电子只能在外电路中移动,故A错误;a极产生O ,c极产生Cl ,根据电子守恒O ~2Cl ~
2 2 2 2
4e-,O 和Cl 的物质的量之比为1∶2,故B错误;阴离子向阳极移动,a和c是阳极,所以SO向
2 2
a电极移动,Cl-向c电极移动,C错误。
10.答案:D
7
学科网(北京)股份有限公司解析:根据图像和电解原理,O~P段电解反应的化学方程式为:2CuSO +2HO 2Cu+O↑
4 2 2
+2HSO ,P~Q段电解反应的化学方程式为:2HO 2H↑+O↑,所以溶液中应加入CuO:
2 4 2 2 2
=0.1 mol,HO: =0.05 mol,分析四个选项,加入0.05 mol Cu (OH) CO 合适。
2 2 2 3
11.答案:A
解析:A项,K闭合后,Zn作原电池的负极,Cu作原电池的正极,Cu电极上发生还原反应;B项,
电子流向是由负极到正极,但a→b这一环节是溶液中的离子导电,电子并没沿此路径流动;C项,
SO 2-浓度基本保持不变,只是盐桥中的Cl-和K+分别向甲、乙两烧杯中移动;D项,滤纸a点是阴
4
极,H+放电,溶液中OH-浓度增大,显碱性,滤纸a点变红色。
12.答案:B
解析:电解除杂过程相当于电解水,阳极反应为4OH--4e-===2HO+O↑,A正确;电解时,阴极反
2 2
应为2H++2e-===H↑,氢离子浓度减小,溶液的pH增大,B错误;K+通过阳离子交换膜从阳极区移
2
向阴极区,C正确;在阴极附近产生氢氧根离子,钾离子向阴极移动,所以除去杂质后氢氧化钾溶
液从b出口导出,D正确。
13.答案:C
解析:设M的相对原子质量为R,电解时,有如下关系:
4M(NO)+2xHO 4M + xO↑+4xHNO
3 x 2 2 3
4R g 22.4x L
5.6ax
a g b L 所以R= 。
b
14.答案:B
解析:用惰性电极电解一定量的硫酸铜溶液,开始时阳极上析出O 、阴极上析出Cu,发生反应
2
2CuSO +2H O 2Cu+O ↑+2H SO ;反应一段时间后,Cu2+反应完,阴极上析出氢气,即PQ段发
4 2 2 2 4
生反应2HO 2H↑+O ↑。P点之前发生反应2CuSO +2H O 2Cu+O ↑+2H SO ,生成硫酸,P
2 2 2 4 2 2 2 4
点之后电解硫酸溶液,实质是电解水,因此溶液中的H+浓度不断增大,A错误;分析图像可知转移
0.2 mol电子时铜离子反应完全,阴极析出铜0.1 mol,质量为6.4 g,转移0.4 mol电子时阴极生成了
氢气,铜的质量仍为6.4 g,B正确;电解过程中的阳极上发生失电子的反应,,电极反应式为
8
学科网(北京)股份有限公司2HO-4e-===4H++O ↑,C错误;到Q点时收集到的混合气体为氢气和氧气,P点1.12 L(标准状况下)
2 2
气体为O ,由电解水的反应可知PQ段生成的3.36 L(标准状况下)气体中H 的体积为2.24 L、O 的
2 2 2
体积为1.12 L,则Q点收集到的气体中H 和O 体积比为1∶1,D错误。
2 2
15.答案:A
解析:由a极生成O 可以判断出a极为阳极,b为阴极,阳离子向阴极流动。则H+由a极区向b极
2
区迁移,故A正确;电极b上发生还原反应,电极反应式为CO +8HCO+8e-===CH +8CO+
2 4
2HO,故B错误;电解过程中是电能转化为化学能,故C错误;电解时OH-比SO更容易失去电
2
子,所以电解NaSO 溶液的实质是电解水,溶液中的水发生消耗,所以NaSO 溶液的浓度是增大
2 4 2 4
的,故D错误。
16.答案:(1)负 电解 2Cl--2e-===Cl↑ Ag++e-===Ag (2)0.025 mol·L-1 (3)13
2
解析:(1)根据已知条件通电5 min后,电极5的质量增加2.16 g,说明电极5作阴极,Ag+放电,电
极反应为Ag++e-===Ag,转移电子的物质的量为0.02 mol,同时可知电极6作阳极,与电源的正
极相连。则a是负极,b是正极,电极1、3、5作阴极,电极2、4、6作阳极。(2)B池中电解总反
应为2CuSO +2HO=====2Cu+O↑+2HSO ,若转移0.02 mol电子时只收集到O(只电解溶质),
4 2 2 2 4 2
则根据关系式2CuSO ~O ~4e-可得n(O )=0.005 mol,体积为112 mL(标准状况)<224 mL,说明溶
4 2 2
质CuSO 已耗完,然后电解水。设整个过程消耗CuSO x mol,HO y mol,则有2x+2y=0.02,x
4 4 2
+y=0.01,解得x=y=0.005 mol,则c(CuSO )=0.025 mol·L-1。(3)由于A池中电解液足量,A池
4
中只发生反应2NaCl+2HO=====2NaOH+H↑+Cl↑,根据关系式NaOH~e-,生成的n(NaOH)=
2 2 2
0.02 mol,则c(NaOH)==0.1 mol·L-1,即溶液的pH=13。
17.答案:(1)①负 ②阳 ③←
(2)①2Cl--2e-===Cl↑ ②2NaCl+2HO=====2NaOH+H↑+Cl↑
2 2 2 2
③Cu-2e-===Cu2+
解析:d极附近显红色,说明d为阴极,电极反应式为2H++2e-===H ↑,c为阳极,电极反应式为
2
2Cl--2e-===Cl↑,Y槽电解NaCl溶液的总反应方程式为2NaCl+2HO=====2NaOH+Cl↑+
2 2 2
H↑;直流电源中a为正极,b为负极,Z槽中f为阴极,e为阳极,电极反应式为Cu-2e-===Cu2
2
+,电子流动方向由e→d。
18.答案:(1)CH +10OH--8e-===CO+7HO (2)负 c端试纸变红 (3)0.1 1
4 2
(4)4Ag++2HO=====4Ag+O↑+4H+ Ag O或Ag CO
2 2 2 2 3
解析:(1)甲烷燃料电池的电解质溶液为KOH溶液,负极上CH 失电子被氧化,电极反应式为CH
4 4
+10OH--8e-===CO+7HO。(2)关闭K ,打开K ,燃料电池A和电解池B组成串联电路,B中
2 1 2
紫红色液滴向d端移动,说明MnO向d移动,则d为阳极,从而推知a为电源的负极,b为正极;
c为阴极,电极反应式为2HO+2e-===2OH-+H↑,c端溶液呈碱性,酚酞遇碱溶液变成红色。(3)
2 2
阳极上先后发生反应:2Cl--2e-===Cl↑、2HO-4e-===4H++O↑,由题图乙可知,t s时,Cl-
2 2 2 1
放电完毕,得到224 mL Cl (标准状况),则有n(NaCl)=n(Cl-)=2n(Cl )==0.02 mol,故原混合液中
2 2
c(NaCl)==0.1 mol·L-1。0~t s阴极反应式为Cu2++2e-===Cu,t~t s生成112 mL O(标准状况),
2 1 2 2
n(O )==5×10-3 mol,结合阳极反应式可知,反应生成n(H+)=4n(O )=4×5×10-3 mol=0.02 mol,
2 2
9
学科网(北京)股份有限公司则t s时所得溶液中c(H+)==0.1 mol·L-1,故溶液的pH=1。(4)利用Pt电极电解AgNO 溶液时,
2 3
阳极上OH-放电,阴极上Ag+放电,电池总反应为4Ag++2HO=====4Ag+O↑+4H+。为使电解
2 2
质溶液复原,可向电解后的溶液中加入Ag O或Ag CO。
2 2 3
19.答案:(1)①正 ②4OH-4e-===2H O+O↑ ③水减少的质量为:100 g×(1-)≈4.5 g,生成O
2 2 2
的体积为:××22.4 L·mol-1=2.8 L ④16 ⑤碱性增大,因为电解后,水量减少,溶液中NaOH浓
度增大 酸性增大,因为阳极上OH-生成O ,溶液中H+浓度增加 酸碱性大小没有变化,因为
2
KSO 是强酸强碱盐,浓度增加不影响溶液的酸碱性 (2)能继续进行,因为CuSO 溶液已转变为
2 4 4
HSO 溶液,反应也就变为水的电解反应。
2 4
解析:(1)①乙中c电极质量增加,则c处发生的反应为Cu2++2e-===Cu,即c为阴极,由此可推
出b为阳极,a为阴极,M为负极,N为正极。丙中为KSO 溶液,相当于电解水,设电解的水的
2 4
质量为x,由电解前后溶质质量相等有:100 g×10.00%=(100 g-x)×10.47%,得x≈4.5 g,故为0.25
mol,整个反应中转移0.5 mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相
等的。②甲中相当于电解HO,阳极b处为阴离子OH-放电,即4OH--4e-===2H O+O↑。③转
2 2 2
移 0.5 mol 电子。则生成 O 的物质的量为 0.5 mol÷4=0.125 mol,标准状况下的体积为 0.125
2
mol×22.4 L·mol-1=2.8 L。④Cu2++2e-===Cu,转移0.5 mol电子,则生成m(Cu)=×64 g·mol-1=
16 g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大;乙中阴极为Cu2+放电,阳极为OH-
放电,所以H+增多,故pH减小;丙中为电解水,对于KSO 而言,其pH几乎不变。(2)铜全部析
2 4
出后,可以继续电解水。
10
学科网(北京)股份有限公司11
学科网(北京)股份有限公司