文档内容
高中化学人教版(2019)选择性必修1 第四章测试卷
一、单选题
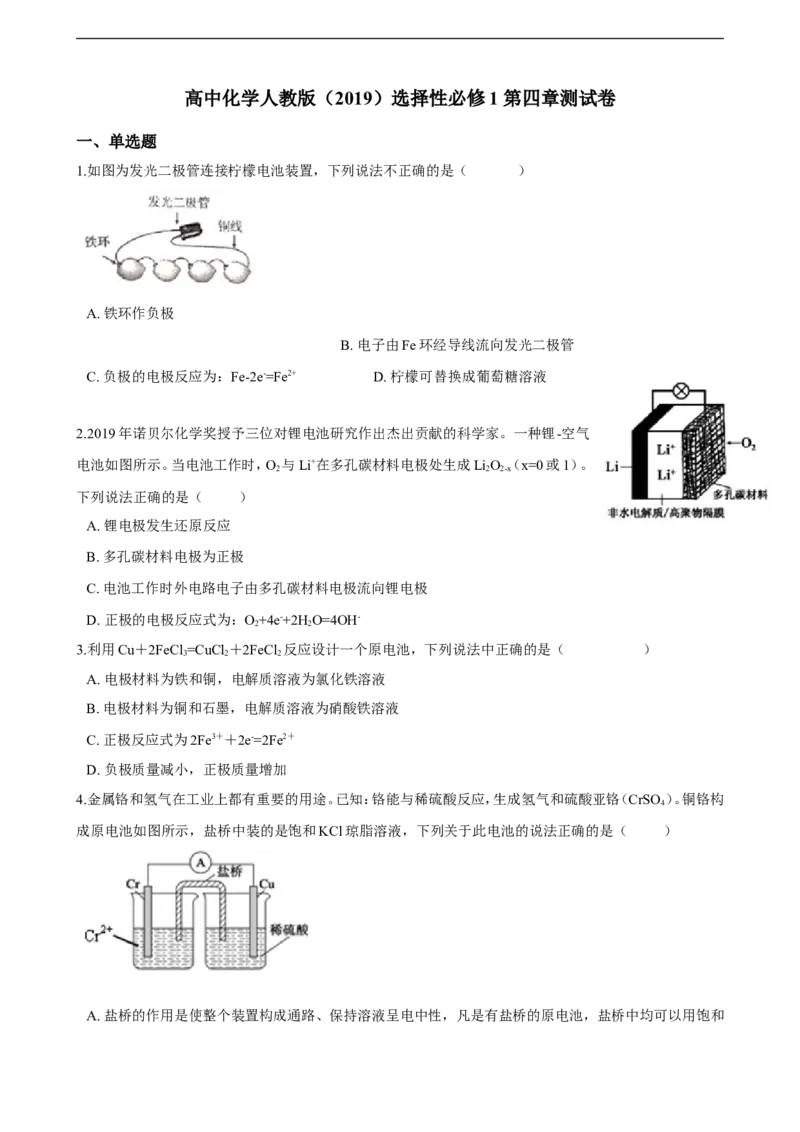
1.如图为发光二极管连接柠檬电池装置,下列说法不正确的是( )
A. 铁环作负极
B. 电子由Fe环经导线流向发光二极管
C. 负极的电极反应为:Fe-2e-=Fe2+ D. 柠檬可替换成葡萄糖溶液
www.21-cn-
jy.com
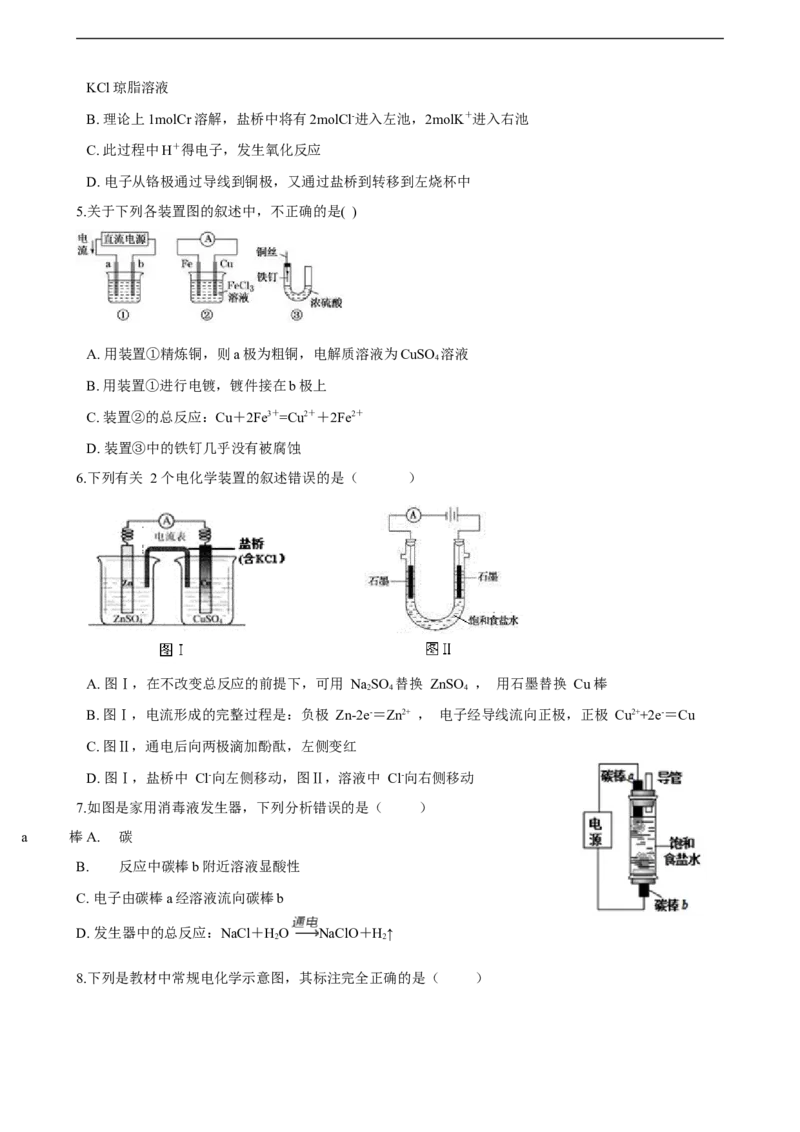
2.2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气
电池如图所示。当电池工作时,O 与Li+在多孔碳材料电极处生成LiO (x=0或1)。
2 2 2-x
下列说法正确的是( )
A. 锂电极发生还原反应
B. 多孔碳材料电极为正极
C. 电池工作时外电路电子由多孔碳材料电极流向锂电极
D. 正极的电极反应式为:O+4e-+2H O=4OH-
2 2 21*cnjy*com
3.利用Cu+2FeCl =CuCl +2FeCl 反应设计一个原电池,下列说法中正确的是( )
3 2 2
A. 电极材料为铁和铜,电解质溶液为氯化铁溶液
B. 电极材料为铜和石墨,电解质溶液为硝酸铁溶液
C. 正极反应式为2Fe3++2e-=2Fe2+
D. 负极质量减小,正极质量增加
21*cnjy*com
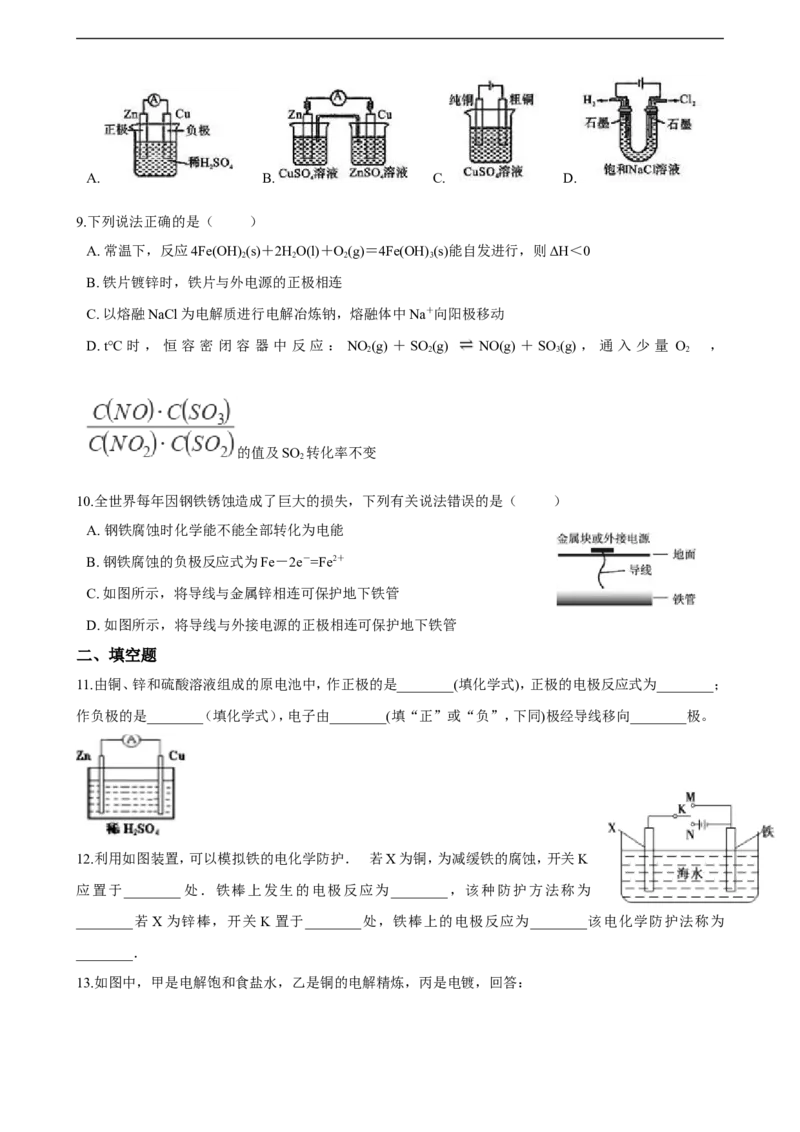
4.金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO )。铜铬构
4
成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )
A. 盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B. 理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C. 此过程中H+得电子,发生氧化反应
D. 电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
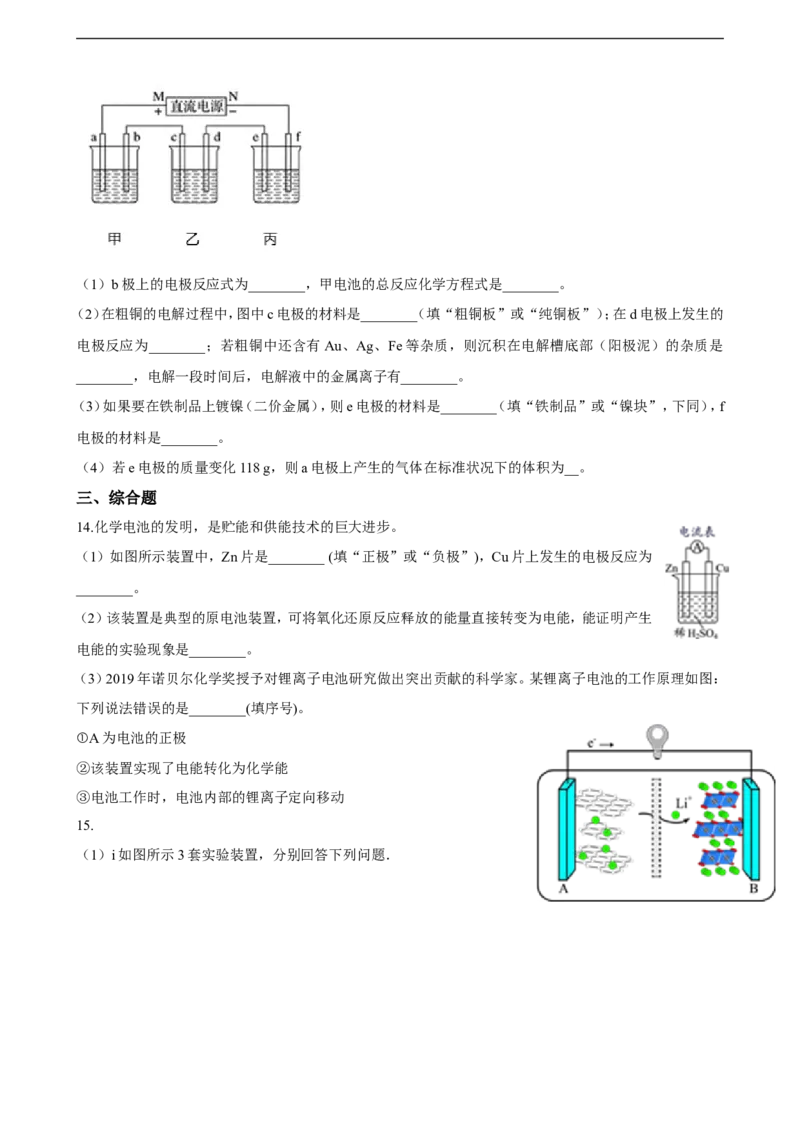
5.关于下列各装置图的叙述中,不正确的是( )
A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO 溶液
4
B. 用装置①进行电镀,镀件接在b极上
C. 装置②的总反应:Cu+2Fe3+=Cu2++2Fe2+
D. 装置③中的铁钉几乎没有被腐蚀
21世纪教育网版权所有
6.下列有关 2 个电化学装置的叙述错误的是( )
A. 图Ⅰ,在不改变总反应的前提下,可用 NaSO 替换 ZnSO , 用石墨替换 Cu 棒
2 4 4
B. 图Ⅰ,电流形成的完整过程是:负极 Zn-2e-=Zn2+ , 电子经导线流向正极,正极 Cu2++2e-=Cu
C. 图Ⅱ,通电后向两极滴加酚酞,左侧变红
D. 图Ⅰ,盐桥中 Cl-向左侧移动,图Ⅱ,溶液中 Cl-向右侧移动
7.如图是家用消毒液发生器,下列分析错误的是( )
极 阴 是 a 棒A. 碳
B. 反应中碳棒b附近溶液显酸性
C. 电子由碳棒a经溶液流向碳棒b
D. 发生器中的总反应:NaCl+HO NaClO+H↑
2 2
8.下列是教材中常规电化学示意图,其标注完全正确的是( )A. B. C. D.
9.下列说法正确的是( )
A. 常温下,反应4Fe(OH) (s)+2HO(l)+O(g)=4Fe(OH) (s)能自发进行,则ΔH<0
2 2 2 3
B. 铁片镀锌时,铁片与外电源的正极相连
C. 以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动
D. t℃ 时 , 恒 容 密 闭 容 器 中 反 应 : NO (g) + SO (g) NO(g) + SO (g) , 通 入 少 量 O ,
2 2 3 2
的值及SO 转化率不变
2 2-1-c-n-j-y
10.全世界每年因钢铁锈蚀造成了巨大的损失,下列有关说法错误的是( )
A. 钢铁腐蚀时化学能不能全部转化为电能
B. 钢铁腐蚀的负极反应式为Fe-2e-=Fe2+
C. 如图所示,将导线与金属锌相连可保护地下铁管
D. 如图所示,将导线与外接电源的正极相连可保护地下铁管
二、填空题
11.由铜、锌和硫酸溶液组成的原电池中,作正极的是________(填化学式),正极的电极反应式为________;
作负极的是________(填化学式),电子由________(填“正”或“负”,下同)极经导线移向________极。
12.利用如图装置,可以模拟铁的电化学防护. 若X为铜,为减缓铁的腐蚀,开关K
应置于________ 处.铁棒上发生的电极反应为________,该种防护方法称为
________若X为锌棒,开关K置于________处,铁棒上的电极反应为________该电化学防护法称为
________.
13.如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:(1)b极上的电极反应式为________,甲电池的总反应化学方程式是________。
(2)在粗铜的电解过程中,图中c电极的材料是________(填“粗铜板”或“纯铜板”);在d电极上发生的
电极反应为________;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是
________,电解一段时间后,电解液中的金属离子有________。
(3)如果要在铁制品上镀镍(二价金属),则e电极的材料是________(填“铁制品”或“镍块”,下同),f
电极的材料是________。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
三、综合题
14.化学电池的发明,是贮能和供能技术的巨大进步。
(1)如图所示装置中,Zn片是________ (填“正极”或“负极”),Cu片上发生的电极反应为
________。
(2)该装置是典型的原电池装置,可将氧化还原反应释放的能量直接转变为电能,能证明产生
电能的实验现象是________。
(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图:
下列说法错误的是________(填序号)。
①A为电池的正极
②该装置实现了电能转化为化学能
③电池工作时,电池内部的锂离子定向移动
15.
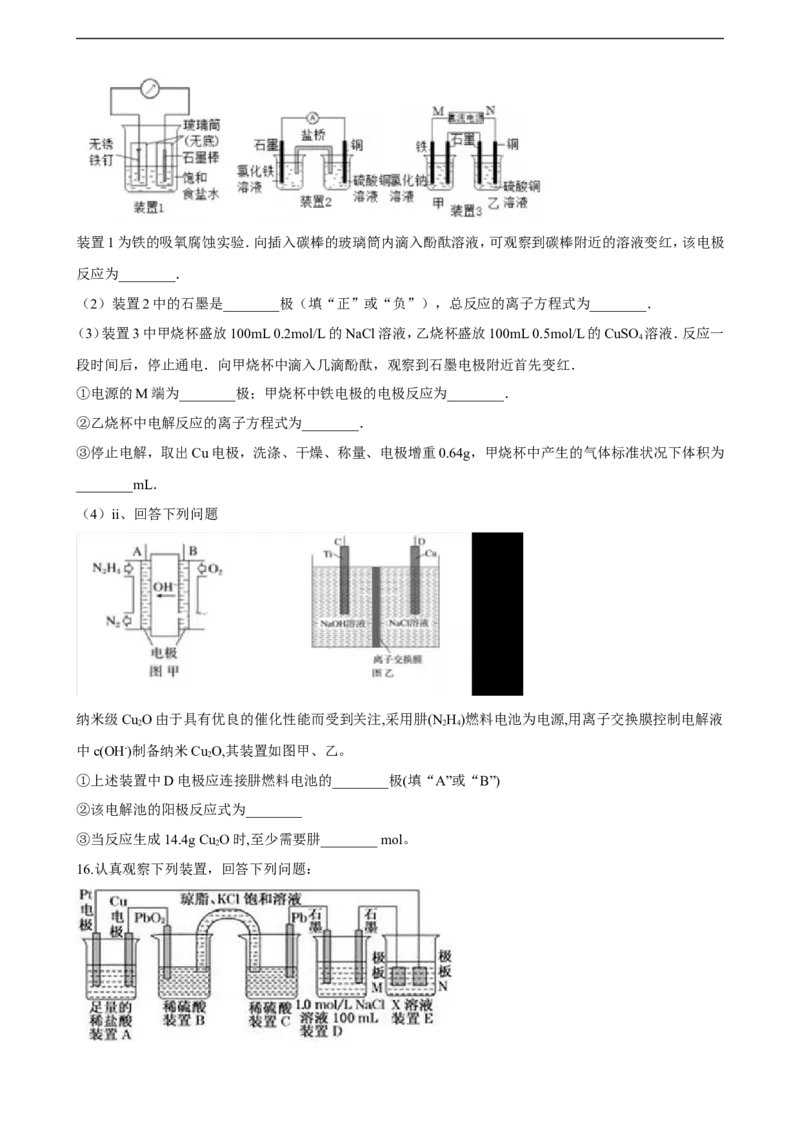
(1)i如图所示3套实验装置,分别回答下列问题.装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极
反应为________.
21·世纪*教育网
(2)装置2中的石墨是________极(填“正”或“负”),总反应的离子方程式为________.
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO 溶液.反应一
4
段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为________极;甲烧杯中铁电极的电极反应为________.
②乙烧杯中电解反应的离子方程式为________.
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为
________mL.
(4)ii、回答下列问题
纳米级Cu O由于具有优良的催化性能而受到关注,采用肼(N H)燃料电池为电源,用离子交换膜控制电解液
2 2 4
中c(OH-)制备纳米Cu O,其装置如图甲、乙。
2
①上述装置中D电极应连接肼燃料电池的________极(填“A”或“B”)
②该电解池的阳极反应式为________
③当反应生成14.4g Cu O时,至少需要肼________ mol。
2
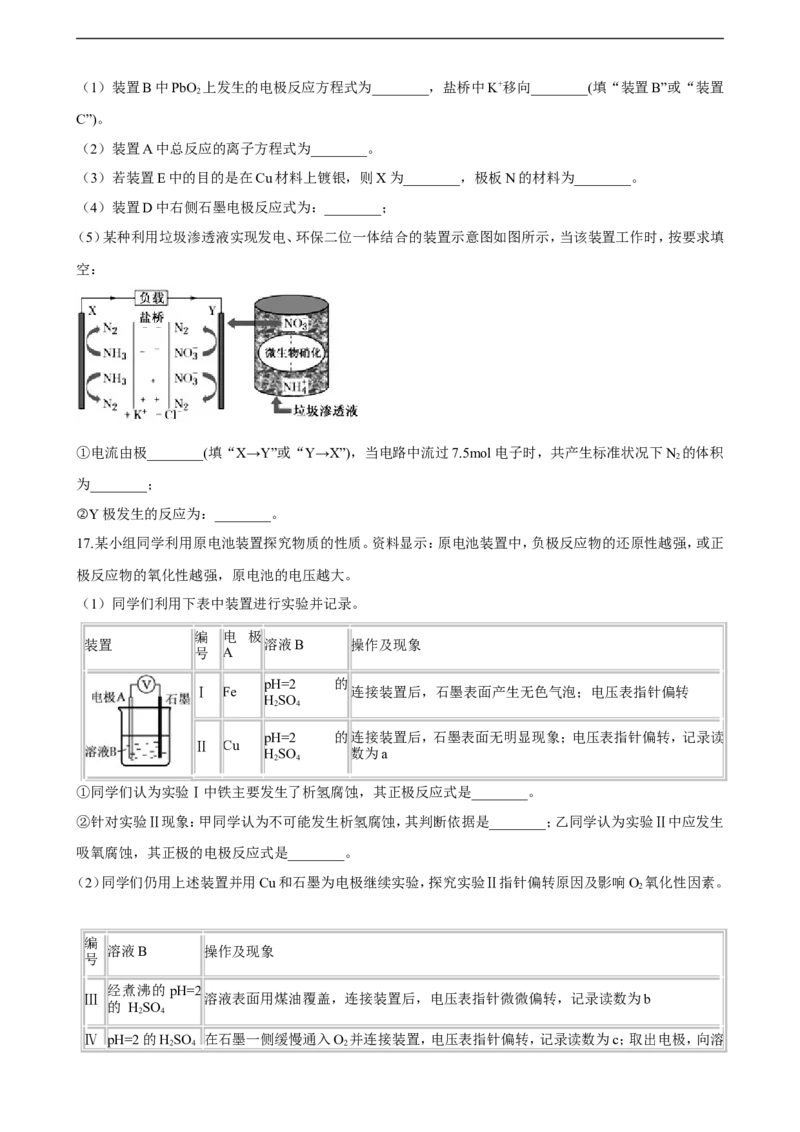
16.认真观察下列装置,回答下列问题:(1)装置B中PbO 上发生的电极反应方程式为________,盐桥中K+移向________(填“装置B”或“装置
2
C”)。
(2)装置A中总反应的离子方程式为________。
(3)若装置E中的目的是在Cu材料上镀银,则X为________,极板N的材料为________。
(4)装置D中右侧石墨电极反应式为:________;
(5)某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如图所示,当该装置工作时,按要求填
空:
①电流由极________(填“X→Y”或“Y→X”),当电路中流过7.5mol电子时,共产生标准状况下N 的体积
2
为________;
②Y极发生的反应为:________。
17.某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正
极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
编 电 极
装置 溶液B 操作及现象
号 A
pH=2 的
Ⅰ Fe 连接装置后,石墨表面产生无色气泡;电压表指针偏转
HSO
2 4
pH=2 的连接装置后,石墨表面无明显现象;电压表指针偏转,记录读
Ⅱ Cu
HSO 数为a
2 4
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是________;乙同学认为实验Ⅱ中应发生
吸氧腐蚀,其正极的电极反应式是________。
21教育网
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O 氧化性因素。
2
2·1·c·n·j·y
编
溶液B 操作及现象
号
经煮沸的pH=2
Ⅲ 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
的 HSO
2 4
Ⅳ pH=2的HSO 在石墨一侧缓慢通入O 并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶
2 4 2液中加入数滴浓NaSO 溶液混合后,插入电极,保持O 通入,电压表读数仍为c
2 4 2
pH=12 的
Ⅴ 在石墨一侧缓慢通入O 并连接装置,电压表指针偏转,记录读数为d
NaOH 2
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究________对O 氧化性的影响;实验Ⅳ中加入NaSO 溶液的目的
2 2 4
是________。答案解析部分
一、单选题
1. D
解析:A.铁比铜活泼,故铁做负极,A不符合题意
B.电子由导线从负极流向正极,B不符合题意
C.负极的反应为 Fe-2e-=Fe2+ ,故C不符合题意
D.葡萄糖为非电解质,不能替换,故D符合题意
故答案为:D
原电池必须要有电解质溶液。
2. B
解析:A.由锂-空气电池示意图可知,锂电极为原电池的负极,锂失去电子发生氧化反应生成锂离子,故A不
符合题意;
B.得到电子的一极为原电池的正极,由氧元素化合价的变化可知,通入氧气的多孔碳材料电极为原电池的
正极,氧气在正极上得到电子发生还原反应生成LiO , 故B符合题意;
2 2-x
C.电池工作时外电路电子由负极流向正极,由锂-空气电池示意图可知,锂电极为原电池的负极,通入氧气
的多孔碳材料电极为原电池的正极,则电子由锂电极流向多孔碳材料电极,故C不符合题意;
D.由氧元素化合价的变化可知,通入氧气的多孔碳材料电极为原电池的正极,氧气在正极上得到电子发生
还原反应生成LiO , 电极反应式为:(2-x)O+4e-+ 4Li+=2 Li O , 故D不符合题意;
2 2-x 2 2 2-x
故答案为:B。
Li做负极,发生反应为锂失去电子变成锂离子
氧气作正极,发生反应为氧气得到电子结合锂离子生成氧化锂
3. C
解析:该原电池的总反应可分为两个电极反应,负极:Cu-2e-=Cu2+ , 正极:2Fe3++2e-=2Fe2+。铜作负极,
其质量不断减小;活动性比铜弱的金属或导电非金属作正极,其质量不变;氯化铁溶液为电解质溶液。
A. 若电极材料为铁和铜,铁比铜活泼,铁做负极,铜做正极,与分析不符,故A不符合题意;
B. 利用Cu+2FeCl =CuCl +2FeCl 反应设计一个原电池,电解质溶液为氯化铁溶液,故B不符合题意;
3 2 2
C. 根据分析,正极反应式为2Fe3++2e-=2Fe2+ , 故C符合题意;
D. 根据分析,负极质量减小,正极质量不变,故D不符合题意;
故答案为:C。A、电极材料为铁和铜,则负极为铁,故A不符合题意
B、若为硝酸铁,则为铜与硝酸铁反应而不是氯化铁,电解质溶液为氯化铁,故B不符合题意
D、负极质量减小,正极质量不变,故D不符合题意。
4. B
解析:【解答】A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,盐桥中的离子不能和电解质溶液
反应,所以盐桥不一定均可以用饱和KCl琼脂溶液,A项不符合题意;
B.理论上1molCr溶解,则转移2mol电子生成1molCr2+ , 同时消耗2mol氢离子,所以根据溶液的电中性
可知盐桥中将有2molCl-进入左池,2molK+进入右池,B项符合题意;
C.此过程中H+得电子,发生还原反应,C项不符合题意;
D.电子不能在溶液中传递,D项不符合题意。
故答案为:B。
铜铬构成原电池,由于铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO ),这说明铬电极是负极,铜电极是
4
正极,氢离子放电,所以盛稀硫酸烧杯中的现象为铜电极上有气泡产生。
5. C
解析:A.①中根据电流流向可知,a为阳极,b为阴极,电解精炼铜时,阳极为粗铜,故A不符合题意
21cnjy.com
B.电镀时,镀件为阴极,故B不符合题意
C.铁和铜,铁作负极,故总反应为铁和铁离子反应,生成亚铁离子,故C符合题意
D.铁和铜,在浓硫酸中,铁在冷的浓硫酸中发生钝化,故D不符合题意
故答案为:C
C中铁比铜活泼,故发生反应的是铁,保护了铜
6. B
解析:A.将图Ⅰ中的ZnSO 替换为NaSO , 对左侧区反应无影响,将Cu棒替换为石墨棒,仍然时锌为负
4 2 4
极,Cu为正极,故并不改变总反应,故A不符合题意;
【出处:21教育名师】
B.图Ⅰ中电流形成的完整过程是:负极Zn-2e-=Zn2+ , 外电路中电子经导线流向正极,正极Cu2++2e-=
Cu,内电路的盐桥中的阴离子移向负极,阳离子移向正极,故B符合题意;
C.图Ⅱ中左侧区时阴极,电极反应为 ,故阴极区显碱性,加酚酞后溶液变红,故C
不符合题意;
D.图Ⅰ中左侧为负极,故盐桥中Cl-向左侧移动,图Ⅱ中右侧时阳极,故溶液中Cl-向右侧移动,故D不符合
题意;
故答案为:B。完整过程还应该包括盐桥当中的阴阳离子移动
7. C
解析:A.由以上分析知,碳棒a是阴极,A不符合题意;
B.反应中碳棒b附近生成Cl , Cl+H O=H++Cl- +HClO,溶液显酸性,B不符合题意;
2 2 2
C.电子不能经过溶液流动,只能沿导线移动,C符合题意;
D.发生器中发生反应:2NaCl+2H O 2NaOH+Cl ↑+H ↑,Cl+2NaOH NaCl+NaClO+H O,总反应为
2 2 2 2 2
NaCl+HO NaClO+H↑,D不符合题意;
2 2 【来源:21·世纪·教育·网】
故答案为:C。
家用消毒液发生器制取NaClO,所以a电极应生成OH-和H , b电极应生成Cl , 由此确定b电极为阳极,
2 2
发生反应2Cl--2e- =Cl↑;a电极为阴极,发生反应2HO+2e- =2OH- +H ↑。
2 2 2
8. D
解析:A.该装置中发生的反应为Zn+2H+=Zn2++H↑,Zn发生失电子的氧化反应,为负极,铜为正极,A不
2
符合题意;
B.该原电池装置中,Zn电极所在的电解质溶液应为ZnSO 溶液,Cu电极所在的电解质溶液应为CuSO 溶液,
4 4
B不符合题意;
C.电解精练铜时,纯铜做阴极,与电源负极相连,粗铜做阳极,与电源正极相连,C不符合题意;
D.电解饱和NaCl溶液时,HO电离产生的H+在阴极发生得电子的还原反应生成H , Cl-在阳极发生失电
2 2
子的氧化反应,生成Cl , D符合题意;
2 21教育名师原创作品
故答案为:D
此题是对原电池、电解池装置的考查,结合原电池、电解池装置的形成进行分析。
9. A
解析:A.反应能自发进行,则ΔH-TΔS<0,由于该反应中ΔS<0,因此要使反应能自发进行,则ΔH<0,A符合
题意;
B.往铁片上镀锌时,铁片为镀件,做阴极,与电源的负极相连,锌为镀层金属,做阳极,与电源的正极相连,B
不符合题意;
C.电解池中,阳离子移向阴极,因此Na+向阴极移动,C不符合题意;
D. 为反应的平衡常数,只与温度有关,因此通入O , 值不变,通入O 后,
2 2
NO能与O 反应生成NO , 因此平衡正向移动,SO 的转化率增大,D不符合题意;
2 2 2故答案为:A
A.根据反应自发进行的条件进行分析;
B.根据电镀分析;
C.根据电解池中离子移动方向分析;
D.根据平衡常数和平衡移动分析;
10. D
解析:A. 钢铁腐蚀时,化学能不能全部转化为电能,还转化为热能,故A不符合题意;
B.钢铁腐蚀时,铁作负极被损耗,电极反应式为Fe-2e-=Fe2+ , 故B不符合题意;
C.锌的金属性强于铁,锌、铁和电解质溶液可形成原电池,锌作负极,铁作正极,锌的腐蚀可保护地下铁管,
故C不符合题意;
www-2-1-cnjy-com
D.采用外加电流的阴极保护法时,被保护金属与直流电源的负极相连,与外加直流电源的正极相连,地下
铁管作阳极,更易被腐蚀,故D符合题意;
故答案为:D。
地下铁管易被腐蚀是因为在潮湿的土壤中形成了原电池而被腐蚀,要保护地下铁管不被腐蚀,则钢管应该
与电源的负极相连或作原电池的正极。
二、填空题
11. Cu; ;Zn;负;正
解析:铜、锌和硫酸溶液组成原电池,反应原理为 ,锌作负极失电子发生氧化反应,
铜作正极,氢离子在正极发生得电子的还原反应产生氢气,电极反应式: ,电子由负极锌流
出,经导线流向正极铜。
故答案为:Cu; ;Zn;负;正。
(1)电极反应式的书写要遵循电荷守恒;
(2)原电池中,活泼性强的金属做负极;
(3)电子的流动方向:负极向正极移动。
【版权所有:21教育】
12.N;2H++2e﹣=H ↑;外接电源的阴极保护法;M;O+4e﹣+2H O=4OH﹣;牺牲阳极的阴极保护法
2 2 2 【来源:
21cnj*y.co*m】
解析:解:若X为铜,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe为电解池的阴极,故K连接N处,铁棒为
阴极,发生的电极反应为2H++2e﹣=H ↑,该种防护方法称为外接电源的阴极保护法; 若X为锌,开关K置
2于M处,Zn为负极被腐蚀,Fe为正极被保护,正极反应为:O+4e﹣+2H O=4OH﹣ , 该防护法称为牺牲阳极
2 2
的阴极保护法;
故答案为:N;2H++2e﹣=H ↑;外接电源的阴极保护法;M;O+4e﹣+2H O=4OH﹣;牺牲阳极的阴极保护法.
2 2 2
若X为铜,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极;若X为锌,开关K置于M处,形
成原电池,Zn为负极被腐蚀,Fe为正极被保护.
13. (1)2H++2e﹣=H ↑;2NaCl+2H O 2NaOH+Cl ↑+H ↑
2 2 2 2
(2)粗铜板;Cu2++2e﹣=Cu;Au、Ag;Cu2+、Fe2+
(3)镍块;铁制品
(4)44.8L
解析:(1)甲是电解饱和食盐水,M为正极,则a为阳极发生氧化反应,b为阴极发生还原反应,电极反应式为
2H++2e-=H ↑,电解饱和食盐水生成氢气、氯气和氢氧化钠,总反应化学方程式为 2NaCl+2H O
2 2
2NaOH+Cl ↑+H ↑,故答案为:2H++2e-=H ↑;2NaCl+2H O 2NaOH+Cl ↑+H ↑;
2 2 2 2 2 2
(2)用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极,该装置中M为原电池的正极,N为原电池的负极,
所以c为电解池的阳极,d为电解池的阴极,电解时,以硫酸铜溶液为电解液,溶液中的Cu2+得到电子在阴极
上发生还原反应,即Cu2++2e-=Cu;作阳极的粗铜中的铜以及比铜活泼的金属失去电子进入溶液,所以Fe发
生Fe-2e-═Fe2+反应,以Fe2+的形式进入溶液中;比铜不活泼的金属Au、Ag不会失去电子,以单质的形成沉
入电解槽形成“阳极泥”,则沉积在电解槽底部(阳极泥)的杂质是Au、Ag,电解一段时间后,电解液中的金
属离子有Cu2+、Fe2+ , 故答案为:粗铜板;Cu2++2e-=Cu;Au、Ag;Cu2+、Fe2+;
(3)要在铁制品上镀镍(二价金属),则铁作阴极与电源负极N相连即f极,镍为阳极与电源正极M相连即e
极,故答案为:镍块;铁制品
(4)若e电极的质量变化118g,根据转移电子数相等,Ni~2e-~Cl , 则a电极上产生的气体在标准状况下
2
的体积为 ×22.4L/mol=44.8L,故答案为:44.8L。
(1)b为电解池的阴极,发生氢离子的还原反应;甲池电解饱和氯化钠溶液生成氢氧化钠、氯气和氢气;
(2)c是阳极,应为粗铜,d为阴极发生铜离子的还原反应;
(3)e是阳极,电镀时应为镀层金属;f为阴极,应为镀件;
(4)根据电子守恒进行计算即可。
三、综合题
14. (1)负极;2H++2e-=H ↑
2(2)电流表指针发生偏转
(3)①②
解析:【解答】(1)由图可知,活泼金属锌做原电池的负极,不活泼金属铜做原电池的正极,氢离子在正极上得
到电子发生还原反应生成氢气,电极反应式为2H++2e-=H ↑,故答案为:负极;2H++2e-=H ↑;(2)由图可知,该
2 2
装置为铜锌硫酸原电池,该装置实现了电能转化为化学能,能证明产生电能的实验现象为电流表指针发生
偏转,故答案为:电流表指针发生偏转;(3)由图给示意图可知,该装置为原电池,由电子和锂离子的移动方
向可知,A电极为电源的负极,B为电源的正极,电池工作时,锂离子向正极B电极移动,则①②不正确,故
答案为:①②。
21·cn·jy·com
(1)由图可知,活泼金属锌做原电池的负极,不活泼金属铜做原电池的正极;(2)由图可知,该装置为铜锌硫酸
原电池,该装置实现了电能转化为化学能;(3)由图给示意图可知,该装置为原电池,由电子和锂离子的移动
方向可知,A电极为电源的负极,B为电源的正极,电池工作时,锂离子向正极B电极移动。
15. (1)O+4e﹣+2H O═4OH﹣
2 2
(2)正;2Fe3++Cu═2Fe2++Cu2+
(3)正;Fe﹣2e﹣═Fe2+;2Cu2++2H O 2Cu+O ↑+4H+;224
2 2
(4)B;2Cu-2e-+2OH-=Cu O+HO;0.05
2 2
解析:(1)吸氧腐蚀,正极 O+4e﹣+2H O═4OH﹣
2 2
(2)石墨作正极,总反应为 2Fe3++Cu═2Fe2++Cu2+
(3) ①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红. 则石墨电极为阴极,铁为阳极,则M
为正极,铁电极区的电极反应为 Fe﹣2e﹣═Fe2+
②乙烧杯为电解硫酸铜溶液, 离子反应方程式为2Cu2++2H O 2Cu+O ↑+4H+
2 2
③Cu~H , 则n(H)=n(Cu)=0.01mol,V=nVm=224ml
2 2
(4)①制备氧化亚铜,则D为阳极,连接正极B
②阳极为Cu→Cu O, 2Cu-2e-+2OH-=Cu O+HO
2 2 2
③Cu O~2e-,NH~2N ~4e-,2Cu O~NH,n(NH)=0.5n(Cu O)=0.5*14.4/144=0.05mol
2 2 4 2 2 2 4 2 4 2
(1) 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红, 可知生成了OH-
(2)装置2为双液原电池,铜为负极,石墨为正极,总反应为2Fe3++Cu═2Fe2++Cu2+
( 3)① 反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红 ,放氢升碱,
则该极为阴极,连接的是电源负极N②乙烧杯中电解反应的离子方程式为 2Cu2++2H O 2Cu+O ↑+4H+
2 2
③根据电子守恒,写出关系式可求
( 4)电解质溶液为碱性,则配平离子方程式用的是OH-,又由Cu→Cu O,则铜作为阳极,根据转移电子守恒,
2
可求消耗肼的量
16. (1)PbO +2e-+4H++SO2- =PbSO +2H O;装置B
2 4 4 2
(2)Cu+2H+ Cu2++H ↑
2
(3)AgNO;Ag
3
(4)2Cl--2e-=Cl↑
2
(5)Y→X;44.8L;2NO +10e-+6H O=N↑+12OH-
2 2
解析:(1)根据分析,B和C构成铅蓄电池,属于原电池装置,铅蓄电池正极为PbO , 电极反应方程式为
2
PbO +2e-+4H++SO2-=PbSO+2H O,原电池中阳离子向正极移动,则盐桥中K+移向PbO 电极所在的装置移
2 4 4 2 2
动即向装置B移动;(2)根据分析,装置A为电解池,装置A中,Cu电极为阳极,电极反应为:Cu-2e-=Cu2+;Pt
电极为阴极,根据放电顺序,氢离子在阴极放电,电极反应为:2H++2e-=H ↑,则装置A中总反应的离子方程
2
式为Cu+2H+ Cu2++H ↑;(3)根据分析,装置E为电解池,其中M电极为阴极,N电极为阳极,若装置E中
2
的目的是在Cu材料上镀银,则银为镀层金属,Cu为镀件,电镀池中镀层金属作阳极,镀件作阴极,电解液要
含有镀层金属离子,则X为AgNO , 极板N的材料为Ag;(4)根据分析,装置D为电解池,其中右端的石
3
墨电极为阳极,电解质溶液为氯化钠溶液,阳极上阴离子放电,根据放电顺序,氯离子在阳极上放电,电极
反应式为:2Cl--2e-=Cl↑;(5)①根据分析可知,装置属于原电池装置,X是负极,Y是正极,电流从正极流向
2
负极,即电流由Y→X;X是负极,氨气发生失电子的氧化反应,电极反应式为:2NH −6e−+6OH−═N +6H O,
3 2 2
Y是正极,NO −发生得电子的还原反应,电极反应式为:2NO −+10e−+6H O═N ↑+12OH− , 则总反应式为:
3 3 2 2
5NH +3NO−═4N +6H O+3OH− , 根据电池总反应可知,生成4mol N 时电路中转移15mol电子,则当电路
3 3 2 2 2
中流过7.5 mol电子时,共产生标准状况下N 的体积为 ×4mol×22.4L/mol=44.8L;
2
②根据分析,Y是正极,NO -发生得电子的还原反应,电极反应式为:2NO -+10e-+6H O═N ↑+12OH-。
3 3 2 2
由图示可知,B、C用盐桥连接,结合B、C装置中电解质溶液和电极,B和C构成铅蓄电池,属于原电池装置,
铅蓄电池正极为PbO , 负极为Pb,则A、D、E为电解池,电解池的阳极与原电池的正极相连,阴极与负极
2
相连,则装置A中,Pt电极为阴极,Cu电极为阳极;装置D中,左端的石墨电极为阴极,右端的石墨电极为
阳极;装置E中M电极为阴极,N电极为阳极,据此分析解答(1)~(4);(5)根据处理垃圾渗滤液并用其发电的
示意图知道:装置属于原电池装置,X是负极,氨气发生失电子的氧化反应,电极反应式为:2NH -6e-+6OH-
3
═N +6H O,Y是正极,NO -发生得电子的还原反应,电极反应式为:2NO -+10e-+6H O═N ↑+12OH- , 电解
2 2 3 3 2 2
质里的阳离子移向正极,阴离子移向负极,电流从正极流向负极,据此回答。17. (1)2H+ + 2e-=H ↑;在金属活动性顺序中,Cu在H后,Cu不能置换出H;O + 4H+ + 4e-=2H O
2 2 2 2
(2)O 浓度越大,其氧化性越强,使电压值增大;溶液的酸碱性;排除溶液中的Na(+ 或SO 2-)对实验的可能
2 4
干扰
解析:(1)①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,即为溶液中的H+得电子生成H , 其正极反应式
2
是2H+ + 2e-=H ↑。②针对实验Ⅱ现象,甲同学考虑到:在金属活动顺序表中,Cu排在H的后面,所以他认为
2
不可能发生析氢腐蚀。乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极是溶解在溶液中的O 得电子,电极反
2
应式是O + 4H+ + 4e-=2H O。(2)①丙同学比较实验Ⅱ、Ⅲ、Ⅳ,同样是pH=2的HSO 溶液,只是溶解的O
2 2 2 4 2
量不同,导致电压表读数为:c>a>b,因此可以看出,氧气浓度越大,导电能力越强。②丁同学对Ⅳ、Ⅴ进行
比较,其变量是溶液pH的不同,因此其目的是探究溶液的酸碱性对O 氧化性的影响。实验Ⅳ中加入NaSO
2 2 4
溶液,结果溶液的导电能力未变,从而说明溶液中的Na(+ 或SO 2-)对实验不产生干扰,也由此得出实验Ⅳ中
4
加入NaSO 溶液的目的是排除溶液中的Na+(或SO 2-)对实验的可能干扰。
2 4 4
(1)①析氢腐蚀: 2H+ + 2e-=H ↑
2
②Cu不能置换出氢,吸氧腐蚀: O + 4H+ + 4e-=2H O
2 2
( 2)煤油覆盖,氧气浓度减小,第四组和第五组一个在酸性条件,一个在碱性条件,加硫酸钠是为了排除钠
离子的干扰。