文档内容
第四章《物质结构 元素周期律》单元检测题
一、选择题
1.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,化学式是NaAl(OH) CO,下列关于该物质的说法正确的是 (
2 3
)
A.该物质属于两性氢氧化物
B.该物质是Al(OH) 和NaCO 的混合物
3 2 3
C.该药剂遇胃酸不产生气体,适合胃溃疡患者服用
D.1 mol NaAl(OH) CO 最多可消耗4 mol H+
2 3
2.铝原子结构示意图为 ,它在元素周期表中所处位置是
A.第二周期第ⅢA族 B.第二周期第ⅥA族
C.第三周期第ⅢA族 D.第三周期第ⅥA族
3.根据元素周期律,下列推断错误的是
A.原子半径:C > N B.热稳定性:HF < HCl
C.还原性:Mg > Al D.碱性:NaOH<KOH
4.W、X、Y、Z为原子序数依次增大的短周期主族元素,W最外层电子数是内层电子数的3倍,Y在短周期元素
中原子半径最大,Z的最高正价与最低负价代数之和为4.下列说法不正确的是
A.氢化物的还原性:X > W > Z B.Z与W形成的某种物质能使品红溶液褪色
C.X与Y形成离子化合物 D.W与Y组成的某种物质可以作为呼吸面具的供氧剂
5.四种主族元素的离子 Xm+、Yn+、Zn-和 Rm-( a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若
a b c d
,对下列叙述的判断正确的是
①元素的原子序数: ② ③元素非金属性: ④最高价氧化物对应水化物碱性:
A.只有③ B.①③ C.①②③ D.①②③④
6.氯元素的原子结构示意图为 ,下列说法正确的是
A.氯原子在化学反应中易失去电子
B.氯原子易得到电子形成稳定的氯离子
C.氯元素的化合价只有-1价
D.氯在元素周期表中位于第3周期第Ⅶ族
7.短周期元素X、Y是元素周期表中第ⅦA族的两种元素,X原子的电子层数比Y原子的电子层数少。下列说法
不正确的是
A.HX的酸性比HY的弱
B.X的最简单气态氢化物比Y的稳定
C.X的单质能将Y的单质从KY的水溶液中置换出来
D.X的非金属性比Y的强
8.旅游景点售卖的仿银饰品大多是白铜(铜镍合金)。下列说法正确的是
A.硬度比铜的大 B.熔点比铜的高
C.容易被腐蚀 D.通过外观颜色即可区分它和白银
9.短周期主族元素W、X、Y、Z的原子序数依次增大,X、Z同主族,这四种元素与C、Li形成的某种离子液体的结构式为 ,下列说法正确的是
A.最简单氢化物的热稳定性:W”或“<”)。
2
(3) 的中子数与电子数的差值为_______。
II.硒( Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
34
(4)Se原子结构示意图可表示为_______。
(5)下列说法合理的是_______。
a.SeO 既有氧化性又有还原性 b.沸点:HO < HS < H Se
2 2 2 2
c.热稳定性:HSe碳酸)。
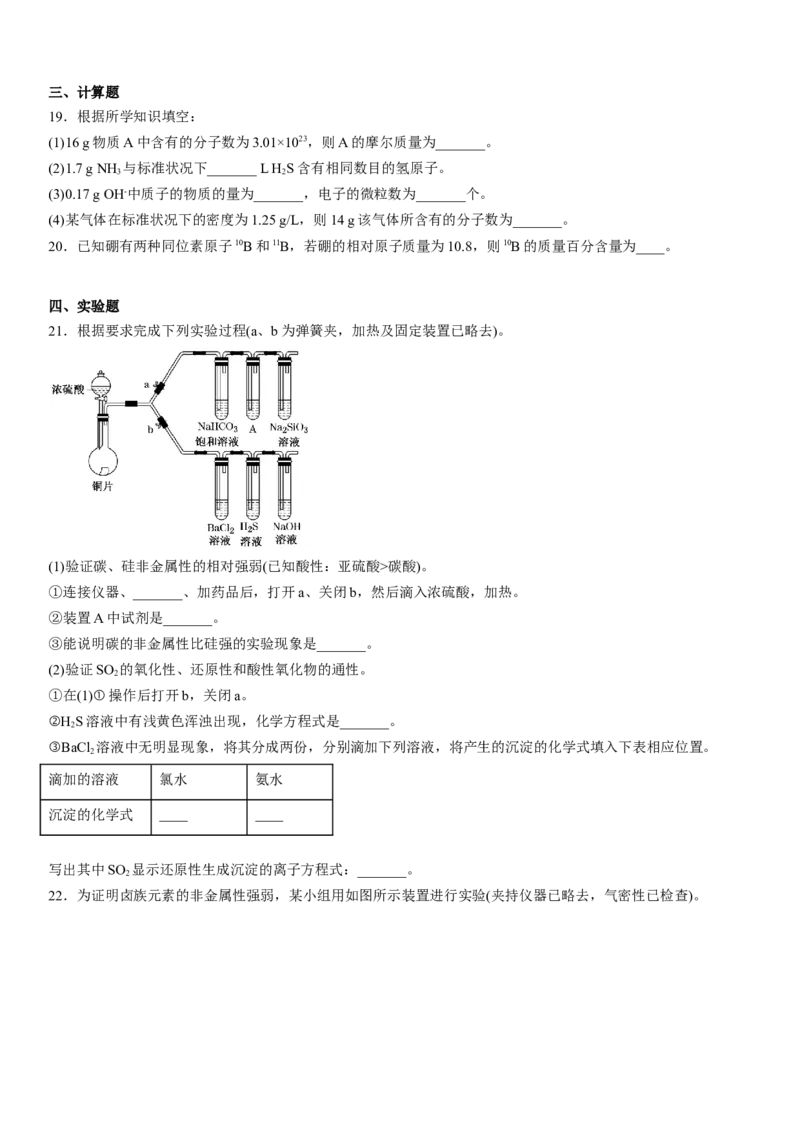
①连接仪器、_______、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。
②装置A中试剂是_______。
③能说明碳的非金属性比硅强的实验现象是_______。
(2)验证SO 的氧化性、还原性和酸性氧化物的通性。
2
①在(1)①操作后打开b,关闭a。
②H S溶液中有浅黄色浑浊出现,化学方程式是_______。
2
③BaCl 溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
2
滴加的溶液 氯水 氨水
沉淀的化学式 ____ ____
写出其中SO 显示还原性生成沉淀的离子方程式:_______。
2
22.为证明卤族元素的非金属性强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检查)。实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是___。
(2)B中溶液发生反应的离子方程式为___。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是___。
(4)过程Ⅲ的实验目的是___。
(5)请从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:___。
参考答案
1.D
【详解】A.该该物质可电离出酸根离子和金属阳离子,属于盐,故A错误;
B.NaAl(OH) CO 只有一种物质构成,属于纯净物,故B错误;
2 3
C.NaAl(OH) CO 能与盐酸反应,所以能治疗胃酸过多的胃病患者,但胃溃疡患者不能服用此物,因为产生的
2 3CO 对胃有刺激作用,胃溃疡患者会加重,故C错误;
2
D.NaAl(OH) CO 与盐酸发生反应NaAl(OH) CO+4HCl=NaCl+AlCl +3H O+CO↑,由方程式可知1mol该物质最多
2 3 2 3 3 2 2
可消耗4molHCl,即消耗4mol H+,故D正确。
答案选D。
2.C
【详解】根据原子结构示意 ,有3个电子层,位于第三周期,最外层电子数为3,位于第ⅢA族,所以该
元素在周期表中位置为第3周期第ⅢA族,故选C。
3.B
【详解】A.同周期元素,从左到右原子半径依次减小,则碳原子的原子半径大于氮原子,故A正确;
B.元素的非金属性越强,氢化物的热稳定性越强,氟元素的非金属性强于氯元素,则氟化氢的热稳定性强于氯化
氢,故B错误;
C.元素的金属性越强,金属单质的还原性越强,镁元素的金属性强于铝元素,则镁的还原性强于铝,故C正确;
D.元素的金属性越强,最高价氧化物对应水化物的碱性越强,钠元素的金属性弱于钾元素,则氢氧化钠的碱性弱
于氢氧化钾,故D正确;
故选B。
4.A
【分析】W最外层电子数是内层电子数的3倍,W位于第二周期,为氧元素;Y在短周期元素中原子半径最大,Y
是钠元素,W、X、Y、Z为原子序数依次增大的短周期主族元素,所以X是氟元素;Z的最高价与最低价代数之
和为4,Z的最高价是+6价,为硫元素。
【详解】A. 非金属越强,氢化物的还原性越弱,则氢化物的稳定性: ,A错误;
B. Z与W形成的某种物质能使品红溶液褪色,该物质是二氧化硫,B正确;
C. X与Y形成离子化合物NaF,C正确;
D. W与Y组成的物质可以作为呼吸面具的供氧剂,该物质是过氧化钠,D正确。
答案选A。
5.B
【分析】四种短周期元素的离子 Xm+、Yn+、Zn-和 Rm-具有相同的电子层结构,则:a-m=b-n=c+n=d+m,若m>
a b c d
n,故原子序数大小顺序是:a>b>c>d,结合离子所带电荷可知,X、Y为金属元素,Z、R为非金属元素,且
X、Y位于Z和R的下一周期,在同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的金属性随
着原子序数的增大而减小,元素的金属性越强,其最高价氧化物的水化物碱性越强。
【详解】①四种短周期元素的离子 Xm+、Yn+、Zn-和 Rm-具有相同的电子层结构,则:a-m=b-n=c+n=d+m,若m>
a b c d
n,故原子序数大小顺序是:a>b>c>d,故正确;
②四种短周期元素的离子 Xm+、Yn+、Zn-和 Rm-具有相同的电子层结构,则:a-m=b-n=c+n=d+m,则a-b=m-n,故
a b c d
错误;
③原子序数c>d,则Z在R右边,所以非金属性Z>R,故正确;
④金属性:Y>X,则其最高价氧化物的水化物碱性Y>X,故错误;
正确的有①③,故选:B。
6.B
【详解】A.氯原子最外层电子数为7,易得到电子形成8电子稳定结构,A项错误;
B.氯原子最外层有7个电子,易得到1个电子形成稳定的氯离子,B项正确;C.氯元素的化合价有-1,0,+1,+4,+5,+7等价,C项错误;
D.氯元素在元素周期表中位于第3周期第ⅦA族,D项错误;
答案选B。
7.C
【分析】短周期元素X、Y是元素周期表中第ⅦA族的两种元素。X原子的电子层数比Y原子的电子层数少,可
推知X为F元素、Y为Cl元素。
【详解】A.HF属于弱酸,HCl属于强酸,HF的酸性比HCl的弱,故A正确;
B.非金属性F>Cl,故氢化物稳定性:HF>HCl,故B正确;
C.氟气与水发生反应,不能置换出氯气,故C错误;
D.同主族自上而下非金属性减弱,故非金属性F>Cl,故D正确;
故选:C。
8.A
【详解】A.合金硬度大于成分金属,A正确;
B.合金熔点低于成分金属,B错误;
C.合金性能优于成分金属,故耐腐性更好,C错误;
D.白铜、白银均为银白色,不能通过颜色区别,D错误;
故选A。
9.AC
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,X能形成2个共价键,Z形成6个共价键,X、Z同
主族,X是O元素、Z是S元素;Y能形成1个共价键,Y是F元素;W形成3个共价键,W是N元素;
【详解】A.同周期元素从左到右,非金属性依次增强,气态氢化物的稳定性依次增强,热稳定性: NH ⑤>③>②>④
(4)
(5)
【解析】(1)
①液氯是液态的氯气,故和氯气是同一种物质;② 、 和 是同一种元素的不同原子,故互为同位素;③
金刚石与“足球烯” 是同种元素的不同单质,故互为同素异形体;④白磷和红磷是同种元素的不同单质,故互
为同素异形体;⑤ 与 是同种元素的不同单质,故互为同素异形体;⑥D与T是同一种元素的不同原子,故
互为同位素;综上所述,互为同素异形体的有③④⑤,属于同位素的有②⑥,属于同一种物质的有①,故答案为:
③④⑤;②⑥;①。
(2)
某元素R与氢形成的气态氢化物的化学式为 ,可知其最低负价为-3价,其最高正价为+5价,其最高价氧化物
的化学式为 ,故答案为: 。
(3)
① 水的物质的量为 =1mol,所含原子的物质的量为1mol 3=3mol;② 个 分子的物质的量为
0.5mol,所含原子的物质的量为0.5mol =1mol;③ 气体的物质的量为 =0.5mol,所含原子的物
质的量为0.5mol 3=1.5mol;④ 所含原子的物质的量为0.2mol 4=0.8mol;⑤ 所含原子的物质
的量为2mol 1=2mol,所含原子的物质的量越大,原子数目越大,则所含原子个数从大到小的顺序为
①>⑤>③>②>④,故答案为:①>⑤>③>②>④。
(4)
Cl-具有还原性,ClO-具有氧化性,在酸性条件下,Cl-与ClO-发生氧化还原反应生成氯气和水,离子方程式为:
,故答案为: 。
(5)
过氧化钠与二氧化碳反应生成碳酸钠和氧气,化学方程式为 ,由方程式可知,生成物
中的氧原子全部来自于 ,2mol 与足量的 反应生成1molO ,故等物质的量的 分别与足量
2
的 、 反应生成氧气的物质的量相等,则质量之比为1:1,故答案为: ; 。
17.(1)第五周期ⅢA族
(2)<
(3)17
(4)
(5)ad
【解析】(1)
稀有气体元素 Xe位于第五周期零族,根据稀有气体元素定位法可知 In是在周期表中的位置是第五周期ⅢA族;
54 49(2)
Ba位于周期表第六周期ⅡA族,In位于第五周期ⅢA族,因此非金属性Ba强于In,In的最高价氧化物对应的水
化物的碱性